生物信息学分析筛查并探讨WNT6与FZD7在前列腺癌中表达的意义
2020-09-29贺子秋付海波胡忠贵
贺子秋 杜 丹 张 志 付海波 胡忠贵 舒 峰
(三峡大学第二人民医院泌尿外科,宜昌 443000)
近年来,前列腺癌(prostate cancer,PCa)的发病率逐年增高,已成为男性生殖系统最常见恶性肿瘤。调查数据显示,老龄化人口特别是60岁以上的男性发病率明显升高[1,2]。PCa的发病原因复杂,除遗传因素外,还与性活动、饮食习惯等有关。病例对照研究表明,性伴侣较少、初次性交年龄较大、适度射精的男性患PCa的风险更低[3]。美国癌症协会2018年公布的癌症死亡率最新数据显示,PCa的致死率仅次于肺癌位居第二,且PCa的发病率在亚洲国家呈逐年上升趋势[4,5]。PCa发病机制尚不明确,因此,研究其发病机制、探索其有效诊断和治疗手段已成为现阶段PCa研究领域的重要方向。本研究主要通过公共基因芯片数据库(gene expression omnibus,GEO)下载2组PCa表达谱芯片数据,筛选出PCa组织与正常前列腺组织差异表达基因(differentially expressed genes,DEGs),对其进行功能注释、通路分析、蛋白互作网络分析,筛选出2个存在上下调关系的DEGs,并通过文献检索确定国内外尚无此2种基因与PCa关系的相关研究,采用Western blot和免疫组化法检测PCa组织中这2种蛋白的表达情况,评估其与PCa病理参数的关系,探讨其在PCa发生发展过程中的作用,为PCa的病因学研究提供依据,也为其早期诊断、治疗和预后提供新思路。
1 材料与方法
1.1材料
1.1.1数据来源 基因芯片数据来源于美国国立生物技术信息中心(NCBI)的GEO数据库,编号分别为GSE69223、GSE28204,包含19例PCa组织和19例正常组织(包括前列腺增生和癌旁组织)。
1.1.2样本来源 收集2018年1月~2019年8月在我院就诊的40例PCa及40例良性前列腺增生(benign prostatic hyperplasia,BPH)患者的手术标本,分为观察组及对照组。观察组平均年龄为73.55岁(56~91岁),对照组平均年龄为72.34岁(61~88岁),所有患者术前均未行放化疗及免疫治疗。本研究经我院伦理委员会批准,所有患者知情同意。
1.1.3主要试剂和仪器 兔抗WNT6单克隆抗体(ab154144)、兔抗FZD7多克隆抗体(ab64636)、兔抗WNT6多克隆抗体(ab150588)均购自Abcam公司;小鼠抗β-actin抗体购自Santa公司;辣根过氧化酶(HRP)标记的山羊抗兔和山羊抗小鼠IgG、5×蛋白上样缓冲液购自Servicebio公司;PVDF膜购自GE Life Science公司;预染蛋白Marker购自Thermo Scientific公司;DAB试剂盒、SP试剂盒购自DAKO公司;全自动脱水机、RM2145切片机、CS-VI型烤片机购自Leica公司;BX53F显微镜购自OLYMPUS公司;全封闭脱水机购自SHANDON公司;电泳转印系统购自北京凯元信锐公司;全波长酶标仪购自Thermo Fisher公司;化学发光成像系统购自Biosine公司。
1.2方法
1.2.1生物信息学分析 limma法筛选出PCa和BPH的DEGs,以P<0.05和|log (FC) |≥1为标准,取2个数据集筛选出的DEGs交集以降低假阳性率,获得的基因集作为PCa和BPH差异表达的基因进行后续分析。DAVID软件进行GO(gene ontology)富集分析,KOBAS软件对筛选出的基因进行KEGG(Kyoto encyclopedia of genes and genomes)信号通路分析;STRING在线数据库和Cytoscape软件对DEGs进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析,MCODE插件计算关键基因和关键模块,筛选出富集于同一信号通路的2种基因,确定其上下游关系,通过文献检索发现,下调基因WNT6及其假定受体FZD7与PCa的相关性尚未见报道[6,7]。
1.2.2Western blot检测WNT6及FZD7蛋白含量 组织充分研磨后提取总蛋白,检测蛋白浓度,取相同质量蛋白加入上样缓冲液,煮沸变性10 min,配制12%分离胶及4%浓缩胶进行SDS-PAGE电泳,4 ℃ 75 V恒压转膜120 min,5%脱脂奶粉封闭2 h,WNT6、FZD7抗体(1∶1 000)和β-actin抗体(1∶3 000)4 ℃孵育过夜,洗膜后分别加入抗兔和抗小鼠二抗(1∶5 000)室温孵育55 min,洗膜,DAB法显影,Image J软件对图像进行灰度值分析,以β-actin灰度值为基准,结果以(WNT6/FZD7)/β-actin表示。
1.2.3免疫组化法检测WNT6及FZD7蛋白含量 标本离体后经10%甲醛固定液固定24 h后石蜡包埋,切为4 μm切片置于载玻片,65℃恒温烤片2 h,依次于脱蜡液Ⅰ、Ⅱ中浸泡5 min,无水乙醇Ⅰ、Ⅱ、95%乙醇、90%乙醇中浸泡2 min,热抗原修复后进行抗体孵育(划线、滴加一抗,WNT6抗体稀释度为1∶50;FZD7抗体稀释度为1∶150),37℃恒温箱中孵育60 min,PBS冲洗3次,滴加二抗溶液37℃孵育 30 min,DAB显色,苏木素复染5 min,蒸馏水冲洗,温水返蓝1 min,脱水,透明,中性树脂封片,显微镜下读片。
结果判断:WNT6蛋白主要位于细胞浆和细胞膜,FZD7蛋白主要位于细胞膜,分别以细胞浆、细胞膜和细胞膜出现浅黄色、棕黄色和棕褐色颗粒为阳性表达。双盲法阅片,评价细胞染色强度:0分:未着色,1分:浅黄色,2分:棕黄色,3分:棕褐色。评价阳性细胞百分率:<5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。总得分为2者得分之积,≥4分为阳性表达,<4分为阴性表达。
1.3统计学分析 采用SPSS22.0软件进行数据处理和分析检验,Western blot结果使用GraphPad Prism7进行统计学分析,样本率比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1DEGs筛选 数据集GSE69223、GSE28204中分别筛选出5 933和1 568个DEGs,取2个数据集DEGs的交集进行综合分析,得到相同DEGs 743个。以P<0.05和|log (FC) |≥1为标准,得到DEGs 286个,其中上调基因53个,下调基因233个。按P值和差异倍数排序并挑选出差异较大的前30个基因,PCa组织和BPH组织间基因表达差异明显且分组聚类良好(图1)。

图1 差异表达最显著的前30个基因热图Fig.1 Heatmap of first 30 genes with most significant differential expression
2.2DEGs的生物信息学分析 GO分析发现,DEGs主要参与细胞黏附、生物黏附、细胞或亚细胞运动、细胞发育、细胞外基质组织等生物学进程,富集于细胞-基质连接、焦点连接、细胞-基质黏附、黏着连接、锚定连接等细胞组件,参与细胞黏附分子结合、肌动蛋白结合、蛋白激酶结合、激酶结合、细胞骨架蛋白结合等。DEGs主要富集于黏附斑激酶通路、癌症通路、磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)通路、Hippo信号通路及WNT信号通路、AMPK信号通路及PCa通路。上调DEGs可参与AMPK信号通路,下调DEGs可参与WNT信号通路(图2、3)。
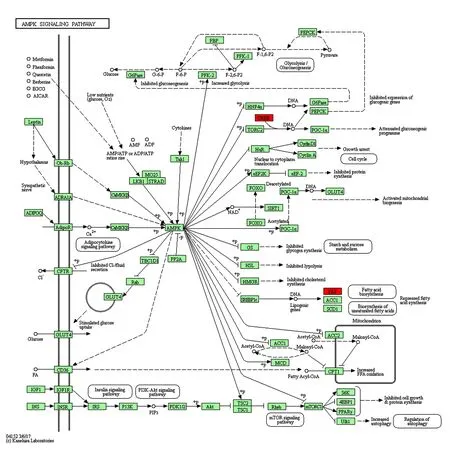
图2 上调的DEGs参与AMPK信号通路Fig.2 Upregulated DEGs participate in AMPK signaling pathwayNote:Red.Upregulated DEGs;green.AMPK signaling pathway genes.

图3 下调的DEGs参与WNT信号通路Fig.3 Involvement of down-regulated DEGs in WNT signaling pathwayNote:Red.Down-regulation of DEGs;green.WNT signaling pathway genes.
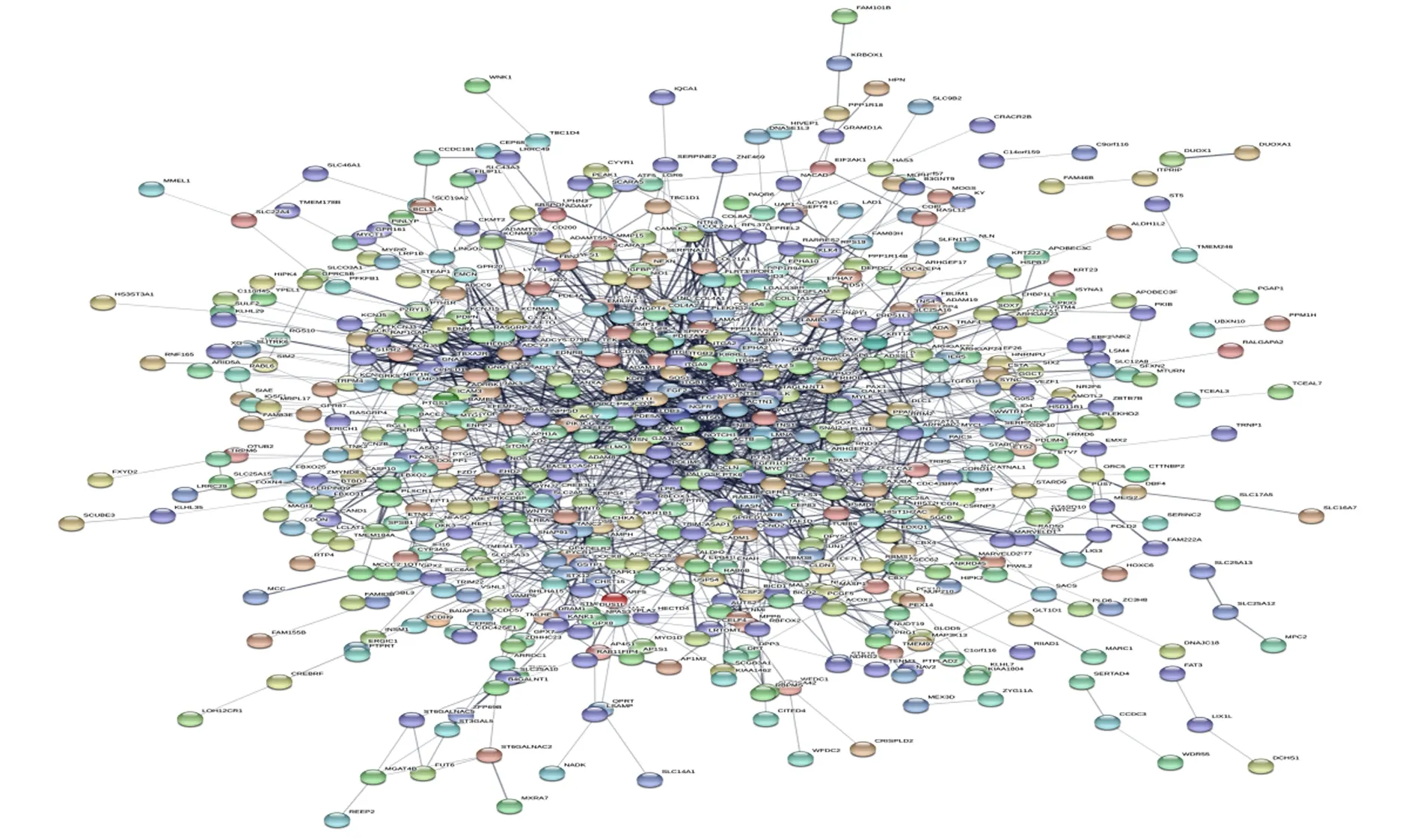
图4 PPI网络Fig.4 PPI networkNote: Each node represents associated protein or gene.
2.3DEGs的PPI分析 对DEGs进行PPI网络分析(图4),MCODE插件进行模块化分析,共筛选出显著模块3个(图5),MOCDE得分依次为8.417、6.000、4.667分,说明WNT6与FZD7为上下游关系。

图5 PPI网络中的3个重要模块Fig.5 Three important modules in PPI networkNote: Each node represents associated protein and yellow represents the seed node.
2.4WNT6及FZD7在PCa和BPH组织的表达 Western blot 结果显示,PCa组织WNT6及FZD7含量明显低于BPH组织(P<0.05,图6)。免疫组化结果显示,BPH组织中,WNT6蛋白的阳性表达率为92.5%(37/40),PCa组织WNT6阳性表达率为37.5%(15/40)(P<0.01,图7、8)。BHP组织中FZD7蛋白阳性表达率为47.5%(19/40),PCa组织阳性率为20.0%(8/40)(P<0.05,表1)。WNT6与FZD7蛋白表达与PCa组织临床病理参数的关系如表2所示, 术前血清PSA≥10 ng/ml组中WNT6与FZD7表达阳性率低于PSA<10 ng/ml组(P<0.05);Gleason评分>7分组中WNT6、FZD7阳性表达率低于Gleason评分≤7分组(P<0.05)。PCa组织WNT6与FZD7阳性表达与年龄及肿瘤分期无关(P>0.05)。
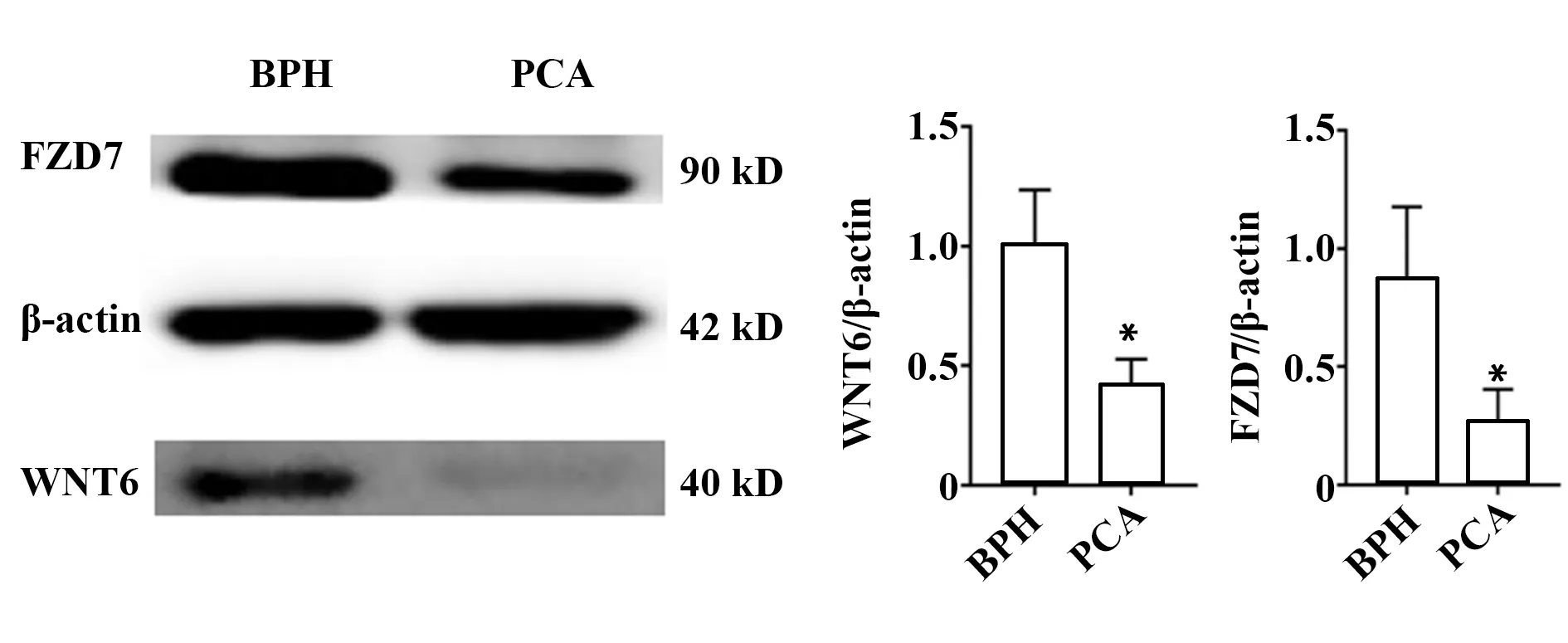
图6 BPH和PCa中WNT6及FZD7蛋白表达Fig.6 Expression of WNT6 and FZD7 in BPH and PCaNote:Compared with BPH group,*.P<0.05.

图7 WNT6在BPH和PCa组织中的表达情况(×100)Fig.7 Expression of WNT6 in BPH and PCa (×100)Note:A.Expression of WNT6 in BPH;B.Expression of WNT6 in PCa.
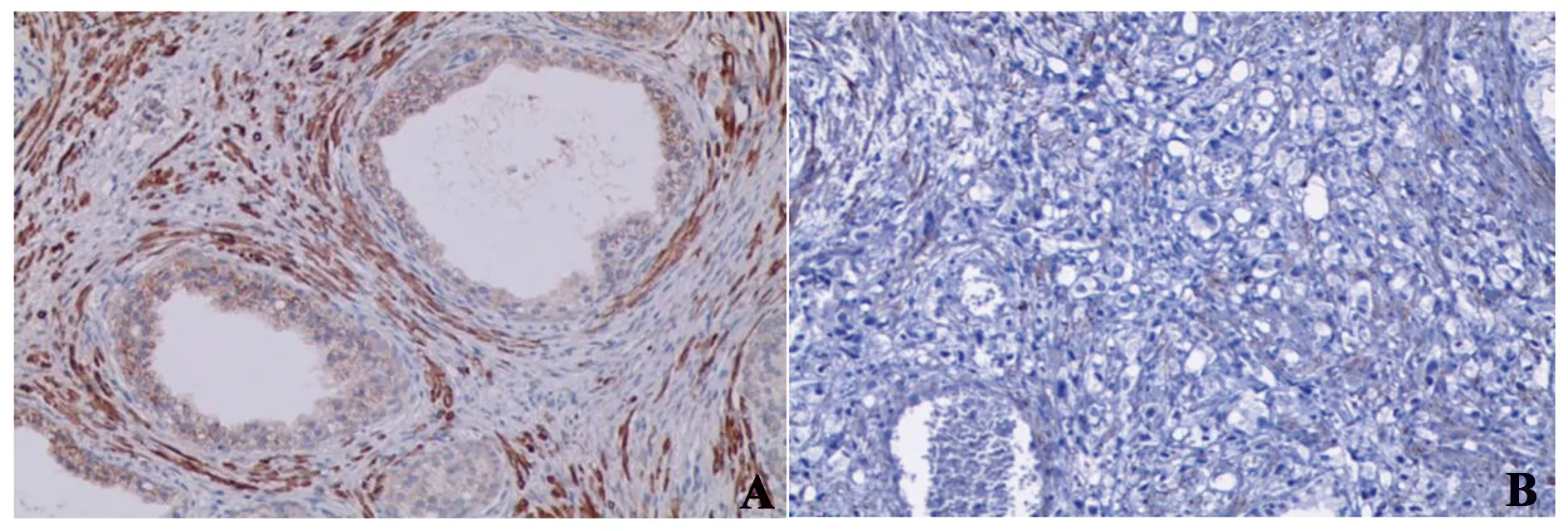
图8 FZD7在BPH和PCa组织中的表达情况(×100)Fig.8 Expression of FZD7 in BPH and PCa(×100)Note:A.Expression of FZD7 in BPH;B.Expression of FZD7 in PCa.
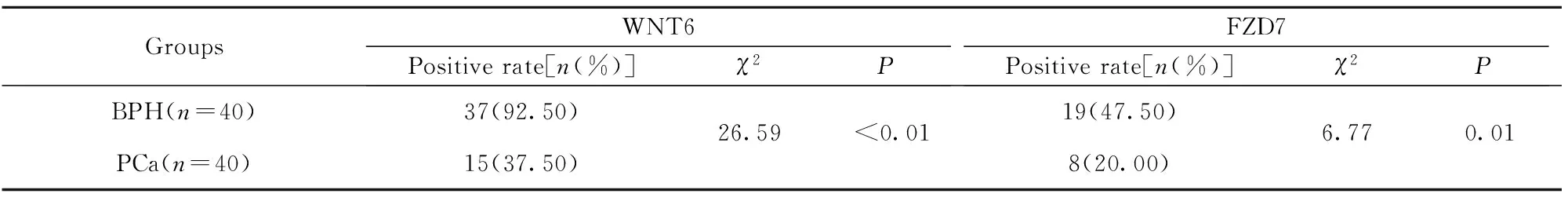
表1 WNT6及FZD7在BPH组织和PCa组织中的表达
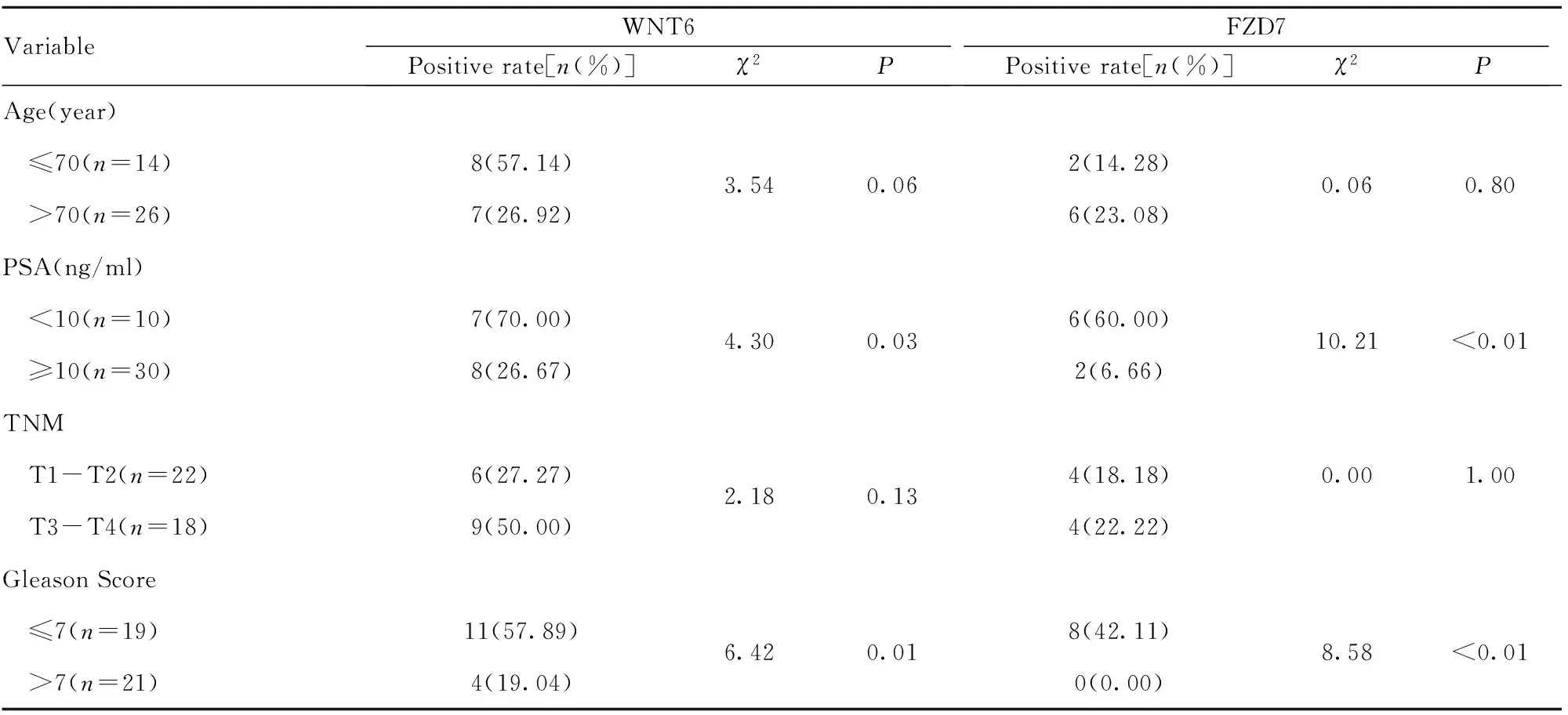
表2 WNT6及FZD7与PCa病理参数的关系
3 讨论
近年来,PCa的发病率及死亡率呈逐年上升的趋势且发病年龄逐渐降低。PCa细胞的持续增殖和转移是晚期PCa的重要临床特征和主要死亡原因[8,9]。PCa与正常前列腺组织基因表达谱的生物信息学分析发现,DEGs主要集中于黏附斑激酶通路、癌症通路、PI3K/AKT通路、Hippo信号通路、WNT信号通路、AMPK信号通路及PCa通路。其中,WNT信号通路是由配体蛋白质WNT和膜蛋白受体FZD结合激发的多下游通道的高度保守信号通路,是调节细胞增殖、迁移和调亡的重要途径,通过某些特定的基因调节,在胚胎发育、维持组织细胞内稳态等生理过程中发挥重要作用[10,11]。Wang等[12]确定WNT1作为WNT信号通路的一部分,在PCa细胞增殖、迁移和干细胞更新中起重要作用。另一项PCa组织的研究中,WNT5a作为非经典WNT信号通路配体,与其受体FZD2共同作用可诱导上皮间充质转化(EMT),与PCa的代谢改变、侵袭和复发联系紧密[13]。而WNT6及其假定受体FZD7在PCa发生发展的作用尚未阐明,且国内外尚无相关研究。本研究通过生物信息学技术分析发现WNT6和FZD7是PCa中的下调基因,二者在PCa和BPH组织中均有表达,但在PCa组织中的表达明显低于BPH组织(P<0.05),提示WNT6及FZD7在PCa组织中呈低表达,与生物信息学分析结果一致,表明WNT6及FZD7的表达差异是区分PCa与BPH的重要标志,二者可能在PCa发生发展中起抑癌作用。本研究还发现WNT6及FZD7的表达与血清PSA水平和Gleason评分相关,提示随着PCa中WNT6及FZD7表达减少,PCa细胞异常增殖、分化,导致PCa预后较差。因此,通过提高WNT6及FZD7表达水平,可抑制PCa细胞生长、增殖及侵袭。
WNT信号通路传导途径复杂。研究发现,WNT家族中WNT3、WNT3a、WNT5a等在PCa细胞中高表达[14-16]。本研究通过基因芯片及Western blot发现,WNT6及FZD7在PCa中低表达,表明WNT家族的19种成员在PCa发生发展中的作用各不相同。WNT信号通路引起PCa发生发展的具体机制尚不明确,可能主要涉及以下几点:①雄激素受体(androgen receptor,AR)。PCa是一种雄激素依赖性疾病,Lee等[17]研究发现,在雄激素依赖性PCa细胞中,AR信号可抑制β-catenin/TCF介导的转导,表明WNT信号可能在PCa进展为去势抵抗性PCa的过程中发挥重要的作用;②PCa干细胞。WNT信号通路在肿瘤干细胞中高度活跃,可能在PCa干细胞中起自我更新作用[18,19]。Wang等[20]通过基因谱研究表明,在成人PCa干细胞群中检测到WNT靶基因lgr5的表达,且lgr5+干细胞具有导致PCa去势抵抗的能力。
综上所述,本研究通过生物信息学方法分析PCa及正常前列腺组织的基因表达谱芯片数据,发现影响PCa发生发展的重要通路及关键基因,选取下调基因富集的WNT信号通路,通过实验证实WNT6及假定受体FZD7在PCa中低表达,同时WNT6及FZD7与PCa的血清PSA水平、Gleason评分密切相关,而与患者的年龄及临床分期无关,提示WNT6与FZD7很可能在PCa的发生、发展中发挥抑癌作用。对PCa患者的WNT6与FZD7进行干预,可能提高PCa治疗效果。检测PCa患者WNT6及FZD7表达有助于PCa危险程度、治疗效果和预后的判断。WNT6与FZD7作为PCa的治疗靶点不可忽视,其很可能在PCa发生发展中起抑癌作用,为阐述PCa的发病机制及诊断提供了全新视角,并为PCa靶向治疗药物的开发提供新方向。WNT信号通路与其他信号通路的联系需进一步研究,使PCa的基因研究更加透彻,深化对PCa发生发展的认识,从而对其进行更好地防治。