一磷酸鞘氨醇在哮喘炎症细胞水平的研究进展①
2020-09-29刘函晔陈正爱刘卫东
刘函晔 陈正爱 刘卫东 崔 弘
(延边大学基础医学院,延吉 133002)
哮喘是普遍的公共卫生问题,其发病率在世界范围内不断上升,特别是在工业化城市人口中,影响到全世界5%~10%的人口。然而,部分重症哮喘患者对长效β-肾上腺素能受体激动剂产生依赖性或难以接受抗炎糖皮质激素等药物,且处于严重发病和威胁生命的高风险中,仅不到50%的患者能达到可接受的临床控制[1]。
1 S1P的来源
鞘磷脂是真核细胞脂质双层中普遍存在的成分。鞘氨酰鞘氨醇(N-酰基鞘氨醇)是鞘脂的骨架,由神经酰胺合成和鞘脂周转产生。鞘脂在分解代谢过程中,神经酰胺脱酰化产生鞘氨醇。鞘氨醇由鞘氨醇激酶1和2(SphK1和SphK 2)磷酸化形成一磷酸鞘氨醇(sphingosine 1-phosphate,S1P)[2]。S1P可以通过可逆去磷酸化和鞘氨醇化降解,也可以通过磷酸水解酶不可逆地裂解成磷酸乙醇胺和十六烷基化合物从而被S1P降解。
2 S1P及其受体的生物学功能
S1P含5种G蛋白偶联受体,被称为S1P1-5,大多数细胞表达一种或多种S1P受体亚型。S1P受体均可与 S1P以较高的亲和力结合并通过受体间相互作用参与增殖、迁移和血管生成等关键的细胞过程[3]。S1P的不同受体均有不同的G蛋白家族的耦合特性:如S1P1有Gi/o家族耦合特性,S1P2有Gi/o,Gi2/i3以及GQ蛋白家族的特性,这种耦合特性可直调节小GTP酶(Rho、Rac和Ras)[4]。此外发现,内皮细胞中可检测到丰富的S1P1,有研究发现成年小鼠主动脉内皮细胞质膜上的 S1P1与炎症黏附分子丰度负相关,因此,S1P具有调节血管发展和微血管屏障功能[5]。在内皮细胞的促炎反应过程中,抑制 S1P及其受体可抑制过敏反应炎症,S1P2受体的抑制完全消除了内皮细胞中TNF-α诱导的血管细胞黏附分子1(VCAM-1)和细胞间黏附分子1 (ICAM-1)表达。抑制S1P与S1P2结合可以直接抑制NF-kB通路参与细胞因子反应和由其诱导产生的内皮细胞促炎反应[6]。
3 S1P及其受体在哮喘细胞应答中作用
3.1S1P与肥大细胞 肥大细胞(mast cell,MC)是血液中的一种粒细胞,广泛分布于皮肤和内脏黏膜下的微血管中,可分泌多种细胞因子。MCs长期以来被认为是哮喘过敏性气道反应的关键效应细胞。接触过敏原后,MCs结合IgE而活化,导致随后的脱颗粒及生物活性介质释放[7]。研究表明,S1P是MCs产生的鞘脂代谢物,且已被证实是过敏原诱导的MCs活化的重要调节剂,临床研究表明S1P在慢性哮喘的发病机制中具有重要作用,其可破坏呼吸系统上皮细胞屏障,激活胆碱能受体[8]。在哮喘患者的支气管肺泡灌洗液(BALF)中观察到S1P水平升高,表明S1P在过敏反应中及MC依赖性炎症反应中有重要作用。抗原刺激的 MCs将 S1P释放到间质中可以显著调节炎症过程,且鞘氨醇激酶(SPHK)抑制剂治疗显著改善了小鼠哮喘模型的免疫反应,特定的SPHK抑制剂在过敏性哮喘的MC依赖性小鼠模型中可减弱气道高反应性和炎症[9]。microRNA(miRNA)是MCs发育的关键调节因子,在MC的生长、分化和迁移中起关键作用。研究表明,miR221通过IgE-抗原复合物调节细胞周期并刺激颗粒和细胞因子释放MCs,且其在哮喘小鼠中明显上调[10]。目前已经证明几种miRNA可靶向影响S1P信号传导途径,如miR-130a-3p和miR-613靶标SphK2,miR133b和miR-363靶标S1PR1。截至笔者撰稿,未有实验阐明miRNA、S1P、MCs间的关系,需要对其进行进一步研究。
3.2S1P与淋巴细胞 淋巴细胞中,Th2淋巴细胞驱动免疫炎症反应并引发过敏性哮喘。转录因子 GATA3是 Th2淋巴细胞表达的关键转录因子,其参与 Th2细胞因子的合成,如 IL-4,IL-5,IL-9和 IL-13。这些细胞因子刺激与过敏级联相关的其他免疫细胞的成熟,如嗜酸性粒细胞和MCs。其中IL-4和IL-13驱动免疫球蛋白类转向IgE作用于B淋巴细胞[11]。在慢性过敏性哮喘中,IgE激活的MCs分泌嗜酸性粒细胞,如 IL-3,IL-4、IL-5、和粒细胞-巨噬细胞集落刺( GM-CSF1)等[12]。S1P是淋巴细胞从次级淋巴器官进入体循环的主要调节剂。血浆中的S1P主要由红细胞和血管内皮细胞产生,淋巴样S1P由淋巴管内皮细胞分泌。由于S1P裂解酶的高活性,组织中仅能维持较低水平的S1P。大多数血浆S1P可与高密度脂蛋白结合,通过调节淋巴细胞生成在免疫稳态中起重要作用,淋巴结中B细胞和T细胞及来自胸腺的成熟 T细胞和天然杀伤T细胞的排泄都需要S1P表达。S1P信号传导在体内外均能刺激TH17分化。研究发现,在S1P1的C末端区域具有磷酸化缺陷的小鼠在实验性自身免疫性脑脊髓炎(EAE)模型中显示了TH17-显性免疫应答和增强的神经炎症。在该模型中,促炎细胞因子IL-6和IL-17及关键的TH17转录因子p-Stat3也得到了增强[13]。S1P1在癌症免疫中可介导Stat3激活,而Stat3可直接促进S1P1表达[14]。
3.3S1P与其他细胞 除了上述免疫细胞外,多种细胞还可参与哮喘炎症反应,如巨噬细胞,树突状细胞(DC),嗜碱性粒细胞等。研究表明巨噬细胞表达高水平的S1P,其激活S1P2和S1P3并触发促炎介质CCL2,IL-1β和IL-18表达[15]。Arlt等[16]的研究表明,脂多糖(LPS)诱导成熟期DC暴露于S1P或FTY720可降低IL-12产生。S1P4可调节 DC分化,并可能影响 TH17细胞分化,在自身免疫中发挥潜在作用[17]。在肺动脉内皮细胞中S1P可以增加连环蛋白和概念蛋白含量,并增加细胞的跨细胞电阻,使其黏附连接结构稳定;也可直接影响巨噬细胞精氨酸和诱导型一氧化氮合酶活性。除了促进精氨酸合成外,TGF-β和 IL-10的促炎细胞因子也在S1P刺激的巨噬细胞中起作用。由此可见,S1P促进了一种新的巨噬细胞表型[18]。另有研究表明,与表征载脂蛋白M(APOM)结合的S1P在内皮细胞中发挥抗凋亡作用[19]。
4 S1P及其受体在哮喘气道平滑肌及气道重塑中的作用
S1P具有调节炎症和气道重塑期间气道平滑肌功能,已经提出S1P通过刺激人ASM细胞增殖影响气道重塑,其中一种机制是通过S1P通过RhoA依赖性抑制肌球蛋白磷酸酶[20]。调节气道抵抗力的毒蕈碱受体(MR)信号传导与哮喘相关MR下游信号传导导致外周气道收缩,该过程涉及SphK的激活和细胞内Ca2+水平的释放。有研究表明S1P全身性给药提高小鼠整个肺模型的气道阻力和胆碱能活性。通过微阵列分析鉴定气道平滑肌细胞中可经S1P调控的有相关文献报道的88个基因的两倍或更多,包括参与细胞增殖和气道重塑的基因(HBEGF,TGFB3,TXNIP,PLAUR,SERPINE1)、细胞内信号传导基因(RGS4,RGS2,DUSP5,MAP2K3,DGKH)和转录调控基因(NR4A1,NR4A3,EGR3,FOSB)[21]。已有研究表明HBEGF、RGS4和PLAUR等在哮喘患者气道中上调。S1P的五种受体在气道平滑肌中可表达三种(S1P1-3),S1P2和S1P3是平滑肌细胞中基因表达所必需的。但与S1P3相反,S1P2不通过钙发出信号,但可能与G12/13偶联并激活细胞中的Rho相关激酶途径[21]。
5 S1P受体激动剂、拮抗剂
根据S1P及其受体在机体内产生的生物学反应,可通过拮抗或激动S1P相关受体来抑制哮喘或更为严重的气道重塑等。FTY-720是S1P的合成类似物,主要激动S1P1、S1P3、S1P4、S1P5受体,经FTY-720治疗后哮喘小鼠Th2相关转录因子受到抑制,进一步证明其可消除急性过敏原激发后的过敏性炎症和气道高反应性[22]。SEW-2871是一种S1P1选择性激动剂,可参与多种免疫炎症反应过程,SEW-2871处理的小鼠中TNF-α、IFN-γ水平显著下降,提示其在淋巴细胞运输和发育的调节中起关键作用[23]。JTE-013是一种S1P2拮抗剂,通过抑制S1P2介导的支气管上皮NF-κB活化和CCL 3产生抑制哮喘变应性反应。除上述受体选择性激动剂和拮抗剂外列出如SEW-2871(S1P1选择性激动剂)、VPC-44116(S1P1拮抗剂)等受体激动剂及拮抗剂(表1)。
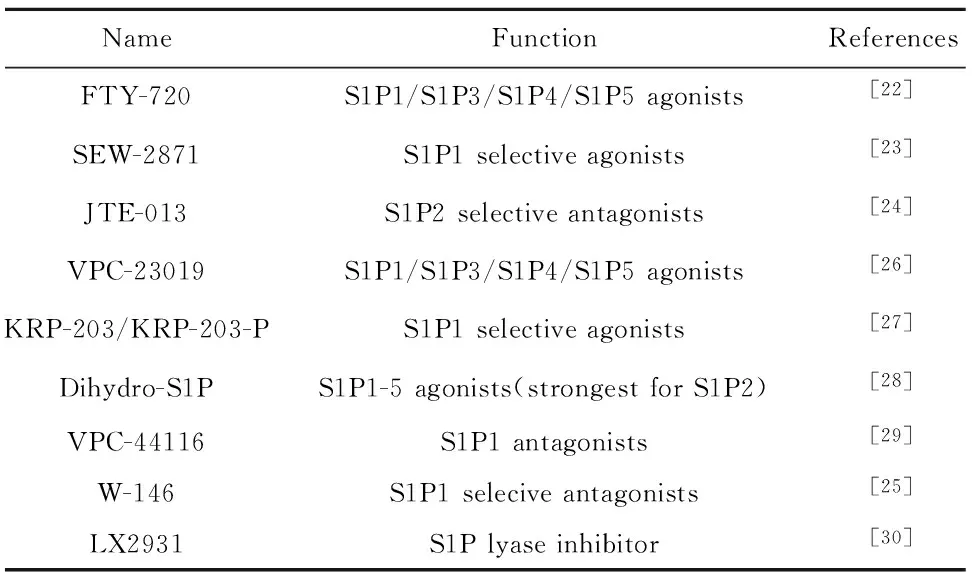
表1 S1P受体激动剂/拮抗剂
6 展望
综上所述,S1P可增加炎症产生并破坏呼吸系统上皮细胞屏障完整性,在细胞内外均影响炎症发生,另一方面S1P可直接参与平滑肌的生物学反应, 影响气道重塑。反复接触变应原可诱发支气管哮喘急性发作、炎症因子分泌及气道重塑,成为哮喘发生的主要特征,且气道重塑是哮喘慢性化、持续化、严重化的病理基础。激活的胆碱能受体等也与哮喘和慢性阻塞性肺病有关。本综述对S1P及其受体在哮喘中作用进行归纳整理并推测对其受体及相关下游炎症通路的研究是切实可行的,但仍有部分S1P受体激动剂和拮抗剂与哮喘关系尚未深入研究,可通过对其S1P/S1PR等下游通路的进一步检测和对相关炎症因子的表达推测其对炎症的抑制作用。