miR-490-5p靶向SP1抑制骨肉瘤的发生发展①
2020-09-29余孟英王金莲蒲劲松
余孟英 王金莲 陈 路 蒲劲松
(川北医学院附属医院骨科,南充 637000)
骨肉瘤是最常见的主要发生于儿童和青少年的原发性骨恶性肿瘤,通常出现在长骨的末端,主要发生在膝盖处[1]。该病属于第八大癌症,发病率高,且被诊断为骨肉瘤的儿童的5年生存率低于30%,10年生存率低于50%,严重威胁家庭和社会安定[2]。虽然近几年骨肉瘤的治疗策略取得了一些进展,但仍然存在预后差等问题。基因水平的治疗一直是骨肉瘤的研究热点。已有研究表明miR-490-5p能够抑制肝癌、膀胱癌、人肝内胆管癌等癌症的发生和发展,但其对骨肉瘤发生和发展的作用尚不清楚[3-5]。SP1属于kruppel样转录因子家族,是一种广泛参与细胞凋亡、生长、代谢和分化的锌指转录因子,在肺癌、结直肠癌和胃癌等癌症中表达均升高,并导致多种致癌基因的表达,已有报道显示SP1可促进骨肉瘤的发生和发展[6]。本文主要研究miR-490-5p对骨肉瘤细胞生长和运动的作用,以期为骨肉瘤的治疗提供参考。
1 材料与方法
1.1材料
1.1.1细胞系 正常成骨细胞株hFOB1.19和骨肉瘤细胞MG63购自美国ATCC细胞库。
1.1.2试剂 RPMI1640培养液购自美国Gibco公司,胎牛血清购自德国PAN公司,mimic-NC、miR-490-5p mimic、SP1质粒购自上海生物工程有限公司,Lipofectamine 2000购自美国 Invitrogen 公司,Dual Luciferase报告基因试剂盒购自美国 Promega 公司,BCA试剂盒购自北京天根生化有限公司。
1.1.3动物 24只裸鼠购自四川夏派森医药科技有限公司,许可证号:SYXK(川)2017-203。裸鼠在25℃,12 h光照/12 h黑暗循环的饲养室,自由获取水和食物。在实验前1周开始适应性喂养。
1.1.4仪器 MD全自动显微镜购自美国Molec-ular Devices公司;超净工作台购自苏州净化设备厂。
1.2方法
1.2.1细胞培养及分组 人骨肉瘤MG63细胞在37℃、5%CO2条件下,培养于含10% 胎牛血清的RPMI1640培养基中。实验设置control组、mimic-NC组、miR-490-5p mimic组、SP1组、mimic+SP1组。根据Lipofectamine 2000说明书将质粒分别或联合转染进入各组骨肉瘤MG63细胞。
1.2.2RT-qRCR检测miR-490-5p和SP1的表达 将细胞收集后用TRIzol裂解液抽提总RNA并逆转录为cDNA,用GAPDH作为内参进行RT-qPCR检测。本实验所用引物序列:miR-490-5p F:5′-GCAAACAACCAUUCGGCUGUC-3′,R:5′-CGCAGGTCCGGAGTAGGT-3′;SP1 F:5′-TGGTGGGCAGTA-TGTTGT-3′,SP1 R:5′-GCTATTGGCATTGGTG-AA-3′;GAPDH F:5′-ATGGGGAAGGTGAAGGTCG-3′,GAPDH R:5′-TTACTCCTTGGAGGCCATGTG-3′。
1.2.3靶基因预测运用基因预测软件 TargetScan软件(http://www.targetscan.org)预测miR-128-3p的靶基因。
1.2.4双荧光素酶活性测定靶向关系 以海肾荧光素酶的荧光值作为内参,按照Dual Luciferase报告基因试剂盒说明书进行操作。
1.2.5MTT法检测细胞增殖 将胰蛋白酶消化的MG63细胞悬浮液按2×103个/孔加入96孔板,待细胞生长至50%时,更换无血清培养基,培养24 h后,加入血清,在不同时间加入MTT,再培养4 h,弃培养基加入DMSO,上机测定A570,代表细胞活力。
1.2.6Western blot检测Ki67、PCNA、Bcl-2、Bax、caspase-3、caspase-9、E-cadherin和N-cadherin表达 用RIPA裂解液提取总蛋白,并用BCA试剂盒检测总蛋白浓度,经 SDS-PAGE分离蛋白后,用半干转膜仪转移蛋白质至PVDF膜,并用脱脂牛奶室温封闭蛋白2 h,然后加入一抗在4℃封闭过夜,再加入对应二抗室温封闭1 h,最后滴ECL曝光。
1.2.7Transwell检测细胞侵袭将细胞 以无血清培养液培养24 h后,用胰蛋白酶消化以3×105个/ml传代接种于用Matrigel预处理的Transwell小室中,小室上层加入无血清培养液培养细胞,下层则加入含血清的正常培养液,48 h后用无菌棉签擦去小室上层细胞,下层细胞HE染色后计数。
1.2.8划痕实验检测细胞迁移 将各组骨肉瘤MG63细胞消化铺满单层后用小号枪头垂直划痕,加入无血清培养基,5%CO2、37℃恒温培养箱培养24 h,显微镜下拍照,Image J 软件分析。
1.2.9裸鼠体内实验 将裸鼠随机分为Control组和miR-490-5p mimic组,每组 12只,雌雄各半。各组裸鼠右后肢腹侧皮下注射 0.2 ml 1×107个/ml骨肉瘤MG63细胞和转染miR-490-5p mimic的骨肉瘤MG63细胞悬液。SPF条件下正常饮食饲养,观察裸鼠皮下成瘤情况。第 30 天颈椎脱位法处死裸鼠,完整取出皮下肿瘤,电子天平称重,Western blot检测Ki67、Bax、caspase-3、E-cadherin蛋白表达情况。

2 结果
2.1miR-490-5p在骨肉瘤细胞MG63中低表达 与正常hFoB1.19细胞相比,骨肉瘤细胞MG63中miR-490-5p的表达量明显下调(P<0.01,图1A),说明miR-490-5p在骨肉瘤细胞MG63中低表达。
2.2miR-490-5p mimic上调骨肉瘤细胞MG63 miR-490-5p 的表达 RT-qPCR结果显示,与Control组骨肉瘤MG63细胞中miR-490-5p的表达量相比,mimic-NC组差异无统计学意义,说明空载质粒对骨肉瘤MG63细胞中miR-490-5p表达无影响,而miR-490-5p mimic组miR-490-5p表达量明显上调(P<0.01,图1B),说明miR-490-5p mimic质粒有效,能上调骨肉瘤细胞MG63 miR-490-5p表达。
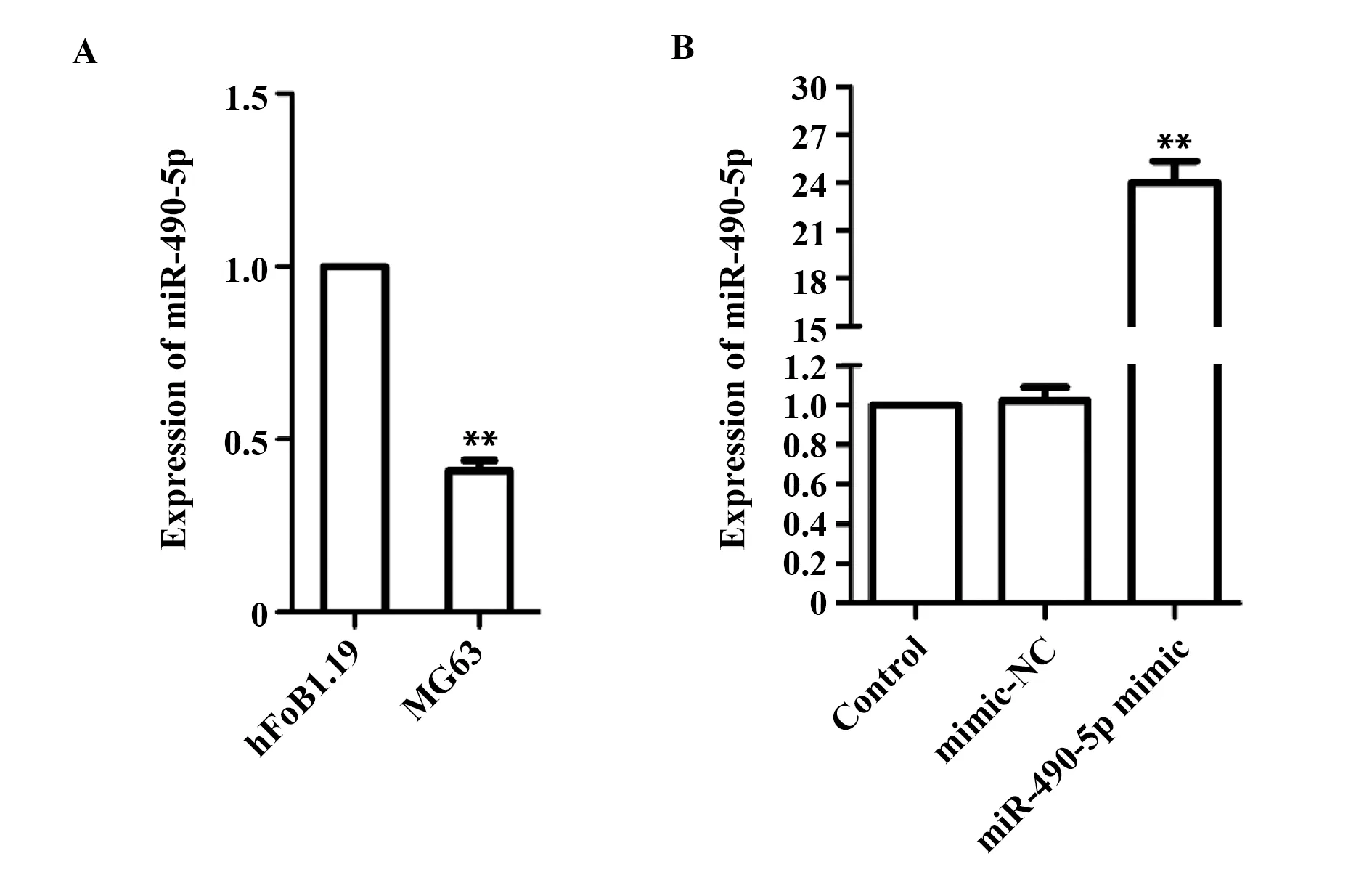
图1 RT-qRCR检测miR-490-5p表达水平Fig.1 miR-490-5p mRNA expression level was detected by RT-qRCRNote:A.**.P<0.01 versus hFOB1.19 cells;B.**.P<0.01 versus control group.
2.3miR-490-5p靶向作用SP1 3′-UTR 通过基因预测软件和Pubmed筛选出SP1作为 miR-490-5p的靶基因,miR-490-5p与SP1在3′UTR区存在结合位点(图2A)。荧光素酶报告基因实验结果表明,miR-490-5p对野生型SP1表达有明显下调作用,对突变型无明显作用,提示 miR-490-5p直接靶向作用于SP1(P<0.01,图2C)。SP1的表达结果表明,与Control组相比,mimic-NC组细胞SP1表达水平无明显变化,miR-490-5p mimic组SP1表达量显著下调,SP1组SP1表达量显著上调,说明空载质粒对细胞SP1表达无影响,miR-490-5p mimic对SP1具有抑制作用,pcDNA-SP1能使SP1过表达;mimic+SP1组SP1表达,与Control组和mimic-NC组比无明显变化,比 miR-490-5p mimic组显著上调,比SP1组显著下调,说明 miR-490-5p和SP1具有靶向关系,并且过表达 miR-490-5p抑制SP1表达(P<0.01,图2B、D)。

图2 miR-490-5p靶向作用于SP1Fig.2 miR-490-5p targets to SP1Note:A.Target genes of miR-490-5p were screened by the gene prediction software TargetScan;B.Expression of SP1 was detected by RT-qRCR;C.Targeting relationship was detected by luciferase activity;D.Expression of SP1 was detected by Western blot;**.P<0.01 versus control group;##.P<0.01 versus single transfection group.
2.4miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63增殖 与Control组相比,mimic-NC组细胞生长速度无明显变化,miR-490-5p mimic组细胞生长速度明显下降,SP1组细胞生长速度明显升高(P<0.01,图3A),说明空载质粒对细胞生长速度无影响,miR-490-5p mimic抑制细胞MG63增殖,pcDNA-SP1促进细胞MG63增殖;mimic+SP1组细胞MG63生长速度与Control组和mimic-NC组比无明显变化,比 miR-490-5p mimic组明显增多,比SP1组明显下降,说明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63增殖(P<0.01,图3A)。与Control组相比,mimic-NC组细胞Ki67和表PCNA表达量显著下调,SP1组Ki67和PCNA表达量显著上调,说明空载质粒对细胞Ki67和PCNA表达无影响,miR-490-5p 过表达抑制Ki67和PCNA表达,SP1过表达促进Ki67和PCNA1表达(P<0.01,图3B);mimic+SP1组Ki67和PCNA表达量,与Control组和mimic-NC组相比无明显变化,比 miR-490-5p mimic组明显上调,比SP1组明显下调,说明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63增殖(P<0.01,图3B)。
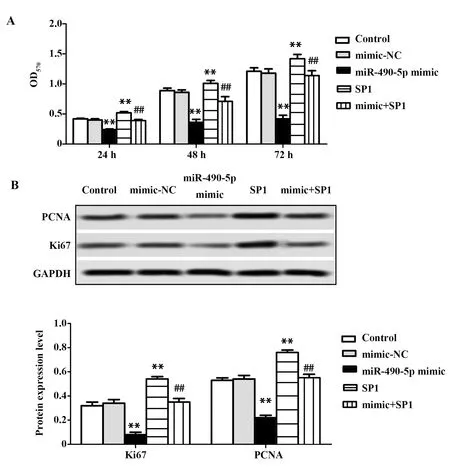
图3 各组细胞增殖情况Fig.3 Cell proliferation in each groupNote:A.Cell proliferation was detected by MTT;B.Ki67 and PCNA protein expressions were detected by Western blot;**.P<0.01 versus control group;##.P<0.01 versus single transfection group.
2.5miR-490-5p过表达靶向SP1促进骨肉瘤细胞MG63凋亡 与Control组相比,mimic-NC组细胞Bcl-2、Bax、caspase-3和caspase-9表达水平无明显变化,miR-490-5p mimic组Bcl-2表达量明显下调,Bax、caspase-3和caspase-9明显上调,SP1组Bcl-2表达量明显上调,Bax、caspase-3和caspase-9明显下调,提示空载质粒对细胞MG63凋亡无影响,miR-490-5p 过表达可能抑制细胞MG63凋亡,SP1过表达可能促进细胞MG63凋亡(P<0.01,图4);mimic+SP1组Bcl-2表达与Control组和mimic-NC组相比无明显变化,比 miR-490-5p mimic组明显上调,比SP1组明显下调,mimic+SP1组Bax、caspase-3和caspase-9表达,与Control组和mimic-NC组相比无明显变化,比 miR-490-5p mimic组明显下调,比SP1组明显上调,提示miR-490-5p过表达靶向SP1可能促进骨肉瘤细胞MG63凋亡(P<0.01,图4)。
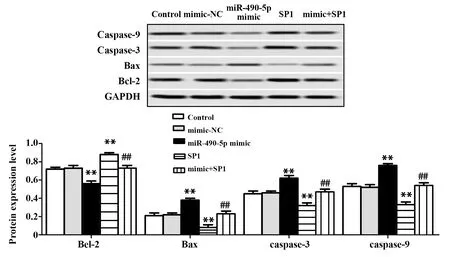
图4 Western blot检测Bcl-2、Bax、caspase-3和caspase-9表达水平Fig.4 Detection of Bcl-2,Bax,caspase-3 and caspase-9 expression levels by Western blotNote:**.P<0.01 versus control group;##.P<0.01 versus single transfection group.
2.6miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63侵袭 与Control组相比,mimic-NC组侵袭细胞数目无明显变化,miR-490-5p mimic组侵袭细胞数目显著减少,SP1组侵袭细胞数目显著增多,说明空载质粒对MG63细胞侵袭能力无影响,miR-490-5p 过表达对MG63细胞侵袭具有抑制作用,SP1过表达促进MG63细胞侵袭;mimic+SP1组侵袭细胞数目与Control组和mimic-NC组相比无明显变化,比 miR-490-5p mimic组显著增多,比SP1组显著减少,说明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63侵袭(P<0.01,图5)。
2.7miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63迁移 与Control组相比,mimic-NC组划痕宽度和愈合率无明显变化,miR-490-5p mimic组划痕显著增宽、愈合率显著降低,SP1组划痕显著变窄、愈合率显著升高,说明空载质粒对MG63细胞迁移速度无影响,miR-490-5p 过表达对MG63细胞迁移速度具有抑制作用,SP1过表达促进MG63细胞迁移能力;mimic+SP1组侵袭愈合率与Control组和mimic-NC组相比无明显变化,比 miR-490-5p mimic组显著升高,比SP1组显著降低,说明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63迁移(P<0.01,图6)。
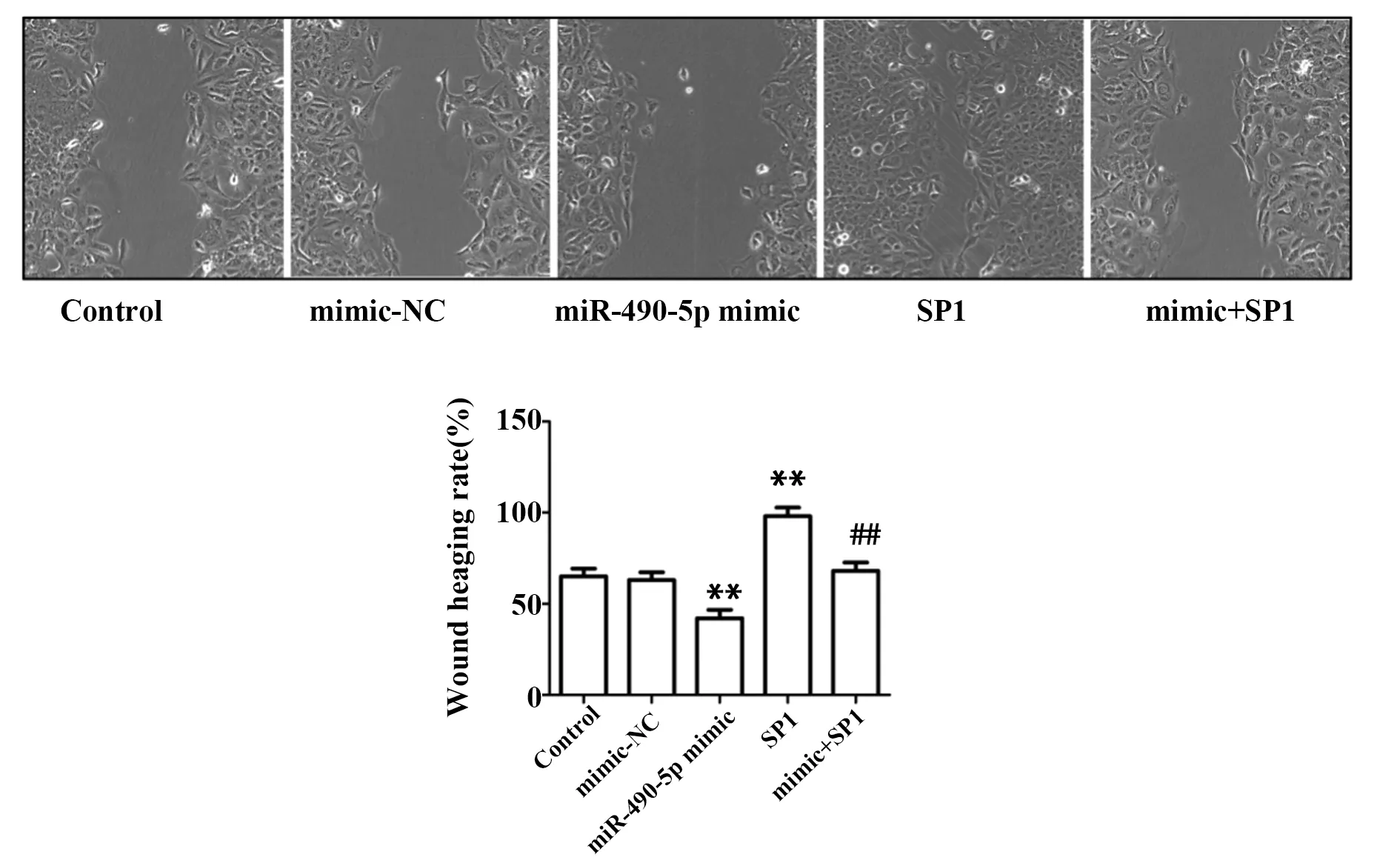
图6 划痕实验检测细胞迁移能力(×400)Fig.6 Migration ability of each group was tested by scratch test(×400)Note:**.P<0.01 versus control group;##.P<0.01 versus single transfection group.
2.8miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63上皮间质转化 与Control组相比,mimic-NC组E-cadherin和N-cadherin的表达无明显变化,miR-490-5p mimic组E-cadherin表达显著上调,N-cadherin表达显著下调;SP1组E-cadherin表达显著下调,N-cadherin表达显著上调,说明空载质粒对MG63细胞上皮间质转化无影响,miR-490-5p 过表达对MG63细胞上皮间质转化具有抑制作用,SP1过表达促进MG63细胞上皮间质转化;mimic+SP1组E-cadherin表达,与Control组和mimic-NC组比无明显变化,比 miR-490-5p mimic组显著下调,比SP1组显著上调;mimic+SP1组N-cadherin表达,与Control组和mimic-NC组比无明显变化,比 miR-490-5p mimic组显著上调,比SP1组显著下调,说明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63上皮间质转化(P<0.01,图7)。
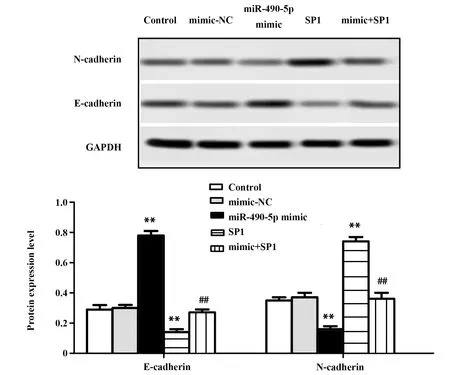
图7 Western blot检测E-cadherin和N-cadherin的表达Fig.7 Expression levels of E-cadherin and N-cadherin were detected by Western blotNote:**.P<0.01 versus control group;##.P<0.01 versus single transfection group.
2.9miR-490-5p过表达抑制骨肉瘤细胞MG63体内生长和运动 30 d后,与Control组相比,miR-490-5p mimic组肿瘤重量显著减轻,说明miR-490-5p过表达抑制骨肉瘤细胞MG63的发生和发展(P<0.01,图8A)。与Control组相比,miR-490-5p mimic组Ki67、Bax和caspase-3表达显著下降,E-cadherin表达显著升高,说明miR-490-5p过表达抑制骨肉瘤细胞MG63体内增殖和上皮间质化、诱导细胞凋亡(P<0.01,图8B)。
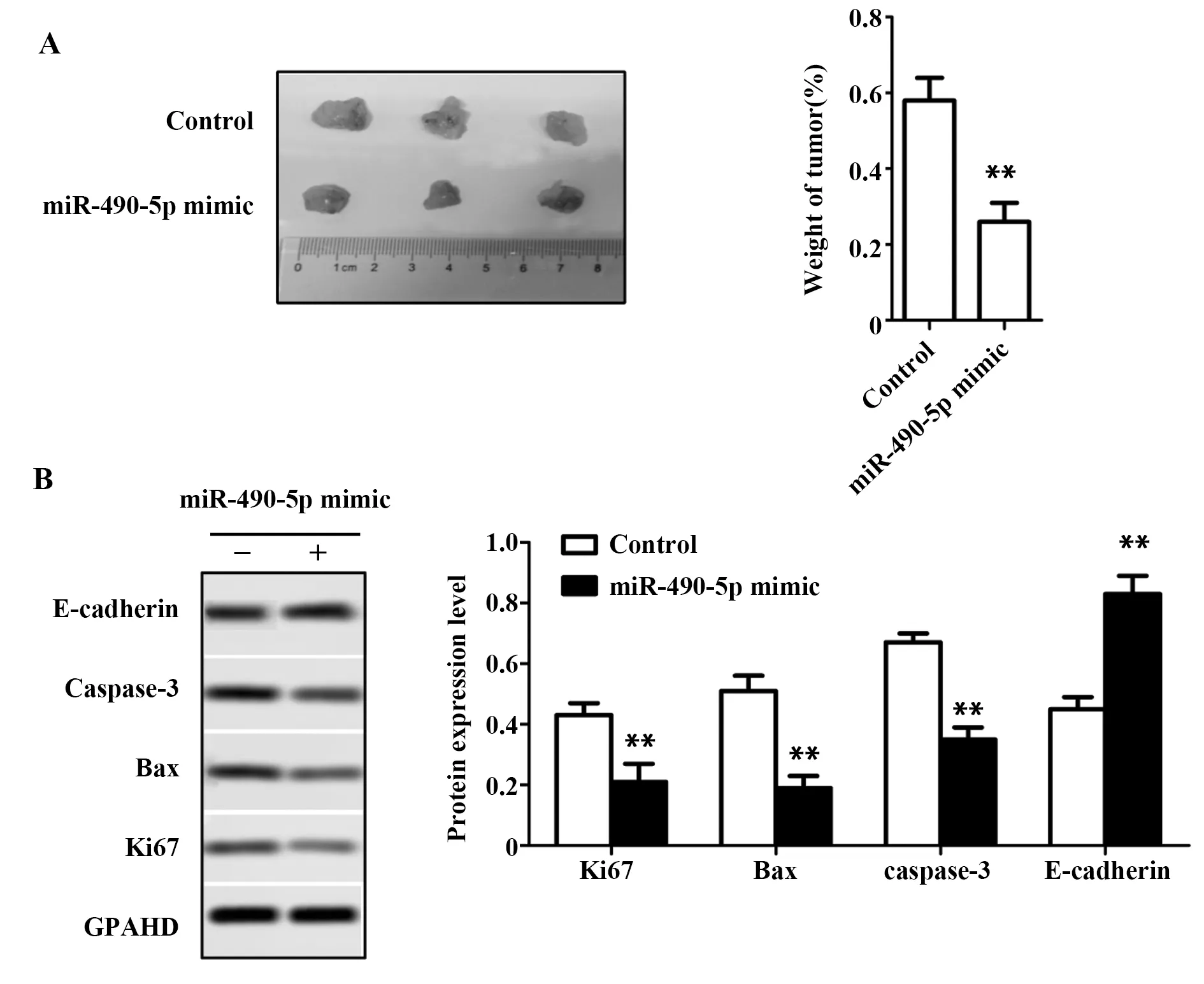
图8 裸鼠体内实验结果Fig.8 Results of nude mouse in vivo experimentNote:A.Tumor weight statistics;B.Expression levels of Ki67,Bax,caspase-3 and E-cadherin were detected by Western blot.**.P<0.01 versus control group.
3 讨论
miRNA在癌症中异常表达,可作为癌基因或抑癌基因发挥作用[7]。如miR-302a在人骨肉瘤细胞中低表达,并抑制骨肉瘤细胞的迁移和侵袭[8]。已有研究发现miR-490-5p在肾细胞癌中低表达,并通过靶向PIK3CA抑制肾细胞癌细胞生长[9]。本研究发现骨肉瘤组织中miR-490-5p表达水平低于非癌组织,提示miR-490-5p可能作为肿瘤抑制因子参与骨肉瘤发病。
SP1 基因位于人染色体第 12q13.1 区域,由 788 个残基组成,参与几乎所有的细胞功能,包括细胞增殖、凋亡和分化[10]。SP1是一种促癌蛋白,在肿瘤组织中的表达显著上调,且与肿瘤的浸润程度呈正相关,而下调SP1能抑制癌细胞形成肿瘤[11]。已有研究发现miR-335通过靶向SP1调控人骨肉瘤细胞MG63的增殖[12]。本研究发现miR-490-5p和SP1具有靶向关系,并与SP1在3′UTR区存在结合位点,并且miR-490-5p过表达抑制SP1表达,从而抑制骨肉瘤细胞MG63的生长和运动。
骨肉瘤作为常见的原发性恶性肿瘤,其发生、发展是多步骤、多阶段、多因素共同参与的结果,而细胞过度增殖是其生理功能最突出的变化[13]。因此,有效抑制细胞增殖是骨肉瘤治疗的关键。已有报道miR-490-5p过表达能够抑制肝癌细胞的增殖,因此,miR-490-5p过表达有望抑制骨肉瘤细胞的增殖[14]。本研究发现,miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63的增殖。而肿瘤的发生不仅是因为细胞的增殖速度快,而且和细胞的凋亡速度息息相关。因此,干预细胞凋亡是骨肉瘤治疗的关键。Xu等[15]报道miR-490-5p过表达诱导肝癌细胞凋亡,因此,miR-490-5p过表达有望诱导骨肉瘤细胞凋亡。本研究证明miR-490-5p过表达靶向SP1诱导骨肉瘤细胞MG63凋亡。
骨肉瘤患者症状为短期疼痛和肿胀,刚发病时易被忽略,因此,一般就诊时症状已经持续了较长时间[16]。而由于骨肉瘤具有高度侵袭性和远处转移的潜能,所以通常确诊时约85%的骨肉瘤患者已经发生转移[17]。骨肉瘤早期及术后易发生血源性转移,最常见于肺,其次为其他身体组织和器官,这往往是造成癌症患者死亡的主要原因[18]。因此,有效抑制细胞的侵袭和转移速度是骨肉瘤治疗的关键切入点之一。已有研究报道miR-490-5p通过直接调控ROBO1抑制肝癌细胞的增殖、迁移和侵袭,因此,miR-490-5p过表达有望抑制骨肉瘤细胞的侵袭和迁移[19]。本研究证明miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63的侵袭和迁移。在转移进展过程中,上皮间质转化驱动原发性上皮样肿瘤细胞获得侵袭性间充质表型,活动性和侵袭性增强,最终通过直接的局部组织浸润或通过血管和淋巴管发生转移[20]。因此,骨肉瘤中控制上皮间质转化是一种有效抑制细胞转移和提高癌症患者生存率的策略。本研究发现,miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63上皮间质转化。
通过体外实验可知,miR-490-5p过表达靶向SP1抑制骨肉瘤细胞MG63生长和运动。相比单一的外部环境,生物体内环境是极其复杂多变的,为了更好地了解miR-490-5p对骨肉瘤细胞生长和运动的影响,本研究进行了裸鼠体内实验,发现miR-490-5p过表达可减轻小鼠骨肉瘤,抑制骨肉瘤细胞MG63体内增殖和上皮间质化、诱导细胞凋亡。
综上所述,miR-490-5p靶向SP1对骨肉瘤细胞MG63生长和运动起调节作用,主要诱导细胞凋亡、抑制细胞增殖、侵袭、迁移和上皮间质转化。这说明miR-490-5p在骨肉瘤的发生和发展中具有重要作用,但其是否为骨肉瘤治疗靶点还有待进一步研究。