IMP3基因沉默介导Notch信号通路对结直肠癌上皮间质转化及血管生成的影响①
2020-09-29肖忠盛丁成明肖友忠刘丽兵
肖忠盛 龙 泓 丁成明 肖友忠 刘丽兵
(南华大学附属第一医院 胃肠外科,衡阳 421001)
结直肠癌是常见的消化系统恶性肿瘤之一,具有发病隐匿、预后较差的特点,对患者的生命健康造成严重威胁[1]。上皮-间质转化(epithelialmesen-chymal transition,EMT)是生物体内上皮细胞向间质细胞表型转化的一种生物学过程,已证实与多种恶性肿瘤的侵袭转移相关[2]。除EMT外,恶性肿瘤非可控的血管新生能力同样是影响肿瘤生长及侵袭转移的重要因素[3]。胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulin-like growth factor Ⅱ mRNA binding protein 3,IMP3)是人体内高度保守的mRNA结合蛋白[4]。既往研究证实其在乳腺癌、胃癌等多种肿瘤的进展中扮演重要角色[5,6]。但对于其具体机制及是否通过Notch信号通路等下游通路影响肿瘤尚未完全明确。Notch信号通路是一种能够对肿瘤细胞增殖、凋亡及周期调控等造成重要影响的通路,高表达的Notch通常促进胃癌及结肠癌等肿瘤的形成[7]。本研究在前人研究的基础上,进一步探讨IMP3是否通过Notch信号通路影响结直肠癌的EMT以及血管生成,以期为结直肠癌的治疗进一步提供依据。
1 材料与方法
1.1材料
1.1.1试剂及设备 IMP3 shRNA序列及阴性对照序列由华大基因合成;lipofectamin 2000试剂盒购自赛默飞世尔;Notch通路抑制剂BMS-708163购自MedChemExpress有限公司; RIPA裂解液和BCA试剂盒购自碧云天生物技术有限公司;Western blot中抗体均购自Abcam;MTT试剂盒购自Sigma-Aldrich;Transwell小室和Matrigel胶购自上海前尘生物科技有限公司;光学显微镜和酶联免疫检测仪购自Molecular Device。
1.1.2研究对象 收集2017年1月~2018年2月于我院确诊的73例结直肠癌患者肿瘤切除术后的新鲜结直肠癌组织及癌旁组织(距病灶5 cm)。患者年龄36~82岁,平均 (59.11±6.60) 岁。依据国际抗癌联盟2010年标准对患者进行TNM分期[8]:Ⅰ期33例、Ⅱ期40例。受试者均遵照以下纳排标准[9]:经过临床、影像、病例确诊的结直肠癌瘤;诊断时未发生转移;经过标准诊疗程序;所有病例术前均未经放疗、化疗。排除标准:继发性病灶;未按照规范程序诊疗;其他恶性肿瘤病史。所有瘤组织及癌旁组织样本均切成小块后迅速置于冻存管中以液氮保存。本研究经我院临床实验伦理委员会同意,所有患者签署知情同意书。
1.2方法
1.2.1免疫组化半定量检测癌症及癌旁组织中IMP3蛋白表达 10%的甲醛固定组织,烤片,脱蜡,梯度酒精脱水。用pH=6.0的柠檬酸钠微波修复,加热沸腾20 min,自然冷却,PBS洗涤5 min×3次。3%的H2O2阻断内源性过氧化物酶15 min,PBS冲洗后擦干,滴加5% BSA封闭液并于37℃孵育30 min。滴加人IMP3一抗4℃孵育过夜,PBS溶液洗涤5 min×3次。滴加生物素化的二抗山羊抗兔IgG于37℃孵育30 min后PBS冲洗5 min×3次。滴加辣根过氧化物酶标记的卵白素工作液,37℃孵育30 min,PBS冲洗5 min×3次。DAB/H2O2反应染色,自来水冲洗,苏木素复染,常规脱水透明后封片。观察IMP3阳性表达的定位及IMP3阳性表达百分比,阴性细胞核为蓝色或浅蓝色,阳性细胞浆为棕黄色或强棕黄色,每张切片随机选取5个高倍视野 (400×),每个视野数100个细胞,按阳性细胞所占百分比评分[10]。
1.2.2细胞分组及处理 将购买的结肠癌细胞株SW620培养于含10%胎牛血清的1640培养液中,以1×105个/孔的密度接种于6孔板,置于37℃、5%CO2及饱和湿度的孵箱中培养。待细胞铺满培养板80%~90%时,用含10%胎牛血清的1640培养基传代培养。将SW620细胞分为空白组(不作任何处理)、阴性对照组(转染含IMP3 shRNA阴性对照序列的脂质体+lipofectamin 2000)、IMP3 shRNA组(转染含IMP3 shRNA序列脂质体+lipofectamin 2000)、通路抑制剂组(Notch通路抑制剂BMS-708163处理)、联合组(IMP3 shRNA联合BMS-708163共同处理)。
1.2.3Western blot检测各组细胞EMT和血管生成相关因子表达 RIPA裂解液溶于PMSF使其终浓度为1 mmol/L,取250 μl裂解液至离心管中裂解各组SW620细胞5 min后于4℃,12 000 r/min离心10 min,取上清,稀释后以BCA试剂盒测定蛋白浓度,SDS-PAGE凝胶电泳。电泳结束后转膜并用含5%BSA的TBST在脱色摇床上室温封闭1 h。弃封闭液,加入一抗Notch1、Hes1、Vimentin、E-cadherin、N-cadherin、VEGF、TNF-α或TGF-β,4℃孵育过夜。TBST漂洗10 min×3次。加入HRP(辣根过氧化物酶)标记的二抗IgG于室温摇床孵育2 h。TBST漂洗5 min×3次,ECL显色,X片曝光,照相。使用E-Gel Imagergel documentation system分析显色条带吸光度。以样本的平均吸光度除以相应内参照的平均吸光度即为样本蛋白的相对含量,将各样本蛋白的相对含量间做统计分析图。
1.2.4四唑盐(MTT)比色法检测各组细胞活力 SW620细胞处理48 h后,0.25%胰酶消化30 s,调整细胞密度为1×104个/孔接种到96孔板中继续培养24~72 h。随后每个培养孔中加入MTT溶液20 μl(5 mg/ml)放于培养箱中继续培养3 h,弃上清。每孔中加入DMSO 150 μl,震荡使结晶溶解并混匀。用酶联免疫检测仪在490 nm波长处测量各孔吸光值,以空白培养基调零,取各组平行孔的平均OD值,绘制各组细胞的生长曲线。
1.2.5Transwell检测各组细胞侵袭能力 用预冷的无血清DMEM培养基以1∶10 稀释Matrigel后,各上室加入100 μl,室温放置2 h;将上述各组处理48 h 的SW620细胞消化后用无血清DMEM 培养基重悬,计数并稀释至3×105个/ml,取100 μl 加入Transwell上室,下室中加入600 μl含10%血清的DMEM培养基,按照Transwell小室说明书操作,用结晶紫染色,光镜下随机选取3个视野并计数跨膜的细胞数并计算细胞侵袭率。侵袭率=穿过基质胶的细胞数/总细胞数×100%。

2 结果
2.1IMP3在癌组织中高表达 免疫组化结果表明,IMP3在组织各处都有表达。与癌旁组织 (38.7%) 相比,癌组织 (78.4%) 中IMP3蛋白表达显著升高(P<0.05),见图1。

图1 IMP3蛋白在结直肠癌及癌旁组织中的表达(×200)
2.2IMP3沉默介导Notch通路抑制SW620细胞上皮间质转化 Western blot结果表明,相较于阴性对照组,IMP3 shRNA组、通路抑制剂组和联合组中Notch1及Hes1表达显著下降,差异均有统计学意义(P<0.05),联合组抑制效果更明显,与IMP3shRNA组、通路抑制剂组相比,差异均有统计学意义(P<0.05)。与阴性对照组相比,IMP3 shRNA组、通路抑制剂组和联合组N-cadherin和Vimentin蛋白水平显著降低,但E-cadherin在上述组中表达显著升高(P<0.05)。联合组N-cadherin和Vimentin指标变化更明显,与shRNA组和抑制剂组相比差异均有统计学意义(P<0.05)。空白组与阴性对照组各指标均无显著差异(P>0.05),见图2。
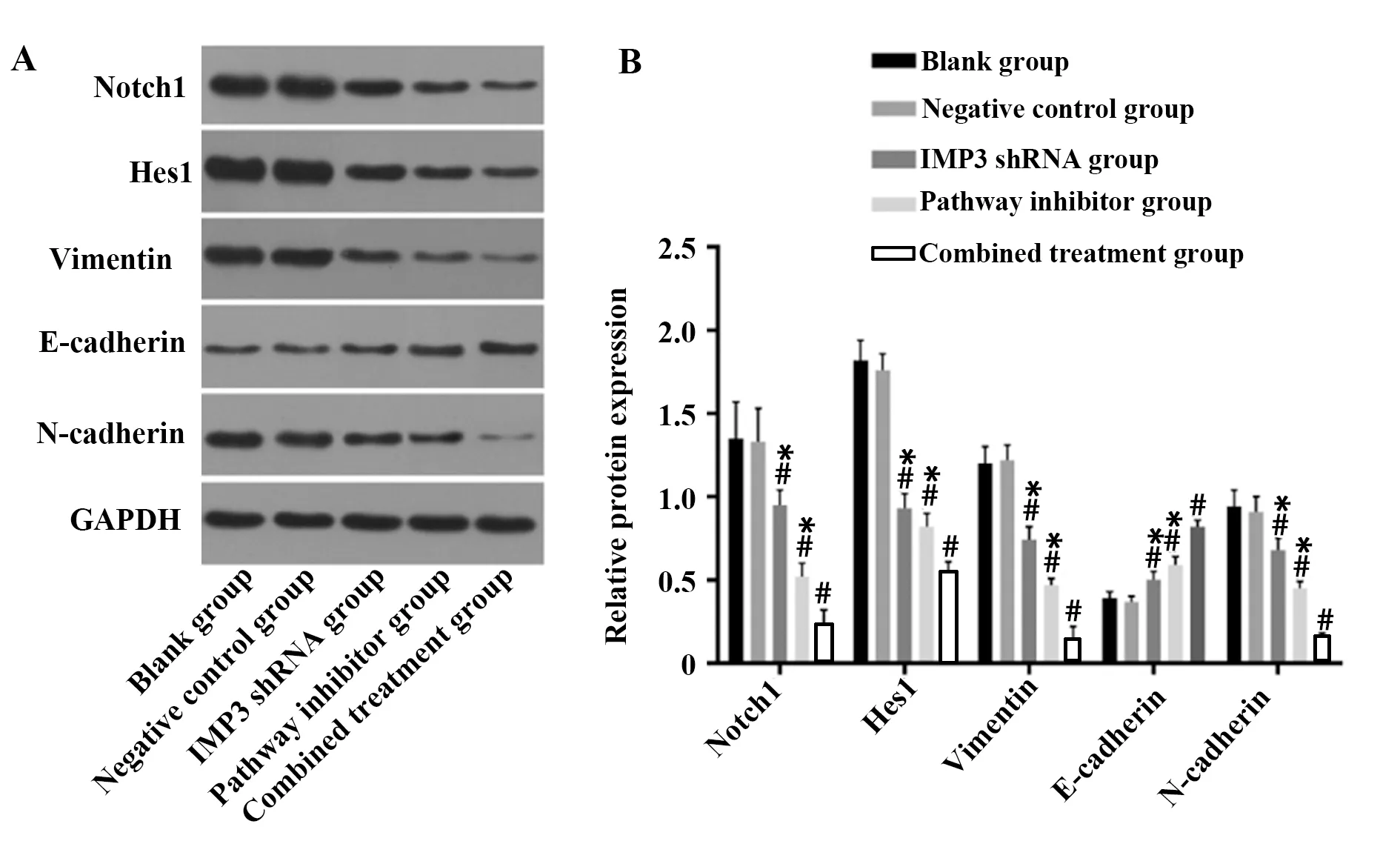
图2 各组细胞Vimentin、E-cadherin和N-cadherin蛋白表达情况Fig.2 Vimentin,E-cadherin and N-cadherin protein expression in each groupNote:A.Expression of Vimentin,E-cadherin and N-cadherin was determined by western blot.B.Quantification of protein expression.Compared with Negative control group,#.P<0.05;compared with combined treatment group,*.P<0.05.

2.3IMP3沉默介导Notch通路抑制SW620细胞血管生成相关因子表达 与阴性对照组相比,IMP3 shRNA组、通路抑制剂组和联合组VEGF、TNF-α和TGF-β蛋白水平降低,差异均有统计学意义(P<0.05);空白组上述三种因子表达均无显著差异(P>0.05)。联合组效果对上述蛋白的抑制效果更明显,与shRNA组和抑制剂组相比差异均有统计学意义(P<0.05),见图3。
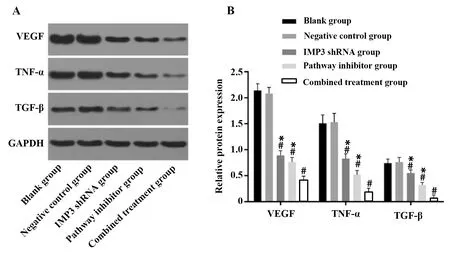
图3 各组细胞VEGF、TNF-α和TGF-β蛋白表达情况Fig.3 VEGF,TNF-α and TGF-β protein expression in each groupNote:A.Expression of VEGF,TNF-α and TGF-β was determined by western blot.B.Quantification of protein expression.Compared with Negative control group,#.P<0.05;compared with combined treatment group,*.P<0.05.
2.4IMP3沉默介导Notch通路抑制SW620细胞活力 与阴性对照组相比,IMP3 shRNA组、通路抑制剂组和联合组细胞活力在24 h、48 h及72 h均显著降低(P<0.05);空白组在上述时间点均无显著差异(P>0.05)。联合组细胞活力降低更为明显,与shRNA组和通路抑制剂组相比差异均有统计学意义(P>0.05),见表1。
表1 MTT检测各组细胞活力

2.5IMP3沉默介导Notch通路减弱SW620细胞侵袭能力 与阴性对照组相比,IMP3 shRNA组、通路抑制剂组和联合组穿胶细胞数均显著增多(P<0.05);空白组无显著差异(P>0.05)。联合组细胞侵袭受到更显著的抑制,与shRNA组和通路抑制剂组相比差异均有统计学意义(P<0.05),见图4。

图4 Transwell法检测各组细胞侵袭能力(×400)
3 讨论
越来越多的研究证实,多种恶性肿瘤中均可见EMT的发生,出现EMT的患者对放化疗不敏感,对分子靶向药物的耐药性也逐渐增强,EMT则是患者对此类药物产生耐药的关键因素之一[11]。非可控的血管新生能力作为恶性肿瘤的重要特征,也是引起肿瘤生长和侵袭转移的重要因素[12]。本研究从结直肠癌EMT及血管生成的分子调控机制出发,证实了IMP3基因介导Notch信号通路在结直肠癌中的调控机制。
本研究对切除的结直肠癌组织和癌旁组织行HE染色发现,相对于癌旁组织,结直肠癌腺体组织结构紊乱,且血管生成和炎症细胞浸润明显。IMP3基因是胰岛素样生长因子mRNA结合蛋白家族(IMPs)的 成员之一,Riener等[13]在研究中发现,IMP3在头颈部鳞状细胞癌中表达显著增强,且其表达程度与癌患者的临床分期、淋巴结转移及远处转移等存在关联。Wei等[14]也发现,IMP3表达增强可能是结肠癌进展过程中的早期事件,也是促进结肠癌细胞增殖的重要原因。本研究通过免疫组化检测IMP3在结直肠癌和癌旁组织中的表达,发现IMP3在癌组织(78.4%)中表达显著高于其在癌旁组织(38.7%)中表达。进一步证实了IMP3在结直肠癌进展中扮演重要角色。
Notch信号通路广泛存在于生物体内,对细胞的生长、发育、凋亡、分化等起重要的调控作用[15]。Notch信号通路与多种肿瘤的发生密切相关,越来越多的研究证实结直肠癌患者体内Notch信号通路被显著激活[16]。Hes1是Notch的靶基因,同时也是肿瘤干细胞的重要标记物。在肿瘤组织中,Hes1高表达会导致肿瘤细胞过度增殖,而阻断其表达则会加速诱导肿瘤细胞的凋亡和分化[17]。Notch1作为Notch通路的主要受体,在细胞的增殖凋亡调控中发挥重要作用。Notch1高表达可加速未分化细胞的恶化,在结直肠癌进展中发挥促癌作用[18]。本研究发现,Notch1以及Hes1在结肠癌细胞中表达显著增强,沉默IMP3基因后,其表达被抑制,提示IMP3基因沉默在抑制Notch信号通路表达中发挥重要作用。肿瘤在进展过程中,其细胞能够与周围间质相互作用,上皮细胞逐渐转化为间质细胞,具体表现为上皮细胞标志物E-cadherin表达的减弱以及间质细胞标志物Vimentin和N-cadherin表达的增强,这种现象也被称为EMT,是导致肿瘤侵袭转移的重要原因[19]。本研究发现,相对于阴性对照组,IMP3 shRNA组及Notch通路抑制组的Vimentin和N-cadherin表达降低,而E-cadherin表达升高,联合组变化更明显,进一步提示了IMP3基因沉默能够抑制Notch信号通路进而抑制SW620细胞EMT的发生。血管生成是肿瘤细胞增殖、侵袭以及疾病进展的重要因素。TNF-α作为人体内关键促炎因子,能够激活多种血管生成相关因子进而引起缺血、肿瘤血管生成增加[20]。VEGF和TGF-β是常见的促血管生成因子,与多种肿瘤的血管生成有关,同时也可作为癌症浸润转移等生物学行为的重要评估指标[21]。本研究测量处理后细胞的血管生成相关因子发现,IMP3基因沉默或抑制Notch信号通路能够抑制TNF-α、VEGF和TGF-β的表达,且联合组抑制程度更明显,提示IMP3基因沉默介导Notch信号通路在抑制结直肠癌血管生成中具有重要作用。MTT以及Transwell实验进一步检测各组细胞活力及细胞侵袭能力,发现IMP3沉默或抑制Notch通路表达后,SW620细胞的细胞活力及侵袭率均显著降低,且联合组更明显,进一步说明了IMP3基因沉默能够介导Notch信号通路发挥对SW620细胞活力和侵袭能力的抑制作用。
综上所述,IMP3基因沉默能够抑制Notch通路活化进而抑制结直肠癌EMT及血管生成,在结直肠癌的进展中具有保护作用。IMP3以及Notch通路联合处理能够在结直肠癌的治疗中发挥更好的效果。对于IMP3介导Notch通路是否受上游miRNA的调控仍需进一步实验证实。