盐酸羟考酮在大鼠胃癌根治术中的超前镇痛效果评价及对应激反应的影响
2022-12-26李正凯阮雁捷郭冠军
李正凯 阮雁捷 郭冠军 张 乐 张 品
胃癌是最常见的恶性肿瘤之一,给人类生命健康带来严重危害,临床上外科手术是主要治疗方式。胃癌根治术对患者造成很大创伤,术后疼痛是患者要面临的严重问题,尤其是深部内脏牵拉的疼痛感,一直是术后镇痛难题[1]。同时手术对机体产生损伤,患者容易发生氧化应激反应,进一步损伤正常组织。良好的镇痛方式可以有效减轻患者术后炎症反应和应激反应,降低并发症发生率[2]。盐酸羟考酮是一种μ、κ受体双重激动的半合成阿片类药物,对中枢神经系统具有强效镇痛作用[3]。临床研究表明,盐酸羟考酮对内脏痛具有良好镇痛作用,常用于内脏手术术后镇痛[4]。超前镇痛是指在伤害性刺激之前采取措施对其进行阻滞,可有效减轻伤害性刺激诱发的疼痛感。研究发现,盐酸羟考酮超前镇痛对恶性肿瘤患者术后镇痛效果良好且不良反应小,但其在胃癌根治术中的效果报道尚少[5]。本研究通过观察盐酸羟考酮对大鼠胃癌根治术超前镇痛效果,并初步探讨其镇痛机制,为临床胃癌根治术患者围术期镇痛提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠40只,SPF级,雄性,4周龄,平均体质量(100±20)g,购自上海南方模式生物科技股份有限公司,生产许可证号:SCXK(沪)2017-0010,使用许可证号:使用许可SYXK(沪)2018-0002。大鼠在温度(23±2)℃,湿度(55±5)%,12 h/12 h明暗循环下适应性饲养7 d。
1.1.2 药物、主要试剂和仪器 N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)(大连美仑生物技术有限公司,纯度>95%),盐酸羟考酮注射液(以色列RAFA LABORATORIES LIMITED公司,国药准字J20180002,1 mL∶10 mg×5支),一氧化氮(nitric oxide,NO)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondial dehyde,MDA)试剂盒(南京建成生物工程研究所),大鼠P物质(substance P,SP)酶联免疫分析试剂盒(上海沪震生物科技有限公司),兔抗大鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)多抗、核转录因子κB(nuclear transcription factor κB,NF-κB)p65多抗、山羊抗兔IgG-HRP(美国Abcam公司),38450-电子触觉测量仪、热辐射痛阈检测仪(意大利Ugo Basile公司)。
1.2 方法
1.2.1 建立大鼠胃癌模型及分组 随机取30只大鼠,参照文献[6],采用MNNG诱导大鼠胃癌模型,用5%酒精-水溶液将MNNG配成浓度为1 g/L的母液,4 ℃避光保存,使用前再稀释成MNNG终浓度为100 μg/mL的溶液,置于避光瓶内。造模第1天起,给予大鼠饮用浓度为100 μg/mL MNNG的水剂作为常规饮用水,饲喂正常块状饲料;连续饮用8周后,饲喂上述MNNG水剂配制的粉状饲料代替之前的块状饲料喂养大鼠;24周后改用正常块状饲料喂养,隔天给予MNNG水剂;28周起停止给予MNNG水剂,改用自来水喂养1周。剔除造模过程中死亡大鼠2只,剩余28只随机分为模型组9只,前给药组9只,后给药组10只。其余10只大鼠正常喂养,为对照组。
1.2.2 干预方法 开腹前30 min,对照组、模型组大鼠按0.2 mg/kg腹腔注射生理盐水,前给药组大鼠按0.2 mg/kg腹腔注射盐酸羟考酮注射液。注射30 min后,模型组、前给药组、后给药组大鼠按4 mL/kg腹腔注射水合氯醛(10% w/v)进行麻醉,腹部剃毛,在腹部正中切口,切除胃部病变部分,将直径1 mm硅胶管埋入胃内,胃前壁双层荷包缝合结扎,腹壁戳口引出导管,将戳口周围腹膜缝合固定。开腹后30 min,后给药组大鼠按0.2 mg/kg腹腔注射盐酸羟考酮注射液。所有手术大鼠术后按0.1 mL/只注射青霉素(80万单位)以防感染。对照组大鼠不做手术。肉眼观察切除的胃黏膜有无灰白色结节、隆起、糜烂、溃疡等变化,将胃黏膜病变部分行HE染色,镜检观察胃黏膜有无肠化生及异型增生等胃癌典型病理变化,剔除胃黏膜无上述变化的大鼠,模型组、前给药组、后给药组各剔除一只。
1.2.3 测定机械性缩足反射阈值(paw withdrawal mechanical threshold,PWMT) 分别于术后24、48、72 h采用电子Von Frey测量仪测定大鼠PWMT。将大鼠单独放入底部为铁丝网的透明塑料隔间内,适应30 min后,用测量仪的测试探针刺激大鼠两后足底中部,至尼龙丝出现弯曲,缓慢加压,不同强度之间间隔30 s,直到大鼠出现缩足反应,每个强度测试5次,出现3次缩足反应为止,记录仪器显示的读数。每足测量3次,取平均值。
1.2.4 测定热刺激缩足反射潜伏期(paw withdrawal thermal latency,PWTL) 分别于术后24、48、72 h测定大鼠PWTL。大鼠测完PWMT值后,将大鼠单独放置于底部为2 mm厚有机玻璃的塑料箱中,适应30 min后,用热辐射痛阈检测仪照射大鼠两后足底部,至大鼠出现缩足或舔足时停止照射,记录检测仪上的时间,为PWTL,设定检测仪自动切断时间为25 s,同一部位刺激间隔时间为5 min,每只大鼠重复测量5次,去除最大值与最小值,取剩余3次平均值。
1.2.5 检测血清NO、SP水平 末次PWTL测完后,颈椎脱臼处死大鼠,心脏采血3 mL,放入EP管,4 ℃ 4000 r/min(离心半径12 cm)离心10 min,分离上清液后保存在-80 ℃的冰箱中。取保存血清,根据试剂盒说明书采用硝酸还原酶法检测血清中NO浓度;SP浓度检测采用双抗体夹心ELISA法,严格按照试剂盒说明书操作,终止反应后用酶标仪在450 nm波长处测光密度(A)值,绘制标准曲线计算出样品大鼠血清SP浓度。
1.2.6 检测脊髓组织GSH-Px、SOD、MDA水平 末次PWTL测完后,颈椎脱臼处死大鼠,快速分离并取出脊髓,放入液氮中冷冻保存备用。取脊髓组织70 mg制备组织匀浆,严格按照ELISA试剂盒说明书进行操作,终止反应后在450 nm处读取吸光度(A)值,绘制标准曲线,计算样品GSH-Px、SOD、MDA的浓度。
1.2.7 检测脊髓组织iNOS、NF-κB p65蛋白相对表达量 取脊髓组织80 mg于液氮中研磨,加入全细胞裂解液,提取总蛋白,检测蛋白浓度后,蛋白样本加入上样缓冲液,变性后进行SDS-PAGE电泳分离等量蛋白,湿法将蛋白转移至PVDF膜,用5%脱脂奶粉封闭2 h,添加iNOS、NF-κB p65一抗(1∶1 000)4 ℃封闭过夜,加入HRP标记的山羊抗兔二抗(1∶4 000),室温孵育2 h,ECL显影、定影、拍照,分析蛋白条带灰度值,计算iNOS、NF-κB p65蛋白相对表达量(以iNOS、NF-κB p65蛋白条带灰度值/β-actin蛋白条带灰度值表示)。
1.3 统计学方法

2 结果
2.1 各组大鼠不同时间PWMT比较
24、48、72 h PWMT组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、前给药组、后给药组24、48、72 h PWMT均减小,差异有统计学意义(P<0.05);与模型组比较,前给药组、后给药组24、48、72 h PWMT均增大,且后给药组24、48、72 h PWMT均低于前给药组,差异有统计学意义(P<0.05)。对照组、模型组、前给药组、后给药组24、48、72 h PWMT随着时间延长而增大,差异有统计学意义(P<0.05)。见表1。
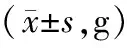
表1 各组大鼠不同时间PWMT比较
2.2 各组大鼠不同时间PWTL比较
24、48、72 h PWTL组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、前给药组、后给药组24、48、72 h PWTL均缩短,差异有统计学意义(P<0.05);与模型组比较,前给药组、后给药组24、48、72 h PWTL均延长,且后给药组24、48、72 h PWTL均长于前给药组,差异有统计学意义(P<0.05)。对照组、模型组、前给药组、后给药组24、48、72 h PWTL随着时间延长而延长,差异有统计学意义(P<0.05)。见表2。
2.3 血清NO、SP水平比较
血清NO、SP浓度组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、前给药组、后给药组NO、SP浓度均升高,差异有统计学意义(P<0.05);与模型组比较,前给药组、后给药组NO、SP浓度均降低,且后给药组NO、SP浓度均高于前给药组,差异有统计学意义(P<0.05)。见表3。
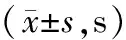
表2 各组大鼠不同时间PWTL比较

表3 各组大鼠血清NO、SP水平比较
2.4 脊髓组织GSH-Px、SOD、MDA水平比较
脊髓组织GSH-Px、SOD活力、MDA含量组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、前给药组、后给药组GSH-Px、SOD活力均下降,MDA含量均升高,差异有统计学意义(P<0.05);与模型组比较,前给药组、后给药组GSH-Px、SOD活力均升高,MDA含量均下降,且后给药组GSH-Px、SOD活力均低于前给药组,MDA含量高于前给药组,差异有统计学意义(P<0.05)。见表4。
2.5 脊髓组织iNOS、NF-κB p65蛋白水平比较
脊髓组织iNOS、NF-κB p65蛋白相对表达量组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、前给药组、后给药组iNOS、NF-κB p65蛋白相对表达量均升高,差异有统计学意义(P<0.05);与模型组比较,前给药组、后给药组iNOS、NF-κB p65蛋白相对表达量均降低,且后给药组iNOS、NF-κB p65蛋白相对表达量高于前给药组,差异有统计学意义(P<0.05)。见表5,图1。

表4 各组大鼠脊髓组织GSH-Px、SOD、MDA水平比较

表5 各组大鼠脊髓组织iNOS、NF-κB p65蛋白相对表达量比较
3 讨论
胃癌根治术创口和内脏疼痛刺激胃部及腹腔组织,诱发机体产生氧化应激反应,引起外周及中枢敏化,增强痛觉信号,导致患者痛觉阈值降低,加剧疼痛反应[7]。因此,选择合适的镇痛药物最大限度减轻手术创伤带给患者的疼痛至关重要。目前多数研究认为,在术前采取干预措施阻滞伤害性刺激,以减少外周及中枢敏化,提高患者痛觉阈值,从而减少或避免术后使用镇痛药物,减小氧化应激损伤[8]。目前研究发现,一些镇痛药物应用于妇科等手术超前镇痛,效果良好,本实验将盐酸羟考酮应用于胃癌根治术大鼠,以研究其对胃癌根治术超前镇痛的效果及其作用机制[9]。

图1 各组大鼠脊髓组织中各蛋白的表达
盐酸羟考酮可减轻与μ受体相关的伤害性疼痛,同时κ受体兴奋可减轻术后内脏痛,且不良反应较小,术后镇痛效果良好[10]。大鼠在胃癌根治术后表现对机械性刺激和热刺激痛觉过敏,与人临床术后疼痛相似。NO在机体疼痛调节机制中发挥着至关重要的作用,参与传递脊髓水平的伤害信息,与痛觉过敏的形成和发展密切相关,抑制体内NO生成可发挥有效镇痛作用[11]。SP是一种传递痛觉信息的神经递质,广泛参与多种疾病性疼痛的传导和调制[12]。本研究结果发现,前给药组及后给药组均可降低/缩短大鼠各个时间PWMT/PWTL,降低血清中NO及SP浓度,提示盐酸羟考酮具有显著镇痛作用,且前给药组比后给药组的镇痛效果更好,提示盐酸羟考酮对大鼠胃癌根治术具有超前镇痛作用。研究表明,采用盐酸羟考酮超前镇痛的腹腔镜胆囊切除术患者,术后不同时间点疼痛评分和血清炎症因子水平显著降低[13]。研究发现,盐酸羟考酮超前镇痛可以有效减轻内镜下儿童扁桃体切除术后的疼痛[14]。由此表明,使用盐酸羟考酮超前镇痛可有效减轻患者术后疼痛,结合本研究结果,提示盐酸羟考酮在胃癌根治术超前镇痛上同样具有应用价值。
正常体内氧化和过氧化系统处于平衡状态,手术等伤害性刺激可以导致神经系统产生氧化应激反应,体内MDA等氧化产物生成增多,SOD和GSH-Px等抗氧化酶生产减少,造成体内氧化和过氧化系统失衡,损伤细胞和组织,引发神经疼痛[15]。Mato等[16]研究表明,在关节炎疼痛大鼠中,减少氧化应激反应可以降低大鼠机械性异常性疼痛。研究显示,中线剖腹手术患者术后体内SOD1水平显著升高,且疼痛评分显著降低[17]。本研究前给药组和后给药组脊髓组织SOD、GSH-Px活力显著升高,MDA含量显著减少,提示盐酸羟考酮具有抗氧化作用,且前给药组抗氧化作用效果更显著,表明盐酸羟考酮对胃癌根治术后镇痛作用可能与抗氧化应激反应有关。
NF-κB以p50/p65异二聚体形式存在,在氧化应激诱导的细胞损伤中发挥着重要作用,氧化应激产生的自由基可以激活NF-κB,从而诱导iNOS转录,高表达的iNOS促进大量合成NO,进而增加伤害性痛觉信息在脊髓的传递和整合,加剧患者术后疼痛反应[18]。研究证实,抑制NF-κB/iNOS信号通路可以减少氧化应激导致的细胞凋亡[19]。另有研究表明,NF-κB、iNOS表达水平下调,抗氧化效果明显[20]。本研究中前给药组和后给药组NF-κB p65、iNOS蛋白水平显著下降,表明盐酸羟考酮通过抑制NF-κB/iNOS信号通路发挥抗氧化作用,同时前给药组NF-κB p65、iNOS蛋白水平更低,表明盐酸羟考酮发挥超前镇痛作用可能是通过抑制NF-κB/iNOS信号通路,减少氧化应激反应,发挥镇痛作用。
综上所述,盐酸羟考酮在胃癌根治术大鼠中具有超前镇痛作用,其作用机制可能是通过抑制NF-κB/iNOS信号通路,从而减少氧化应激反应,阻断伤害性信息传递,发挥镇痛作用,为临床胃癌根治术患者围术期镇痛提供理论参考。
