电极反应式的书写
2020-09-10张世敏
张世敏






摘要:电极反应式的书写是高考化学的热点之一,由于其陌生程度高、情境新颖且教材中未曾出现过,所以一直备受高考青睐,近年来该类题型在各地高考中均有出现,基本上以较难题为主,重点考查学生的理解分析能力和综合应用氧化还原反应知识的能力。下面笔者就电极反应的书写介绍一种快速准确地方法—四步法。该方法既适用于原电池又适用于电解池。
关键词:电极反应式;四步法;氧化剂和还原剂
一、常见氧化剂和还原剂
二、四步法
电极反应式书写“四步法”列物质—标得失—配电荷—配原子。
第一步,列物质:根据负极(或阳极)发生氧化反应,正极(或阴极)发生还原反应,
负极(或阳极)须找出还原剂并推测其氧化产物,正极(或阴极)须找出氧化剂并推测其还原产物;
第二步,标得失:根据化合价升价标示出得失电子数;
第三步,配电荷:若在酸性环境下,须通过H将方程式两边电荷配平;若在碱性环境下,须通过OH-将方程式两边电荷配平;若在中性环境下,须通过生成的H或OH-将方程式两边电荷配平;
第四步,配原子:一般情况下,是通过在方程式两边加H2O使得原子个数守恒。
三、依题说法
例1【2016江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。铁炭混合物在水溶液中可形成许多微电池,将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
解析:第一步,列物质:根据正极发生还原反应,结合化合价规律,正极列出物质:
Cr2O72- Cr3+;
第二步,标得失:根据化合价升价标示出得失电子数,Cr2O72- +6e- 2Cr3+;
第三步,配电荷:Cr2O72- +6e- 2Cr3+,方程式左边带8个单位负电荷,右边带6个单位正电荷,题目已知为酸性环境,故为使方程式两边电荷数相等,须通过左边加14个H,则14H+Cr2O72- +6e- 2Cr3+;
第四步,配原子:即通过观察法在方程式右边加7个H2O使原子个数相等。故该电极反应式为14H+Cr2O72- +6e- =2Cr3++7H2O。
例2【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。正极的电极反应式是_________。
解析:第一步,列物质:根据正极发生还原反应,结合化合价规律,正极列出物质:
NO3- NH4+;
第二步,标得失:根据化合价升价标示出得失电子数,NO3- +8e- NH4+;
第三步,配电荷:NO3- +8e- NH4+,方程式左边带9个单位负电荷,右边带1个单位正电荷,为使方程式两边电荷数相等,可通过左边加10个H或右边加10个OH-,若右边加10个OH-会与NH4+反应,不符合情境条件,故应在左边加10个H配平电荷,则NO3- +10H+8e- NH4+;
第四步,配原子:即通过观察法在方程式右边加3个H2O使原子个数相等。故该电极反应式为NO3- +10H+8e-=NH4++3H2O。
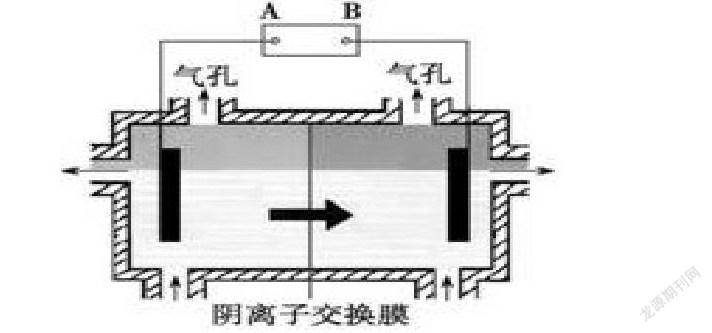
例3【2018年曲靖市高三第一次复习统测题】阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,实际生产中,阳极以稀硫酸为电解液。该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式___________________。
解析:
第一步,列物质:根据阳极发生氧化反应,结合化合价规律,阳极列出物质:
Mn2+ MnO2;
第二步,标得失:根据化合价升价标示出得失电子数,Mn2+ -2e- MnO2;
第三步,配电荷:Mn2+ -2e- MnO2,方程式左边带4个单位正电荷,右边电荷数为0,题目已知陽极为酸性环境,故为使方程式两边电荷数相等,须通过右边加4个H,则Mn2+ -2e- MnO2+4H;
第四步,配原子:即通过观察法在方程式左边加2个H2O使原子个数相等。故该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+。
参考文献:
[1].蒋红年.电极反应式书写混乱原因及对策[J].化学教育(中英文),2014,35(005):73-75.
[2].杨明生.关于电极反应式书写的两个问题的讨论[J].化学教育,2008,29(008):75-76.
