葫芦蜂幼虫褐变抑制的研究
2020-09-08张根生陈晓明黄国忠陈济宽张红城
张根生,陈晓明,2,黄国忠,陈济宽,张红城,2
(1. 哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2. 中国农业科学院 蜜蜂研究所,北京 100093;3. 龙陵县黄氏蜂业有限公司,云南 保山 678300)
葫芦蜂(Vespa velutinaLepeletier)[1],又叫黄脚胡蜂。原产于中国、印度北部和东南亚的热带和亚热带地区,后来引入法国西南部,进而在欧洲各国传播[2]。葫芦蜂具有很高的资源价值,体现在很多方面。生态坏境方面,可以为野生植物传粉[3]和捕食农林害虫[4];食用价值方面,含有丰富的营养素,亦可作为保健食品[5];药用价值方面,葫芦蜂既具有抗炎作用,又具有抗衰老功效[6]。因此,葫芦蜂的养殖、生产和销售产业链正在如火如荼地构建,已经达到一定的产业化规模。但是,市售的葫芦蜂幼虫和蛹通常呈现黄褐色,影响消费者的购买欲望。在昆虫中,多酚氧化酶(PPO) 是诱发黑化反应的主要酶,对于防止病原微生物入侵和伤口愈合至关重要[7-8]。昆虫中的多酚氧化酶是3 型含铜蛋白(type 3 copper protein),该蛋白的活性中心有2 个铜结合位点,每个铜结合位点由3 个保守的组氨酸螯合铜离子形成[8]。
酶促褐变的控制主要有化学方法和物理方法2 种。化学方法按照控制机理又可分为直接抑制和间接抑制。直接抑制是指抗褐变剂直接作用于PPO 分子,通过螯合PPO 活性中心铜离子而使其失去活性,如高兴祥等人[9]用曲酸抑制甜菜夜蛾中的PPO。间接抑制是指抗褐变剂与褐变中间产物或底物反应形成络合物,从而其避免与PPO 接触以达到抑制褐变的目的,如1 mmol/L 半胱氨酸能明显抑制家蚕中的多酚氧化酶活性[10]。物理方法主要包括热处理和非热处理2 种方式。因为热处理会导致营养成分和风味的损失,所以越来越多地用非热处理钝化PPO。但是非热处理技术几乎没有应用在昆虫上,而在更加常见的海产品和果蔬上应用较多。李秀霞等人[11]利用超高压钝化南美白对虾的多酚氧化酶。结果表明,钝化效果随着超高压压强的增大而逐渐增大,超过350 MPa/10 min 超高压处理能有效钝化多酚氧化酶活性。肖建等人[12]利用高密度CO2钝化哈密瓜汁中的PPO,处理后的PPO 酶活最大下降了约79%。
酶促褐变抑制的另外一种延伸就是物理方法结合化学方法,如超声波联合抗坏血酸可显著抑制鲜切苹果果肉褐变率及多酚氧化酶的活性,抑制率分别高达46%和98%[13]。单独使用苹果酸(10,20,30 mmol/L) 或超声波处理都无法有效钝化PPO,但两者结合的钝化效果明显强于单独使用的效果[14]。这种非热处理联合抗褐变剂的方法能保证食品的感官品质和营养价值,但是几乎很少用于昆虫。因此,采用超高压联合抗坏血酸抑制葫芦蜂幼虫中的多酚氧化酶,通过SDS 电泳和Native 电泳筛选出多酚氧化酶条带,并对该条带做了质谱分析。
1 材料与方法
1.1 材料与试剂
葫芦蜂幼虫,云南省龙陵县黄氏蜂业有限公司提供;二水合磷酸二氢钠、十二水合磷酸氢二钠,Sigma 公司提供;邻苯二酚、L - 抗坏血酸,上海麦克林生化科技有限公司提供;预染蛋白Maker (NO.26616)、NativeMark (LC0725),美国Thermo Fisher公司提供;NovexR 4- 12%Tris- 甘氨酸凝胶、Novex R Tris- 甘氨酸SDS 上样缓冲液(2x)、NovexR Tris-甘氨酸Native 上样缓冲液(2x)、NovexR Tris- 甘氨酸SDS 电泳缓冲液 (10x)、Novex R Tris- 甘氨酸Native 电泳缓冲液(10x),Invitrogen 公司提供。
1.2 仪器与设备
AL104 型电子天平、SevenEasy 型pH 计,梅特勒- 托利多仪器(上海) 有限公司产品;Milli- Q Intergral 型超纯水一体化系统,美国Merk Millipore公司产品;UP- 250 型超声波细胞破碎机,宁波新芝生物科技股份有限公司产品;Sorvall Biofuge Startos型台式离心机、Orbitrap Fusion 质谱仪,美国Thermo Fisher 公司产品;SY21- K 型电热恒温水浴锅,北京长风仪器仪表公司产品;UV- 2550 型紫外分光光度计,日本岛津公司产品;HPP.W1 系列超高压设备,天津华泰森淼生物工程技术股份有限公司产品;DYY- 6C 型电泳仪,北京市六一仪器厂产品;XCell SureLockTM Mini- Cell and Xcell 型蛋白垂直电泳槽,Invitrogen 公司产品;IKAR C- MAG HP10 型数显加热板,德国IKA 公司产品;TS- 2 型脱色摇床,江苏海门其林贝尔仪器制造有限公司产品;电泳图像扫描仪,美国Bio- Rad 公司产品。
1.3 方法
1.3.1 PPO 的制备
参照Shi X L 等人[15]制备粗酶液,并稍作修改。取4.0 g 冻存的葫芦蜂幼虫样品,加入20 mL 预冷的磷酸盐缓冲液(50 mmol/L,pH 值7,温度4 ℃) 冰浴研磨,之后迅速放入冰浴的离心管中,然后用超声波细胞破碎机匀浆破碎2 min,匀浆液于4 ℃下浸提30 min 后于4 ℃下以转速10 000 r/min 离心20 min,用16 层纱布过滤,上清液即为粗酶液,于- 80 ℃下备用,测定前冷水浴溶解。
1.3.2 PPO 活力的测定
参照Sadawarte A K 等人[16]的方法并略有改进。以邻苯二酚为底物,将浓度50 mmol/L 磷酸盐缓冲液2 mL (pH 值6.0) 与浓度20 mmol/L 的邻苯二酚1 mL混合均匀,于30 ℃下预热10 min,然后加入30 ℃预热2 min的酶液200 μL,混匀后,于波长420 nm 处每10 s 记录一次吸光度的变化,连续记录90 s。共做3 次平行。最后,酶活力用单位时间内吸光度变化的平均值(ΔA/min) 来表征。
1.3.3 抗坏血酸对PPO 的抑制
体系中依次加入30 ℃预热过的浓度50 mmol/L磷酸盐缓冲液2 mL (pH 值6.0)、浓度20 mmol/L 的邻苯二酚1 mL、不同质量分数(W/W) 的抗坏血酸100 μL (0,0.08%,0.16%,0.24%,0.32%,0.40%)和酶液200 μL,酶活力测定方法同1.3.2,空白对照组以超纯水100 μL 代替抗坏血酸。酶被抗坏血酸处理前后酶活力变化以剩余酶活力表示。
式中:Ax——抗坏血酸处理后的酶活力;
A0——新鲜样品的酶活力。
1.3.4 抗坏血酸联合超高压对PPO 的抑制
吸取1.2 mL 酶液装入7 cm×12 cm 的PE 薄膜包装袋中,用封口机热封口。用重物栓将包装袋放置于超高压处理釜中,压强设为300 MPa,时间设为5,10,15,20,25 min。处理后的样品放入- 80 ℃备用,测定前冷水浴溶解。反应体系中依次加入30 ℃预热过的50 mmol/L 磷酸盐缓冲液2 mL (pH 值6.0)、20 mmol/L 的邻苯二酚1 mL,质量分数为0.16%、0.24%的抗坏血酸100 μL 和酶液200 μL,酶活力测定方法同1.3.2,空白对照组以100 μL 超纯水代替抗坏血酸。酶被抗坏血酸处理前后酶活力变化以剩余酶活力 表示。
1.3.5 非还原SDS- PAGE 电泳
参照Zhang Y 等人[17]的方法并稍有修改。将粗酶液与等体积的SDS 上样缓冲液混合均匀,但不加热也不加还原剂。电泳在恒定电压(225 V) 下进行,直到溴酚蓝前沿开始从凝胶中耗尽。一块凝胶用考马斯亮蓝R- 250 染色;另一块凝胶先在浓度50 mmol/L磷酸盐缓冲液(pH 值6.0) 中预平衡20 min,然后加入浓度10 mmol/L 4- 甲基邻苯二酚在30 ℃下进行活性染色。用电泳图像扫描仪记录染色后的结果。
1.3.6 Native 电泳
参照Del Valle Loto F 等人[18]的方法并稍有修改。将粗酶液与等体积的Native 上样缓冲液混合均匀。电泳在恒定电压(225 V) 下进行,直到溴酚蓝前沿开始从凝胶中耗尽。一块凝胶用考马斯亮蓝R- 250染色;另一块凝胶切割成2 个部分,一部分先在浓度50 mmol/L 磷酸盐缓冲液(pH 值6.0) 中预平衡20 min,然后加入浓度10 mmol/L 4- 甲基邻苯二酚在30 ℃下进行活性染色。用电泳图像扫描仪记录染色后的结果。另一部分做LC- MS 质谱分析,不染色。
1.3.7 LC- MS 质谱分析
(1) 蛋白条带脱色及还原烷基化。将Native 电泳不进行染色的条带按照活性染色染出的条带同位置进行切割,装于EP 管中。首先,向离心管中加入浓度为0.025 mol/L 的DTT,常温静置1h 后将多余的DTT 吸出;再加入无水乙腈,脱去蛋白条带中多余的水分,反复操作直至条带缩小变白;除去多余的无水乙腈并进行真空干燥。然后,将蛋白条带浸没于浓度为0.055 mol/L的碘乙酰胺中,常温静置1 h 后将多余的碘乙酰胺吸出;再加入无水乙腈,脱去蛋白条带中多余的水分,反复操作直至条带缩小变白,除去多余的无水乙腈并进行真空干燥。
(2) 蛋白条带酶解。将烷基化的蛋白条带浸入25%的甲酸中,然后加入胃蛋白酶,放入4 ℃冰箱中。待蛋白条带充分吸胀后除去多余酶液,置于37 ℃恒温箱中消化16 h。将酶解后的肽段用质量分数1%三氟乙酸和质量分数50%丙酮的萃取液200 μL 于37 ℃下萃取1 h,收集上清液置于新的EP 管中;重复萃取2 次,并将收集的上清液合并,最后将上清液经真空离心蒸发浓缩器浓缩至大约40 μL。
(3) 蛋白条带的质谱分析。将收集的上清浓缩液装入新的EP 管中,于4 ℃下以转速12 000 r/min离心10 min,取上清液30 μL 用于质谱分析。仪器为Easy- nLC 1000 与Orbitrap Fusion 质谱耦合;色谱柱为Acclaim PepMap C18色谱柱 (100 μm×2 cm,3 μm);流动相A 为质量分数0.1%甲酸的超纯水,流动相B 为质量分数0.1%甲酸的乙腈;流速为300 nL/min,运行时间为60 min。模式为阳离子模式,Veap 1 900 V;干燥气温度为300 ℃;干燥气流速为2.5 L/min;分液器电压为65 V;碎裂电压为175 V。结果用Protepme Discoverer(Version PD1.4)软件进行数据库比对。
2 结果与分析
2.1 抗坏血酸对多酚氧化酶活力的影响
抗坏血酸对多酚氧化酶活力的影响见图1。
由图1 可知,抗坏血酸可以显著抑制葫芦蜂幼虫PPO 的活力,不同于核桃扁叶甲[19]对抗坏血酸抑制的不敏感性。总体上PPO 活力随着抗坏血酸质量分数(W/W) 的增加而降低。当抗坏血酸质量分数为0.08%时,PPO 的剩余活力基本没有变化。但随着抗坏血酸质量分数的进一步增加,PPO 的剩余活力则下降明显。当抗坏血酸质量分数达到0.40%时,酶活被完全抑制,IC50值为0.190 6%。
抗坏血酸是一种强还原剂,可把中间产物邻苯二醌还原成邻二酸和脱氢抗坏血酸,阻止了中间产物进一步聚合成黑色素。但是,由于抗坏血酸抑制褐变的途径并不直接针对于PPO 本身,一旦溶液中的抗坏血酸被消耗殆尽,醌类物质又会重新聚集[20]。因此,抗坏血酸抑制褐变的有效性与溶液中抗坏血酸的质量分数直接相关。
2.2 抗坏血酸对葫芦蜂pH 值的影响
抗坏血酸对葫芦蜂幼虫pH 值的影响见表1。
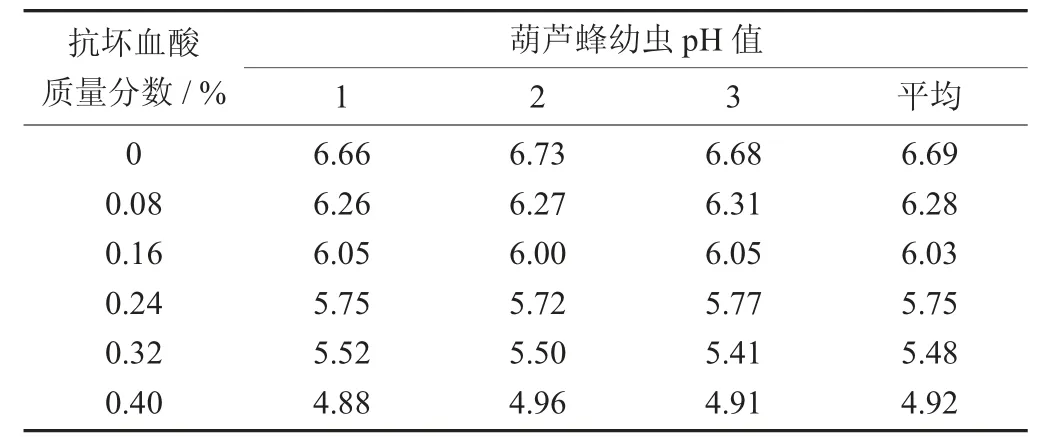
表1 抗坏血酸对葫芦蜂幼虫pH 值的影响
由表1 可知,抗坏血酸能很好抑制葫芦蜂幼虫PPO 的活力,但是高质量分数的抗坏血酸也会影响幼虫的pH 值。表1 显示抗坏血酸添加量超过0.24%时,pH 值会降到6 以下,导致葫芦蜂系列产品的口感过酸。而且pH 值在等电点附近时,蛋白质溶解性较低。采用碱溶酸沉法测得蛋白等电点大约4.0。因此,综合以上因素,选取质量分数为0.16%的抗坏血酸联合超高压进行试验。
2.3 抗坏血酸联合超高压对PPO 活力的影响
抗坏血酸联合超高压对PPO 活力的影响见图2。
由图2 可知,质量分数为0.16%的抗坏血酸联合超高压能使葫芦蜂幼虫PPO 活性显著下降。且经过超高压处理的都低于起始时间的酶活,这表明抗坏血酸联合超高压比单独使用抗坏血酸处理效果好。处理5 min 时,相对酶活降至10.89%;处理10 min时,相对酶活降至4.26%;处理15 min 时,剩余酶活仅剩1.47%。
2.4 非还原SDS 电泳及Native 电泳
PPO 的SDS- PAGE 和Native- PAGE 图见图3。
非还原性SDS- PAGE 凝胶用考马斯亮蓝R- 250蛋白染色(图3 (a)),结果显示蛋白条带集中分布在15~55 kDa,但是这些条带是弥散带;另外,在70 kDa 有2 条,120,180,260 kDa 各有1 条明显的条带。用4 - 甲基邻苯二酚染色(图3 (b)),结果显示葫芦蜂PPO 的分子量约为120 kDa,高于果蝇 (60 kDa)[21]、埃及伊蚊 (50 kDa)[22]和家蚕(81 kDa)[23]。 Native- PAGE 凝 胶 用 考 马 斯 亮 蓝R- 250 蛋白染色 (图3 (c)) 结果与非还原性SDS- PAGE 凝胶条带分布相似。用4 - 甲基邻苯二酚染色(图3 (d)),结果显示PPO 的分子量约为720 kDa,表明葫芦蜂PPO 为亚基120 kDa 的多聚体。
2.5 LC- MS 质谱分析鉴定
LC- MS 质谱分析图见图4。
为精确鉴定PPO,采用LC- MS 进行分析。胶上蛋白经胃蛋白酶酶解后,将蛋白质多肽片段进入LC- MS 进行质谱分析。所得质谱结果经NCBI 数据库检索后, 得出的匹配蛋白为胡蜂属 (Polistes Canadensis) 的多酚氧化酶 (phenoloxidase 2- like),序列号为XP_014613621.1,匹配度分值为135.25 分,覆盖范围为7.63%。
3 结论
抗坏血酸能有效抑制葫芦蜂幼虫PPO 的活力,剩余酶活随着抗坏血酸质量分数的增多而降低,甚至在0.4%时,酶活被完全抑制。抗坏血酸联合超高压对葫芦蜂幼虫PPO 的抑制呈协同效应,幼虫添加质量分数0.16%的抗坏血酸,并在压强300 MPa 处理15 min,PPO 活力基本完全被抑制。通过电泳及质谱鉴定,得知葫芦蜂幼虫PPO 的蛋白名称是phenoloxidase 2- like,表观分子量大约为120 kDa。
