活血祛瘀药对三棱-莪术治疗胃癌的网络药理学作用机制研究
2020-09-04张磊程健余莹何君君
张磊 程健 余莹 何君君
1.广东省第二人民医院 广州 510405 2.北京大学深圳医院 3.广州中医药大学
胃癌是常见的消化系统肿瘤,目前病因尚未明确,由于早期诊断难、发病率高、死亡率高,在全球范围内广受关注[1-2]。胃癌早期症状缺乏特异性,多数患者确诊时已到中晚期,这加大了胃癌的治疗难度,西医临床多采取手术、化疗或姑息疗法[3]。中医药以其“安全低毒”“固本扶正祛邪”“辨证论治”等优势,在胃癌的治疗中发挥了重要作用。中医多将胃癌归属为“癥瘕”“岩”“积聚”等范畴,活血化瘀是治疗胃癌的基本法则之一,而“三棱-莪术”作为行气活血中药的代表,功专活血祛瘀、消癥散结,广泛应用于胃癌的临床治疗中。
莪术,始载于《药性论》,味辛,性温,具有行气破血、消积止痛之功效。现代药理学研究发现,姜黄素类、莪术醇、挥发油、多糖类成分是莪术主要活性成分[4]。姜黄素类为莪术活血化瘀的主要活性成分[5];莪术油有广泛的抗肿瘤作用,在胃癌、肝癌、直肠癌、卵巢癌、乳腺癌等的治疗中均有效[6]。三棱,最早载于《本草拾遗》,其性平,味辛、苦,具有破血中之气、消积祛瘀止痛之功效。三棱主要活性成分有黄酮类、有机酸和挥发油类,其中如苯丙素、琥珀酸、皂苷类、β-谷甾醇等具有抗炎、抗血小板聚集、抗血栓形成、抗肿瘤等多重功效[7-8]。中医遣方用药不仅注重“君臣佐使”,而且讲究“七情配伍”,临床疗效及药理研究均表明,三棱、莪术二者配伍,相须为用,在肿瘤、囊肿等实体肿物的治疗中效果更佳。尽管诸多临床案例皆证实了该药对抗胃癌的疗效,然而其具体作用机制尚不明确,这在一定程度上限制了二者的推广与应用。网络药理学作为一门新兴学科,将传统中药与现代药理学、分子生物学、生物信息学相结合,其整体性、系统性的特点与中医药整体合参、辨证论治的原则一致[9],为从微观角度阐明三棱-莪术药对治疗胃癌的作用机制提供了途径,并为中医药抗癌的客观化、精准化研究提供了证据及新思路。
1 材料和方法
1.1 化学成分构建及筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php) 检索三棱-莪术药对的所有化学成分,共搜集了111个化合物,其中三棱30个、莪术81个。为更好地筛选药对中的有效化合物,本研究联合口服利用度(oral bioavailability,OB)与CaCo-2细胞渗透性进行三棱-莪术药对活性成分的筛选。其中OB反映的是药物被机体吸收进入循环的百分比,CaCo-2细胞渗透性则可反映小肠上皮细胞对药物的转运效率。基于此,将OB≥30%、CaCo-2细胞渗透性≥0作为化合物分子的筛选标准。
1.2 药物靶点筛选 在TCMSP中查找与筛选出的药对活性分子相对应的蛋白靶点,同时利用UniProt数据库(https://www.uniprot.org/),查询靶点蛋白对应的人类基因名称,进行名称标准化处理后录入Excel表格。
1.3 胃癌靶点筛选 利用人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)(http://www.ncbi.nlm.nih.gov/omim) 与 GeneCards(http://www.genecards.org/)搜索关键词gastric cancer,查找与其相关的疾病靶基因,合并2个数据库的搜索结果,去除重复和假阳性的基因,以score>5作为疾病靶点筛选的标准。
1.4 网络构建 运用UniProt数据库,查询筛选出的三棱-莪术药对中活性分子相关靶点,将药对作用靶点与胃癌相关靶点进行映射,从而获取共同靶点,使用Cytoscape 3.7.1软件构建中药活性成分-胃癌靶点相互作用的网络图。运用String数据库(https://stringdb.org/cgi/input.pl),对靶点进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建。
1.5 基因本体(gene ontology,GO)功能富集及京都基因组百科全书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 为了阐明三棱-莪术药对治疗胃癌的作用机制,将网络中的靶蛋白投射到DAVID生物信息资源库6.8(https://david.ncifcrf.gov/),进行GO功能富集和KEGG通路富集,从生物过程及信号通路角度分析三棱-莪术药对治疗胃癌可能的作用机制,继而绘制靶点-通路网络图。
2 结果
2.1 药物筛选结果 研究结果表明,三棱-莪术药对中有60个活性成分满足OB与CaCo-2细胞渗透性要求,其中三棱含有18个活性成分,莪术含有43个活性成分,二者共有活性成分1个,为常春(藤苷)配基(MOL000296)。符合筛选条件的60个活性化合物基本信息见表1。
2.2 靶点预测结果 利用UniProt数据库,将TCMSP上检索的活性成分所对应的蛋白靶点,转换成与之对应的人类基因名称,共得到117个靶点基因。检索Gene Cards及OMIM数据库,分别得到靶基因18 250、2 289个,合并去重后得到3 221个。将三棱-莪术药对靶基因与胃癌相关基因进行映射,得到共同靶基因67个。以67个靶基因对应的蛋白作为三棱-莪术药对治疗胃癌的靶点,建立三棱-莪术药对活性成分-胃癌病变靶点网络图,其中黄色菱形代表三棱-莪术药对的活性成分,红色矩形代表胃癌相关靶点。见图1。
2.3 PPI网络图构建 将得到的活性成分作用靶点导入String数据库,进行PPI网络构建。采用Cytoscape 3.7.1软件绘制PPI网络图,设置节点大小与颜色以反映节点自由度值 (degree),边的粗细表示综合分值(combine score),最终获得PPI网络。半胱天冬氨酸蛋白酶-3(caspase-3,CASP3)、c-JunN-末端激酶(c-Jun N-terminal kinase,JNK)、雌激素受体1(estrogen receptor 1,ESR1)、热休克蛋白90AA1(heat shock protein 90AA1,HSP90AA1)、前列素内环氧化物合成酶2(prostaglandin endoperoxide synthase 2,PTGS2),Degree值分别为33、32、29、28、26, 表明这些蛋白是三棱-莪术药对治疗胃癌的关键蛋白靶点。见图2。

表1 三棱-莪术药对部分活性成分Tab.1 Part of active compounds from Sparganii Rhizoma and Curcumae Rhizoma

图1 成分-靶点网络图Fig.1 Compound-target network

图2 PPI网络Fig.2 PPI network
2.4 GO功能富集分析 通过DAVID软件对三棱-莪术药对治疗胃癌所涉及的67个靶蛋白进行GO功能富集分析。根据P<0.01、基因频率>0.05%,确定出10个条目,涉及“类固醇激素受体活性”“转录DNA模板”“细胞增殖调控”“丝氨酸型内肽酶活性”等生物学过程。见图3。

图3 靶基因的GO功能富集Fig.3 GO enrichment of target genes
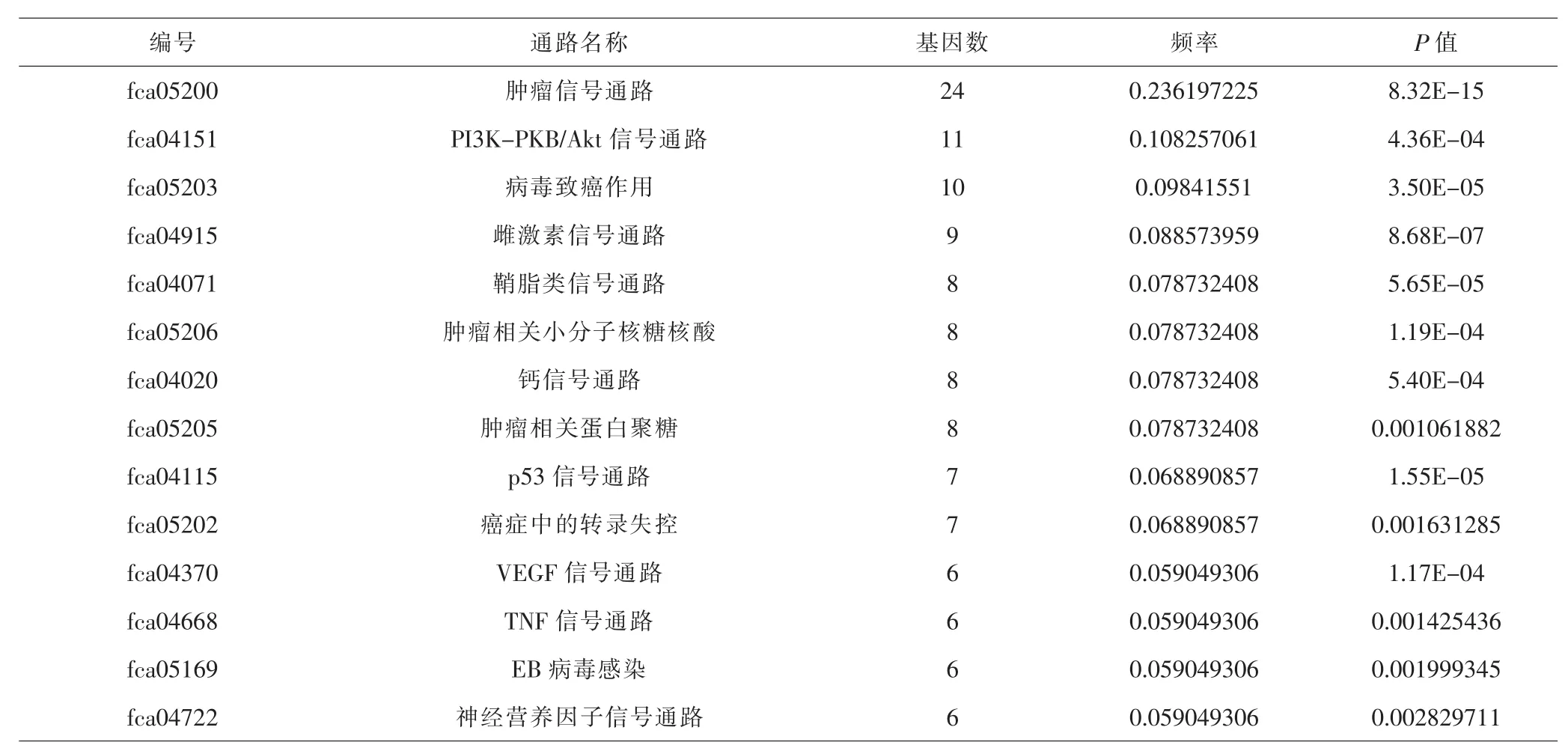
表2 靶基因的KEGG通路富集Tab.2 KEGG enrichment of target genes
2.5 KEGG通路富集分析 对三棱-莪术药对治疗胃癌所涉及的67个靶蛋白进行KEGG通路富集分析。根据P<0.01、基因频率>0.05%,并排除如“小细胞肺癌”“甲状腺激素信号通路”等与胃癌不相关的通路,最后确定出14条通路,包括“肿痛信息痛路”“肿病蛋白多糖”“p53信号通路”等信号通路,并做出KEGG通路富集分析图。见表2及图4。
根据靶点与信号通路之间的联系,建立靶点-通路网络图,其中蓝色三角形表示疾病靶点,红色矩形表示信号通路。见图5。

图4 KEGG通路富集Fig.4 KEGG pathway of target genes

图5 靶点-通路网络图Fig.5 Target-pathway network
3 讨论
胃癌,归属于中医学中“积”“岩”“癥瘕”等范畴。中医病机乃五脏六腑正虚为本,气结、食滞、血瘀、湿阻、寒凝、热壅等为标,脾气亏虚,肝气郁结,气机不行,血运不畅,病久化瘀,入络入脏腑,毒瘀交阻,久积成块,故正虚是胃癌形成的基础,而血瘀是肿块形成的关键因素,治疗应标本兼顾,以益气固本扶正、活血化瘀消积为基本治则。
“三棱-莪术”药对作为临床活血祛瘀的常用药对,二者均能行气活血、化癥散结,相须配伍,散结消积、活血化瘀之力增强,尤适用于胃癌等有形实邪积聚之癥瘕肿块。且现代研究证实,三棱-莪术药对可通过显著抑制内皮细胞增殖、阻滞细胞生长周期、抑制肿瘤细胞生成、直接杀死肿瘤细胞、诱导肿瘤细胞凋亡、抑制血管生成、阻断信号传导通路等机制起到治疗胃癌的作用[10-12]。尽管现阶段对三棱-莪术二者抗癌的临床疗效已有较多研究报道,但检索国内外文献发现,目前尚无针对三棱-莪术药对抗胃癌的有效化学成分、作用靶点、信号通路及生物学途径等具体机制的研究。因此,借助网络药理学平台明确其发挥临床疗效的活性成分及作用靶点,将成为现代中医药研究的新方向。
本研究发现,三棱-莪术药对活性成分在胃癌的治疗上存在多成分、多靶点、多向作用的特点,针对复杂交叉的肿瘤内环境,中药成分“一对多”发挥多靶点调控的作用,体现出中医整体治疗作用的优势。通过整合分析得出,三棱-莪术药对防治胃癌的关键靶点为CASP3、JNK、ESR1、HSP90AA1、PTGS2等。CASP3在细胞凋亡进程中发挥核心作用,是当前治疗肿瘤的一个重要靶点,其激活后损伤DNA,并破坏细胞内多种蛋白的结构和功能,导致蛋白水解,引起细胞凋亡,以此为途径杀伤肿瘤细胞[13],使胃癌组织中CASP3表达下调[14]。JNK在不同肿瘤的恶性转化过程中发挥着重要作用,Jun基因编码的c-Jun蛋白是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的组成成员,在调控细胞增殖、分化、侵袭和凋亡方面起关键作用,主要参与MAPK信号通路上游的调控,JNK-MAPK与核转录因子-κB (nuclear factor-κB,NF-κB)、两面神激酶/信号传导及转录激活蛋白(Janus kinase/signal transducer and activator of transcription,JAK/STAT)等多条信号通路协同作用于肿瘤进程[15-17]。胃癌在男女不同性别人群中发病率存在差异,而这种差异在女性绝经后消失,进一步研究发现其与雌激素水平相关[18]。雌激素与胞内雌激素受体(estrogen receptor,ESR)结合,通过激活经典的雌激素信号途径,调控下游基因的表达,从而在胃癌发病进程中发挥多种生物学效应[19]。ESR1基因的内含子包含增强子、启动子等调控转录过程的重要序列,与编码ESR相关,而不同的基因型导致不同个体间ESR的表达、结构、功能等不同,进而影响雌激素发挥生物学效应,诱发胃癌、乳腺癌、卵巢癌等疾病[20-22]。HSP90作为一种高度保守的分子伴侣蛋白,被认为是肿瘤蛋白稳定性的重要调控因子[23]。随着胃癌前病变到胃癌的进展,HSP90的表达呈上升趋势,且在胃癌组织中高表达[24]。而HSP90AA1蛋白作为HSP90家族中一种进化上高度保守的蛋白亚型,与其它分子伴侣协同作用,维持数百种蛋白的稳定性,在胃癌相关蛋白功能发挥中扮演重要调控角色。三棱-莪术药对的主要活性成分(L)-alpha-Terpineol、(R)-p-Menth-1-en-4-ol、oleic acid中均有HSP90的作用靶点,阻断HSP90可阻断胃癌细胞多种促血管生成信号通路,抑制肿瘤生长[25]。PTGS2是花生四烯酸合成前列腺素类物质的关键性限速酶的异构酶,参与调控肿瘤、炎症、凝血等多种生理和病理过程[26-27]。国外研究表明,幽门螺旋杆菌相关的急慢性胃炎与胃上皮细胞中PTGS2的表达有关,PTGS2在幽门螺杆菌感染者的胃上皮细胞中显著升高[28],且参与了胃癌细胞的恶性增殖、侵袭、转移及免疫抑制[29]。
KEGG通路富集分析表明,三棱-莪术药对主要作用的信号通路有肿瘤信号通路、PI3K-PKB/Akt信号通路、p53信号通路、VEGF信号通路、TNF信号通路等。PI3K-PKB/Akt信号通路被激活后,导致Akt下游靶基因活化,调控E-钙黏蛋白(E-cadherin)、β-连环蛋白(β-cadherin)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、 基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、波形蛋白(vimentin)等的表达,引起细胞外基质降解、细胞间黏附力下降,加速胃癌上皮细胞间质转化(epithelial mesenchymal transition,EMT)[30]。 另有研究证实,PI3K-PKB/Akt信号通路对重要抑癌基因p53的表达具有关键调控作用[31]。p53通路可通过对p53等基因的调控,引起胃癌细胞周期阻滞、老化及凋亡。VEGF信号通路包括VEGF-C、VEGF-D、VEGFR-3等不同途径,肿瘤血管生成在肿瘤细胞增殖和转移中起着重要作用,VEGF的作用机理为刺激血管内皮细胞的增殖与迁移,促进肿瘤组织的血管及淋巴管新生,对肿瘤侵袭转移进行调控[32-34]。研究发现胃癌伴随淋巴管侵犯患者癌组织中VEGFC、VEGF-D、VEGFR3的表达强于癌旁组织[35],VEGF信号通路与消化道肿瘤的生长、转移以及预后密切相关。体外实验显示,三棱-莪术通过降低胃癌发展过程中的关键分子VEGF、环氧化酶-2(cyclooxygenase-2,COX-2)的含量,从而抑制肿瘤生长[11]。 此外,VEGF亦受到PI3K-PKB/Akt信号通路的调控,PI3K-PKB/Akt信号通路可影响包括VEGF在内的多种促血管新生因子,促进肿瘤血管新生[36]。TNF信号通路主要在细胞自稳、细胞凋亡中发挥巨大作用,其中TNF-α作为该通路的核心成员,可维持体内免疫平衡,诱发炎症级联反应,诱导细胞凋亡。TNF-α通过和细胞表面的受体相结合后发挥多种生物学效应,引起下游如抑制性卡巴蛋白 (I-κBα,IkBα)、NF-κB p65亚基蛋白等一系列蛋白的磷酸化,亦可由此激活MAPK、JNK、NF-κB信号通路,导致肿瘤、炎症及免疫性疾病的发生[37]。Rossi等[38]研究发现,胃癌中TNF与其受体2(TNF receptor 2,TNFR2)结合介导细胞存活基因上调,而CASP3、TNFR1等促凋亡基因下调,有利于其促肿瘤作用的发挥。总之,不同的信号通路途径并非独立发挥作用,它们以肿瘤相关基因、细胞因子、酶等为物质基础,相互协调,共同参与机体肿瘤的发病进程。
KEGG通路富集与GO功能富集从不同侧面揭示了三棱-莪术的抗胃肿瘤作用机制,二者相互联系,互为补充。GO功能富集结果提示,三棱-莪术药对主要通过调控细胞增殖周期,实现对细胞核、细胞质、DNA转录、RNA聚合酶Ⅱ启动子等及对类固醇激素受体活性、丝氨酸型内肽酶活性的调控,发挥抗肿瘤生物学作用。药理学研究发现,莪术中的β-榄香烯、姜黄素、莪术醇、莪术二酮、莪术酮等成分通过直接细胞毒性、阻断细胞生长周期、激活机体免疫系统等发挥抗癌作用[12,39];姜黄素可抑制DNA甲基化,上调E-钙黏蛋白的表达,同时抑制MMP的表达,从而能够抑制肿瘤的侵袭及转移[40-41];莪术醇可上调B细胞淋巴瘤-2相关x蛋白(B cell lymphoma-2 associated x protein, bax)、下调B细胞淋巴瘤-2(B cell lymphoma-2,bcl-2)基因的表达,将胃癌细胞阻滞于S期和G2期,抑制胃癌细胞增殖[42]。三棱中活性成分三棱内酯B、三棱总黄酮、铝络合黑三棱碱三糖苷具有改善机体微环境、抗肿瘤血管新生、调节免疫等功效[43]。三棱总黄酮通过干扰细胞有丝分裂、阻滞细胞周期来抑制肿瘤增殖[44],亦能下调VEGF等蛋白的表达,诱导胃癌细胞凋亡[45]。赵航等[46]将胃癌根治术后患者分为化疗组及化疗加三棱莪术中药组,结果发现化疗加三棱莪术中药组患者临床症状明显减轻,且肿瘤相关标志物血清VEGF、癌胚抗原(carcinoembryonic antigen,CEA)、肿瘤抗原125(cancer antigen 125, CA125)、肿瘤抗原724(cancer antigen 724,CA724)含量较化疗组明显降低。由此可见,基础及临床研究从不同角度均验证了三棱-莪术药对胃癌的治疗作用,其作用机制以调控肿瘤细胞生长周期及干预相关信号传导通路为主。
综上所述,胃癌的形成与发展是一个由多基因调控、多因素参与、多信号通路交叉作用的复杂过程,其治疗至今仍然是一个世界性难题[47]。中药以其“多成分、多靶点、多途径”的特点在胃癌防治方面展现出独特优势。本研究运用网络药理学,分析活血祛瘀之代表药对三棱-莪术治疗胃癌的有效活性成分、关键靶点和信号通路,为阐明其抗胃肿瘤的具体作用机制提供了客观依据。
