丝瓜籽核糖体失活蛋白Luffin-α的基因克隆、表达及抗肿瘤活性研究
2020-09-04
浙江中医药大学生命科学学院 杭州 310053
丝瓜[Luffa cylindrica (L.) Roem.]中含有甾醇三萜及皂甙类、黄酮体和酚类、蛋白质和氨基酸类等药用成分,具有特殊的药用价值。1988年,Kamenosono等[1]从丝瓜种子中分离出分子量很接近的两种丝瓜蛋白Luffin-α和Luffin-β。研究发现,包括Luffin-α、Luffin-β以及Luffin-P1在内的多种蛋白均属于Ⅰ型核糖体失活蛋白(ribosome inactivating proteins,RIPs)[2]。RIPs是通过与核糖体rRNA分子相互作用,从而阻断蛋白质合成的高效毒素[3],通常来源于植物、细菌和真菌,被认为是抗真菌和抗病毒剂,并且具有抗肿瘤、免疫抑制和抗生育活性[4-6],因此是一种具有发展潜力的抗肿瘤药物,特别是在生物医学领域研究广泛的Ⅰ型RIPs,可应用于肿瘤的免疫治疗[7]。但使用天然毒素治疗癌症存在许多固有的问题,如植物资源有限、分离纯化过程复杂等[5],因此通过基因工程技术获取该重组蛋白具有明显的优势。
在本研究中,通过提取丝瓜籽总RNA,然后逆转录为cDNA,并以cDNA为模板,运用反转录PCR(reverse transcription polymerase chain reaction,RTPCR)技术克隆Luffin-α基因,并将该基因在大肠杆菌系统中进行可溶性表达,同时检测其对HepG2和MDA-MB-231细胞的抑瘤活性,以期为后续抗肿瘤药物的研发奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验材料 绿皮丝瓜选购自滨江农贸市场。质粒pGEX6P-1、大肠杆菌BL21(DE3)、TG1均由本实验室保存;人肝癌细胞HepG2、人乳腺癌细胞MDA-MB-231均购于中科院上海细胞库。
1.1.2 试剂 Trizol试剂购自源叶生物公司(批号:L25M8G32443);T4 DNA连接酶、Taq酶和cDNA反转录试剂盒均为TAKARA公司产品(批号:AG50076A、AJ51060A、AHE4572A);质粒抽提试剂盒、胶回收试剂盒购自Axygen公司(批号:06114KA1、01316KE1);谷胱甘肽琼脂糖、氨苄青霉素(ampicillin,Amp)、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、 异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和蛋白质定量检测试剂盒购于生工生物工程(上海)有限公司(批号:F402DA0003、E702BA0004、F410BA0019、DB16BA 0006、E115BA0019、F129DA0001);胰蛋白酶、双抗购自吉诺生物医药技术有限公司(批号:1911150405、1911110107);二甲基亚砜(dimethyl sulfoxide,DMSO)购自SIGMA公司(批号:BCBW5664);DMEM培养液购自HyClone公司(批号:AE29422278);谷胱甘肽硫转移酶(glutathione S-transferase,GST)单克隆抗体(小鼠单抗)、辣根过氧化物酶标记山羊抗小鼠lgG(H+L)、蛋白Marker购自上海碧云天生物技术有限公司(批号:09251911219、080819191204、112618190604)。
1.1.3 仪器 scientz-950E超声波裂体仪购于上海虔钧科学仪器有限公司;蛋白质电泳与转膜仪为美国Bio-rad公司产品;Tanon 2500凝胶成像仪购于上海天能科技有限公司;Tpersonal型PCR仪购于Biometra公司;3K-18台式高速冷冻离心机为Sigma公司产品;DSHZ-300A恒温摇床购于江苏太仓实验设备厂。
1.2 方法
1.2.1 丝瓜籽RNA的提取 在预冷的研钵中,加入新鲜丝瓜籽0.2g,添加液氮后将其研磨成粉末,再加入Trizol试剂1mL,采用Trizol一步法提取丝瓜籽总RNA,变性琼脂糖凝胶电泳检测RNA的完整性,核酸微量分光光度计测A260/A280比值,-70℃冻存备用。
1.2.2 RT-PCR扩增丝瓜籽Luffin-α基因 反转录的操作步骤根据TAKARA公司反转录试剂盒说明书进行。根据GeneBank中的Luffin-α的cDNA序列,设计合成引物Luffin-F1和Luffin-R1,扩增丝瓜Luffin-α基因,引物设计和测序均由上海铂尚生物有限公司完成,引物序列见表1。 反应体系如下:cDNA 2μL,10×PCR Buffer 5μL,dNTP (2.5mol·L-1)2μL,Taq酶 (1U·μL-1)0.5μL,正反向引物各1μL,ddH2O 38.5μL,总计50μL。反应条件如下:94℃预变性3min,98℃ 20s,61℃ 45s,68℃ 45s,2个循环;98℃ 20s,59℃ 45s,68℃ 45s,3个循环;98℃ 20s,57℃ 45s,68℃ 45s,共28个循环。 结束后,通过1%琼脂糖凝胶电泳鉴定PCR产物,然后按照Axygen公司的胶回收试剂盒内附说明书进行切胶回收。PCR产物与pTA2载体进行T-A克隆,连接产物转化至TG1感受态细胞中,均匀涂布在含Amp的LB固体培养基上,37℃培养12h。随机挑取6到8个菌落,菌落经PCR初步鉴定后,再寄送至上海铂尚生物有限公司测序。测序结果通过NCBI上的Blast软件进行比对。
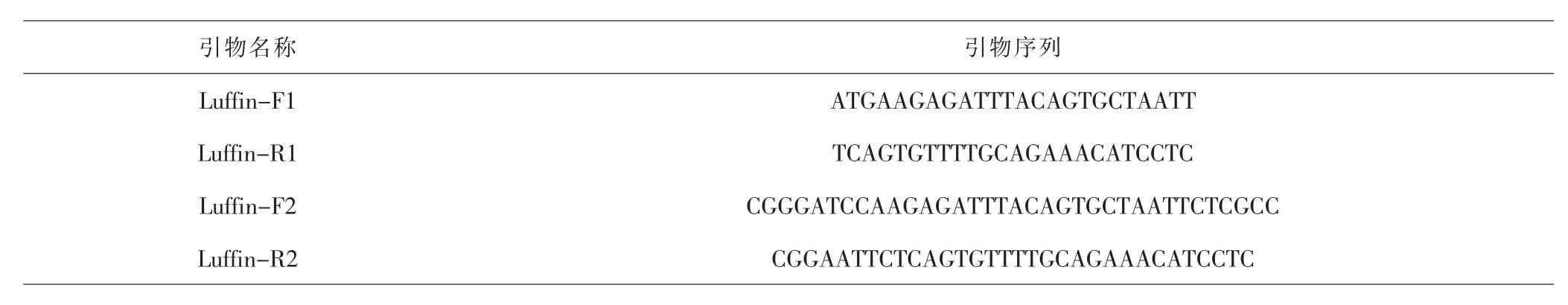
表1 引物序列Tab.1 Primer sequences
1.2.3 pGEX6P-1/Luffin-α重组载体构建 以经测序验证的pTA2-Luffin-α质粒为模板,采用Luffin-F2/R2引物重新扩增Luffin-α基因,切胶回收扩增产物。然后用限制性内切酶BamHI和EcoRI双酶切Luffin-α基因,再利用T4 DNA连接酶连接至pGEX6P-1载体上,转化至大肠杆菌BL21(DE3)中,涂布在含Amp的LB固体培养基上,挑取单克隆菌落至5mL LB液中摇菌12h左右,抽提质粒,通过BamHI和EcoRI双酶切鉴定阳性克隆。
1.2.4 丝瓜籽Luffin-α基因在E.coli中的可溶性表达鉴定 挑取重组大肠杆菌单菌落至5mL含Amp的LB培养基中,37℃,180r/min振荡培养过夜后,将菌液按1∶100的比例接种至200mL含Amp的LB培养基中,37℃,220r/min振荡培养约2h后,加入IPTG至终浓度为1mmol·L-1,在诱导温度为16℃,180r/min的条件下培养20h左右。5 000r/min离心收菌后进行超声裂体,超声2s,间隙2s,功率50%,总时20min,12 000r/min离心收集上清液与沉淀,以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)进行可溶性表达鉴定。
1.2.5 丝瓜籽Luffin-α基因可溶性表达的优化体系构建
1.2.5.1 IPTG浓度的优化 按1.2.4中操作常温培养菌液后,取出冷却数分钟,分别加入IPTG至终浓度为0.3、0.5、0.8、1mmol·L-1, 分别置于16℃的低温摇床中培养20h,超声裂解后收集上清液,进行SDS-PAGE电泳检测,筛选最佳IPTG浓度。
1.2.5.2 诱导温度的优化 按1.2.4中操作常温培养菌液后,加入IPTG终浓度至0.8mmol·L-1,分别在10、16、25、37℃的条件下诱导20h左右。诱导结束后超声裂体收集上清液,进行SDS-PAGE电泳检测,筛选最佳诱导温度。
1.2.6 Luffin-α重组蛋白的SDS-PAGE和Western blot检测 按照1.2.5探索出的最佳优化体系进行目标蛋白的可溶性表达,下一步进行GST融合标签纯化,步骤如下:取上清液过0.45μm滤膜,将上清液与400μL谷胱甘肽琼脂糖纯化树脂混合后在冰上摇45min,然后用10倍柱体积的磷酸盐缓冲液(phosphate buffer saline,PBS)清洗,Bradford检测是否洗净,最后用10mmol GST Elution Buffer 400μL洗脱4次,SDSPAGE电泳检测目标蛋白纯度。
提取的Luffin-α蛋白经SDS-PAGE电泳后,在转膜仪上将凝胶转至硝酸纤维素膜上,转膜结束采用脱脂奶封闭2h,加入GST单克隆抗体,4℃孵育过夜,Tris-吐温缓冲液(Tris buffered saline Tween,TBST)洗涤,加入辣根过氧化物酶标记山羊抗小鼠二抗,摇床常温孵育2h,TBST洗涤,用电化学(electro-chemiluminescence,ECL)发光液显影。
1.2.7 重组蛋白的抗肿瘤活性实验 将对数生长期的HepG2细胞和MDA-MB-231细胞分别按5×104个/L和1×105个/mL的细胞数量接种于96孔板中,每孔100μL,置于培养箱中培养24h。细胞贴壁后,分别以6.25、12.5、25、50、100、200、400μg·mL-1的重组蛋白对HepG2细胞和MDA-MB-231细胞进行梯度给药,每种浓度设6个复孔,同时设置对照组,对照组重组蛋白浓度为0μg·mL-1。HepG2细胞置于5%CO2,37℃培养箱中继续培养24、48、72h,MDA-MB-231细胞则置于无CO2培养箱中继续培养24、48h。终止培养时,每孔加入20μL MTT溶液,培养箱中再孵育4h,然后吸除MTT溶液,加入150μL DMSO,避光振荡15min后,490nm处检测吸光度,计算细胞存活率及其半数抑制浓度(half maximal inhibitory concentration,IC50),并比较Luffinα重组蛋白对两种细胞的抑制作用。
1.3 统计学分析 采用SPSS 25.0统计软件进行统计学分析,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 丝瓜籽Luffin-α基因的扩增 PCR产物经1%琼脂糖电泳,发现一条大小约为800bp的明显亮带,与目的基因大小基本吻合。见图1。该基因经过T-A克隆,与pTA2载体相连接并测序,鉴定发现该基因序列与GeneBank中已报道的Luffin-α基因序列完全相同。

图1 RT-PCR扩增丝瓜籽Luffin-α基因Fig.1 Amplification of the Luffin-α gene from the seeds of Luffa Cylindrica by RT-PCR
2.2 重组表达质粒的构建 将上述克隆获得的Luffin-α基因通过酶切、连接方式克隆到pGEX6P-1载体的BamHI和EcoRI位点处。将获得的重组质粒(pGEX6P-1/Luffin-α)进行双酶切鉴定,1%琼脂糖电泳检测结果显示,双酶切(BamHI和EcoRI)产物出现一条大小约为800bp的条带,与目的条带大小一致。见图2。进一步测序验证后表明重组质粒构建成功。

图2 重组质粒(pGEX6P-1/Luffin-α)双酶切鉴定Fig.2 Identification of recombinant plasmid(pGEX6P-1/Luffin-α) by restriction enzymatic digestion
2.3 重组蛋白的初步表达鉴定 重组质粒pGEX6P-1/Luffin-α转化至大肠杆菌BL21(DE3)中进行诱导表达,对细胞裂解后的上清液和沉淀进行SDS-PAGE电泳检测。第2泳道是pGEX6P-1/Luffin-α转化至大肠杆菌诱导表达后的上清液,发现有56kD的目标蛋白条带,而沉淀中目标蛋白的含量较少。见图3。由此表明,融合蛋白大多以可溶性形式存在于上清液当中。
2.4 丝瓜籽Luffin-α基因可溶性表达的最佳优化条件
2.4.1 诱导的最佳IPTG浓度 在诱导温度为16℃,IPTG终浓度分别为0.3、0.5、0.8、1mmol·L-1的条件下分别诱导20h。SDS-PAGE电泳图显示重组可溶性蛋白Luffin-α均有表达, 但IPTG终浓度为0.8、1mmol·L-1的表达量比IPTG终浓度为0.3、0.5mmol·L-1的多,且由于IPTG终浓度为0.8和1mmol.L-1时表达量较为接近。见图4。 因此,选用0.8mmol·L-1作为诱导Luffin-α基因可溶性表达的最佳IPTG浓度。
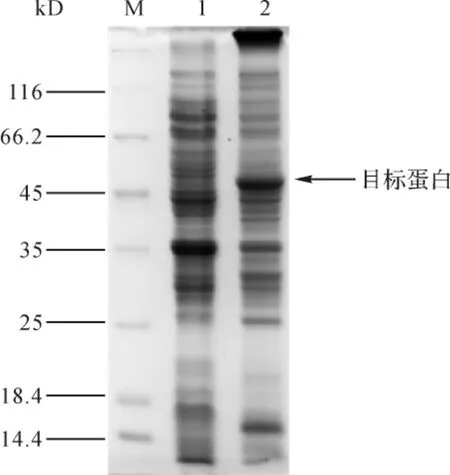
图3 重组蛋白在BL21(DE3)中的表达Fig.3 Expression of recombinant protein in BL21(DE3)

图4 IPTG浓度对Luffin-α重组蛋白原核表达的影响Fig.4 Effects of IPTG concentrations on prokaryotic expression of Luffin-α recombinant protein
2.4.2 诱导的最佳温度 在IPTG终浓度为0.8mmol·L-1、诱导温度为10、16、25、37℃的条件下分别诱导20h后进行SDS-PAGE电泳鉴定。结果表明,Luffin-α重组蛋白均有表达,但以16℃条件下表达量最多。见图5。
2.4.3 Luffin-α重组蛋白的可溶性表达 在0.8mmol·L-1IPTG,16℃诱导20h的最佳优化体系下可溶性表达Luffin-α重组蛋白,将纯化后的蛋白进行SDS-PAGE电泳,结果显示56kD处产生一条特异性条带,表明带有GST标签的Luffin-α重组蛋白已成功表达。见图6。Western blot鉴定发现纯化后的重组蛋白条带浓集,GST标签含量较少,且重组蛋白反应原性较强。见图7。

图5 诱导温度对Luffin-α重组蛋白原核表达的影响Fig.5 Effects of induction temperature on prokaryotic expression of Luffin-α recombinant protein

图6 重组GST-Luffin-α蛋白的SDS-PAGE检测Fig.6 SDS-PAGE analysis of recombinant GST-Luffin-α protein

图7 重组GST-Luffin-α蛋白的Western blot鉴定Fig.7 Western blot analysis of recombinant GST-Luffin-α protein
2.5 重组蛋白的抗肿瘤活性实验 Luffin-α重组蛋白对HepG2细胞和MDA-MB-231细胞具有不同程度的抑制作用。作用HepG2细胞24、48、72h后,细胞存活率见图8,IC50分别为182、100.04、87.85μg·mL-1。 作用MDA-MB-231细胞24、48h后,细胞存活率见图9,IC50分别为278.53、208.94μg·mL-1。随着Luffin-α蛋白浓度的增加和作用时间的延长,细胞存活率显著下降,呈现一定的浓度-时间依赖性。 400μg·mL-1Luffin-α重组蛋白对HepG2细胞和MDA-MB-231细胞均具有较好的抑制效果。见图10、11。分别对HepG2细胞和MDA-MB-231细胞的24、48h给药组进行比较,两者只有50、100、200μg·mL-1组差异具有统计学意义(P<0.05)。见图12。由此表明低浓度的Luffin-α重组蛋白对两种细胞的增殖抑制作用较为相似,而高浓度则呈现一定的差异。
3 讨论
RIPs是广泛存在于不同植物细胞中并能抑制真核细胞蛋白质合成的一类毒素蛋白[8],现已从350余种植物中筛选到110多种RIPs。根据分子结构的不同可以分为3型:Ⅰ型RIPs为单链蛋白,只含有单一的RNA N-糖苷酶结构域,其代表是天花粉蛋白(trichosanthin,TCS)[9]、 苦瓜蛋白 (momoridica anti-HIV protein,MAP30)、丝瓜蛋白(Luffin)等,因其具有良好的抗肿瘤、抗病毒活性,特别是具有抗艾滋病毒的活性而引起广泛关注[10];Ⅱ型RIPs含有一个具有RNA N-糖苷酶活性的A链和一个具有糖基识别活性的B链[4],例如蓖麻毒素[11]、相思豆毒素等;Ⅲ型RIPs只有一条多肽链且不具备RNA N-糖苷酶活性,该类RIPs并不多见。
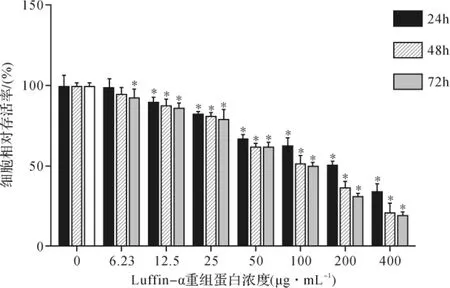
图8 Luffin-α重组蛋白对HepG2细胞增殖的影响Fig.8 Effects of Luffin-α recombinant protein on HepG2 cell proliferation

图9 Luffin-α重组蛋白对MDA-MB-231细胞增殖的影响Fig.9 Effects of Luffin-α recombinant protein on MDA-MB-231 cell proliferation

图10 Luffin-α重组蛋白对MDA-MB-231细胞的抑制作用(100×)Fig.10 The inhibition of 400μg·mL-1Luffin-α recombinant protein on MDA-MB-231 cell (100×)

图11 Luffin-α重组蛋白对HepG2细胞抑制作用(100×)Fig.11 The inhibition of Luffin-α recombinant proteinon HepG2 cell(100×)
丝瓜籽中存在—组单链RIP,包括Luffin-α、Luffin-β、Luffin-S等,其中Luffin-α是迄今为止分离到的毒性最强的RIP之一[12]。RIPs对肿瘤细胞的杀伤作用远高于对正常细胞的影响,而且由于I型RIPs缺乏B链,所以这类毒素对完整的细胞几乎没有毒性[13],而对单细胞系统中的蛋白生物合成则具有强烈的抑制活性,因此它是—种很有效的抗肿瘤蛋白[14-15]。

图12 Luffin-α重组蛋白作用于HepG2和MDA-MB-231的细胞毒性分析Fig.12 Cytotoxicity analysis of Luffin-α recombinant protein on HepG2 and MDA-MB-231
鉴于Luffin-α显著的抗肿瘤活性,本实验构建了Luffin-α的GST标签融合蛋白,但作为重组蛋白其在大肠杆菌中的表达较为复杂。通常情况下,融合蛋白的可溶性受到培养条件和表达载体的影响。大肠杆菌表达系统具有操作简便、成本低廉的优点,但在表达过程中极易形成不溶性的包涵体,影响可溶性蛋白的表达[16]。为尽可能增加Luffin-α重组蛋白在上清液中的含量,本实验从IPTG浓度和诱导温度两方面进行考察,期望能尽量减少低温诱导过程中蛋白质的不正确折叠。 结果表明,IPTG终浓度为0.8mmol·L-1、16℃下诱导20h能最大程度地获得Luffin-α重组蛋白,并用于下一步细胞毒性实验研究。将Luffin-α重组蛋白分别作用于HepG2和MDA-MB-231两种肿瘤细胞,由于不同细胞对药物的敏感度存在差异,所以Luffin-α重组蛋白对两种细胞显示出不同程度的抑制作用。针对MDA-MB-231细胞的IC50明显高于HepG2细胞,可能是因为与HepG2细胞比较,MDA-MB-231细胞对Luffin-α重组蛋白的吸收能力较差。而高浓度Luffinα重组蛋白对两种细胞均显示出较高的抑制作用,表明进入细胞内的Luffin-α重组蛋白均能够发挥较强的抗肿瘤活性。
本实验对丝瓜籽Luffin-α基因进行了成功的克隆和原核表达,并通过SDS-PAGE和Western blot验证了重组蛋白的纯度和反应原性,进一步通过细胞增殖抑制实验,初步鉴定了重组Luffin-α蛋白对肿瘤细胞的毒性作用,为抗肿瘤药物的研发提供了新思路。但由于其肿瘤细胞靶向性不强[17],一定程度上需要增加给药浓度,无可避免地增强了其毒性,下一步将考虑将其与肿瘤导向肽结合,增强其针对肿瘤细胞的导向性[18-19],从而达到靶向治疗的目的。
