姜黄素通过抑制NF-κB信号通路和NLRP3炎性体轴调控大鼠急性胰腺炎的研究
2020-08-28陈卓锋王治伟
徐 娟,陈卓锋,王治伟
0 引言
急性胰腺炎(Acute pancreatitis,AP)是临床上常见的一种胰腺组织炎症反应性疾病,由胰蛋白酶原异常活化引起[1],具有很高的发病率和死亡率。近年来,AP的发病率逐年增加[2],大约有20%的患者会发展为重症急性胰腺炎(SAP),甚至有一些患者由于其引发的全身性炎症反应综合征和多种器官衰竭而死亡[3-4]。AP早期典型的特征是消化酶诱导的胰腺腺泡细胞局部坏死,然后触发促炎细胞因子如肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)等的产生[5],并促使这些炎性因子募集到炎症发生部位,从而加剧了胰腺损伤以及病情的恶化等[6-7]。尽管近几十年对AP进行了大量的研究,但是引起胰腺炎性反应的病理生理机制仍未被完全阐明,并且尚未开发出有效的治疗药物和方法。
核因子-κB(NF-κB)是一种核促炎转录因子,可调节多种基因的表达,而这些基因表达对于炎症信号通路的转导起着至关重要的作用[8]。NOD样受体蛋白3(NLRP3)炎性小体介导了机体对微生物感染和细胞损伤的免疫应答,是多种疾病病理生理机制的重要组成部分[9]。在AP的研究中,NF-κB和炎症介质的作用不断受到重视。研究表明,NF-κB与NLRP3炎性小体参与AP的发生,抑制NF-κB通路与NLRP3炎性小体激活可减轻胰腺和其他器官的损伤[10-12]。
姜黄素(Curcumin)是一种来源于姜黄根茎且具有活性的多酚物质,已有研究证明,姜黄素不仅具有抗炎、抗氧化与抗肿瘤作用[13],还能够通过抑制肿瘤细胞生长与转移有效阻止肿瘤发生发展[14]。因此,本研究旨在探讨姜黄素对牛磺胆酸钠诱导的AP大鼠的保护作用,以及对NF-κB通路与NLRP3炎性体轴的作用机制,为临床治疗提供参考。
1 材料与方法
1.1 主要材料与试剂 主要试剂:姜黄素(质量分数>95%)购自天津科密欧化学试剂有限公司,2%戊巴比妥钠购自上海邦景实业有限公司,5%牛磺胆酸钠购自上海鼓臣生物技术有限公司,血清淀粉酶和脂肪酶检测试剂盒购自北京索莱宝科技有限公司,苏木素、伊红染液购自美国Sigma公司;山羊血清、5%脱脂牛奶购自美国Gibco公司;抗NLRP3、NF-κB、caspase-1、ASC、p65、IκBα、p-p65以及鼠抗β-actin、抗辣根过氧化物酶标记山羊抗小鼠IgG等抗体均购自美国Sigma-Aldrich公司;BCA蛋白测定试剂盒与TNF-α、IL-1β、IL-6酶联免疫吸附试剂盒购自上海碧云天生物技术有限公司。
动物:84只健康SPF级Wistar大鼠,雄性,6~8周龄,体重180~220 g,购自广州医科大学实验动物中心,合格证号:SYXK(粤)2018-0013。
1.2 方法
1.2.1 大鼠分组、造模及给药 84只雄性Wistar大鼠实验前在温度为20~25 ℃、湿度为45%~55%、12 h明暗交替的饲养环境内适应性喂养1周,自由饮水及摄食。参照文献[15]制备AP模型。在造模前所有大鼠禁食12 h,然后随机分为4组(每组21只):模型组、假手术组、姜黄素低剂量组和姜黄素高剂量组。模型组通过腹膜内注射2%戊巴比妥钠麻醉,将5%牛磺胆酸钠溶液穿刺管逆行注射到胆胰管建立AP模型;假手术组大鼠用等量生理盐水代替5%牛磺胆酸钠溶液进行注射,其他操作均与模型组相同;姜黄素低剂量组在注射牛磺胆酸钠前1 h腹腔注射姜黄素50 mg/kg,然后在注射牛磺胆酸钠后每天注射姜黄素(50 mg/kg)1次,持续3 d;姜黄素高剂量组在注射牛磺胆酸钠前1 h腹腔注射姜黄素100 mg/kg,然后在注射牛磺胆酸钠后每天注射姜黄素(100 mg/kg)1次,持续3 d。3 d后采集大鼠下腔静脉血,采血完毕处死所有大鼠,解剖取大鼠胰腺组织,将一部分胰腺组织固定在4%多聚甲醛中,将另一部分置于液氮后储存在-80 ℃下。
1.2.2 血清淀粉酶和脂肪酶活性测定 抽取血液自然凝固后,4 ℃下以2 000 r/min的速度离心10 min分离血清,通过比色法检测血清淀粉酶和脂肪酶活性。①淀粉酶活性测定步骤:将底物缓冲液在37 ℃预温5 min,加入稀释的血清,混匀,37 ℃反应7.5 min,加入碘应用液,立即加水混匀,以蒸馏水调零,使用酶标仪在660 nm处测定各管的吸光度(OD)值。②脂肪酶活性测定步骤:将底物缓冲液在37 ℃预温6 min,依次加入待测血清、底物缓冲液,混合均匀,在酶标仪420 nm处测定吸光度值A1,接着在37 ℃反应10 min,再次读取吸光度值A2。
1.2.3 ELISA法 将收集的血液,室温下孵育2 h后,4 ℃下以2 000 r/min的速度离心10 min分离血清,检测血清中IL-1β、IL-6、TNF-α的含量,具体操作严格按照ELISA试剂盒说明书进行。用酶标仪在450 nm处测定OD值。
1.2.4 HE染色 将4%多聚甲醛溶液中固定好的胰腺组织取出,进行脱水与石蜡包埋,切成5 μm切片。37 ℃干燥过夜,60 ℃处理20 min,将玻片浸入二甲苯中泡片10 min,使用由高到低的梯度酒精(100%,90%,80%和70%)浸泡,每次2 min,在流水下冲洗。然后使用苏木精染色5 min,流水冲洗后,伊红染色液染色3 min,由低到高的梯度酒精(70%,80%,90%和100%)依次脱水,二甲苯浸泡5 min,中性树胶封片,于光学显微镜下进行组织病理学检查。
1.2.5 免疫组织化学染色 将石蜡切片脱蜡至水,PBS溶液中浸泡5 min,0.01 mol/L枸橼酸盐缓冲液进行抗原修复,4%过氧化氢清除内源性过氧化物酶活性,加山羊血清液室温孵育30 min,然后分别滴加兔抗NLRP3(1∶200)与兔抗NF-κB(1∶200)作为一抗,4 ℃孵育过夜。次日PBS冲洗,滴加二抗辣根过氧化物酶标记山羊抗小鼠IgG(1∶1 000)37 ℃孵育30 min,PBS冲洗,DAB显色,使用苏木素进行复染,常规脱水、透明,中性树胶封片,在电子显微镜下进行图像采集与分析。若胞浆呈黄色细颗粒状则判断为阳性产物。
1.2.6 Western blot 使用RIPA裂解缓冲液提取各组大鼠胰腺组织总蛋白,BCA蛋白测定试剂盒测定蛋白浓度。取30 μg各组蛋白样本进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,将分离后的蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h,然后分别加兔抗NLRP3(1∶1 000)、caspase-1(1∶1 000)、ASC(1∶1 000)、p65(1∶1 000)、IκBα(1∶1 000)、p-p65(1∶1 000)以及鼠抗β-actin(1∶1 000),4 ℃孵育过夜。次日,TBST洗涤,加入辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)室温孵育1 h,TBST洗涤,采用化学发光试剂(ECL)显影后,使用Quantity One软件分析蛋白质灰度值。

2 结果
2.1 各组大鼠胰腺组织病理性形态学观察 HE染色结果如图1所示,假手术组胰腺组织结构清晰正常,未出现明显炎性细胞浸润、充血的现象;模型组胰腺组织局部坏死、出血以及水肿,腺泡细胞结构模糊,出现大量炎症细胞浸润,间隔明显变宽;姜黄素低剂量组胰腺组织局部坏死、出血及水肿减轻,腺泡细胞结构不完整,而炎症细胞浸润减少;姜黄素高剂量组胰腺组织局部坏死、出血及水肿显著改善,偶见少量炎症细胞浸润,腺泡细胞结构较完整。

图1 HE染色检测各组大鼠胰腺组织病理形态变化
2.2 各组大鼠血清淀粉酶和脂肪酶含量比较 各组大鼠血清中淀粉酶和脂肪酶测定结果如图2所示,与假手术组比较,模型组大鼠血清淀粉酶含量显著升高(P<0.01);与模型组比较,姜黄素低剂量组和姜黄素高剂量组大鼠血清淀粉酶含量降低,且具有剂量依赖性(P<0.01)。与假手术组比较,模型组大鼠血清脂肪酶含量显著升高(P<0.01);与模型组比较,姜黄素低剂量组和姜黄素高剂量组大鼠血清脂肪酶含量呈剂量依赖性地降低,且差异有统计学意义(P<0.01)。

图2 比色法测定各组大鼠血清淀粉酶和脂肪酶含量
2.3 各组大鼠血清炎性因子水平比较 各组大鼠血清炎性因子IL-6、IL-1β和TNF-α检测结果见表1,与假手术组比较,模型组大鼠血清中IL-6、IL-1β和TNF-α水平均显著升高;与模型组比较,姜黄素低、高剂量组大鼠血清中IL-6、IL-1β和TNF-α水平逐渐降低,差异均有统计学意义(P<0.01)。
2.4 各组大鼠胰腺组织NLRP3、NF-κB通路蛋白阳性表达率比较 通过免疫组化染色观察胰腺组织NLRP3、NF-κB的阳性表达情况,结果如图3所示。与假手术组比较,模型组NLRP3、NF-κB蛋白阳性表达率升高,差异有统计学意义(P<0.01)。与模型组比较,姜黄素低剂量组和姜黄素高剂量组NLRP3、NF-κB蛋白阳性表达率均降低,且呈剂量依赖性,差异有统计学意义(P<0.01)。

表1 ELISA法检测各组大鼠血清炎性因子水平(pg/ml,n=21)

图3 免疫组织化学染色检测各组大鼠胰腺组织NLRP3、NF-κB的阳性表达
2.5 各组大鼠胰腺组织NLRP3、NF-κB通路蛋白表达水平比较 Western blot检测各组大鼠胰腺组织中NLRP3炎性体和NF-κB通路相关蛋白的表达情况,结果如图4所示。
结果显示,与假手术组比较,模型组NLRP3、caspase-1、ASC蛋白表达升高(P<0.01);与模型组比较,姜黄素低剂量组和姜黄素高剂量组NLRP3、caspase-1、ASC蛋白表达呈剂量依赖性降低(P<0.01)。与假手术组比较,模型组IκBα蛋白表达降低(P<0.01),p-p65、p65蛋白表达升高(P<0.01);与模型组比较,姜黄素低剂量组和姜黄素高剂量组IκBα蛋白表达升高(P<0.01),而p-p65、p65蛋白表达降低,均具有剂量依赖性(P<0.01)。
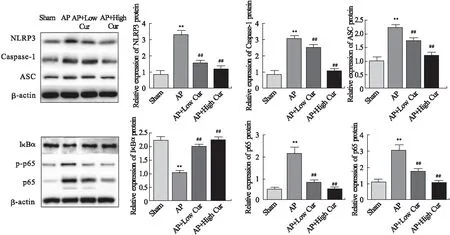
图4 Western blot检测各组大鼠胰腺组织NLRP3炎性小体和NF-κB通路相关蛋白的表达
3 讨论
AP的发生机制较为复杂,其临床特点为上腹痛、恶心、呕吐与发热等。其病情发展迅速,严重时导致多器官损伤从而引起死亡[16]。本研究通过逆行胰胆管穿刺法制备AP大鼠模型,检测结果显示,胰腺腺泡细胞大量坏死,出现大面积炎症细胞浸润,血清淀粉酶和脂肪酶含量增加,血清炎性因子IL-6、IL-1β和TNF-α水平均升高,表明模型大鼠胰腺组织出现严重炎症性损伤和组织病理改变,提示大鼠AP模型制备成功。改善AP关键在于控制炎症反应,通过减少炎症反应来减轻胰腺损伤,进而促进肠道功能恢复并防治多器官功能并发症[6]。
本研究显示,姜黄素低剂量组与高剂量组大鼠胰腺组织损伤程度逐步减轻,血清淀粉酶和脂肪酶含量呈下降趋势,IL-6、IL-1β和TNF-α水平降低。说明姜黄素可减轻AP模型大鼠胰腺组织损伤,改善胰腺炎时微循环的状况。胰腺腺泡细胞中的淀粉酶和脂肪酶通常用作AP诊断的生化标记,这些酶会使腺泡细胞发生损伤,促进局部和全身性炎症反应[17]。同样,各种炎性因子的过度释放会导致腺泡细胞发生凋亡和坏死,从而引发局部胰腺炎发展为全身性炎症反应[18]。TNF-α和IL-6为促发早期胰腺炎的重要诱因,在其刺激下,单核巨噬细胞会释放更多的内源性炎症介质,并上调黏附分子水平,从而介导组织损伤、脂质过氧化、细胞肿胀和死亡的发生[19]。本研究中,姜黄素处理阻止了血清淀粉酶和脂肪酶含量的增加,以及IL-6、IL-1β和TNF-α水平升高,这表明姜黄素可能会减少AP期间外分泌酶的过度分泌与炎性因子的产生。
NF-κB在多种炎症反应信号通路中发挥重要作用,是调节炎症反应和免疫反应的关键性核转录因子,激活后会导致多种炎症细胞因子的产生,NF-κB信号通路激活是AP发展过程中的关键一步[20]。研究表明,抑制NF-κB可以延长牛磺胆酸盐诱导的胰腺炎大鼠的生存时间并减轻炎症反应,NF-κB持续升高可能导致慢性胰腺炎发生恶化[21]。本研究结果与先前的结果一致,AP大鼠胰腺组织中NF-κB的阳性表达增加,IκBα蛋白表达降低,p-p65、p65蛋白表达升高,而低剂量和高剂量姜黄素能使胰腺组织中NF-κB阳性表达水平逐步下降,IκBα蛋白表达升高,p-p65、p65蛋白表达降低。
NLRP3炎性小体是由无活性的caspase-1前体、NLRP和凋亡相关斑点样蛋白(ASC)组成的复合体,能够识别多种诱导炎症的刺激并激活caspase-1,进而促进IL-1β和IL-18的成熟以及其他一些重要促炎因子产生与释放,最终使组织细胞发生炎症反应[22-23]。本研究中,AP大鼠胰腺组织中NLRP3的阳性表达增加,NLRP3、caspase-1、ASC蛋白表达升高,而低、高剂量姜黄素均能使胰腺组织中NLRP3阳性表达以及NLRP3、caspase-1、ASC蛋白水平下降。ASC作为NLRP3炎性小体的衔接蛋白,能够把caspase-1前体与NLRP3连接起来,形成高浓度caspase-1前体并使自身活化,形成具有酶活性的caspase-1[24]。caspase-1作为炎性小体的效应蛋白,可以将无活性的IL-18和IL-1β前体剪切为成熟且具有功能的IL-18和IL-1β[25]。
综上所述,姜黄素可减轻AP大鼠的胰腺组织损伤,减少血清脂肪酶和淀粉酶含量并降低炎性因子的水平,抑制NF-κB通路与NLRP3炎性体轴激活,提示姜黄素对AP大鼠具有保护作用。
