miR-17-5p和MMP2在百草枯致肺上皮-间质转化中的机制研究
2020-08-28贾茹珺李铁刚
贾茹珺,李铁刚
0 引言
近年来,百草枯(Paraquat,PQ)中毒的死亡率居高不下。百草枯可在多种器官内分布,具有明显的肺毒性,其引起的不可逆的肺纤维化是PQ中毒的主要死因[1]。上皮-间质的转化(Epithelial-mesenchymal transition,EMT)是指在一定的病理生理条件下上皮细胞表型发生改变,转化为间质细胞的过程[2]。在此过程中,细胞上皮标志物如E-cadherin、紧密连接蛋白-1、细胞角蛋白表达下降[3],而表达间质的标志物如α-SMA、波形蛋白(Vimentin)、N-钙黏附蛋白(N-cadherin)等表达上升[4-6]。EMT可参与肺间质纤维化的过程,肺泡Ⅱ型上皮细胞可通过EMT获得成纤维细胞样表型,促进胶原沉积及肺纤维化的发生,有研究证实,EMT参与百草枯中毒所致的肺间质纤维化的过程[7-8]。
细胞发生EMT后,其分泌基质金属蛋白酶(Matrix metalloproteinase,MMP)的能力会增强[9],MMP是调节细胞外基质(Extracellular matrix,ECM)降解破坏的重要蛋白水解酶,ECM合成和降解失衡会引起细胞外基质积聚,是导致肺间质纤维化的重要病理生理因素,MMP家族的重要成员包括MMP2和MMP9,目前关于MMP2在肺纤维化中的作用研究主要集中于二氧化硅和博来霉素诱导的肺纤维化中[10-12]。有关MMP2在PQ诱导的肺纤维化中的研究极少。在PQ诱导的肺损伤中,MMP9主要参与PQ诱导的急性肺损伤的早期炎症阶段,而MMP2可能主要参与晚期的肺组织损伤修复和纤维化过程[13],深入研究MMP2在PQ中毒所致的肺EMT过程中的作用具有重要的意义。
近年来,基因芯片和高通量测序等技术的飞速发展彻底改变了研究者对呼吸系统疾病的认识,除了编码蛋白的mRNA,细胞内还存在大量不能编码蛋白的RNA即非编码RNA(Non-protein-coding RNA,ncRNA)。ncRNA分为管家性和具有调控功能的RNA,其中调控型ncRNA包括微小RNA(microRNA,miRNA)和长链非编码RNA(Long non-coding RNA,LncRNA)等,miRNA和LncRNA在机体中发挥重要的调控功能,它们可通过调节mRNA的转录或翻译来影响生物反应[14]。
miRNA是长度为22~28 nt的单链RNA,由一段具有发夹环状结构的miRNA前体依次经2个核糖核酸酶Ⅲ内切酶(RNase Ⅲ endonucleases)(Drosha和Dicer)作用后形成,在进化方面具有保守性,其表达具有组织特异性和阶段特异性,是影响不同细胞的生理及病理机制的重要元件,可影响靶基因的稳定性并抑制靶基因蛋白水平的表达。在人类基因组中约有1 000个miRNA被鉴定出来,其中约有30%的基因都受其调控[15]。成熟的miRNA与RNA诱导沉默复合体(RNA-induced silencing complex,RISC)结合,再特异性地与靶RNA结合致其降解。miR-17~92 家族包括7种亚型:miR-17-5p、miR-17-3p、miR-20a、miR-19a、miR-19b、miR-92a和miR-18a。miR-17-5p在特发性肺间质纤维化(Idiopathic pulmonary fibrosis,IPF)的肺组织和成纤维细胞中低表达[16]。miR-17-5p可以调控MMP2[17],且经TargetscanHuman 7.2网站(www.targetscan.org/vert_72/)预测miR-17-5p和MMP2之间存在结合位点。目前对miR-17-5p在PQ中毒中的作用仅仅局限于神经毒性的研究,尚无人探讨其在PQ致肺EMT中的作用,且MMP2和miR-17-5p在PQ致肺EMT中的作用仍然未知,本研究就此进行分析,为PQ所致肺EMT提供新的潜在诊治靶点。
1 材料与方法
1.1 细胞培养 人类肺腺癌肺泡基底上皮细胞A549细胞购自中国科学院上海生命科学研究院细胞库,用含10%胎牛血清(Foetal bovine serum,FBS)的RPMI 1640 (SH30809.01,Hyclone)培养基进行培养,培养环境:37 ℃,5%CO2。
1.2 百草枯染毒 二氯百草枯购买于Sigma-Aldrich (36541,USA)。设置一定范围的PQ染毒暴露浓度梯度,用无血清的RPMI 1640培养基溶解PQ粉末,配制成高浓度PQ储备溶液备用。最终加入培养皿中的PQ终浓度依次稀释为15、30、60 μmol/L,培养6 d,2 d换液1次。
1.3 Western blot 用RIPA中性裂解液(P0013C,江苏碧云天生物技术有限公司)裂解A549细胞并提取蛋白。经BCA法(北京康为世纪公司)蛋白定量后,取30 μg的蛋白进行SDS-PAGE电泳,恒流转膜、5%脱脂奶粉封闭后孵育一抗[抗GAPDH抗体(10494-1-AP)购自武汉三鹰生物技术有限公司,抗E-cadherin抗体(ab76055)、抗α-SMA抗体(ab32575)、抗MMP2(ab37150)抗体购自Abcam公司]4 ℃过夜,孵育相应的羊抗鼠(ab97040)或羊抗兔(ab7085)二抗1 h。孵育结束后显色成像,并用Image J软件进行条带灰度分析。
1.4 qRT-PCR 用RNAisoplus (TAKARA,Japan)提取细胞总RNA,取500 ng的RNA进行反转录(TAKARA,Japan),miR-17-5p及U6在进行反转录反应时使用广州锐博生物技术有限公司提供的特异性RT Primer。
反转录完成后进行qRT-PCR扩增,miR-17-5p及U6扩增引物购自广州锐博生物技术有限公司,其余引物由上海生工生物股份有限公司合成。见表1。
1.5 细胞转染 miR-17-5p的mimic及inhibitor购自广州锐博生物技术有限公司。将生长状态良好的细胞均匀接种于60 mm培养皿中,稳定24 h左右,使细胞量达到50%左右;参照锐博生物miRNA产品说明书稀释mimic或inhibitor及其各自的阴性对照,并制备转染混合液;将混合液加入到完全无双抗培养基中并进行加药处理,37 ℃培养96 h收集细胞检测。
2 结果
2.1 PQ染毒后E-cadherin、α-SMA及MMP2蛋白表达情况 选取15、30、60 μmol/L 3个浓度PQ溶液对A549细胞进行染毒,培养6 d后,提取细胞蛋白质从蛋白水平检测染毒细胞E-cadherin、α-SMA及MMP2表达的变化情况。
结果显示,15 μmol/L PQ染毒组E-cadherin表达与对照组比较差异无统计学意义(t=1.759,P=0.153);30 μmol/L PQ染毒组E-cadherin表达下调(t=3.871,P=0.018),60 μmol/L PQ染毒组E-cadherin表达下调更明显(t=4.783,P=0.009)。15 μmol/L PQ染毒组α-SMA表达与对照组比较差异无统计学意义(t=0.235,P=0.820);30 μmol/L PQ染毒组α-SMA表达上调(t=2.504,P=0.037),60 μmol/L PQ染毒组α-SMA表达上调更明显(t=3.474,P=0.008)15 μmol/L PQ染毒组MMP2表达与对照组比较差异无统计学意义(t=1.088,P=0.338);30 μmol/L PQ染毒组的MMP2表达上调(t=3.977,P=0.016),60 μmol/L PQ染毒组MMP2表达上调更明显(t=5.165,P=0.007)。见图1。
2.2 PQ染毒后E-cadherin、α-SMA、MMP2 mRNA表达情况 细胞完成染毒后,提取RNA从mRNA水平验证EMT相关基因及MMP2的表达情况,qRT-PCR结果与Western blot一致。PQ染毒组与对照组相比,15 μmol/L PQ染毒组E-cadherin表达无显著改变(t=0.620,P=0.569),30 μmol/L PQ染毒组E-cadherin表达下调(t=4.679,P=0.010),60 μmol/L PQ染毒组E-cadherin表达下调更明显(t=97.520,P<0.001);15 μmol/L PQ染毒组α-SMA表达无显著改变(t=1.148,P=0.315),30 μmol/L PQ染毒组α-SMA表达上调(t=6.481,P=0.003),60 μmol/L PQ染毒组α-SMA表达上调更明显(t=24.53,P<0.001);15 μmol/L PQ染毒组MMP2表达无显著改变(t=2.659,P=0.057),30 μmol/L PQ染毒组MMP2表达上调(t=6.004,P=0.004),60 μmol/L PQ染毒组MMP2表达上调更明显(t=7.198,P=0.002)。见图2。
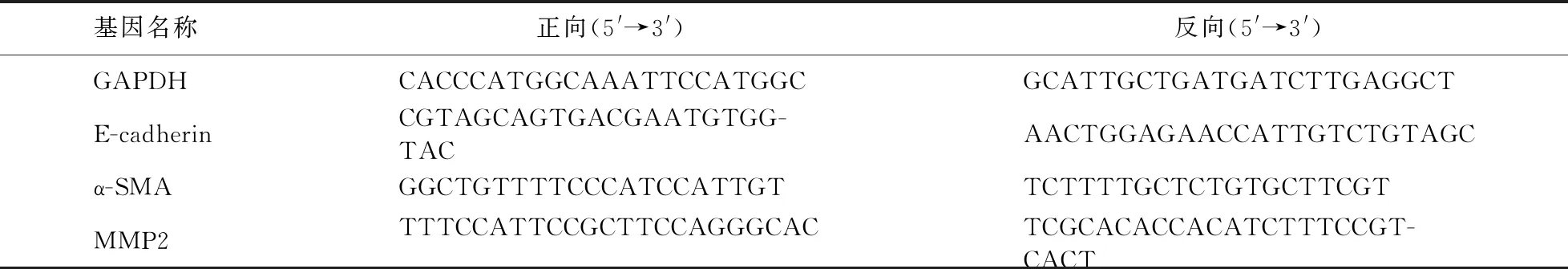
表1 qRT-PCR引物序列
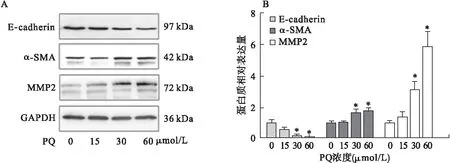
图1 Western blot检测PQ染毒后E-cadherin、α-SMA、MMP2表达
2.3 miR-17-5p和MMP2之间结合位点预测 TargetscanHuman 7.2网站(www.targetscan.org/vert_72/)预测miR-17-5p和MMP2的3’端非翻译区(3-untranslated region,3’UTR)存在两处结合位点。见图3。
2.4 miR-17-5p在PQ致细胞EMT模型中的表达情况及其对MMP2的影响 从RNA水平检测PQ染毒后miR-17-5p相对表达量的变化,与对照组相比,15 μmol/L PQ染毒组miR-17-5p表达无显著改变(t=0.211,P=0.843),30 μmol/L PQ染毒组miR-17-5p表达下调(t=4.568,P=0.010),60 μmol/L PQ染毒组miR-17-5p表达下调更明显(t=8.325,P=0.001),说明miR-17-5p在PQ中毒所致EMT的细胞模型中低表达(图4A)。进一步验证miR-17-5p与MMP2之间的关系,通过转染miR-17-5p的mimic(化学合成的成熟miRNA双链)和inhibitor(化学修饰的成熟miRNA互补单链)来上调或下调miR-17-5p的表达。通过qRT-PCR验证mimic和inhibitor的效能及其对MMP2表达的影响,转染mimic后细胞中miR-17-5p表达明显上调(t=21.510,P<0.001),MMP2表达下调(t=7.458,P=0.002)(图4B);转染inhibitor后细胞中miR-17-5p表达下调(t=2.856,P=0.046),MMP2表达上调(t=5.746,P=0.005)(图4C)。
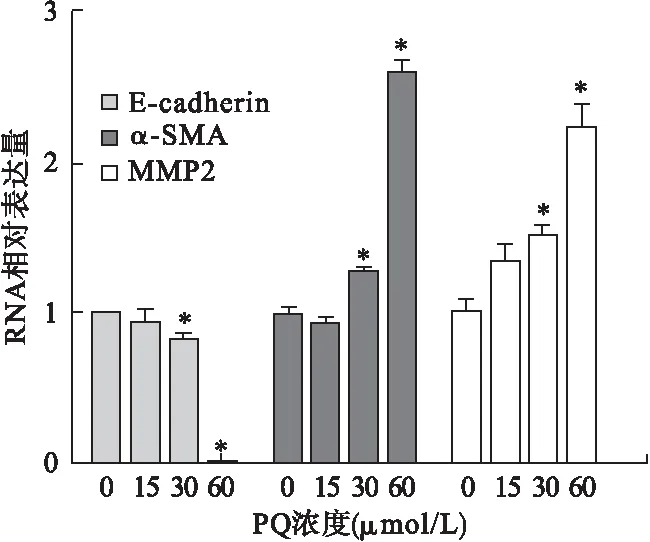
图2 qRT-PCR检测PQ染毒后E-cadherin、α-SMA、MMP2 mRNA表达
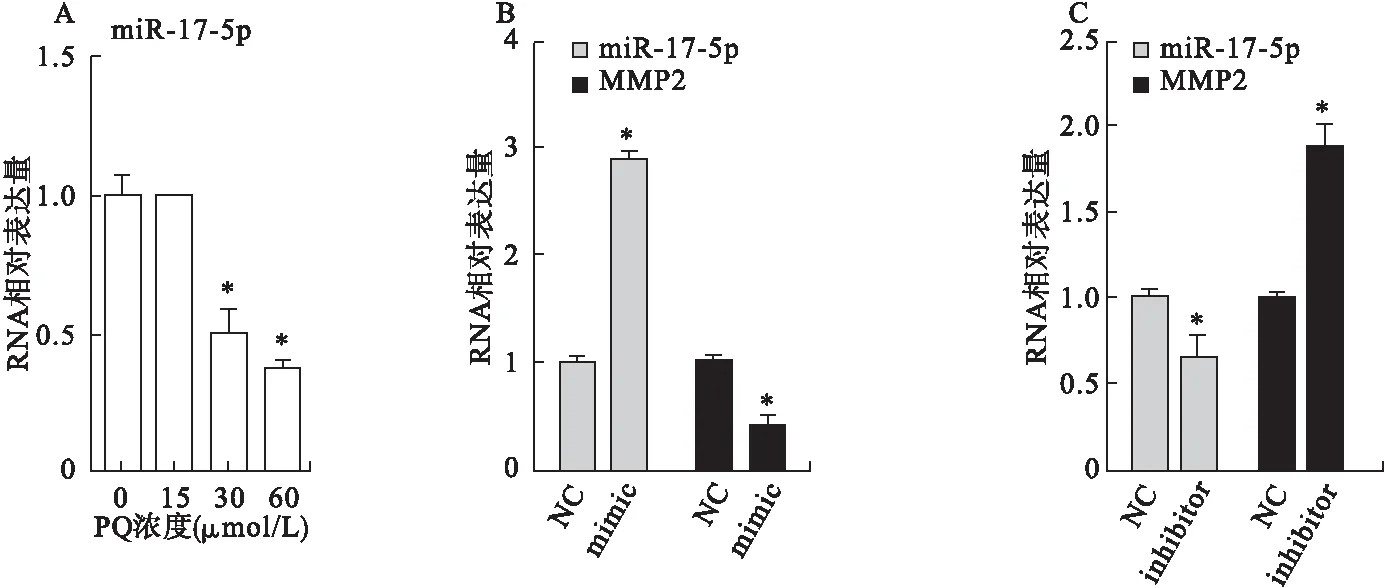
图4 miR-17-5p在PQ致细胞EMT模型中的表达情况及作用
3 讨论
PQ是目前世界范围内广泛使用的除草剂,其毒性强、中毒剂量小、预后极差。目前尚无针对PQ的特效解毒药,PQ中毒机制的研究具有重要的临床意义。PQ具有明显的肺毒性,在任何暴露途径下都主要积聚于肺泡上皮细胞,PQ在肺内的聚积呈时间依赖性增加,会破坏肺组织、引起过度修复及间质组织异常沉积,其导致的不可逆的和广泛的肺纤维化是PQ中毒的主要死因[18]。EMT常见于肿瘤和纤维化过程,在此过程中,上皮细胞会下调E-cadherin在内的细胞黏附分子的表达,使细胞之间的连接作用减弱甚至消失,而间质表达标志物会上调,增强细胞的迁移能力[19-20],EMT也可参与肺间质纤维化的过程[21],肺泡Ⅱ型上皮细胞可通过EMT获得成纤维细胞样表型,促进胶原沉积及肺纤维化的发生[22-23]。深入探讨EMT在PQ所致肺EMT中的作用机制具有重要临床意义。
PQ中毒后,肺上皮细胞的EMT可以促进细胞外基质的沉积[23-24],首先,本研究通过体外细胞实验检测PQ中毒后细胞的EMT过程,发现PQ中毒可以引起A549细胞的EMT改变,Western blot和qRT-PCR结果一致提示:一定适宜浓度的PQ染毒后,A549细胞会下调上皮表达标志物E-cadherin的表达,而上调间质标志物α-SMA的表达,验证了PQ的促EMT作用。
明胶酶MMP2是一种与迁移能力密切相关的蛋白水解酶,可降解基膜的层黏连蛋白和Ⅳ型胶原蛋白,破坏其完整性。同时这种破坏会进一步加重组织损伤修复,使肺纤维化进行性加重恶化[25]。除了降解基质成分外,MMP2可以调节趋化因子和细胞因子,在炎症调节过程中可促进迁移到炎症部位,是和细胞迁移能力增强有关的重要分子[26]。已有研究表明,MMP2的表达异常与肺纤维化密切相关[27]。在肺纤维化的发展过程中,MMP2的异常调节影响疾病的病理过程,MMP2可特异性地裂解ECM的重要成分,如明胶和胶原蛋白,从而破坏肺泡壁的结构[10]。在慢性损伤过程中,MMP可能会破坏肺泡细胞外基质支架,以致破坏正常修复所需的结构模板[28-29]。本研究显示,在PQ致A549细胞EMT模型中,MMP2表达上调。MMP2在PQ致肺EMT中的作用有待进一步研究。
miRNA是一种具有调节功能的短链ncRNA,在动物细胞中大多数的miRNA与其靶基因并不完全互补,miRNA的种子区序列(Seed region)通过和靶基因的3’UTR部分互补,进而阻止其转录后的翻译,起到下调和抑制基因表达的作用[30]。miRNA在肺纤维化的发生发展中具有重要的调控作用[31-33]。miR-17-5p是miR-17~92 家族的成员,在IPF患者肺组织和成纤维细胞中表达下调,可以作用于DNA甲基化相关的分子,在IPF肺成纤维细胞中上调miR-17~92 的表达,可以下调纤维化基因的表达,并使细胞表型正常化[16]。本研究通过qRT-PCR检测PQ致A549细胞EMT模型中miR-17-5p的表达情况,研究表明,miR-17-5p在该模型中表达下调。TargetscanHuman 7.2网站(www.targetscan.org/vert_72/)预测miR-17-5p和MMP2存在结合位点,因此,我们进一步通过转染miR-17-5p的mimic和inhibitor上调或下调miR-17-5p来研究其对MMP2的影响。本研究证实,增加miR-17-5p的表达量可使MMP2的表达下调,相反,降低miR-17-5p的表达量可使MMP2的表达上调,该结果验证了MMP2是miR-17-5p的下游靶基因,它的表达受到miR-17-5p的抑制。
综上所述,在PQ致肺上皮细胞EMT模型中,MMP2的表达升高,miR-17-5p表达下调,miR-17-5p和MMP2之间存在结合位点,MMP2的表达受miR-17-5p调控,使其表达受到抑制。本研究初步揭示了PQ致肺上皮细胞EMT中的miR-17-5p和 MMP2之间的相互作用,为PQ致肺EMT的诊断和治疗提供新的理论依据,但仍需要进一步的研究加以证实和应用。
