胰腺内副脾与G1级神经内分泌肿瘤的MRI鉴别诊断
2020-08-25卢明智王铁功邵成伟詹茜
卢明智 王铁功 邵成伟 詹茜
1海军军医大学第一附属医院放疗科,上海 200433;2海军军医大学第一附属医院影像医学科,上海 200433
副脾是指发生在正常脾脏之外的脾组织,较常发生于脾门及胰尾部[1]。胰腺内副脾(intrapancreatic accessory spleen, IPAS)与胰腺富血供肿瘤容易混淆,其中G1级胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, PNENs)因临床表现不典型、与IPAS影像学表现特征重叠较多,成为临床鉴别诊断的难点,容易互相误诊。临床上IPAS不需要特别处理,而G1级PNENs则多需手术切除[2],所以在影像学上对两者进行鉴别诊断意义较大。本研究通过对两组病例图像分析,以期发现IPAS和G1级PNENs的MRI特征及鉴别点,提高诊断准确率。
资料与方法
一、一般资料
回顾性分析2013年1月至2019年12月间海军军医大学第一附属医院收治的IPAS及PNENs患者资料。IPAS纳入标准:(1)经手术病理或99mTc热变性(Tc-99m-heat-denatured red blood cell, HDRBC)红细胞显像证实为胰尾副脾患者;(2)术前行MRI平扫加增强检查。排除标准:图像质量不佳,不能用于分析者。PNENs纳入标准:(1)经手术病理证实的G1级PNENs患者;(2)病灶位于胰尾部;(3)术前行MRI平扫加增强检查。排除标准:(1)有远处脏器和(或)淋巴结转移的患者;(2)图像质量不佳,不能用于分析者。
二、MRI检查方法
采用美国GE3.0T超导型MR仪和体线圈。受检者于MR检查前8 h禁食禁水,检查前训练呼吸。采用胰腺轴位和冠状位T2WI、2D-MRCP扫描,再进行横断面T1WI平扫和3期增强扫描。具体参数:(1)轴位脂肪抑制T2WI序列,重复时间(repetition time, TR)6316.0 ms,回波时间(echo time, TE)87.0 ms,层厚5 mm,层间距1 mm,视野(field of view, FOV)360 mm×420 mm,矩阵192×320。(2)冠状位屏气单次激发快速自旋回波(single-shot fast spin echo,SSFSE)序列,TR 2438.0 ms,TE 120 ms,层厚6~10 mm,无层间距,反转角90°,FOV 420 mm×420 mm,矩阵224×288。(3)2D-MRCP序列,TR 7000.0 ms,TE 1230.0~1270.0 ms,层厚64 mm,无层间距,反转角90°,FOV 420 mm×420 mm,矩阵288×288。(4)肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)T1WI序列,TR 2.58 ms,TE 1.18 ms,层厚5 mm,无层间距,FOV 440 mm×440 mm,矩阵224×270。增强扫描使用高压注射器注射对比剂,注射速率为3.0 ml/s,分别于注射后20~25 s、60~70 s、110~130 s扫描获取动脉期、静脉期和平衡期图像。扫描范围包括胰腺及邻近器官。
三、图像分析
由2名影像科主治医师盲法分别阅片,最终达成一致意见,主要观察内容:(1)病灶一般情况,如形态、大小、是否突出于胰腺轮廓之外、是否囊变等;(2)病灶实性部分、病灶平扫T2WI及DWI信号,以脾脏信号为参考,信号程度与脾脏信号相近为等信号,高于脾脏信号为高信号;(3)多期强化方式,包括病灶强化前后一致或病灶强化前后不一(动脉期和平衡期强化范围不同,通常动脉期强化范围较小,平衡期强化范围较大);(4)增强后病灶边缘假包膜;(5)胰管是否扩张。
四、统计学处理

结 果
一、一般情况
IPAS组共11例,其中男性8例,女性3例,年龄34~65岁。病灶最大径0.8~2.7cm;9例病灶形态规整,2例边缘呈浅分叶状;3例病灶突出于胰腺轮廓之外,8例无突出;3例病灶内囊变,8例无囊变;11例病灶均未见假包膜。G1级PNENs组共9例,其中男性7例,女性2例,年龄48~68岁。病灶最大径1.5~4.8 cm;4例病灶形态规整,5例边缘呈浅分叶状;9例病灶均突出于胰腺轮廓之外;7例病灶内囊变,2例无囊变;9例病灶均可见假包膜。两组性别、年龄、病灶最大径差异均无统计学意义,而病灶形态、病灶突出胰腺轮廓、病灶囊变及假包膜的差异均有统计学意义。IPAS组病灶较PNENs组病灶更规整,更易局限于胰腺轮廓之内,病灶内较少出现囊变,病灶边缘基本无假包膜(表1)。
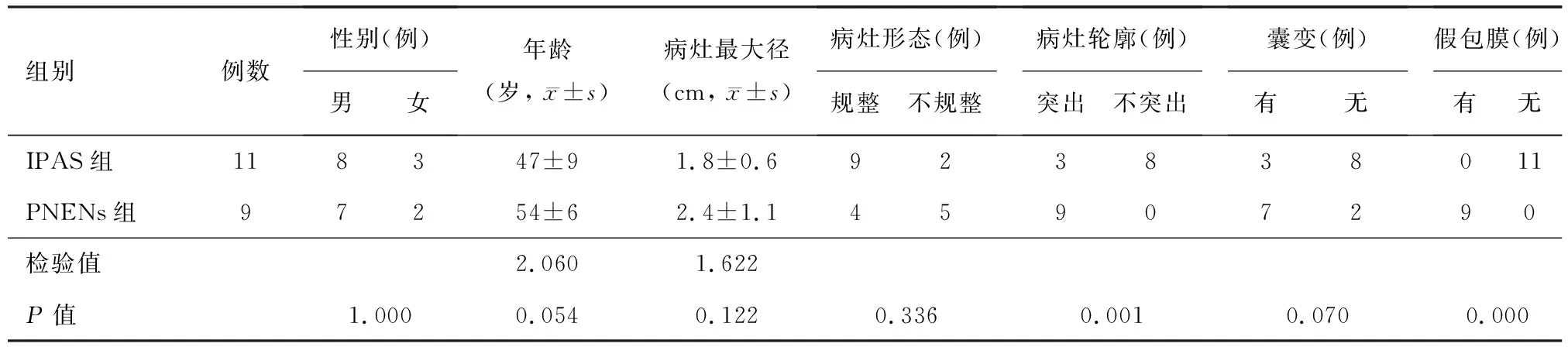
表1 胰腺内副脾组与神经内分泌肿瘤组患者一般情况比较
二、病灶T2WI和DWI信号特征及多期强化方式
IPAS组信号与同层面脾脏信号基本一致,11例病灶T2WI及DWI均表现为等信号。PNENs组中3例T2WI等信号,6例高信号;5例DWI等信号,4例高信号。两组T2WI、DWI信号特征的差异均有统计学意义。IPAS组以前后不一的强化方式为主,其中10例呈前后不一,1例表现为前后一致;动脉期表现为花斑样不均匀强化,平衡期强化均匀。PNENs组的强化方式多变,但基本呈前后一致的表现,即动脉期强化部分与平衡期强化部分重叠,强化程度可变;3例强化前后不一,实性部分呈现出逐渐向内填充式强化,6例强化前后一致。两组强化方式差异有统计学意义(表2,图1、2、3)。
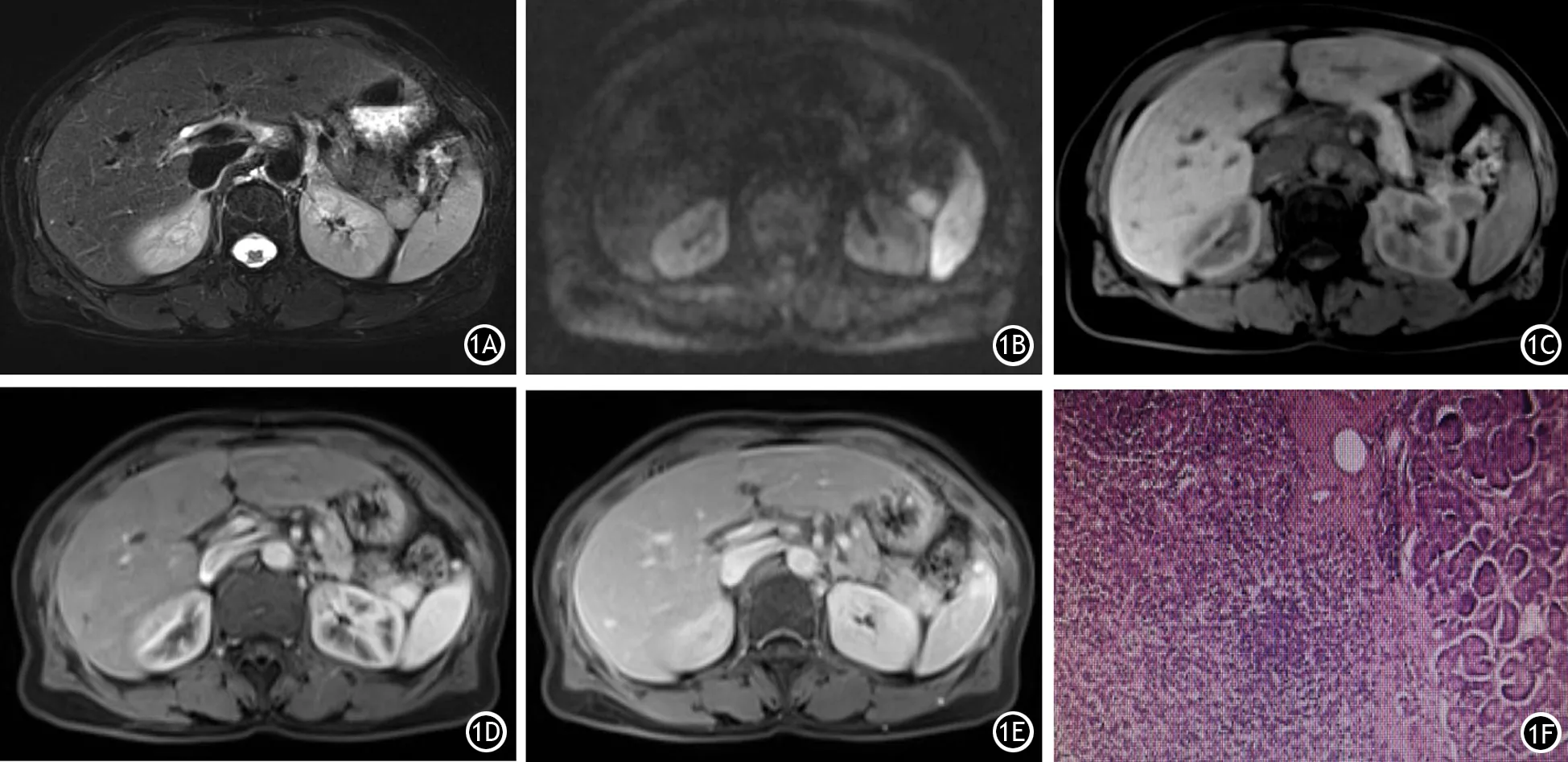
图1 患者女性,58岁。腹部坠胀感2年,加重2月,病灶T2WI(1A)、DWI(1B)及T1WI(1C)均与同层面脾脏信号相近,增强动脉期(1D)病灶整体呈花斑样强化,节选层面强化较明显,平衡期(1E)强化均匀,病理检查提示脾小梁结构存在,细胞无异型(1F,HE染色 ×40)
三、胰管受累情况
IPAS组无胰管受累,均无胰管扩张。PNENs组2例胰管扩张,其中1例合并慢性胰腺炎。两组胰管受累情况差异无统计学意义(表2)。
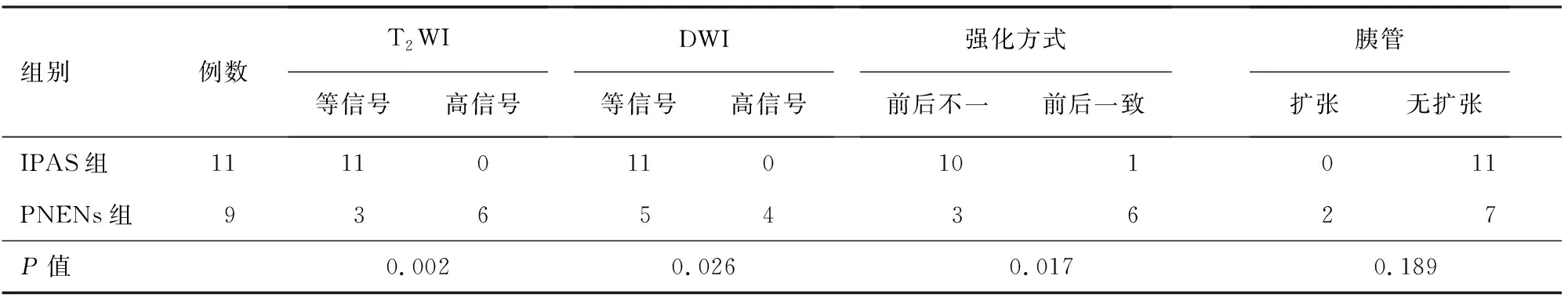
表2 胰腺内副脾组与神经内分泌肿瘤组患者影像学特征及胰管受累情况比较(例)
讨 论
IPAS与脾脏成分一致,成像基础同脾脏。占脾脏体积90%的红髓内含大量的静脉性血窦[3],水分含量较多,直接表现为脾脏组织T1WI信号偏低。胰腺腺体内富含水溶性蛋白和糖原,这两种物质均可缩短T1,致胰腺组织T1WI信号偏高[4]。因此,胰腺和胰腺内副脾的T1信号对比较明显,在T1WI平扫上常可检出病灶。另外,脾脏红髓静脉性血窦之间由致密的网状内皮系统构成,起到过滤血液的作用,细胞通过缓慢,分子弥漫稍受限,导致脾脏组织在DWI上信号偏高。同理由于网状内皮系统结构致密、血流缓慢,增强动脉期脾脏呈花斑样强化,平衡期强化均匀,强化方式呈现出前后不一的表现。
相对于G1级PNENs,G2~G3级肿瘤更易出现体积大、边界欠清、低强化、胰管扩张、远处转移等偏恶性征象[5-6],所以本研究选择与IPAS有更多共同影像特征的G1级PNENs进行分析。两者均为男性好发,IPAS发病年龄略低于PNENs,与Ishigami等[7]研究结果类似,但是两者年龄差异无统计学意义,这可能与样本量较少有关。两者在MR上均可表现为小病灶、强强化,所以两者在影像学诊断中容易误诊。
本研究结果显示,IPAS常局限于胰腺轮廓之内,可能与IPAS的发生机制相关。胚胎期融合失败的胃背系膜脾芽种植于胰尾,随后与胰腺组织共同生长,所以基本不会破坏胰腺本身形态。本组11例IPAS中3例突出于胰腺轮廓之外;而9例PNENs均突出于胰腺轮廓之外,因此这一影像学特征可以作为两者的鉴别征象。IPAS与PNENs病灶内均可发生囊变,11例IPAS中3例病灶内发生囊变,9例PNENs中7例病灶内发生囊变,可见PNENs更易发生囊变,但两者差异无统计学意义,考虑与样本量过少有关。另外,IPAS组11例均无胰管扩张,PNENs组9例仅2例胰管扩张,其中1例并发慢性胰腺炎,所以胰管是否扩张不能用于两者鉴别诊断。
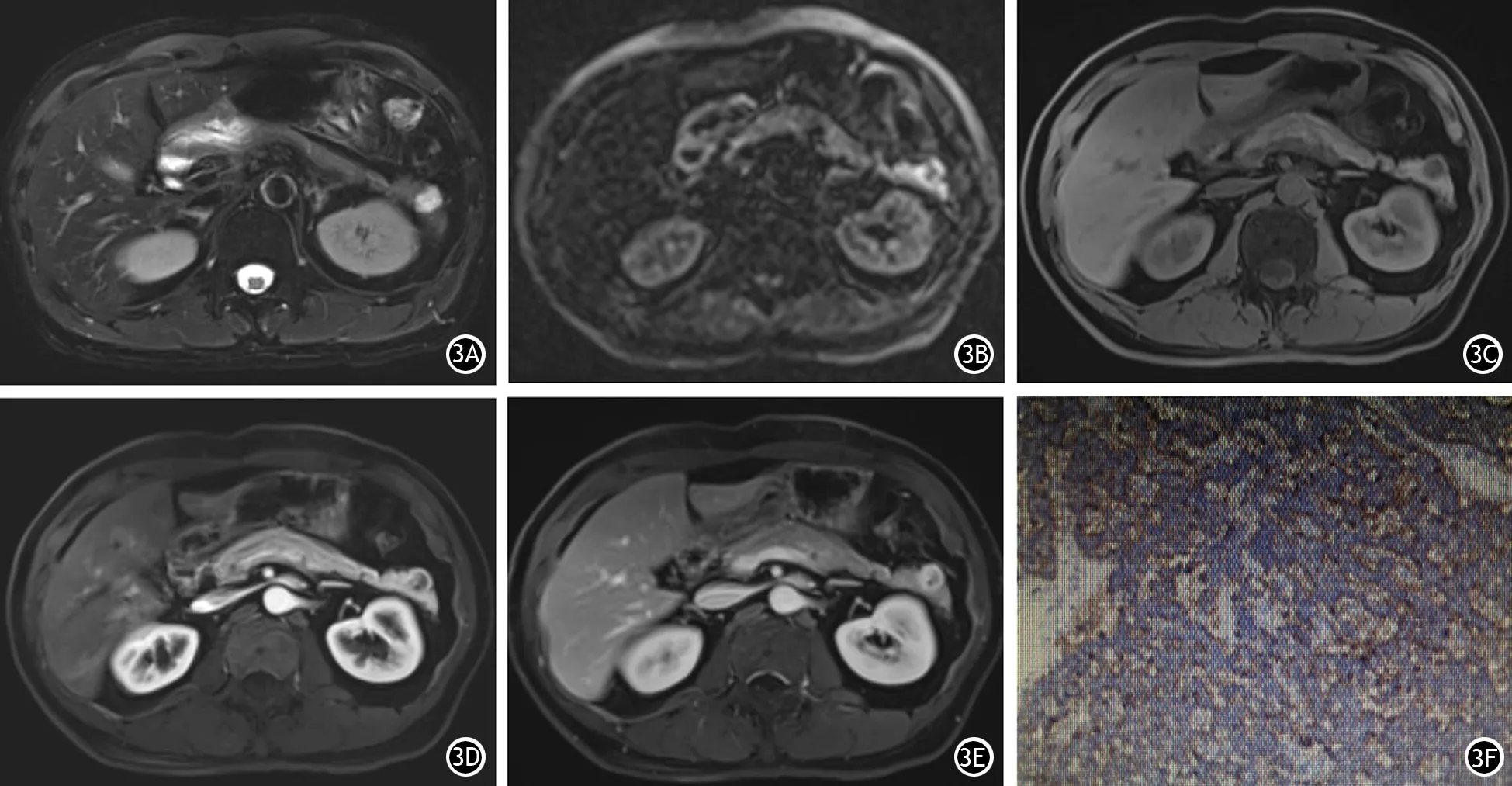
图3 患者男性,52岁。体检发现胰尾部占位,病灶突出于胰腺轮廓之外,T2WI(3A)呈明显高信号,DWI(3B)呈环形高信号,T1WI(3C)呈低信号,增强动脉期(3D)病灶环形强化,平衡期(3E)强化范围较动脉期增宽,免疫组织化学显示嗜铬素A阳性(3F ×100)
由于特殊的组织成分,IPAS的T1WI信号偏低,与胰腺信号对比明显,但PNENs的肿瘤细胞成分及囊变成分也表现为T1WI低信号,所以两者T1WI信号差异较小。然而PNENs实性部分在T2WI上以高信号多见、在DWI上约一半病灶表现为高信号,而IPAS在T2WI及DWI上均表现为等信号,两组差异均有统计学意义,与Kang等[8]研究结果一致,提示T2WI和DWI信号可以作为两者鉴别的参考因素。
增强动脉期IPAS常表现为花斑样强化,平衡期强化均匀,呈现出前后不一的表现。本组11例IPAS中10例表现为典型的前后不一强化方式,1例动脉期均匀强化,该例病灶最长径约1.0 cm,且脾脏动脉期也为均匀强化,考虑为病灶较小、动脉期扫描时间偏迟所致。PNENs较常发生囊变,囊变部分不强化,实性部分强化,动脉期及平衡期强化范围基本一致,差异主要表现在强化程度上。本组9例PNENs中3例表现为前后不一,均为逐渐扩散式强化,与IPAS前后不一的强化方式不完全一样。另外,增强扫描后PNENs病灶周围均可见假包膜,表现为病灶边缘环形强化,而IPAS组均无此现象,可以作为两者的鉴别征象。
综上所述,除了共有表现以外,IPAS和PNENs分别具有各自的影像学特征。IPAS病灶常局限于胰腺轮廓之内,病灶信号与同层面脾脏信号相近,内部信号均匀,囊变少见,多期增强显示为前后不一的强化方式,无假包膜;PNENs病灶基本均突出于胰腺轮廓之外,病灶T2WI及DWI信号均可高于脾脏信号,内部信号欠均,囊变多见,多期增强显示为前后一致的强化方式,病灶边缘可见假包膜。典型的IPAS通过以上影像学特点,基本可以将其与PNENs鉴别开来。
IPAS与PNENs鉴别的难点在于囊变的IPAS,囊变破坏了IPAS本身的形态特点,导致病灶更易突出于胰腺轮廓之外,本组3例囊变病灶有2例突出于胰腺轮廓之外,另外囊变的病灶实性部分减少,不利于信号及强化方式的观察,也给鉴别诊断带来了难度。所以,当遇到胰尾部囊变病灶时,需要更加仔细地观察残余实性成分的信号特点、强化方式及假包膜等因素进行诊断。
目前临床上通过HDRBC对IPAS进行确诊。本研究IPAS组中3例行HDRBC检查,其中1例未见明显放射性浓聚,漏诊后行手术治疗,病理提示为IPAS,回顾分析该病例,考虑为病灶过小(最长径约1.0cm)、距离脾脏过近,导致病灶被脾脏的放射性浓聚所掩盖可能。
因本研究为回顾性研究,不能对多b值DWI信号进行对比分析;且样本量较少,导致部分研究结果可能存在偏差。
利益冲突所有作者均声明不存在利益冲突
