系统性硬化症并发肺动脉高压患者甲襞微循环特征分析
2020-08-14滕超张蕾张丽琴吴洋
滕超 张蕾 张丽琴 吴洋
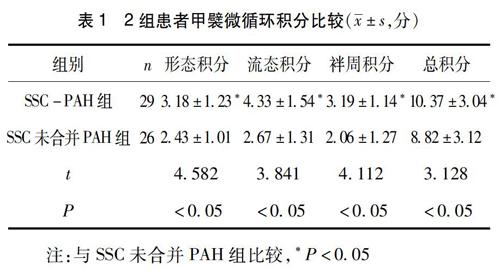

摘要:目的分析系统性硬化症并发肺动脉高压患者甲襞微循环改变的特征,探析其在诊断系统性硬化症并发肺动脉高压中的作用及现实意义。方法选取云南省中医医院风湿病科2018年1月—2018年12月收治的系统性硬化症患者55例,按照是否并发肺动脉高压分成系统性硬化症并发肺动脉高压组(SSc-PAH,n=29)以及系统性硬化症未并发肺动脉高压组(n=26)),在本科对其行甲襞微循环检测,分析2组患者甲襞微循环各项积分差别,探析其与系统性硬化症患者甲襞微循环积分之间的关联性。结果SSc-PAH组的患者甲襞微循环形态积分、流态积分、袢周积分和总积分均显著高于未并发PAH的SSc患者(t=4.582,3.841,4.112,3.128,P<0.05);在甲襞微循环特征上SSc-PAH组与SSc未并发PAH组比较,SSc-PAH组管袢清晰度较差,模糊管袢比重显著高于未并发PAH组,组间比较差异有统计学意义(P<0.05),SSc-PAH组管袢畸形、管袢短缩、管袢细窄、管袢数少(乳头以平坦或浅波纹状多见)、袢周渗出、袢周出血占比均明显高于未并发PAH组,2组相比差异有统计学意义(P<0.05)。结论甲襞微循环在系统性硬化症并发肺动脉高压患者管袢清晰度及形态等较系统性硬化症未并发肺动脉高压患者有显著改变,表明甲襞微循环可以作为诊断系统性硬化症患者肺动脉高压的一项辅助检查。
关键词:系统性硬化症;肺动脉高压;甲襞微循环
中图分类号:R593.25文献标志码:B文章编号:1007-2349(2020)04-0027-04
系统性硬化症(systemic sclerosis,SSc)又称硬皮病,是一种病因不明、发病率不太高的结缔组织病,以免疫失调、血管病变、炎症、皮肤及内脏的过度纤维化为主要特点[1]。世界各地均有患病,患病率在(0.7~50)/10万,可因地理位置、种族等有很大差异[2]。SSc的发病机理主要是血管、免疫和纤维过程间复杂的相互反应,微血管病变在SSc发病机理中占有重要位置。[1]。SSc临床表现多样,包括雷诺现象、皮肤增厚、皮肤肿胀变厚变硬、毛细血管扩张、甲襞毛細血管异常、肺动脉高压(pulmonary arterial hypertension,PAH)和间质性肺病(interstitial lung disease,ILD)、胃肠道并发症、肾脏并发症及心血管并发症等[3]。随着临床ACEI类药物使用增加以及血透技术的革新,系统性硬化肾危象发生比重逐年下降,转而肺部成为其攻击的主要脏器,其中PAH已成为SSc死亡的主要关注点之一,西班牙最近的一项研究证实了这一点[4]。研究表明SSc-PAH患者在没有治疗的情况下,其平均存活时间为1年,与原发性肺动脉高压相比,其死亡风险上升了3倍。同时,循证医学研究证实改善PAH预后主要在于及早发现、及早治疗[5]。甲襞微循环检测是镜下直接观察指甲根部毛细血管反映微血管灌注情况,同时对人体大循化情况有一定的提示。2013年ACR/EULAR对1980年ACR发布的SSc诊断标准进行了首次修订,新增“甲襞毛细血管异常”,细化和突出了SSc特征性毛细血管改变可以作为SSc的诊断依据[6]。本研究通过分析SSc与SSc并发PAH患者甲襞微循环差别,探析甲襞微循环在SSc合并PAH早期诊断的价值。
1资料与方法
1.1一般资料本研究选取2018年1月—2018年12月在云南省中医医院风湿病科收治的SSc患者55例。其中女43例,男12例;按照是否并发PAH分为:SSc-PAH组29例,其中男3例,女26例,年龄32~50岁之间,平均(42.1±6.4)岁,发病病程在3~8 a不等,平均为(5.16±1.50)a;SSc未并发PAH组26例,其中男1例,女25例,年龄31~53岁之间,平均(41.8±7.1)岁,发病病程在3~10 a不等,平均为(5.0±1.6)a。所有患者均排除并发其他风湿科疾病者。2组患者基线资料对比差异无统计学意义,具有可比性(P>0.05)。
1.2诊断标准SSc的诊断标准:符合1980年ACR的SSc诊断标准或2013年ACR/EULAR SSc新诊断标准≥9分就可诊断为SSc;PAH的诊断标准:采用2004年美国胸科医师学会诊治指南[7]的诊断标准,通过对患者进行心脏彩超检查或者经患者同意采用右心导管结合心电图及胸片,测算出肺动脉平均压力在静息状态下>25 mmHg或运动后>30 mmHg(1 mmHg=0.133 kPa)即诊断为PAH。
1.3病例纳入标准①SSc及PAH诊断明确。②患者病历记录及检查资料完整无丢失。③甲襞微循环检测与心脏彩超检查时间间隔不能超过3个月。
1.4排除标准①合并肺部或其他部位感染。②确诊时合并恶性肿瘤。③既往使用可致肺动脉高压的药物(苯氟雷司、干扰素、冰毒等)。④既往心血管疾病病史。⑤环指指端存在溃疡瘢痕、坏疽或指端缺如。⑥合并肺间质病变。⑦合并尘肺。
1.5甲襞微循环检测每天早晨9:00~11:00在云南省中医医院风湿病科B超室,[HJ2.8mm]检查前使室内温度及湿度相对恒定;检查前安静休息半小时;检查前1 h内禁止服用食物、对心血管系统和毛细血管有作用的药物以及洗手;女性避开月经期;嘱患者坐位,放松,在其左手环指指甲根部皮肤皱褶处滴1~2滴香柏油,涂匀,将手指平放在彩色微循环检测仪(徐州同人医疗电子科技有限公司生产,型号TR8000B型)的凹槽中,保持左手环指末端和心脏在同一平面,通过电脑显示器观察患者左手环指甲襞上皮下真皮乳头内第1排毛细血管,同时对图像资料处理后,检测结果详尽保留于电脑内,通过最少2名本科甲襞微循环专家对患者结果进行分析[8]。
1.6统计学方法采用SPSS22.0计算软件对所得结果进行统计分析。计量资料用(x±s)表示,符合正态分布的两样本均数相比运用t检验,多样本比较运用方差分析,不符合正态分布采用非参数秩和检验。P<0.05为差异有统计学意义。
2结果
2.12组甲襞微循环积分比较与未并发PAH的SSc患者相比,并发PAH的SSc患者甲襞微循环形态积分、流态积分、袢周积分和总积分均显著增高(P<0.05)。见表1。
2.22组患者甲襞微循环特征比较SSc-PAH组与 SSc未并发PAH组比较,SSc-PAH组管袢清晰度较差,模糊管袢比重显著高于未并发PAH组,组间比较差异有统计学意义(P<0.05);SSc-PAH组管袢畸形、管袢短缩、管袢细窄、管袢数少(乳头以平坦或浅波纹状多见)、袢周渗出、袢周出血占比均明显高于未并发PAH组,2组相比差异有统计学意义(P<0.05),其余的微循环特征,2组之间差异无统计学意义(P>0.05)。见表2。
3讨论
随着1973年首次报道了SSc患者毛细血管特征性变化,越来越多医生的关注微血管病变的早期检查手段[9]。PAH是SSc的常见并发症之一,其发病机理可分为两种,一种是疾病累及肺组织引起的ILD,从而导致PAH。另一种即继发性PAH,如SSc患者血管内皮细胞受损,运动性变差,血管收缩,肺动脉压力上升。同时临床上合并PAH起病隐匿,早期不易察觉,容易被忽视,一旦发病进展较快,现已成为该病死亡的首要原因之一[10]。因此,及早筛査,明确诊断,改善预后是亟待解决的问题。尽管临床中右心导管术是公认的诊断PAH的金标准,但其本身的有创性及不易被大多患者所接受,临床推广较为困难,故寻找一种相对安全有效、易被病患接受的检测方法显得尤为重要。
甲襞微循环检测是镜下直接观察指甲根部毛细血管反映微血管灌注情况,该检测无创,可操作性及重复性强,容易被更多患者接受[11]。SSc患者并发PAH时,分析本研究中PAH组患者镜下毛细血管流速、血管运动性、袢周出血、乳头平坦异常的原因可能是微血管病变累及肺部并发PAH,患者血管内皮细胞功能严重受损,NO的合成受阻,肺部血管收缩,导致毛细血管的血流速度减慢,血管舒张功能变差[12],镜下所表现出来的即袢周的出血及平坦的乳头。因此对于专科医生而言,SSc患者进行甲襞微循环检测发现总积分升高时,并发PAH的风险也在增加,说明对于早期发现SSc患者是否并发PAH甲襞微循环检测具有重要参考价值。同时此次研究发现SSc并发PAH的患者,36.4%的患者镜下乳头为平坦,提示临床中对于甲襞微循环检测发现乳头平坦的SSc患者应该引起医生的重视,需进一步完善心脏彩超或右心导管检查明确诊断。
综上所述,对于早期筛查SSc患者是否并发PAH,临床中除了常规检查外,应该重视甲襞微循环检测这项既简单且易被接受的检查,改善PAH预后主要在于及早发现、及早治疗,对于SSc微循环特征异常患者应引起重视,进一步行相关检查明确诊断[13]。
参考文献:
[1]Furue M,Mitoma C,Mitoma H,et al.Pathogenesis of systemic sclerosis-current concept and emerging treatments[J].Immunol Res,2017,65(4):790-797.
[2]Distler O,Cozzio A.Systemic sclerosis and localized scleroderma-current concepts and novel targets for therapy[J].Semin Immunopathol,2016,38(1):87-95.
[3]Denton CP,Khanna D.Systemic sclerosis[J].Lancet,2017,390(10103):1685-1699.
[4]SANTOSA A,TAN C S,TENG G G,et al.Lung and gastrointestinal complications are leading causes of death in SCORE,a multiethnic Singapore systemic sclerosis cohort[J].Scand J Rheumatol.2016,45(6):499-506.
[5]SIMEON-AZNAR C P,FONOLLOSA-PLA V,TOLOSA-VILELLA C,et al.Registry of the Spanish network for systemic sclerosis:survival,prognostic factors,and causes of death[J].Medicine(Balti-more),2015,94(43):e1728.
[6]van den Hoogen F,Khanna D,Fransen J,et al.2013 classification criteria for systemic sclerosis:an American college of rheumatology/European league against rheumatism collaborative initiative[J].Ann Rheum Dis,2013,72(11):1747-1755.
[7]Mc Goon M,Gutterman D,Steen V,et al.Screening,early detection,and diagnosis of pulmonary arterial hypertension:ACCP evidence-based clinical practice guidelines[J].Chest,2004,126(1 Suppl):14S-34S.
[8]田牛,劉凤英.甲襞,球结膜微循环主要改变的病理生理基础[M].北京:原子能出版社,1996:44.
[9]Marino Claverie L,Knobel E,Takashima L,et al.Organ involvement in Argentinian systemic sclerosis patients with “late” pattern as compared to patients with“early/active” pattern by nailfold capillaroscopy[J].Clin Rheumatol,2013,32(6):839-843.
[10]ORIHARA Y.ASAKURA M.ANDO T,etal.The Roles of IL-18 and Ferritin in Systemic Sclerosis Patients With Pulmonaiy Hypertension[J].Journal of Cardiac Failure,2017,23(10):S69.
[11]徐雪,朱小霞,薛愉,等.系统性硬化病患者甲襞毛细血管的特点及其与其他结缔组织病的比较[J].中华风湿病学杂志,2012,5(16):237.
[12]Cutolo M,Sulli A,Smith V.Assessing microvascular changes in systemic sclerosis diagnosis and management[J].Nat Rev Rheumatol,2010,6(10):578-587.
[13]Riccieri V,Vasile M,Iannace N,et al.Systemic sclerosis patients with and without pulmonary arterial hypertension:a nailfold capillaroscopy study[J].Rheumatology(Oxford),2013,52(8):1525-1528.
(收稿日期:2020-01-19)
基金項目:云南省卫生科技计划项目(2018NS0041)
作者简介:滕超(1994-),男,在读硕士研究生,研究方向:中西医结合临床风湿病的防治与研究。
通信作者:吴洋,E-mail:wuyang201719@126.com
