驼乳生物活性肽的研究进展
2020-08-03王瑞雪吉日木图
王瑞雪 伊 丽,2 吉日木图,2*
(1 内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特010018 2 内蒙古骆驼研究院 内蒙古阿拉善750306)
乳源性生物活性多肽是来源于各种乳蛋白,并与乳蛋白肽链的某些片段序列相同或相似,在乳蛋白中,或在其降解过程中得到的具有不同生物活性功能的肽类[1]。近年来,由于乳源生物活性肽生物活性强、天然、安全、容易制备且来源广泛,故成为乳品领域的研究热点。在过去的几十年里,研究者们利用不同的提取技术和方法,不断从乳蛋白中发现新的生物活性肽。随着组学技术的飞速发展,基于生物质谱的蛋白质组学技术也逐渐应用于乳源生物活性肽的研究中,使得乳源生物活性肽的研究更加深入[2]。
驼乳源中的蛋白质是生物活性肽的丰富来源地。驼乳蛋白质主要分为乳清蛋白、酪蛋白和乳脂肪球膜蛋白。其中酪蛋白含量最高,占总蛋白质含量的61.8%~88.5%[3],并以β-酪蛋白(65%)和αs1-酪蛋白(22%)为主,其中β-酪蛋白含量远高于牛乳(39%),与人乳(65%)相近。乳清蛋白约占总蛋白质含量的30%左右。与牛乳相比,驼乳中含有大量的乳铁蛋白(1.74 mg/mL)、乳过氧化物酶(0.09 mg/mL)、溶菌酶(0.00015 mg/mL)和免疫球蛋白(1.54 mg/mL)等保护性蛋白(见表1)[4]。近年来,已有多项研究表明,驼乳不仅具有抗氧化,保肝,抗炎和抗菌等作用,还可用于治疗肺结核和妇科疾病,辅助治疗癌症、糖尿病及预防儿童佝偻病等[5-6]。然而,相较于驼乳功能作用的研究,驼乳生物活性肽的研究起步较晚,本文将结合国内外驼乳蛋白质水解及发酵降解产生的特定生物活性肽及其生理功能进行综述。
1 驼乳蛋白生物活性肽的提取
1.1 酶解法
蛋白酶法水解驼乳蛋白是目前获得生物活性肽普遍采用的一种方法。该法是在提取出的驼乳蛋白液中加入特定蛋白酶,通过设定不同反应条件获取酶解液,并经过层析和高效液相色谱等方法对其酶解物进行分离纯化,获取生物活性肽。不同蛋白酶水解会得到不同功效的肽段,其中驼乳酶解中使用最广泛的为消化酶类,如胃蛋白酶、胰蛋白酶和糜蛋白酶。此外,其它一些蛋白酶,如木瓜蛋白酶、小麦蛋白酶、嗜热芽孢菌蛋白酶、碱性蛋白酶以及细菌和真菌中所含的酶也用来酶解驼乳蛋白质。
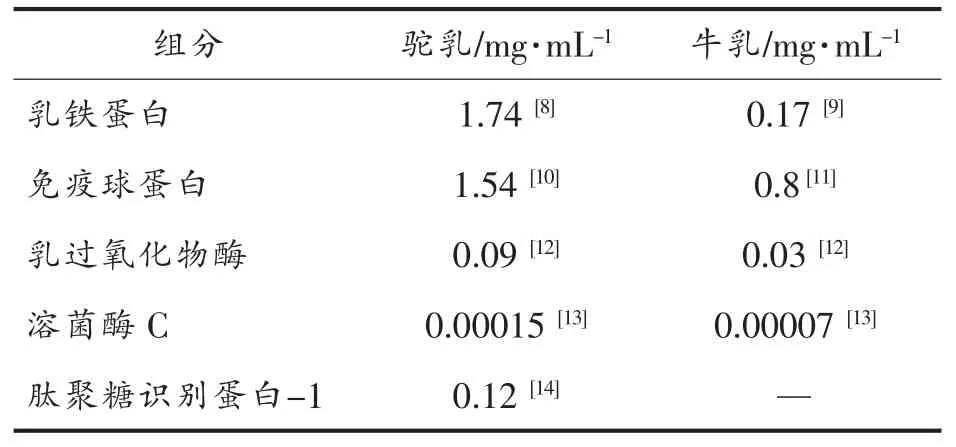
表1 驼乳和牛乳蛋白含量对比[7]Table 1 Protein content of camel milk and cow milk contrast[7]
1.2 发酵液
利用微生物发酵液处理驼乳也可获得丰富的活性多肽。发酵培养基系统本身是高度蛋白酶解系统,与蛋白酶解系统原理相同,例如:乳酸杆菌的发酵液含有多种胞内多肽酶[15]。发酵液分解蛋白质与其含有的微生物息息相关,这与酶水解蛋白质存在本质上的差异。近来,很多研究阐明了这些酶的生化和遗传特性。研究表明这些酶的活性与微生物的生长条件密切相关。因此可以通过调节微生物的生长温度、pH 和时间等物理因素,以及筛选发酵菌种,从而控制不同活性多肽的生成。最近很多研究表明,驼乳蛋白质的微生物发酵液中,已发现诸如ACE 抑制肽、抗高血压肽、免疫调节肽、抗氧化及抗菌肽等多种乳源性生物活性多肽。发酵液中的菌株,以瑞士乳酸杆菌和鼠李糖乳杆菌最为常用。研究表明,含有这两种菌株的发酵液产物比蛋白酶水解产物能释放更多种类的ACE抑制肽。由于发酵液中存在多种微生物,因此分离出的肽段生物活性更加丰富,值得进一步探索。
1.3 体外模拟肠胃消化液
体外模拟消化液即通过模拟动物消化的生理特点,采用与动物体内相近的消化酶系统,模拟出相近消化环境从而分解蛋白。该法可直观的反应人体对于驼乳蛋白的消化吸收利用度。目前,驼乳蛋白消化的试验体系并不健全。例如,体外应采用更复杂的消化方案进行消化试验;应模仿成人或婴儿肠道模型或模仿不同的生理情况进行消化试验。这个技术在开发工业化生产驼乳制品等方面具有很高的应用价值。
2 驼乳生物活性肽的分类
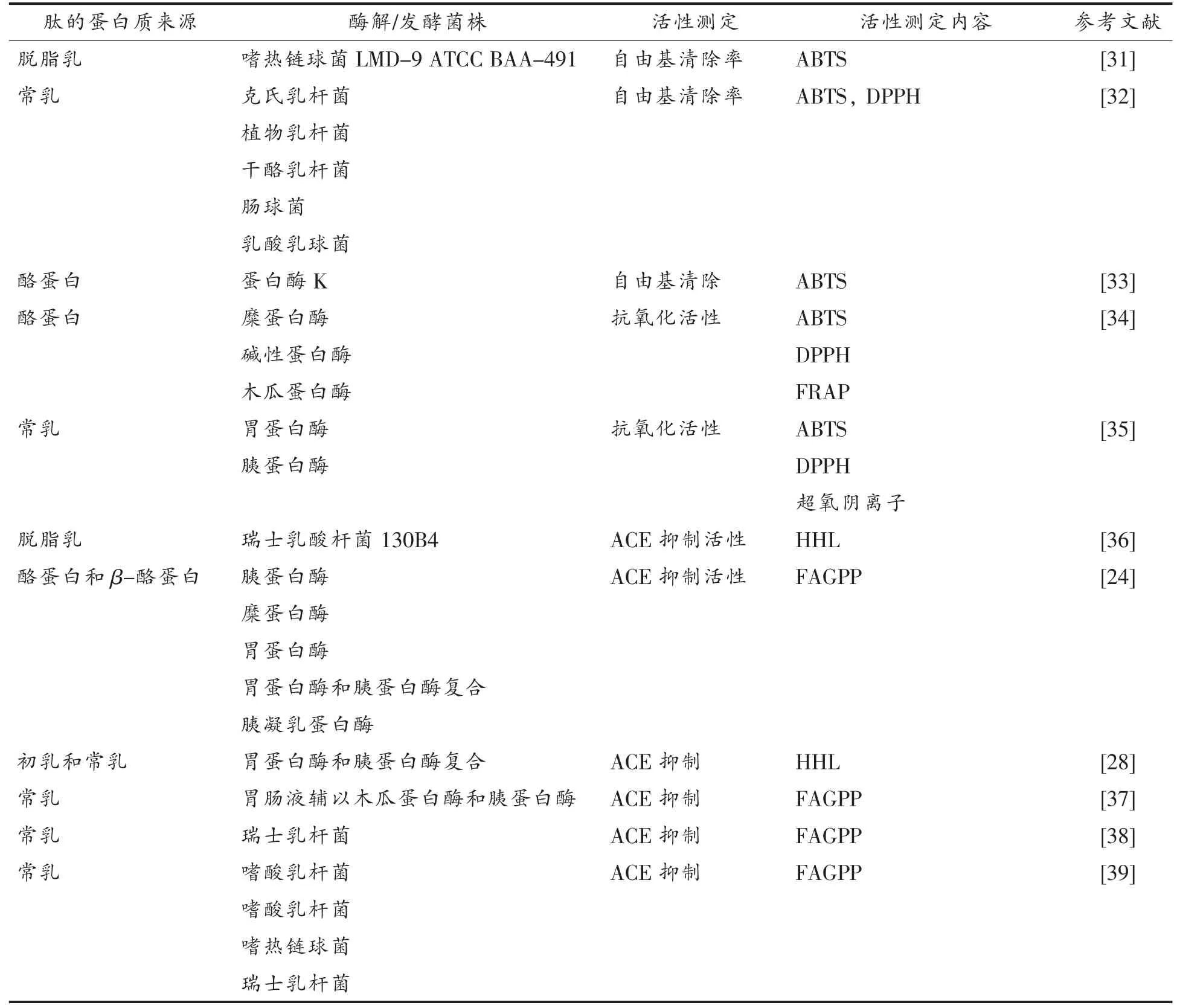
目前已鉴定出许多驼乳中潜在的生物活性肽前体,这些生物活性肽前体可能具有潜在的免疫调节、细胞调节、抗糖尿病、抗炎、抗高血压、抗氧化以及矿物质结合(含有磷酸丝氨酰残基的酪蛋白磷酸肽)等功能[16]。表2中总结了近年来驼乳生物活性肽的研究进展。目前,对于驼乳生物活性肽的研究主要集中在抗菌、抗氧化以及ACE 抑制活性3 个方面。国内对于驼乳肽的研究尚少,国外研究居多。国外大多数为单峰骆驼种,国内骆驼主要以双峰驼为主,存在品种差异,因此驼乳中的生物活性肽可能产生不同的生物学效应,有待进一步研究鉴定。
2.1 抗菌肽
抗菌肽又称为肽类抗生素,是生物体产生的具有抗菌作用的小分子蛋白质,是宿主先天性非特异性防御系统的重要组分。抗菌肽的氨基酸数目小于100,常带正电荷,能杀伤细菌、真菌和原虫,还能抑制病毒的繁殖以及特定肿瘤细胞的生长。
目前,乳源抗菌肽的研究主要集中于牛乳和羊乳,有关驼乳抗菌肽的研究极少。Noreddine 等[17]将未处理的驼乳和牛乳进行抑制效果比较,结果表明驼乳的抑菌效果较为显著。Jrad 等[28]利用驼乳蛋白酶水解产物进行抑菌试验。结果表明,骆驼初乳的抗菌活性高于牛乳,且经过与未处理原乳的对比试验得出蛋白酶解后释放出更多具有抗菌活性的肽的结论。文献[28]中确定了181 种肽,其中25 种肽的序列呈同源性,且蛋白质片段具有多种潜在的生理活性。2014年Lafta 等[40]将驼乳经嗜热链球菌和德氏保加利亚亚种乳杆菌发酵处理,获得具有抗菌活性的肽段。由此看来,驼乳作为天然且丰富的抗菌肽来源仍需深入研究。
2.2 抗氧化肽
自由基对人体的危害非常大,不仅会破坏DNA 组织,导致基因突变,还会干扰体内系统的运作,以致产生更多自由基,其连锁反应可导致自由基危害遍及全身。抗氧化肽是具有较强的抑制生物大分子过氧化和清除体内自由基功能的肽类。一般认为,抗氧化肽的抗氧化活性与多肽的相对分子质量大小、氨基酸序列、氨基酸侧链基团以及金属盐络合有关。抗氧化肽的抗氧化活性由其分子供氢的能力和自身结构的稳定性决定。抗氧化肽的作用机理是直接作用在自由基,或间接消耗容易生成自由基的物质,防止发生进一步反应。抗氧化肽是目前的研究热点,抗氧化肽对抑制、延缓脂质氧化,保护人体组织器官免受自由基侵害有特定作用。目前,驼乳抗氧化肽抗氧化活性的测定方法包含ABTS (总抗氧化能力检测试剂盒法)法、DPPH (广泛用于定量测定生物试样和食品的抗氧化能力)法和FRAP(亚铁还原能力实验,广泛运用于食品与保健品的抗氧化能力分析。不仅能够证明膜的流动性,同时也能测量膜蛋白扩散速率)法,并发现驼乳蛋白质的水解程度随水解时间的延长而增加。其中,DPPH 法使用最广泛[25]。
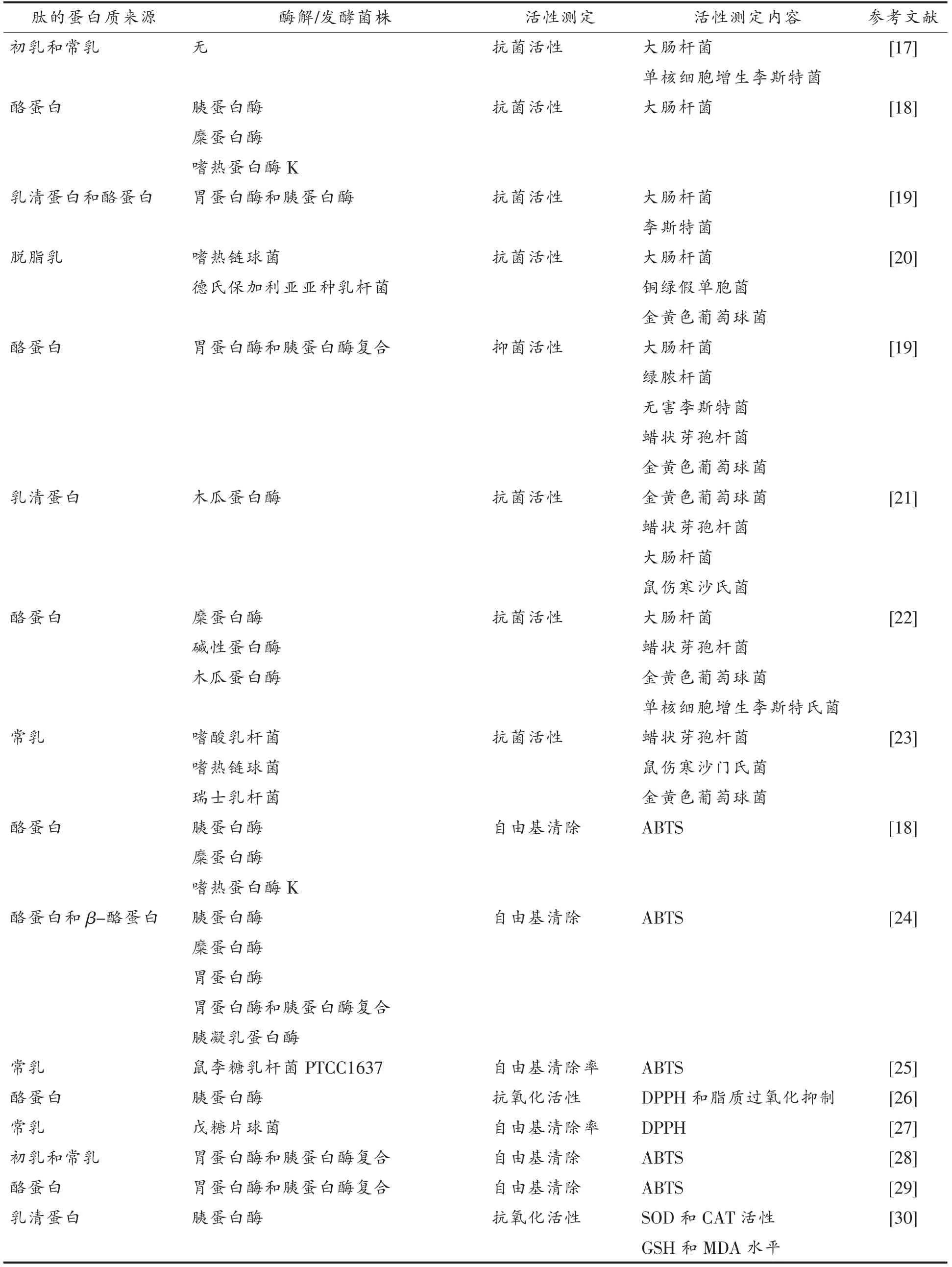
表2 驼乳生物活性肽的研究Table 2 Study on camel milk bioactive peptides
(续表2)
Homayounitabrizi 等[35]使用胃蛋白酶和胰蛋白酶水解驼乳和牛乳并提取具有生物活性的肽级组分,共鉴定出3 种具有抗氧化能力的肽。Hatmi 等[31]发现用鼠李糖乳杆菌发酵驼乳制备的5~10 ku 的肽段具有很高的自由基清除活性。Balakrishnan 等[27]报道,经戊糖片球菌发酵的驼乳也得到了具有抗氧化活性的肽段,然而其抗氧化活性不及同样方式发酵的山羊乳。Salami 等[24]发现驼乳清蛋白胰蛋白酶和糜蛋白酶水解物的抗氧化水平低于牛乳清蛋白,并且驼乳和牛乳的酪蛋白比乳清蛋白更容易被糜蛋白酶酶解。Abderrahmane 等[41]研究发现,与牛乳清蛋白相比,驼乳清蛋白更容易被胃蛋白酶、胰蛋白酶和糜蛋白酶水解。哺乳动物不同物种的同源蛋白质之间由于氨基酸序列存在差异,因此产生的生物学效应不同。事实上,驼乳酪蛋白与牛乳酪蛋白显示较低的氨基酸同一性。根据发酵乳对比得出,牛的发酵乳更容易被蛋白酶水解,这可能是因为发酵牛乳具有更多可供酶水解的位点。这解释了为什么驼乳酪蛋白产生的潜在生物活性肽与从牛乳酪蛋白中获得的生物活性肽不同[31]。与模拟胃肠消化相比,菌株发酵在水解蛋白质过程中裂解的蛋白位点不同,所释放的生物活性肽功能也不同[31]。在驼乳中,Hatmi 等[31]观察到,用嗜热链球菌发酵制备的肽段比通过模拟胃肠消化获得的肽段具有更强的自由基清除活性[28]。Moslehishad 等[25]研究表明以鼠李糖乳杆菌PTCC 1637 发酵产生的肽段,其自由基清除力比胃(胃蛋白酶)或胰腺(胰蛋白酶和胰凝乳蛋白酶)酶产生的酶解产物强,可能由于水解物的氨基酸组成不同所致[24]。由于发酵乳制品具有较高的感官品质,因此乳酸菌发酵的驼乳制品越来越多。根据以上研究可知,无论是通过蛋白酶解还是发酵驼乳均可获得具有较高抗氧化活性成分的肽段,因此驼乳是很好的天然抗氧化剂[18]。
2.3 ACE 抑制肽
ACE(具有降血压活性的血管紧张素转换酶)是一种膜结合的二肽羧基酶,广泛存在于人体组织及血浆中,在肺毛细管内皮细胞的含量最为丰富[42]。ACE 是多功能酶,在体内肾素-血管紧张素系统(RAS)和激肽释放酶-激肽系统(KKS)中,对血压的调节起着重要作用。对于体外试验,大多数使 用HHL 或FAGPP 法,来测定ACE 活性。Shuang 等[36]在含有瑞士乳杆菌130B4 的发酵驼乳中观察到ACE 抑制活性。通过反相高效液相色谱从发酵乳中纯化出抑制ACE 的肽。该肽的氨基酸序列被鉴定为:Ala-Ile-Pro-Pro-Lys-Lys-Asn-Gln-Asp(IC50=19.9 μmol/L)。在来自牛乳的酪蛋白(-CNf107-115)中发现相同的氨基酸序列。即使用胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶连续消化后,该肽(-CN f107-115)的抑制活性几乎保持不变。并且,纯化肽的抑制活性在100 ℃热处理20 min后完全保留。因此得出结论:瑞士乳杆菌130B4 制备的发酵乳含有ACE 抑制肽(-CN f107-115)。由于该肽对消化蛋白酶和体外热处理稳定,因此认为该发酵乳可能具有抗高血压的作用。Tagliazucchi 等[37]通过模拟胃肠消化液消化驼乳,确定了驼乳中的几种ACE 抑制肽。值得注意的是,试验过程中鉴定了3 种ACE 抑制肽(即三肽IPP),而之前牛乳抗高血压的作用和动脉粥样硬化的预防作用就是以三肽IPP 的发现而闻名[43]。此外,驼乳κ-酪蛋白经消化后释放的IPP 量约为2.56 mg/L,该剂量下IPP 具有显著降血压作用。高血压相关临床研究发现,每日摄入2~6 mg 的IPP 可以使血压下降1.5~10 mg Hg[37]。这是第一次在驼乳蛋白质中鉴定出已知具有体内生物学效应的肽。
2.4 其它生物活性肽
Agrawal 等[44]发现用驼乳中分子质量低于10 ku 的肽培养(HEK293)细胞,能表达对人胰岛素受体(hIR)具有活化作用(人胰岛素的分子质量为5 807 u)的胰岛素肽。驼乳的这种胰岛素肽可以显著降血糖活性[44]。Nongonierma 等[45]在驼乳胰蛋白酶的水解物中鉴定出9 种新型DPP-IV(二肽基肽酶IV) 抑制肽(FLQY,FQLGASPY,ILDKEGIDY,ILELA,LLQLEAIR,LPVP,LQALHQGQIV,MPVQA和SPVVPF),并确定了DPP-IV 的最大抑制浓度(IC50)。该项研究表明,在相同水解条件下产生的驼乳和牛乳蛋白质水解物中鉴定出DPP-IV 抑制肽的序列不同。这与驼乳和牛乳蛋白质肽键裂解酶的选择性差异以及氨基酸序列的差异有关。该新型DPP-IV 抑制肽可能在调节人类血糖中起非常重要的作用。此外,Homayounitabrizi 等[35]研究了驼乳胃蛋白酶和胰蛋白酶水解物对HepG2 细胞生长的影响。HepG2 细胞来源于一个15 岁白人的肝癌组织。研究表明,从驼乳中提取并纯化的肽对HepG2 细胞的细胞毒性具有缓解作用,此研究为驼乳多肽在抑制或预防肿瘤和癌症方面提供参考依据。
3 结论
乳源活性肽具有多种生物活性,其来源于天然乳蛋白,具有极高的食品安全性。同时,乳源活性肽衍生的高品质乳制品的开发可将该地区的资源优势转化为经济优势。因此,乳源活性肽成为当前国际食品界极具发展前景的研究课题。由于乳源生物活性肽既可作为食品添加剂,又可作为保健食品的功能成分,因此具有广阔的应用前景。
骆驼作为我国荒漠地区生态系统中的重要组成部分,对于牧区人民的生产、生活以及牧区的经济发展具有极其重要的意义。骆驼乳营养成分接近人乳,蛋白构成比例合理,具有多种生物活性物质,致敏性低,可作为牛乳过敏人群的替代乳,因此具有重要的开发利用价值。据不完全统计[46],2014年,仅阿拉伯国家驼乳制品消费者就达2亿,全球市场潜在价值达100 亿美元,现有产品的种类和规模已不能满足市场需求。因此,大力推动驼乳产业发展,帮助干旱和半干旱地区发展经济很有必要。鉴于骆驼乳业极强的发展潜力,很多国家和地区都致力于发展当地的骆驼养殖业和驼乳加工业。除非洲、阿拉伯地区和中亚地区等骆驼乳传统消费地区外,欧洲也已允许进口驼乳及驼乳制品。美国也已开始养殖骆驼,生产销售驼乳及骆驼乳香皂等产品,驼乳市场正向发达国家扩张[46]。从全球范围来看,我国驼乳产业还比较弱小,没有形成规模和产业链,有待各地政策支持和科技力量注入,推动我国驼乳产业发展。
