婴幼儿牛乳蛋白过敏机制及解决方法研究进展
2020-08-03张晓宁霍麒文李明慧尚一娜王俊国
陈 境 张晓宁 霍麒文 李明慧 尚一娜 王俊国
(内蒙古农业大学食品科学与工程学院 乳品生物技术与工程教育部重点实验室 呼和浩特010018)
母乳为婴儿生长发育所必需的一种组分完整的复合食物。世界卫生组织(WHO)建议在新生儿最初6 个月采取纯母乳喂养[1]。对新生儿来说,人乳是最好的食物,然而由于母乳不足等问题,婴幼儿配方奶粉成为最好的食物补充;对6 个月以上的婴儿,母乳的营养可能满足不了婴幼儿快速成长的营养需求,因此配方奶粉可作为辅助食物促进婴幼儿的生长发育[2]。
19世纪,母乳替代物逐渐兴起并发展起来。20世纪初期,人们开始以牛乳为主原料,将母乳作参照,添加一些其它营养成分,制作婴儿配方奶粉[3]。然而,用婴儿配方奶粉代替母乳喂养会发生过敏反应,即牛乳蛋白过敏(Cow’s milk protein allergy,CMPA)。牛乳蛋白过敏是最常见的婴儿食物过敏之一,先发于皮肤后至胃肠道、呼吸道,危害不可小觑[4]。这不仅会影响婴幼儿的生长发育,甚至会威胁生命。调查发现在婴幼儿中CMPA 的发生率为2%~7.5%[5],并且呈逐年上升趋势[6]。
本文探讨牛乳蛋白过敏的发生机制,并概述了目前解决牛乳蛋白过敏症的措施,以此为婴幼儿配方奶粉的生产提供一些理论参考。
1 牛乳蛋白过敏症的发生机制
牛乳蛋白过敏症的发生主要与牛乳中的非母乳蛋白的成分和含量有关,也取决于婴幼儿的胃肠消化系统及肠黏膜的机械、化学、免疫及生物等屏障功能,以及肠黏膜免疫系统的调控能力,这些因素导致婴幼儿牛乳蛋白过敏症的发生。
牛乳蛋白过敏是由牛乳中蛋白质引起的异常免疫反应。母乳与牛乳中蛋白质的成分存在一些差异,如表1所示。在各种营养素日趋完善的同时,建立在牛乳蛋白基础上的婴儿配方奶粉虽能够在营养成分和微量成分上与母乳相同,但从理论而言,牛乳中任何一种区别于母乳的蛋白质都有可能为过敏原,目前普遍认为乳清蛋白(主要是β-乳球蛋白和α-乳白蛋白) 及酪蛋白 (主要是αS1-酪蛋白)是主要的过敏原[7-8],这两种蛋白共占牛乳蛋白的40%以上。母乳中没有β-乳球蛋白和αS1-酪蛋白,且两者在婴儿胃肠内不易被蛋白酶分解,造成婴儿过敏[9]。酪蛋白在牛乳中含量最高,约占牛乳总蛋白的80%,在对牛乳过敏的人群中有约65%是由酪蛋白过敏引起[10],且近几年酪蛋白过敏患者呈增长趋势[11]。
正常情况下膳食中的蛋白质被酶降解为游离的氨基酸和小肽后再被吸收,婴儿摄入牛乳蛋白后,由于其消化功能发育不完全,相应的蛋白消化酶作用不强,导致牛乳中一些差异蛋白未经消化酶水解而不易被消化;当这些异源蛋白进入肠道后,由于婴儿肠黏膜免疫系统发育不完全,免疫屏障功能不成熟,免疫球蛋白分泌率低,特别是胃肠道和黏膜表面主要免疫效应分子——分泌型免疫球蛋白A(Secretory immunoglobulin A,SIgA)的分泌量少,因而不能准确阻止抗原进入体内或控制机体对侵入抗原的免疫反应;另一方面,肠道黏膜上皮细胞及细胞间的紧密连接构成了机械屏障,不仅可以防止一些抗原物质进入肠黏膜,而且也能进一步降解致敏蛋白,然而婴儿肠黏膜系统的发育尚未成熟,黏液层薄,肠道通透性高,抗原便更易进入肠黏膜,激发人体产生抗体,导致过敏。同时一些研究发现婴幼儿的肠道通透性也受到一些其它因素的影响,特别是有些肠道微生物会使肠道上皮细胞之间连接受到破坏,导致肠道通透性增大,肠道屏障作用减弱或丧失,因此保持肠道黏膜上皮细胞的稳态对于抑制过敏十分重要[12-13]。
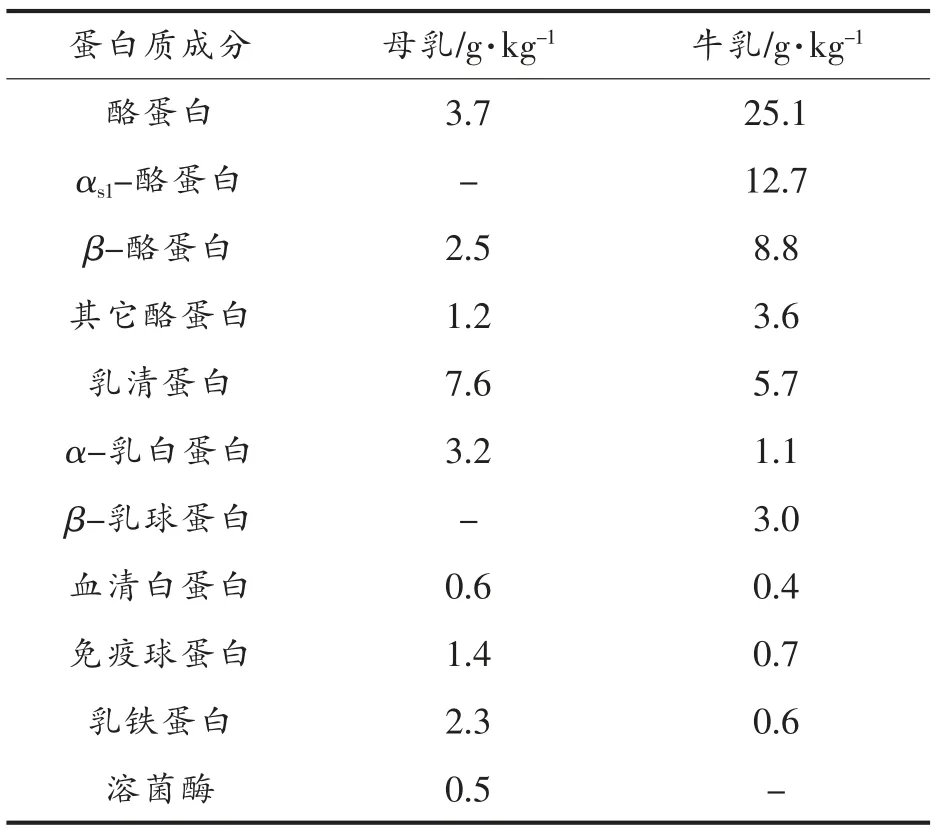
表1 母乳与牛乳蛋白质成分及含量对比Table 1 Comparison of ingredients and content between human milk and cow’s milk
当这些致敏蛋白质进入人体内后,引起过敏反应的程度与体内淋巴细胞的免疫调控密切相关。研究表明CD4+淋巴细胞是过敏性疾病发生的重要免疫调控者。CD4+淋巴细胞接受抗原刺激后,可以分化成不同亚型的T 细胞,其主要类型有Th1 型、Th2 型、Th17 型及Treg 型,其分化方向受多种因素调控,其中细胞因子的种类和细胞因子之间的平衡对其分化具有重要的调节作用。同时,不同亚型的T 细胞彼此间也能通过分泌不同的细胞因子相互影响制约,形成复杂的免疫调节体系,以维持机体的免疫平衡,一旦失衡就可能导致免疫耐受功能异常,致使各种自身免疫性疾病发生[14]。有研究证实婴幼儿牛乳蛋白过敏反应与不同亚型的T 细胞调节体系的失衡有关,早先发现Th2 占优势的Th1/Th2 细胞失衡是牛乳蛋白过敏的一个重要机制,而近年越来越多的研究表明Treg 和促炎性Th17 细胞比例即Treg/Th17 的失衡也是引发过敏性疾病的关键因素之一,当牛乳蛋白过敏反应发生,Th17 占优势,Treg 数量降低。
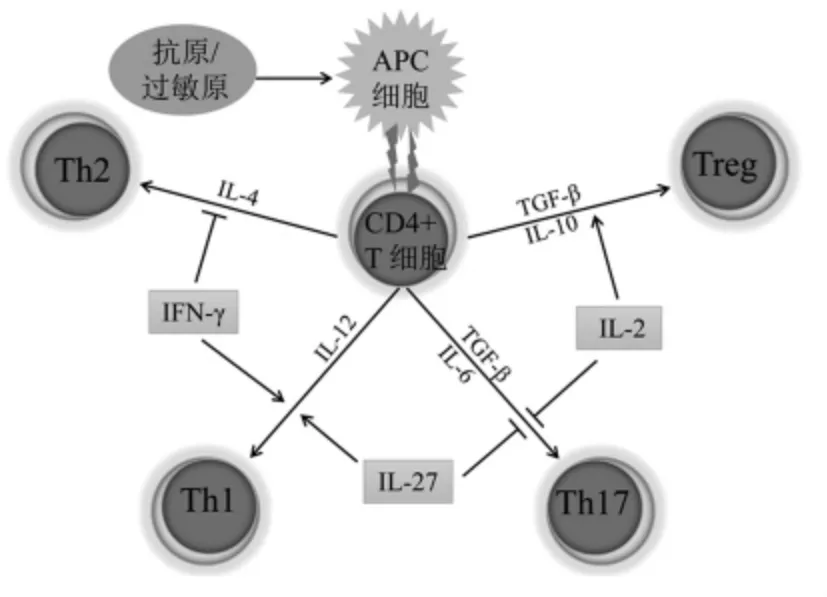
图1 不同亚型的T 细胞形成过程Fig.1 Differentiation process of CD4+ T cell
2 减轻牛乳蛋白过敏症
毫无疑问,从婴幼儿配方奶粉中剔除牛乳蛋白是预防和减少牛奶蛋白过敏最有效的措施[15],然而完全避免牛奶中的蛋白质存在困难,因为消除全部牛乳蛋白会导致营养不足,影响婴幼儿的生长发育。因此需寻找有效的技术与方法来缓解过敏反应。
目前采取的主要措施有物理、化学或生物等技术方法减少过敏原,用益生菌增强宿主肠道免疫屏障及改善免疫系统中Treg 细胞的免疫调节能力。
2.1 改变牛乳蛋白致敏性的加工方法
食物的过敏原性与抗原表位关系密切。引起过敏反应的牛乳蛋白含有的抗原表位,包括构象表位和线性表位,可以被免疫系统识别并引起相应的反应。对牛乳蛋白而言,构象表位的活性依赖于蛋白质的空间构象,线性表位的活性则依赖于构成蛋白质的氨基酸序列的一级结构[16]。研究发现通过热处理、高压、糖基化以及酶解等方法可以使牛乳蛋白的抗原表位发生改变,进而降低其致敏性。
2.1.1 热处理 热处理是常用的一种减少牛乳过敏原的物理方法[17]。对于大多数乳制品制造过程而言,热处理是其中的一个重要环节,牛乳蛋白中的酪蛋白热稳定性最强,而乳清蛋白对热敏感,加热会导致乳清蛋白产生热变性。各种乳清蛋白的热敏感性排序为:免疫球蛋白<牛血清白蛋白<β-乳球蛋白<α-乳白蛋白[18]。β-乳球蛋白是以二聚体结构存在的含有二硫键的蛋白质,且每个单体都含有5 个半胱氨酸,形成2 个二硫键。加热处理时[19],随着温度的升高,依靠二硫键等次级键形成的β-折叠及α-螺旋发生断裂,引起过敏原蛋白即β-乳球蛋白结构发生改变,主要是二级和三级结构的改变。这种加热导致牛乳蛋白的构象表位发生的变化会对牛乳蛋白过敏原的抗原性产生影响。
研究表明,不同热处理温度对乳清蛋白过敏性的影响不同,Bu 等[20]发现从50 ℃加热到90 ℃,β-乳球蛋白的抗原性随温度升高而增加;加热至90 ℃以上,β-乳球蛋白的抗原性明显降低。Kleber等[21]也发现,对脱脂乳和甜乳清经不同温度处理15 min 后,β-乳球蛋白抗原性变化不同,当加热温度从50 ℃升至80 ℃,在脱脂乳和甜乳清内的β-乳球蛋白的抗原性均随温度的升高而增加,在80~90 ℃检测到了最高的抗原性,而当加热温度升高到90 ℃后,β-乳球蛋白的抗原性随温度的升高而降低。进一步研究发现,当低温加热时,乳清蛋白抗原性增加的原因可能为:其一,是热变性期间,随着构象结构的展开,导致一些原先在乳清蛋白内部的致敏性抗原决定簇暴露在表位;其二,在加热过程中存在不同种键的断裂与形成的现象,因此可能会形成新的过敏原。而在90 ℃以上,抗原性降低可能是原分子表面的致敏构象表位被破坏或被掩盖所致[22]。
就热处理对乳清蛋白致敏性的影响而言,存在争议,Rytkönen 等[23]发现经30 min,90 ℃加热处理与未经处理的β-乳球蛋白相比,更能密集的诱导在大鼠胃肠黏膜的局部免疫反应,其致敏性反而增加。所以这一方法中的温度和时间有待考究,然而如果经热处理后结合其它改性方法,效果也许有所提高。
2.1.2 高压 通过高压处理牛乳,可降低乳蛋白的致敏性。研究发现高压会破坏乳蛋白分子间和分子内部的非共价键作用,影响其三级结构,从而破坏蛋白的构象表位,使致敏蛋白活性降低。此外有研究表明高压对保留牛乳的营养品质特征有一定的意义[24]。
曲志华等[25]研究发现,通过超高压处理酪蛋白可以降低其致敏性,当压力350 MPa、温度30℃、时间20 min 时,与未处理样品相比,其致敏性降低了39.95%,且随压力的增大,其致敏性显著降低(P<0.05)。在Meng 等[26]的研究中,将牛乳中β-乳球蛋白分离出来,在100,200,300,400,500 MPa 的高静水压下处理,结果表明:随着处理压力增加,β-乳球蛋白的致敏性随之降低。
动态超高压微射流均质技术(DHPM)也可以改变蛋白质结构和构象[27],从而影响β-乳球蛋白的致敏性[28]。Zhong 等[29]发现低于80 MPa 时,β-乳球蛋白的抗原性增加,当高于80 MPa,β-乳球蛋白的抗原性显著降低。这可能是由于在较低DHPM 压力下,抗原性的增加可能与天然蛋白分子内部的抗原表位暴露有关,由于压力引起显露与集结,蛋白质结构的解聚和分子的展开,导致其内部的抗原表位暴露在外,更易与抗体结合。当压力逐渐升高,β-乳球蛋白的再聚合会使暴露在表面的构象表位再次被掩盖,使致敏性降低[30]。
2.1.3 糖基化 糖基化作用是种化学反应,是将碳水化合物以共价键与蛋白质分子上的α-或ε-氨基相连接而形成糖基化蛋白。通过糖基化作用不仅可以提高蛋白质的功能特性,而且还可改变乳蛋白的线性表位以降低食物中蛋白的致敏性[31-32]。
有研究表明,通过糖基化改性的β-乳球蛋白,其致敏性明显降低,而且其热稳定性和乳化特性也有所提高。任珊[33]用低聚半乳糖和梭甲基壳聚糖,通过美拉德反应使之与β-乳球蛋白结合,得到糖基化产物,其致敏性降低率分别为43%和39%。Enomoto 等[34]用麦芽五糖(MP)将α-乳白蛋白(α-LA)糖基化得到MP-α-LA,随后在焦磷酸存在的条件下,通过干加热进行磷酸化,结果显示此过程降低了α-LA 的抗原性,其致敏性应答显著降低。
通过糖基化作用不仅能破坏抗原线性表位的活性,还会影响其构象表位。低抗原的大分子物质作为改良剂与抗原部位结合,通过屏蔽致敏部位降低了乳蛋白致敏性。研究发现利用糖基化反应在β-乳球蛋白上结合一些低抗原性的大分子物质,如聚乙烯乙二醇及其衍生物(Polyethyleneglycols,PEGs),使蛋白构象改变,可降低β-乳球蛋白的致敏性,因此PEGS 被广泛应用于蛋白质的糖基化改性中,如:在牛血清白蛋白上结合聚乙烯乙二醇衍生物可降低其免疫活性,聚乙烯乙二醇衍生物可中和乳蛋白表面电荷,使蛋白构象发生改变,抗原性明显降低[25]。此外,Makoto 等[35]以葡聚糖、葡萄糖胺、壳戊糖和壳聚糖为糖基供体,通过美拉德反应对β-乳球蛋白的糖基化改性进行研究,ELISA 免疫试验发现,以壳聚糖和葡聚糖为糖基供体的糖基化反应能明显降低β-乳球蛋白的过敏性,而且糖基化的β-乳球蛋白的乳化特性比原β-乳球蛋白明显提高。另外,以葡萄糖胺[GLCN]、壳聚戊糖[CPO]和壳聚糖[CHS]、海藻酸寡糖[ALGO]和磷酸寡糖[PO]与β-乳球蛋白分别合成的β-LG-GLCN、β-LG-CPO、β-LG-CHS、β-LGALGO 和β-LG-PO,其致敏性均降低[25]。
此外,Taherikafrani 等[36]发现将超声波技术与糖基化改性技术相结合,结果降低了牛乳蛋白的抗原性,因超声波预处理促进了核糖糖基的引入,导致β-乳球蛋白的结构重组,使得部分可识别的过敏表位被引入的糖基掩蔽,致使β-乳球蛋白的致敏性降低。这为制备脱敏婴儿奶粉提供了一条新思路。
2.1.4 酶解 酶解是有效降低或消除牛乳蛋白过敏原的方式之一[37]。针对牛乳蛋白过敏,国外已开发出不同酶解程度的婴幼儿配方奶粉,深度水解奶粉已被证明可以有效减少牛乳蛋白过敏的发生。通过酶解,将蛋白之间的肽键断裂,生成小肽和氨基酸,减小了过敏原的分子质量,从而降低乳蛋白的致敏性[38]。酶解不仅能够破坏牛乳蛋白的线性表位,而且还会改变致敏蛋白的构象表位,导致其结构发生改变,降低过敏性。在此过程中,酶解的条件方式、酶的种类以及酶解程度等因素对降低致敏性效果有明显差异性。
张微等[39]以胰蛋白酶为水解酶水解牛乳蛋白,发现在最适条件下乳蛋白的总致敏性有所降低:β-乳球蛋白致敏性降低率为51.94%,酪蛋白致敏性降低率为73.26%,α-乳白蛋白致敏性降低率为80.16%。Ahmad 等[40]在pH 为2.2 和5.5 时,用胃蛋白酶水解αS1-酪蛋白后,发现其抗原性分别降低至60%和38%。虽然单酶可降低致敏性,但其对致敏蛋白的水解能力有限。刘晓宇等[41]通过使用二步法水解(碱性蛋白酶和木瓜蛋白酶)水解酪蛋白发现,与单一酶酶解相比,双酶水解能够更有效地降低酪蛋白的抗原性。
此外,研究发现经过热处理或高压处理后的牛乳,蛋白质构象发生改变后结构展开,可以使酶消解更容易。在高压下,β-乳球蛋白能被各种酶有效水解[42]。Peñas 等[43]研究了高压处理(100~300 MPa)对胰蛋白酶水解乳清蛋白、胰凝乳蛋白酶、胃蛋白酶的影响,结果表明,高压增强乳清蛋白水解,降低了其致敏性。史瑜婷[44]将热处理与双酶解相结合,结果表明在85 ℃,处理20 min 后再进行最佳双酶组合酶解,β-乳球蛋白的残余率低于1%。
2.1.5 乳酸菌发酵 通过乳酸菌发酵牛乳可以使牛乳蛋白的致敏性大大降低[45]。主要原因:其一,发酵牛乳前的杀菌处理可以诱导致敏蛋白构象发生变化,导致蛋白失活,掩蔽抗原表位,降低致敏性;其二,在发酵过程中,乳酸菌分解乳糖产生乳酸导致pH 值降低,电荷改变,乳蛋白的结构受到影响,即构象发生改变,这也是牛乳蛋白致敏性降低的一个原因;其三,乳酸菌发酵可产生一些蛋白酶,酶解也可降低牛乳蛋白的致敏性;此外发酵乳中的活性乳酸菌进入人体肠道内可能对宿主的免疫系统产生调节作用,从而降低牛乳蛋白的致敏性。
许多研究表明,乳酸菌可以降解牛乳致敏蛋白[33],Pescuma 等[46]发现德氏乳杆菌(Lactobacillus delbrueckii)CRL656 可水解β-乳球蛋白的主要致敏表位,使其抗原性达32%,缓解过敏反应的发生。Yao 等[47]探究了发酵干酪乳杆菌(Lactobacillus casei)1134 对牛乳蛋白的影响,通过间接竞争酶联免疫吸附试验检验了pH 值对各蛋白致敏性和抗原性的影响,并对发酵过程中产生的游离氨基酸进行分析,对乳蛋白的蛋白水解进行检测。结果表明:发酵的干酪乳杆菌(Lactobacillus casei)1134 能显著降低乳球蛋白和酪蛋白的抗原性。Bu等[48]研究发现瑞士乳杆菌(Lactobacillus helveticus)和嗜热链球菌(Streptococcus thermophilus)菌株组合发酵,在减少牛乳致敏性上也很有效。张颖等[49]用8 株乳酸菌对脱脂乳进行发酵,测定不同菌种、发酵时间、冷藏时间下发酵乳中β-乳球蛋白的残留抗原性。结果表明,经不同乳酸菌发酵12 h 后,发酵乳中β-乳球蛋白的致敏性均出现不同程度的下降,且菌株间差异显著,复合菌株发酵对降低抗原性具有协同效果。
此外,多方式结合也是一种有效手段,张颖等[50]以瑞士乳杆菌(Lactobacillus helveticus)为发酵菌种,胃蛋白酶作为水解酶,探究了两种方式结合对乳清蛋白抗原性的影响,结果表明β-乳球蛋白的抗原性降低了5%。
2.2 免疫系统功能的改善
研究发现CMPA 的发生与免疫系统的功能有密切关系。由此,改善免疫系统的功能亦是缓解婴幼儿牛乳蛋白过敏的重要方法之一。
大量研究表明益生菌对婴幼儿免疫系统有重要影响[51,52-53]。肠道是人体最大的免疫器官,人体和肠道菌群间进行着活跃的代谢过程,并共同决定人的健康状态。婴幼儿的免疫系统发育相对未成熟,因此肠道抵御过敏蛋白的能力也相对较差。在肠道上层的细胞表面有一层菌膜屏障,具有免疫保护作用,维持肠道微生态;当婴幼儿肠道菌群失调时,有害菌会造成肠黏膜通透性改变,导致致敏性蛋白进入体内,引起过敏反应,而益生菌定植后,能够在肠黏膜上形成一层保护膜,不仅修复并增强肠黏膜的屏障功能,还调节了菌群平衡,促进了免疫屏障的稳固;此外,益生菌的代谢产物有丁酸等,而丁酸盐正是肠道上皮细胞生长和分化所必需的能量营养物质,因此益生菌可以给肠道细胞提供养分,这对维持肠道的屏障功能有促进作用[54]。Zhang 等[55]证实口服益生菌双歧菌属(Bifidobacterium) 可以通过改善肠上皮细胞受损的屏障功能来减轻食物过敏小鼠的肠道炎症。Nermes等[56]研究发现益生菌通过促进内源性肠道屏障机制可以作为减轻肠道炎症并治疗过敏的一个有效工具。通过口服益生菌,增加人体肠道菌群多样性,有研究证实这对减少过敏的发生有一定作用。
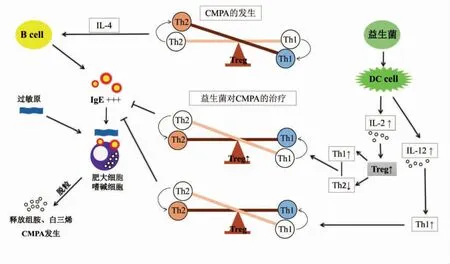
图2 益生菌治疗CMPA 的机制Fig.2 Mechanism of probiotics treating CMPA
有研究发现肠内益生菌不仅可以改善防御屏障,而且对增强婴幼儿肠道免疫力有刺激作用[57],益生菌通过促进分泌性免疫球蛋白 (slgA) 的分泌,减少过敏原从肠道进入血液。在肠道黏液层,slgA 可通过与细菌胞壁抗原决定簇结合包裹异物来减缓过敏的发生[58]。陈毅秋[59]发现给小鼠灌胃LGG 后,LGG 在肠道定植的同时增强了B 细胞的活化,调节B 细胞分泌免疫球蛋白,显著提高了小鼠肠道黏膜sIgA 的分泌量,从而调节了小鼠黏膜免疫系统,以此提高了机体免疫水平;Rigoadrover 等[60]为探究哺乳期补充益生菌短双歧杆菌(B.breve)M-16V 对肠道和免疫系统成熟的影响,自新生小鼠出生后的第6~18 天,对其补充益生菌并进行每日评估。在第19 天,其处理后得到肠系膜淋巴结细胞、脾细胞和上皮内淋巴细胞,结果发现:虽然在小鼠早期生活时所补充的益生菌并没有提高其自身的免疫成熟,但短双歧杆菌M-16V 增强了小鼠肠道内IgA 的合成。总之,在小鼠哺乳期间,益生菌菌株短双歧杆菌M-16V 的补充促进了早期黏膜免疫的发展。
进一步研究表明益生菌可以通过对淋巴细胞的免疫调控来减少牛乳蛋白引起的过敏反应。CMPA 主要是由过敏原特异性IgE 介导的过敏反应[61],因此IgE 的分泌量与CMPA 过敏反应的发生及其程度直接相关,而不同T 细胞(Th1/Th2 及Treg/Th17)之间的平衡影响IgE 分泌,过多的Th2及Th17 均会导致IgE 的分泌量增多,引发CMPA发生;同时缺少Treg 也会影响Th1/Th2 的平衡。正常机体Th1 与Th2 细胞以及Th1 型和Th2 型的细胞因子处于动态平衡状态,且共同受调节性T 细胞(Treg)调控[62]。研究发现Treg 的功能受损是新生儿过敏的主要原因之一,Treg 在牛乳蛋白过敏婴幼儿的脱敏中所发挥的关键作用已在各研究中得到证实,Shreffler 等[63]表明Treg 与牛乳过敏性儿童的良好预后相关。
有很多研究表明益生菌可通过增进Th1 型免疫反应,调控因过敏而反应过度的Th2 型免疫反应,从而减缓过敏症状[64-65]。杨景等[66]以β-乳球蛋白过敏小鼠原代淋巴细胞为模型,探究了副干酪乳杆菌(Lactobacillus paracasei)L9 对牛乳β-乳球蛋白过敏反应的影响,发现L9 对β-乳球蛋白过敏引起的Th1/Th2 失衡具有调节作用,益生菌可以促进T 细胞分化,抑制Th2 型免疫应答,降低IL-4 等细胞因子水平,降低IgE 分泌,缓解β-乳球蛋白的过敏反应。最新研究也表明益生菌能控制相关促炎症细胞因子的表达,抑制Th17 细胞分化,增强Treg 的细胞活性,进而促进体内Treg/Th17 细胞平衡,最终提高机体的免疫耐受性[67]。在Zhang 等[68]对β-乳球蛋白的致敏小鼠进行为期3周的嗜酸乳杆菌(Lactobacillus acidophilus)KLDS 1.0738 灌喂实验,结果显示KLDS 1.0738 可以使Treg 的表达增强,改善致敏小鼠的Treg/Th17 失衡,抑制β-乳球蛋白引发的致敏炎症。同时益生菌可促进Treg 分泌TGF-β、IL-10 等细胞因子,抑制Th2 型免疫应答,减少IgE 的产生,使免疫系统处于动态平衡,减少CMPA 的发生[69-70]。Zhang 等[71]证实了益生菌双歧杆菌(Bifidobacterium)对缓解过敏反应的影响,实验中对过敏小鼠益生菌双歧杆菌的灌喂,增加了Treg 的数量,抑制了偏移的Th2 免疫应答,由此减轻了过敏小鼠的肠道免疫炎症。季晓梅[72]探究了嗜酸乳杆菌(L.acidophilus)KLDS 1.0738 对β-乳球蛋白过敏小鼠的影响,并对过敏组小鼠(灌喂嗜酸乳杆菌菌悬液)和对照组小鼠(腹腔辅以等量生理盐水)灌喂3 周后过敏症状的评估,结果表明:嗜酸乳杆菌KLDS 1.0738 减少了炎症因子的释放并降低了过敏小鼠血清中IgE 水平,有效缓解了过敏症状。因此,通过诱导机体产生细胞因子,抑制IgE 产生并对过敏反应起免疫调节作用的益生菌是难得的免疫调控者。
3 结语
随着科学研究技术的不断发展,越来越多的方法被用来解决婴幼儿牛乳蛋白的过敏问题。在已有技术手段的基础上,人们发现利用辐照、超声波等加工处理技术处理牛乳也可以减少婴幼儿牛乳过敏症的发生;而且与单一处理技术相比,多种方式协同作用可以更好地解决牛乳中的过敏蛋白的致敏问题,因此研究者们不断尝试将牛乳的各种加工技术相结合以期得到最佳的脱敏效果。
分子生物学技术突飞猛进,为解决婴幼儿牛乳蛋白过敏问题提供了新思路,利用基因打靶技术将牛乳中合成过敏蛋白的特定致敏基因敲除,从根本上阻断致敏基因的表达,而且还可以将外源目的基因定位整合到基因组的特定位点,借助细胞内源性调控序列指导外源目的基因高效表达,从而有效降低经整合引起的位置效应的影响。这为培育致敏蛋白基因敲除的优质奶牛新品种和生产“人源化”牛乳奠定了一定基础。
此外,针对婴幼儿牛乳蛋白过敏问题,可添加具有脱敏作用的天然活性物质作为脱敏因子,如耳突麒麟菜寡糖、姜黄提取物、茶叶中茶多酚以及海洋天然藻类来源的活性物质等,以缓解相关过敏症状[73]。
将以上这些技术手段应用于抗过敏的预防以及治疗中,具有广阔的发展前景,对开发低敏牛乳制品均具指导性意义。虽提倡母乳喂养,但牛乳脱敏仍是一个重要领域,更加安全、有效的脱敏方案还有待进一步研究和探索。
