基于DNA-银纳米颗粒比色法高灵敏度检测过氧化氢和葡萄糖
2020-08-03邓健康刘亚青
邓健康 刘亚青 王 硕,2*
(1 食品营养与安全国家重点实验室 教育部食品营养与安全重点实验室天津科技大学食品工程与生物技术学院 天津300457 2 天津市食品科学与健康重点实验室 南开大学医学院 天津300071)
近年来,构建食品相关目标物的生物传感器引起研究者的广泛兴趣。由于过氧化氢(Hydrogen peroxide,H2O2)的灭菌功能,常被用作包装材料的消毒剂[1]。葡萄糖天然存在于或人工添加至各种食物基质中。分析葡萄糖含量对于食品质量控制、食品鉴伪有一定意义[2]。测定过氧化氢和葡萄糖含量在食品工业中具有重要的实际意义[3]。监测血液和饮食中的葡萄糖含量对于预防或延缓糖尿病及其并发症(如心脏病、血管疾病和血液循环不良、失明、肾功能衰竭、愈合不良、中风等)的发生至关重要[4]。目前,学者们开发了多种方法检测过氧化氢和葡萄糖,包括电化学方法[5]、高效液相色谱法[6]和表面等离子体共振法[7]。然而,上述方法存在耗时长,需要复杂的操作和昂贵的设备等不足。比色法具有灵敏度高,操作简单,速度快等特点,在微量物质检测方面具有明显优势。
银纳米颗粒 (Silver nanoparticles,AgNPs)是重要的金属纳米材料,在催化、抗菌和分析等领域得到广泛应用。由于AgNPs 易氧化和聚集,因此需加入稳定剂(如聚合物、有机小分子和纳米颗粒等)使其稳定存在[8]。DNA 保护的金属纳米材料已应用于很多领域。基于某些金属阳离子与DNA 的相互作用,其可作为合成金属纳米材料的模板[9]。DNA 特别是富含胞嘧啶的DNA 链对银离子具有高亲和力。利用不同的DNA 序列和还原剂,金属离子可被还原成不同的金属纳米材料,如银纳米簇[10]、纳米颗粒[11]和纳米环[12]。
在氧气存在时,葡萄糖氧化酶(Glucose oxidase,GOx)对葡萄糖具有高选择性,可催化葡萄糖氧化生成过氧化氢[13-14]。基于此原理,研究者们开发了许多葡萄糖传感器用于食品和饮料工业[15]。然而,仅有少数基于银纳米颗粒的比色传感器用于检测过氧化氢和葡萄糖。本研究中,建立了一种基于DNA-AgNPs 的比色传感器,用于高灵敏检测过氧化氢和葡萄糖。在DNA 保护下,用硼氢化钠(NaBH4)还原硝酸银(AgNO3)合成DNA-Ag-NPs。加入过氧化氢后DNA-AgNPs 颜色由黄褐色变为无色,从而实现过氧化氢的比色法检测。在葡萄糖氧化酶作用下,间接测定葡萄糖的含量。为食品中过氧化氢和葡萄糖的检测提供新方法。
1 材料与方法
1.1 材料与试剂
过氧化氢、硝酸银、硝酸、果糖、蔗糖、麦芽糖、半乳糖,国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris)、硼氢化钠,美国Sigma-Aldrich 公司;葡萄糖氧化酶(GOx),北京索莱宝科技有限公司;DNA:GGTATCTAGTTGAGCTGTCTAGTC;HPLC纯化,上海生工生物工程股份有限公司。试剂均为分析纯级,试验用水为超纯水(>18.25 MΩ·cm)。
1.2 设备与仪器
5804R 高速离心机,德国Eppendorf 公司;Milli-Q 超纯水系统,美国Millipore 公司;MX-S可调式漩涡混合器,美国SCILOGEX 公司;MB-102 恒温振荡金属浴,加拿大Thermocell 公司;EV300 紫外-可见光分光光度计,美国Thermo Scientific 公司;雷磁PHS-3G pH 计,上海仪电科学仪器股份有限公司;Hitachi-600 透射电子显微镜,日本Hitachi 公司;Alliance Waters 2695 高效液相色谱仪(配Waters 2414 示差检测器),美国Waters 公司。
1.3 DNA-AgNPs 的合成
DNA-AgNPs 的合成参照Wu 等[16]的方法,并稍作修改。将AgNO3与DNA 溶液混合后剧烈摇动用NaBH4还原合成AgNPs。将100 μL ssDNA溶液(50 μmol/L)与390 μL Tris-HNO3(10 mmol/L,pH 7.0)和AgNO3溶液混合,旋涡混合1 min。在冰中孵育30 min 后,加入新鲜制备的NaBH4溶液,剧烈振荡混合物1 min。DNA/AgNO3/NaBH4的摩尔浓度比为1/30/40。溶液在4 ℃避光反应2 h。向混合溶液中加入Tris-HNO3(10 mmol/L,pH 7.0)缓冲液至终体积为3 mL。
合成时加入不同pH 值的Tris-HNO3缓冲液,研究不同pH 缓冲液对合成DNA-AgNPs 的影响。pH 范围为4.0,5.0,6.0,7.0,8.0,9.0,10.0。其余合成条件同上。
1.4 优化反应时间
固定DNA-AgNPs 浓度为140 nmol/L,添加25 μmol/L H2O2或200 μmol/L 葡萄糖或0.1 mg/mL 葡萄糖氧化酶,37 ℃下避光反应不同时间,研究不同反应时间DNA-AgNPs 的变化。测定紫外-可见光光谱,光谱范围为300~600 nm。
1.5 检测缓冲液中的H2O2 和葡萄糖
固定DNA-AgNPs 浓度为140 nmol/L,加入不同浓度H2O2或葡萄糖/GOx (GOx:0.1 mg/mL),用Tris-HNO3(10 mmol/L,pH 7.0)缓冲液定容至200 μL,37 ℃下避光反应75 min。测定紫外-可见光光谱,光谱范围为300~600 nm。
1.6 检测方法的特异性研究
为评价该方法对于检测葡萄糖的选择性,选择了4 种单糖和二糖(包括果糖、蔗糖、麦芽糖和半乳糖),浓度均为200 μmol/L,根据1.5 节所述试验步骤进行检测。
1.7 检测梨汁样品中的葡萄糖
1.7.1 HPLC 法检测梨汁中原始葡萄糖含量 HPLC条件参照Ma 等[6]的方法,并稍作修改。将梨汁用0.22 μm 针管过滤器过滤,并用水(50%)/乙腈(50%)稀释。使用Waters e2695 高效液相色谱仪,配制2414 示差检测器,色谱柱为Agilent ZORBAX 碳水化合物分析柱(5 μm,4.6 mm×150 mm)。色谱条件∶流动相为水∶乙腈=25∶75 (体积比),等度洗脱,流速为1.5 mL/min,色谱柱温度为30 ℃,进样体积为10 μL,以保留时间定性,外标法定量。
1.7.2 加标回收试验 为测试该方法在实际样品中的检测性能,选择从当地超市购得的梨汁。添加浓度为20,50,100 μmol/L。按照1.5 节的试验条件对葡萄糖含量进行检测。重复测定3 次取平均值。
1.8 材料表征
通过扫描透射电镜(TEM)表征DNA-AgNPs的形貌和尺寸。将DNA-AgNPs 滴涂在超薄碳膜上,自然晾干后检测。
2 结果与分析
2.1 材料表征
通过TEM 和紫外-可见光吸收光谱对DNAAgNPs 的形貌、尺寸和光学性质进行研究。DNAAgNPs 是AgNO3在DNA 保护下由NaBH4还原而成。在没有DNA 保护的情况下 (即DNA/AgNO3/NaBH4比例为0/30/40,摩尔浓度比),AgNPs 在制备后立即沉淀(图1a)。在DNA 保护下,形成均匀稳定的DNA-AgNPs 棕褐色溶液(图1b),并在黑暗条件下保持稳定几个月。在pH 7.0 时合成的DNA-AgNPs 的吸收峰位于424 nm (图2),DNAAgNPs 的紫外-可见光吸收特性与前人报道基本一致[11,16]。DNA-AgNPs 吸收峰尖锐,材料颜色呈黄褐色。如图3,TEM 结果表明合成的DNA-AgNPs单分散性良好。图3嵌入图像是200 个纳米颗粒的粒度分布直方图。经统计,DNA-AgNPs 粒径为(3.83±1.11)nm(图3)。
固定DNA/AgNO3/NaBH4比例为1/30/40 (摩尔浓度比),在pH 4.0~10.0 条件下合成DNA-Ag-NPs,如图2所示,不同pH 值下DNA-AgNPs 的吸收峰峰型和强度差异都很小,结果表明,pH 值对DNA-AgNPs 的紫外-可见光光谱影响很小。为保证后续试验葡萄糖氧化酶的活性,选择pH 7.0 为最优的合成和后续试验反应条件。
2.2 检测原理
图4描述了该方法的工作原理。加入过氧化氢后DNA-AgNPs 被刻蚀成银离子,溶液颜色由黄褐色变为无色,从而实现过氧化氢的比色法检测。在氧气存在时,葡萄糖氧化酶可以催化葡萄糖氧化形成过氧化氢和葡萄糖酸,可以间接测定葡萄糖含量[17-18]。

图1 不存在(a)或存在(b)DNA 保护时合成的AgNPsFig.1 Image of composed AgNPs without (a) and with (b) DNA protection
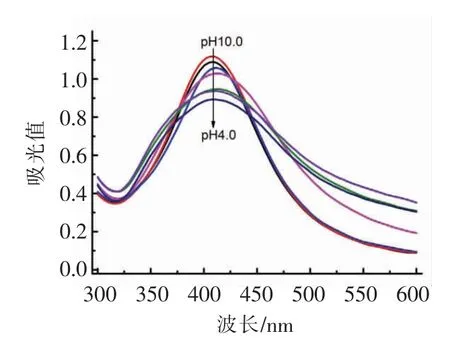
图2 不同pH 缓冲液中合成DNA-AgNPs 的紫外-可见光吸收光谱图Fig.2 The absorption spectra of composed DNA-AgNPs in Tris-HNO3 buffer of different pH
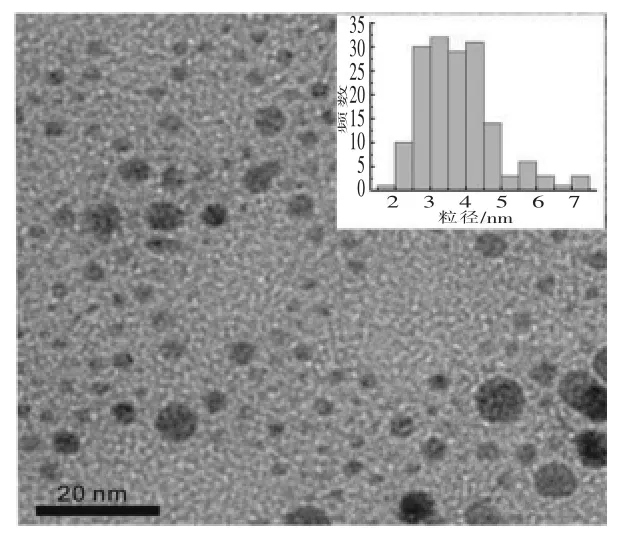
图3 DNA-AgNPs 的TEM 图Fig.3 TEM images of the DNA-AgNPs
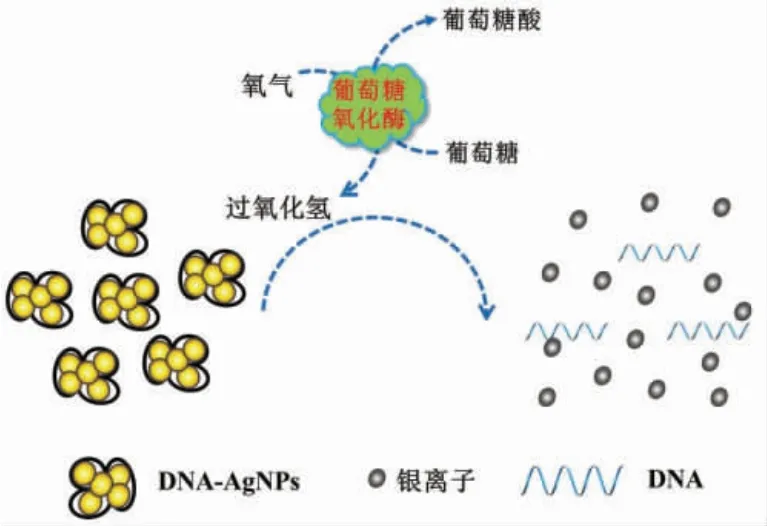
图4 比色法检测过氧化氢和葡萄糖Fig.4 Detection of H2O2 and glucose by label-free colorimetric assay
如图5所示,相对于图5a 的原始DNA-Ag-NPs,单独加入葡萄糖氧化酶或葡萄糖存在时(图5b,5c),溶液吸光度无变化。在添加100 μmol/L H2O2情况下,DNA-AgNPs 在424 nm 处的紫外-可见吸收峰强度降低(图5e)。添加200 μmol/L 葡萄糖和0.1 mg/mL 的葡萄糖氧化酶,观察到同样的现象(图5d),证明生成了H2O2。在加入H2O2后观察到紫外-可见吸收峰逐渐红移,这表明AgNPs 的平均尺寸增加。
为验证以DNA 为模板合成的AgNPs 在本检测体系中的优越性,根据Qin 等[19]的方法合成了柠檬酸保护的AgNPs,即citrate-AgNPs。调整citrate-AgNPs 浓度至吸光度和DNA-AgNPs 相等时,添加100 μmol/L H2O2,发现citrate-AgNPs(图6a)对H2O2几乎无响应(图6b),而DNA-AgNPs的吸光度降低超过90%(图6c,6d)。上述结果说明DNA-AgNPs 用于本方法可以获得更高的灵敏度。
H2O2可以根据以下反应的刻蚀溶解金属银[20]:使用透射电子显微镜研究了添加不同浓度H2O2时DNA-AgNPs 的形态变化。TEM 图像表明,在10 μmol/L H2O2存在时,球形DNA-AgNPs 纳米颗粒被蚀刻成更小的粒子(图7a),同时发现蚀刻过程与H2O2浓度有关,这与已报道的研究结果类似[21-22]。在100 μmol/L H2O2存在下,观察到银颗粒的聚集体(图7b),这可能由于在高浓度银离子的条件下,发生了盐诱导的AgNPs 聚集[23]。TEM 的结果与其紫外吸收响应数据相一致,基于此,可以通过监测DNA-AgNPs 的吸光度变化来检测H2O2和葡萄糖。
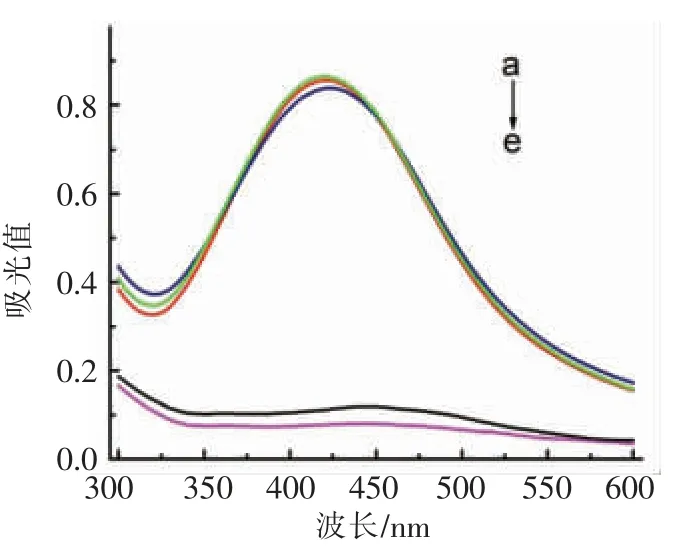
图5 不同组分存在下DNA-AgNPs(a)的吸收光谱:葡萄糖氧化酶(b);葡萄糖(c);葡萄糖氧化酶/葡萄糖(d);H2O2(e)Fig.5 Absorbance of DNA-AgNPs (a) in the presence of GOx (b), glucose (c), GOx/glucose (d), H2O2 (e)
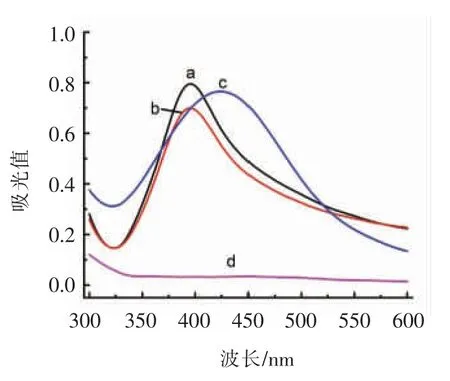
图6 添加100 μmol/L H2O2 对citrate-AgNPs(a,b)和DNA-AgNPs(c,d)吸光度影响Fig.6 Comparison of the effect of 100 μmol/L H2O2 on citrate-AgNPs (a,b) and DNA-AgNPs (c,d)

图7 加入10 μmol/L(a)或100 μmol/L(b)H2O2 后的DNA-AgNPs 的TEM 图像Fig.7 TEM images of the DNA-AgNPs after addition of 10 μmol/L (a),100 μmol/L (b) H2O2
2.3 最优反应时间
有研究表明,孵育时间对过氧化氢刻蚀金属纳米颗粒的程度有重要影响[24]。如图8所示,加入H2O2或葡萄糖氧化酶/葡萄糖后,随着孵育时间的延长,吸光度下降,并且在75 min 后变化不明显。因此,选择75 min 作为检测H2O2或葡萄糖氧化酶/葡萄糖的反应时间。
2.4 检测方法灵敏度
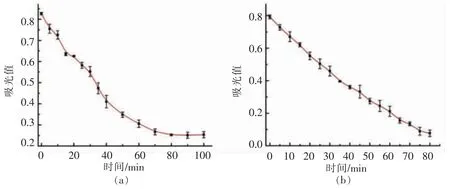
图8 不同反应时间对DNA-AgNPs 吸光度变化的影响Fig.8 Effects of incubation time on the absorbance of DNA-AgNPs
为进一步探明本方法的分析性能,研究其对过氧化氢和葡萄糖的线性检测范围及检出限。DNA-AgNPs 在424nm 波长处的吸收峰强度(A424nm)随着H2O2(图9)或葡萄糖(图10)浓度的增加而逐渐降低。对应的颜色由黄褐色逐渐变为浅黄色最终变为无色。吸光值与H2O2浓度在1~20 μmol/L范围内表现出良好的线性关系,线性方程为Y=-0.0301X+0.8661,其中Y 为吸光值,X 为H2O2浓度(μmol/L),相关系数R2=0.992,基于S/N=3 计算得出H2O2检出限为0.36 μmol/L。对于葡萄糖检测,吸光值与葡萄糖浓度在10~50 μmol/L 范围内线性关系良好,线性方程为Y=-0.00785X+0.8495,其中Y 为吸光值,X 为葡萄糖浓度(μmol/L),相关系数R2=0.997,检出限为1.13 μmol/L。上述结果表明,该方法利用比色法可以检测H2O2和葡萄糖,线性关系良好,灵敏度较高。
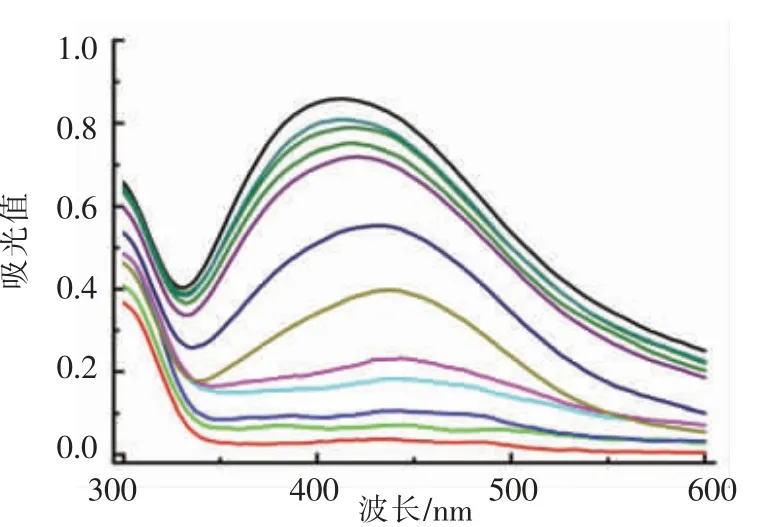
图9 DNA-AgNPs 在不同浓度H2O2 存在时的紫外-可见光吸收光谱Fig.9 The absorption spectra of DNA-AgNPs with H2O2 at different concentrations

图10 日光下传感体系颜色随H2O2 浓度的变化Fig.10 The image of the sensing system under visible light with H2O2 at different concentrations

图11 A424nm 随H2O2 浓度不同的变化曲线(a)及线性关系曲线(b)Fig.11 The relationship between the A424nm and the concentrations of H2O2
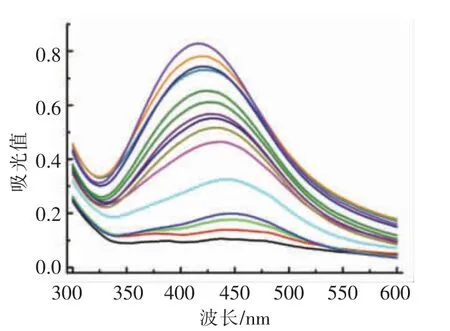
图12 DNA-AgNPs 在不同浓度葡萄糖存在时的紫外-可见光吸收光谱Fig.12 The absorption spectra of the sensing system under visible light with glucose at different concentrations

图13 日光下传感体系颜色随葡萄糖浓度的变化Fig.13 The image of the sensing system under visible light with glucose at different concentrations

图14 A424nm 随葡萄糖浓度不同的变化曲线及线性关系曲线Fig.14 The relationship between the A424nm and the concentrations of glucose
2.5 选择性
为评价该方法对于检测葡萄糖的选择性,选择4 种单糖和二糖(包括果糖、蔗糖、麦芽糖和半乳糖,浓度均为200 μmol/L),利用比色法进行检测。如图15所示,添加4 种干扰物质后,溶液吸光度没有明显下降,加入葡萄糖后吸光度显著降低。结果表明本方法对葡萄糖具有高度选择性,并且葡萄糖的检测可以通过可见光下颜色变化来进行可视化检测。
2.6 实际样品检测
以梨汁为实际样品,经高效液相色谱法测定,梨汁中原始的葡萄糖含量为(15±0.13)mg/mL。通过在梨汁中加入不同浓度的葡萄糖,在最优条件下测定其回收率。加标样品的回收率范围从87.00%~96.02%(见表1),表明该方法在实际样品中检测葡萄糖含量具有潜在的实用性。
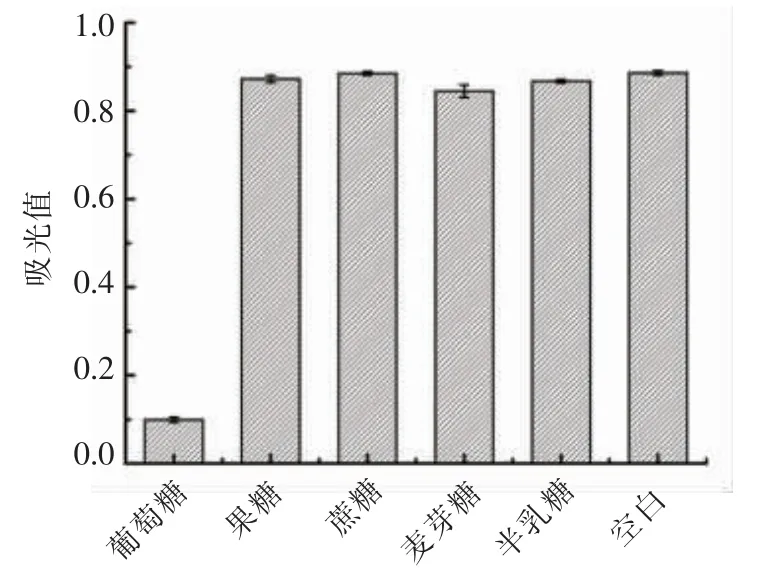
图15 选择性验证结果Fig.15 The results of selectivity tests

表1 在梨汁样品中检测葡萄糖回收率试验Table 1 Recovery of glucose in pear juice samples
3 结论
建立了一种基于DNA-AgNPs 的比色传感器,用于高灵敏度检测过氧化氢和葡萄糖。在DNA 保护下,用硼氢化钠还原硝酸银合成DNAAgNPs。加入过氧化氢后DNA-AgNPs 颜色由黄褐色变为无色,从而实现过氧化氢的比色法检测。与citrate-AgNPs 相比,DNA-AgNPs 对过氧化氢响应更灵敏。在葡萄糖氧化酶辅助下,间接测定了葡萄糖的含量。通过在梨汁中加入不同浓度的葡萄糖,采用比色法测定其回收率,结果表明该方法可以用于实际样品中的葡萄糖检测,具有优异的检测特异性。该方法实现了食品中目标物的快速、可视化检测,具有易制备,操作简单,消耗低等优势,为构建食品中目标物的检测方法提供了有益参考。
