速冻面米制品中金黄色葡萄球菌和肠毒素A基因三重PMA-qPCR快检方法的建立
2020-08-03宋明辉施春雷李琼琼史贤明杨美成
宋明辉 施春雷 李琼琼 史贤明 杨美成*
(1 上海市食品药品检验所 国家药品监督管理局药品微生物检测技术重点实验室 上海201203 2 上海交通大学农业与生物学院 上海200240)
金黄色葡萄球菌是一种重要的食源性致病菌,由其引起的食物中毒是一个世界性卫生问题,对公共健康和食品安全带来巨大威胁[1]。2011年,我国卫生部根据致病菌风险评估结果,参照国际食品微生物标准委员会采样方案和限量规定,对食品安全国家标准 《速冻面米制品》(GB 19295-2011)进行了修订,其中金黄色葡萄球菌由不得检出调整为限量检出[2]。2013年实施的致病菌限量通用标准GB 29921-2013 也将预包装食品(不适用罐头类食品) 中的金黄色葡萄球菌检测修订为限量检出[3]。虽然国家对食品安全标准进行了调整,但配套的金黄色葡萄球菌定量检测方法仍为传统的平板培养法。该方法不仅耗时久(至少4~5 d),而且操作繁琐,不能满足当前对食品快速风险评估的要求。
荧光定量PCR(qPCR)技术和传统培养方法相比,在检测时间、灵敏度、成本以及高通量方面都具有很大优势,可实现对致病菌快速定性、定量检测[4-5]。然而,直接应用qPCR 技术检测食品中污染的致病菌时,无法区分活菌与死菌。研究表明:在细菌胁迫条件下保藏的食品会造成致病菌失活[6],如速冻食品,因此采用qPCR 技术检测时,无法准确定量食品中污染的致病菌。叠氮溴化丙锭(Propidium monoazide,PMA) 是一种具有高亲和力的光敏反应DNA 结合染料,它可与qPCR 联合使用,选择性扩增活细胞中的DNA,提高检测的准确性[7-9]。此外,对于PCR 检测技术,检测靶点的特异性对于致病菌准确检测格外重要。由于靶序列变异、基因水平转移等因素,往往会导致假阴性、假阳性等误检结果[10]。检测靶点的特异性和数量限制了基于核酸检测致病菌的能力,因此不断发掘新的特异检测靶点势在必行。
金黄色葡萄球菌肠毒素A 被认为是引起食物中毒的最主要致病因子,90%以上的食物中毒菌株都携带肠毒素sea 基因[11-12]。与大部分肠毒素不同,肠毒素A 不受群体感应系统调控,在细菌数目较低时也能产生肠毒素,而且94 ng 的肠毒素A就能导致食物中毒[13-14]。在允许食品中较低数目金黄色葡萄球菌存在的同时,有必要对食品中肠毒素sea 基因进行检测,来评估食品中污染肠毒素A的风险。此外,食品基质、DNA 提取过程中残留的有机酸及其它多种因素均可抑制PCR 反应,造成假阴性结果。在检测体系中添加扩增内标可有效指示检测过程中出现的假阴性结果,目前被认为是分子检测技术所必须具有的[15]。多重qPCR 技术能在一个反应中同时检测多种致病菌或者多个致病因子,具有更高效快速的优势[16]。本研究拟开发一种能同时定量金黄色葡萄球菌活菌,筛查肠毒素sea 基因及指示PCR 反应假阴性的多重PMAqPCR 体系,来准确评估速冻食品中污染金黄色葡萄球菌的风险。
1 材料和方法
1.1 主要试剂与仪器
胰酪大豆胨培养基,美国BD 公司;Baird-Parker 琼脂基础,美国Life Technologies 公司;PMA 染料、PMA-lite LED 光分解仪,美国Biotium公司;Qubit 3.0 荧光定量仪,美国Thermo Fisher Scientific 公司;Qiagen DNA 提取试剂盒,德国Qiagen 公司;Premix Ex TaqTM(Probe qPCR),大连TaKaRa 公司;Mastercycler ep realplex 实时荧光定量PCR仪,德国Eppendorf 公司;LABGARD 型生物安全柜,美国Nuaire 公司。
1.2 试验菌株
本研究使用的菌株信息见表1,其中ATCC 表示美国标准菌种收藏所,CMCC 表示中国医学细菌菌种保藏管理中心,IQCC 表示检验检疫菌种保藏中心。
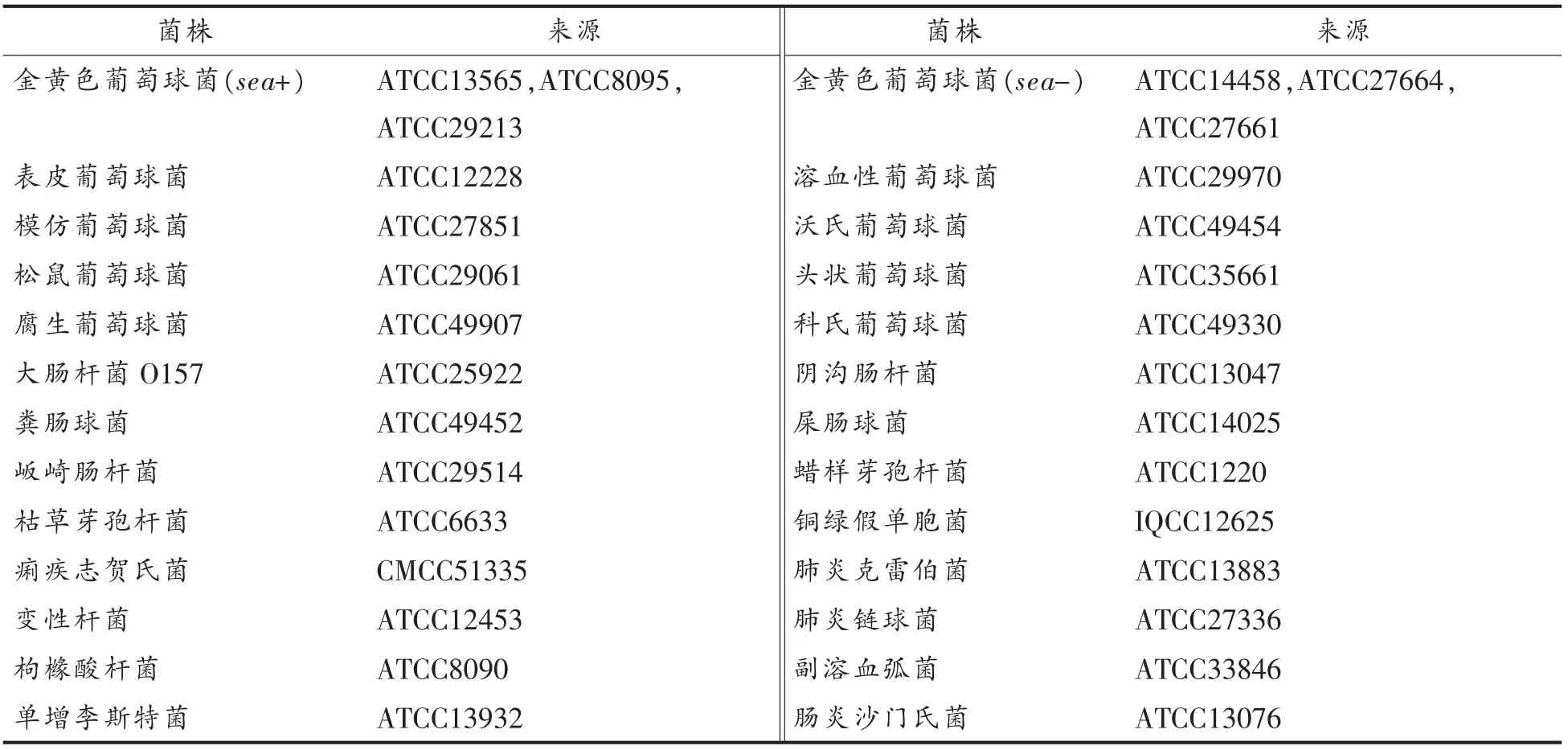
表1 菌株信息表Table 1 Information of the strain
1.3 引物和探针设计
基于食源性致病菌特异性靶点发掘平台SMM-system[17],通过比较基因组学,获得金黄色葡萄球菌特异靶基因RpiR (编码表达Sucrose-specific PTS transporter protein RpiR family transcriptional regulator)。利用软件Beacon designer 7.0,针对RpiR 和sea 基因保守区域,设计多对引物和探针,筛选出性能较好的引物和探针,见表2,其中引物由上海生工有限公司合成,探针由赛默飞世尔科技公司合成。
1.4 扩增内标模板及探针序列
利用DNA Random Shuffling 方法[18]改组肠毒素A 基因探针序列,构建扩增内标探针5’-NEDATTGGTGCTGAATAGTGTGT-MGB-3’。用内标探针序列替代肠毒素A 基因PCR 产物中的目标探针序列,作为扩增内标模板序列,如下:GTGGTACACCAAACAAAACAGCTTGTAATTGGTGCTGAATAGTGTGTCATGATAATAATCGATTGA CCGAAGAGA,扩增内标模板序列由上海生工有限公司合成。
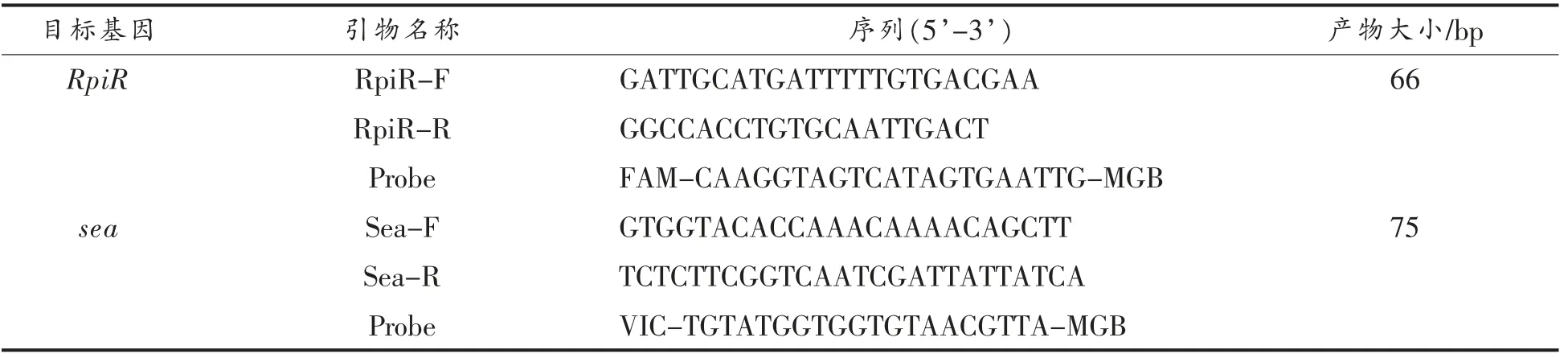
表2 检测引物和探针序列信息Table 2 The sequence of primers and probes used in this study
1.5 三重qPCR 检测体系构建与优化
构建包含金黄色葡萄球菌特异靶基因RpiR、肠毒素基因sea 和扩增内标的三重qPCR 检测体系,对引物、探针及内标模板浓度优化,确定最佳反应体系,如下:Premix Ex Taq (2×)12.5 μL,RpiR-F(10 μmol/L)0.5 μL,RpiR-R(10 μmol/L)0.5 μL,sea-F(10 μmol/L)0.5 μL,sea-R(10 μmol/L)0.5 μL,Probe-1(FAM,10 μmol/L)0.5 μL,Probe-2(VIC,10 μmol/L)0.5 μL,扩增内标探针(NED,10 μmol/L)0.5 μL,扩增内标模板(550 拷贝)1 μL,模板5 μL,无菌水3 μL。PCR 循环参数:95 ℃预变性30 s,40 个循环,每个循环的程序包括95 ℃变性10 s,60 ℃退火30 s,采集荧光信号。
1.6 三重qPCR 检测体系特异性及灵敏度评价
表1列出的30 株金黄色葡萄球菌以及非金黄色葡萄球菌活化后,采用Qiagen DNA 提取试剂盒进行DNA 提取,利用优化好的三重qPCR 检测体系,验证靶基因RpiR 和sea 引物及探针的特异性。利用Qubit 3.0 核酸定量仪,对金黄色葡萄球菌标准菌株ATCC13565(sea+)基因组DNA 浓度进行定量,质量浓度为11.5 ng/μL,10 倍梯度稀释后,用优化的三重qPCR 体系分别进行扩增,以确定靶基因RpiR 和sea 的最低检测浓度。
1.7 速冻面米制品样品PMA 前处理
PMA 处理速冻面米制品样品的具体步骤如下:称取食品样品25 g,加入225 mL 无菌生理盐水,均质拍打100 s,吸取均质液10 mL,10 000 r/min 离心1 min,弃上清;加入含10%TritonX100 的TE 缓冲液10 mL,振荡混匀,10 000 r/min 离心1 min,弃上清;加入含10%TritonX100 的TE 缓冲液5 mL,振荡混匀后,加入PMA 溶液,使其终质量浓度为30 μg/mL[19]。混匀后,暗室孵育5 min,然后置于PMA-lite LED 光分解仪器上作用30 min 后,用于后续DNA 提取及qPCR 检测。
1.8 三重PMA-qPCR 定量标准曲线的绘制
金黄色葡萄球菌纯培养物定量标准曲线绘制:将过夜培养的标准菌株ATCC13565 新鲜菌液平板计数后进行10 倍梯度稀释,浓度分别为1.02×107,1.02×106,1.02×105,1.02×104,1.02×103,1.02×102,1.02×101CFU/mL,每个浓度梯度3 个平行,加入PMA 溶液使其终质量浓度为30 μg/mL,PMA-lite LED 光分解30 min。采用Qiagen 试剂盒进行DNA 提取,qPCR 定量检测后,根据每个浓度对应的Ct 值(Ct<35),绘制金黄色葡萄球菌纯培养物的PMA-qPCR 定量标准曲线。
速冻面米制品中金黄色葡萄球菌定量标准曲线绘制:将过夜培养的ATCC13565 新鲜菌液,平板计数后10 倍梯度稀释。从超市购买速冻猪肉水饺和速冻小馒头样品,采用国标GB 4789.10-2016 的方法进行金黄色葡萄球菌检测[20]。在无菌条件下,分别称取25 g 金黄色葡萄球菌阴性的速冻猪肉水饺和速冻小馒头样品,依次加入225 mL生理盐水和稀释计数后的金黄色葡萄球菌菌液,使食品样品中金黄色葡萄球菌的污染量分别为1.9×108,1.9×107,1.9×106,1.9×105,1.9×104,1.9×103,1.9×102,1.9×101CFU/g,每个浓度梯度3 个平行。参照1.7 节的步骤进行速冻面米制品PMA 前处理,然后采用Qiagen 试剂盒进行DNA 提取。qPCR 定量检测后,把不同种类速冻面米食品中获取的有效Ct 值进行综合评价分析,绘制金黄色葡萄球菌在速冻面米食品中的PMA-qPCR 定量标准曲线。
1.9 三重PMA-qPCR 检测方法性能评估
称取25 g 金黄色葡萄球菌检测阴性(采用国标GB 4789.10-2016 方法预先检测) 的速冻猪肉水饺样品,加入225 mL 生理盐水,均质仪拍打100 s 后,分别加入标准菌株ATCC13565(sea+)和ATCC25923(sea-)新鲜菌液,制备10 份金黄色葡萄球菌人工污染样品,每个样品3 个平行。样品中污染菌液浓度分别约为102,103,105,107CFU/g,其中1~4 号样品为标准菌株ATCC13565 污染样品,5~8 号样品为标准菌株ATCC13565 污染样品,9~10 号样品为两株菌的混合污染样品(样品9为ATCC25923:107CFU/g 和ATCC13565:103CFU/g,样品10 为ATCC25923:107CFU/g 和ATCC13565:105CFU/g)。然后采用本研究建立的PMA-qPCR方法定量金黄色葡萄球菌,根据Ct 值,利用绘制的速冻面米食品中金黄色葡萄球菌定量标准曲线,定量金黄色葡萄球菌的浓度。人工污染样品同时采用国标GB 4789.10-2016 方法进行金黄色葡萄球菌平板计数,以评价三重PMA-qPCR 方法的检测性能。
2 结果与分析
2.1 引物特异性评价
金黄色葡萄球菌特异靶基因RpiR 的检测引物探针的特异性评价结果,如图1a 所示,结果表明6 株金黄色葡萄球菌均得到有效扩增(Ct<20),而24 株非金黄色葡萄球菌均未见明显扩增 (Ct>35)。肠毒素A 基因的检测引物探针的特异性评价结果,如图1b 所示,3 株sea 阳性金黄色葡萄球菌均获得有效扩增(Ct<20),而在27 株sea 阴性菌株中均未见明显扩增(Ct>35)。特异性评价结果表明靶基因RpiR 和sea 的检测引物和探针具有良好的特异性。

图1 金黄色葡萄球菌特异靶基因RpiR(a)和肠毒素A 基因(b)检测引物和探针特异性评价Fig.1 The specificity result of primers and probes for the targeted RpiR (a) and sea gene (b)
2.2 三重qPCR 检测体系灵敏度评价结果
优化建立的三重qPCR 反应体系的检测灵敏度评价结果如图2所示,标准菌株ATCC13565 基因组DNA 等比稀释,qPCR 检测结果呈规律性Ct值变化,说明qPCR 检测体系和仪器参数稳定。由结果可知,当基因组DNA 质量浓度大于115 fg/μL(图2标记为D),靶基因RpiR 和肠毒素A 基因的扩增Ct 值大于35,表明其不能获得有效扩增,因此靶基因RpiR 和肠毒素A 基因的检测下限同为115 fg/μL。由于扩增内标和肠毒素A 基因存在竞争关系,因此,进一步研究了不同肠毒素A基因模板浓度对扩增内标的影响,评价结果如图3所示,当多重检测体系中添加的内标模板浓度为550 拷贝/反应,肠毒素A 基因模板质量浓度>11.5 pg/μL 时,内标模板不能获得有效扩增,而肠毒素A 基因可以有效检测。

图2 三重qPCR 反应体系中靶基因RpiR 和sea 的检测灵敏度评价结果Fig.2 The DNA detection limit for the targeted RpiR and sea gene in triplex qPCR reaction system
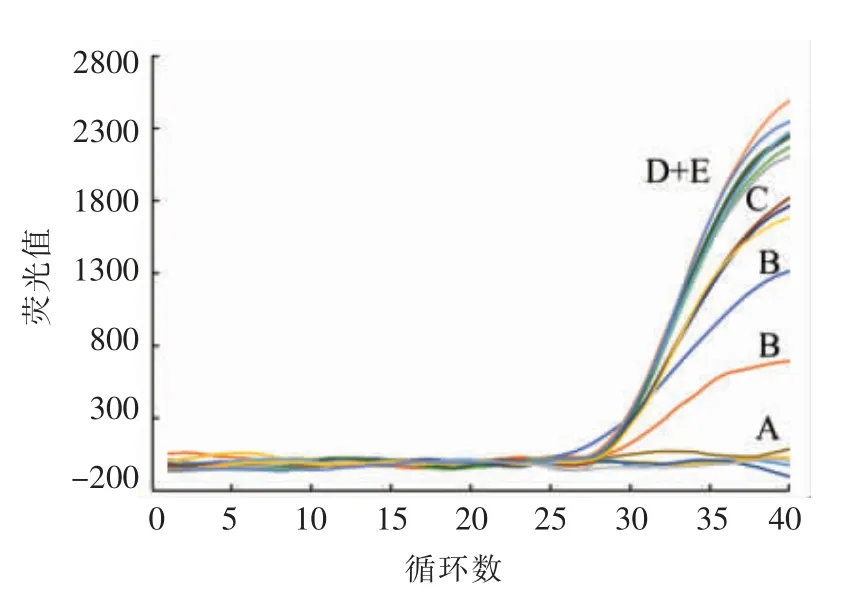
图3 三重qPCR 反应体系中扩增内标的有效扩增能力评价Fig.3 Amplification efficiency of internal amplification control in triplex qPCR reaction system
2.3 三重PMA-qPCR 定量标准曲线
以金黄色葡萄球菌浓度的对数值为横坐标,Ct 值为纵坐标建立标准曲线。其中金黄色葡萄球菌纯培养物的定量标准曲线如图4a 所示,靶基因RpiR 在目标菌液浓度101~107CFU/mL 范围内,与扩增Ct 值之间可以获得良好线性关系 (Ct<35),R2=0.9960;而肠毒素A 基因在目标菌液浓度102~107CFU/mL 范围内,与扩增Ct 值之间可以获得良好线性关系(Ct<35),R2=0.9998。速冻面米食品中金黄色葡萄球菌的定量标准曲线如图4b 所示,靶基因RpiR 在目标菌液浓度103~107CFU/g 范围内可以得到有效扩增,线性良好,R2=0.9943,而肠毒素A 基因在目标菌液浓度103~107CFU/g 范围内也可以得到有效扩增,线性良好,R2=0.9973。
2.4 三重PMA-qPCR 检测方法的性能评价
人工污染的10 份速冻面米食品样品,采用三重PMA-qPCR 进行检测,并在所建立的标准曲线上计算获得金黄色葡萄球菌活菌定量结果,同时采用国标GB 4789.10-2016 中平板计数法对PMA-qPCR 检测方法的性能进行评估。人工污染食品样品中金黄色葡萄球菌的定量检测结果如表3所示,当金黄色葡萄球菌污染量大于103CFU/g时,PMA-qPCR 方法定量获得的检测结果与平板计数获得的结果一致性较好 (71.8%~91.5%,PMA-qPCR 检测结果/平板计数结果×100)。当目标菌污染量小于103CFU/g,采用PMA-qPCR 方法检测污染样品时,平行样品之间没有明显一致的阳性扩增信号,无法对样品中的金黄色葡萄球菌进行定量。采用三重PMA-qPCR 方法筛查样品中污染金黄色葡萄球菌是否携带肠毒素A 基因,仅当sea 基因阳性金黄色葡萄球菌污染量大于103CFU/g 时,可获得准确的检测结果。此外,当金黄色葡萄球菌污染量大于103CFU/g 时,虽然PMAqPCR 金黄色葡萄球菌定量结果普遍比平板计数获得的定量结果低,但是配对T 检验结果表明两者的结果并无显著性差异。
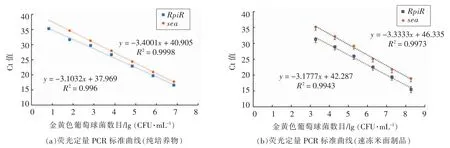
图4 PMA-qPCR 检测体系在金黄色葡萄球菌纯培养物(a)和速冻米面制品(b)中的荧光定量标准曲线Fig.4 The standard curves for quantification of Staphylococcus aureus in pure culture (a) and frozen foods (b)
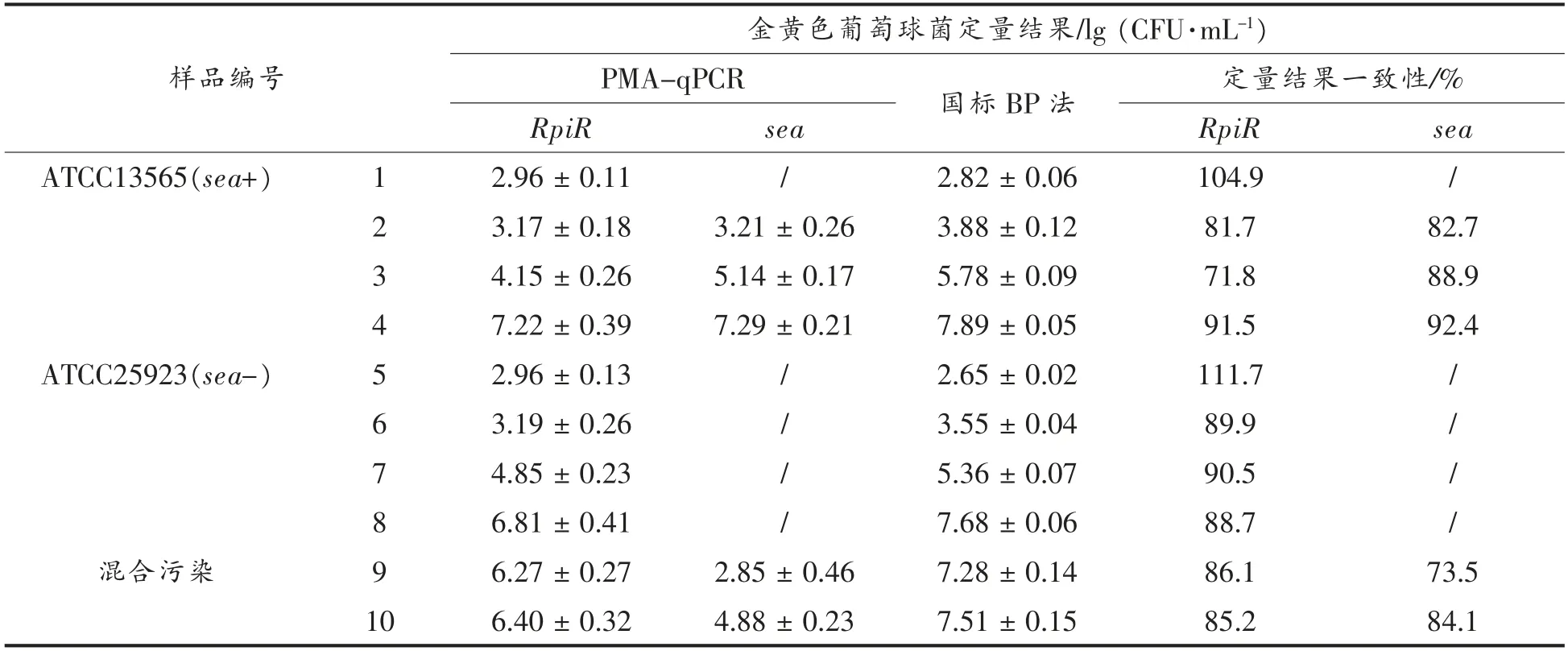
表3 人工污染速冻面米制品中三重PMA-qPCR 和国标BP 平板法的金黄色葡萄球菌定量检测结果Table 3 The enumeration results for Staphylococcus aureus in artificial contamination food samples by triplex qPCR method and plate count method
3 讨论
Taqman 荧光定量PCR 技术,因其快速、灵敏的特点已成为食源性病原微生物检测的重要手段[21]。目前已建立的金黄色葡萄球菌qPCR 检测体系主要针对相对纯净的样品(如培养基、牛奶)[22-23],对qPCR 在复杂食品中的实际检测能力缺少系统性评价。而研究表明复杂的食品基质,如肉类、禽类及其加工产品等都是金黄色葡萄球菌污染的主要对象[24]。因此本研究针对基质复杂的速冻面米食品(以米、面、杂粮等为主要原料,以肉类、蔬菜等为辅料),通过优化样品前处理方法,利用新发掘的金黄色葡萄球菌特异靶基因RpiR,建立了多重qPCR 检测体系,可以准确定量金黄色葡萄球菌污染量大于103CFU/g 的速冻面米制品。目前我国国标GB 19295-2011 对速冻面米生制品和熟制品中金黄色葡萄球菌的最高安全限量值分别为104CFU/g 和103CFU/g,因此本研究建立的多重qPCR 检测体系能够满足速冻面米食品中污染金黄色葡萄球菌的定量要求。
金黄色葡萄球菌食物中毒主要是由肠毒素造成的,而目前金黄色葡萄球菌的检测多以检出菌体为目的,忽视了对肠毒素的调查。而研究表明许多种肠毒素在100 ℃加热处理30 min 后仍具有活性,特别是肠毒素A 在细菌数目比较低的时候也能产生,导致食物中毒[25]。本研究建立的三重qPCR 检测体系在定量速冻面米食品中污染金黄色葡萄球菌的同时,也能够检测食品中污染金黄色葡萄球菌是否携带肠毒素A 基因。研究结果显示,当食品样品中肠毒素sea 基因阳性菌株污染量大于103CFU/g 时,三重qPCR 检测体系可以准确筛查肠毒素sea 基因,评估食品中污染金黄色葡萄球菌的潜在致病风险。此外,食品基质成分等PCR 抑制剂会造成qPCR 检测的假阴性结果,大大限制了qPCR 技术的实际应用[15]。本研究在检测体系中,添加了扩增内标可以有效指示实际食品检验中的假阴性结果,在提高检验结果准确性的同时,增强了qPCR 检测方法的实际应用价值。
速冻面米食品属于冷冻食品,研究表明食品经过冷冻能够使食品中90%的微生物种群死亡[26]。而qPCR 技术是基于DNA 拷贝数来定量检测细菌,因此有效消除死菌DNA 是qPCR 方法准确检测细菌的前提。为达到检测活菌的目的,光敏性核酸染料(PMA 和EMA)被用于修饰死菌核酸,抑制死菌核酸的扩增,与qPCR 联合使用后,可以选择性扩增活细胞DNA,提高检测的准确有效性[7,27-28]。近年研究发现EMA 在一定条件下对活菌具有抑制作用,影响检测结果的准确性[29]。而PMA 在质量浓度大于30 μg/mL 时,则能够完全抑制金黄色葡萄球菌死菌的扩增,而在质量浓度小于50 μg/mL 时,不会对活菌检测造成影响[19]。因此本研究选择PMA 结合三重qPCR 检测方法定量检测速冻面米食品中污染的金黄色葡萄菌。采用人工污染速冻面米食品样品,评价本研究建立的PMAqPCR 定量检测性能,结果显示,当金黄色葡萄球菌污染量大于103CFU/g 时,PMA-qPCR 定量检测结果与国标平皿计数结果在对数值水平上具有较好的一致性,表明本研究建立的三重PMA-qPCR方法检测结果准确可靠,可有效检测速冻面米食品样品中污染的金黄色葡萄球菌。
4 结论
本研究建立了能够同时定量速冻面米食品中金黄色葡萄球菌,筛查肠毒素A 基因并指示PCR反应假阴性的三重PMA-qPCR 体系,该检测方法操作简便、特异性强,可以在5~6 h 内,对食品中污染量在103~108CFU/g 范围内的金黄色葡萄球菌进行准确定量,同时筛查肠毒素A 基因,无论对食品工业生产流程中金黄色葡萄球菌的监测和终产品质量控制,还是对政府部门食品安全的管理和监控都具有重要意义。
