新疆伊犁地区发酵驼乳中酵母菌多样性分析
2020-08-03李王强樊哲新刘月李宝坤李开雄
李王强 樊哲新 刘月 李宝坤 李开雄
(石河子大学食品学院 新疆石河子056400)
发酵乳制品中有多种微生物参与发酵过程,其中酵母菌的作用不可忽视,其利用价值也越来越高。Njage 等[1]从干旱、半干旱地区的发酵驼乳筛选到21 种酵母菌,通过生理生化特征结合RFLP、RAPD 分子标记技术分析,尚未阐明各类酵母在发酵过程中的作用。陈历水等[2]从原料乳中筛选到一株抗氧化活性良好的毕赤酵母(Pichia fermentans),用于生产天然抗氧化剂。对酵母菌的分离、鉴定,以及研究其在乳品发酵过程中的作用,将有助于加快工业化生产健康发酵产品。
在分子生物学中DGGE 电泳技术具有快速、准确的特点,适用于样品中微生物多样性的研究。1979年Fischer 和Lerman[3]最先提出利用变性梯度凝胶电泳检测DNA 碱基序列的点突变,理论上可检测一个核苷酸序列的差异。1993年,Muyzer等[4]首次将DGGE 电泳技术应用到分子微生物的研究中,证实该技术在揭示自然界不同微生物区系的遗传多样性和菌群差异方面具有独特的优势。随着分子生物学的改进与发展,DGGE 电泳技术在分析样品微生物菌群差异和菌群演变方面发挥了不可替代的作用。目前,该技术已广泛应用于土壤[5-8]、废水[9-11]、肠道[12-16]、食品[17-20]等微生物群落多样性的研究。
牧民自制发酵驼乳中的酵母菌是经过多代自然选择而优化的种群。本文对新疆牧民制作的发酵驼乳中酵母菌进行分离、鉴定、收集、保藏,为新疆特色的地域性微生物提供了保护。
1 材料与方法
1.1 材料
驼乳样品采自新疆伊犁州国营牧场、巴音傲瓦乡、伊克乌图布拉格牧场,精河小海子、精河阔岱管护站。12 个发酵驼乳样品均由哈萨克族、蒙古族和维吾尔族牧民家庭传统发酵而成,无菌采集样品,4 ℃冷藏运回实验室,备用。
1.2 设备与仪器
LX-1002 离心机,江苏海门其林贝尔仪器制造有限公司;5417R 高速冷冻离心机、Eppendorf移液枪,德国Eppendorf 公司;立式自动电热压力蒸汽灭菌锅,上海申安医疗器械厂;超净工作台,苏州净化设备有限公司;万分之一电子天平,丹佛仪器(北京)有限公司;DGGE 电泳仪,荷兰INGENY 公司;TC-512 PCR 扩增仪,英国Techne 公司;凝胶成像仪(GelDoc 2000 system Bio-Rad),美国BIO-RAD 公司;DNP-9272 型电热恒温培养箱,上海精宏实验设备公司。
1.3 试验方法
1.3.1 基于传统培养方法分析样品中优势酵母菌
1.3.1.1 酵母菌总数的测定 取10 mL 样品混匀在90 mL 质量分数为0.9%的灭菌生理盐水中,混匀,10 倍梯度稀释悬浮液。采用平板涂布法,分别吸取0.1 mL 10-2~10-54 个稀释度的菌悬液于酸化的YPD 固体平板上,涂布均匀,25 ℃培养48~56 h 后计数。每个处理重复3 次。
1.3.1.2 酵母菌的分离、纯化及保藏 仔细观察计数培养基上酵母菌的菌落形态,挑选不同特征的单菌落,在酸化的YPD 培养基上划线分离,25℃恒温培养48~56 h。反复划线纯化,直到菌落形态单一,选择符合酵母形态(大小、形状、颜色等)的菌株再次接种到酸化液体YPD 培养基中,25℃培养48~56 h,连续培养3 代。吸取第3 代菌液800 μL 于1.5 mL 离心管中,再加入600 μL 50%的甘油,-80 ℃保藏。
1.3.1.3 酵母菌生理生化试验[21-24]酵母菌分离菌株主要通过菌落特征观察、糖发酵试验、碳源同化试验、氮源同化试验、脲素水解试验、硝酸盐还原试验进行验证。
1.3.2 基于PCR-DGGE 技术分析样品中酵母菌多样性
1.3.2.1 样品预处理 提取样品DNA 前,将三角瓶、枪头及移液管等高压灭菌处理。用移液管分别吸取45 mL 无菌驼乳在150 mL 三角瓶中,移液枪移取5 mL 发酵驼乳样品到三角瓶中,对应样品编号,充分混匀,在25 ℃下继续发酵24 h,形成二次发酵乳。所有操作均在无菌操作室进行,避免人为及环境的污染。
1.3.2.2 样品总DNA 的提取 将上述纯化的酵母菌接种于YEPD 液体培养基中置于28 ℃培养36 h 后,去1 mL 活化菌液,12 000 r/min 离心1 min,收集沉淀即为菌体。按照酵母菌基因组DNA提取试剂盒(离心柱型)说明书上的方法操作,然后将所提取的DNA 于-20 ℃保存。
1.3.2.3 26S rDNA D1 区的PCR 扩增 以DNA提取液为模板,蒸馏水为阴性对照,DGGE 扩增引物NL1GC 和LS2,二轮扩增引物为NL1 和LS2[25]。
PCR 扩增体系50 μL:DNA 模板2 μL,引物各2 μL,2×Taq PCR Master Mix 25 μL,ddH2O 19 μL。PCR 扩增程序:95 ℃预变性5 min,36 个循环 (95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸50 s),72 ℃延伸10 min。取5 μL PCR 扩增产物在0.8%琼脂糖凝胶上电泳,稳压90 V,电泳时间约为20~30 min,检测扩增结果。
1.3.2.4 DGGE 指纹图谱构建 参考文献[26]及反复试验,根据酵母菌扩增片段大小选择6%丙烯酰胺凝胶,变形梯度定为30%~50%。变性梯度凝胶电泳基本操作和条带的回收、处理及分析同参考文献[26]。

表1 酵母菌DGGE 制胶配比Table 1 The ratio of denaturing solution of yeast
2 结果与分析
2.1 酵母菌的分离与鉴定
2.1.1 酵母菌计数 新疆不同地区不同民族牧民家庭采集的发酵驼乳中酵母菌计数结果及采样信息如表2所示。
2.1.2 菌落形态观察 样品中分离出35 株酵母菌,菌落特征初步观察,如表3所示。
2.1.3 菌株生理生化性质 分离菌株糖发酵、碳源同化及氮源同化结果分别见表4和表5。
通过形态观察、测定菌株生理生化特性,结合查阅《酵母菌的特征与鉴定手册》[27],推断分离得到的35 株酵母菌在生理特性上归属于5 个属,结果为:菌株G1,G2,B2,B8,Y2,Y8,X2,K4 为马克斯克鲁维酵母;G3,G5,G6,G9,B3,B5,B6,B7,Y1,Y4,Y7,Y11,X1,K1,K3 为单胞酿酒酵母;G4,G7,B1,B4,B9,Y3,Y5,Y6,Y10 为林 德纳克勒酵母;Y9 和K2 为酿酒酵母;G8 为白地霉酵母。
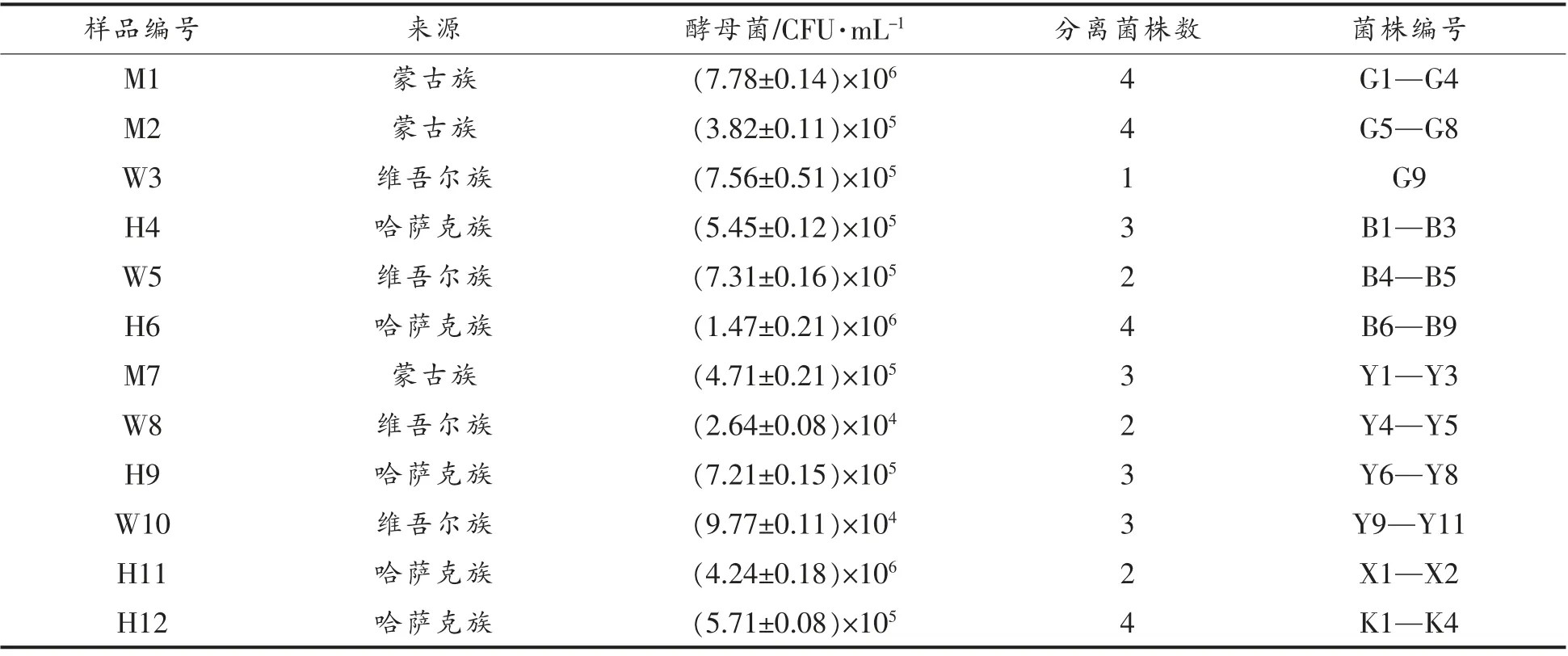
表2 新疆地区样品采集与分离结果Table 2 Result of isolated strains from samples of Xinjiang

表3 菌落形态和细胞形态结果Table 3 Results of colony shape and cellular shape
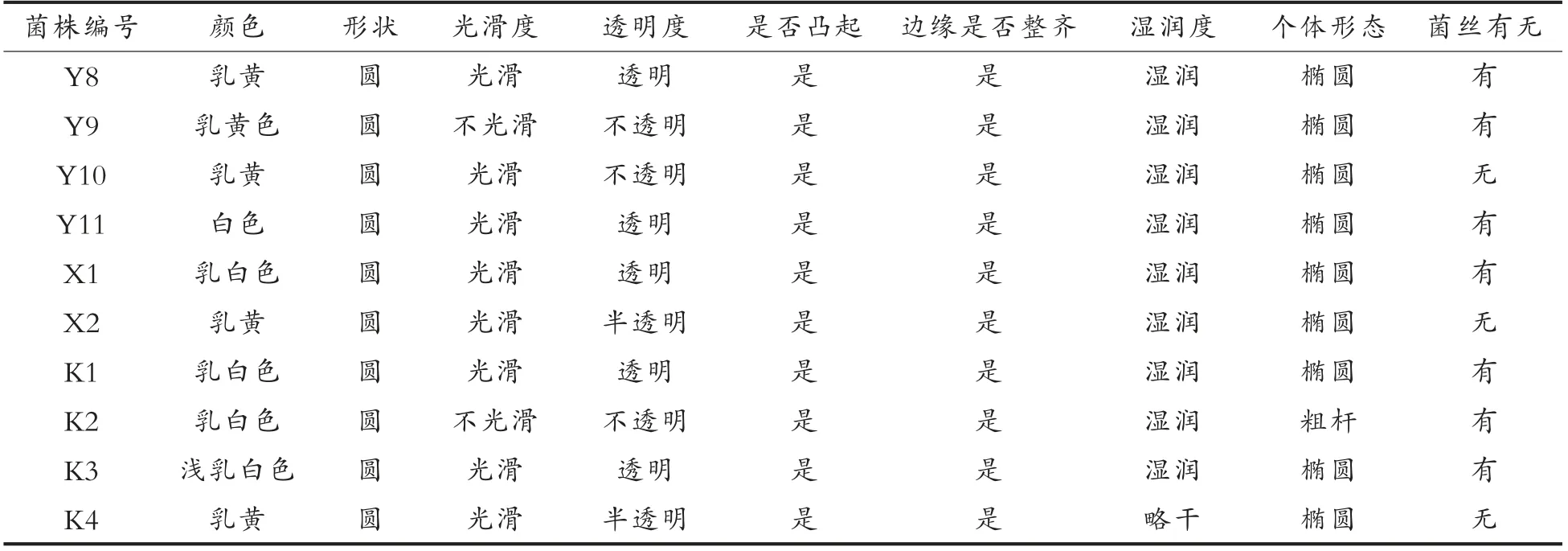
(续表3)

表4 酵母菌株糖发酵试验及生理鉴定结果Table 4 Results of carbohydrate fermentation and physiological and biochemical properties of yeasts
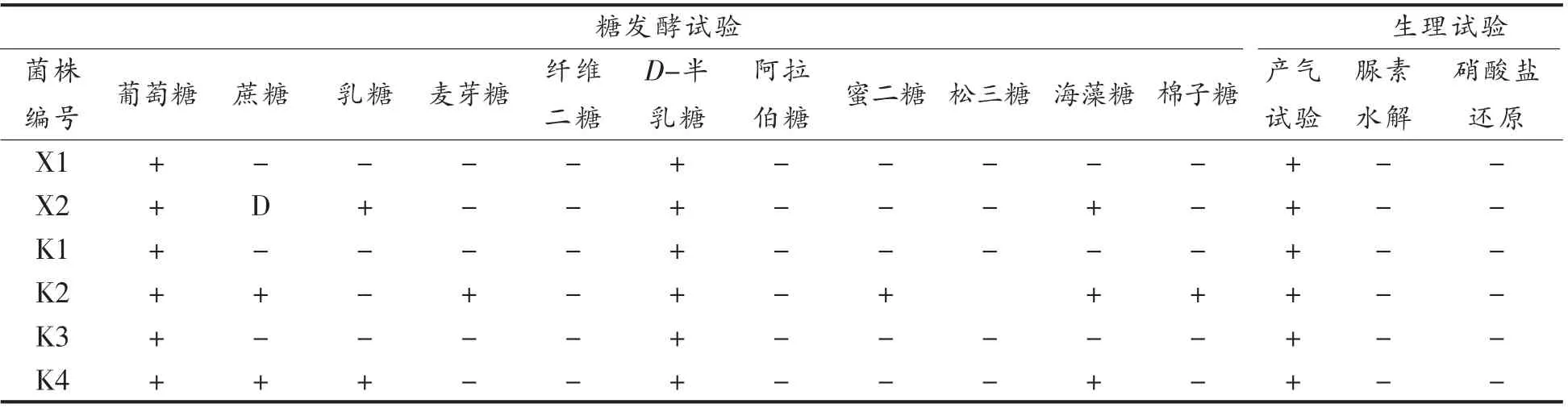
(续表4)

表5 分离菌株碳源同化试验及氮源同化试验结果Table 5 Results of carbon and nitrogen assimilation tests for identification of isolated yeasts
2.2 PCR-DGGE 技术分析多样性
2.2.1 真菌总DNA 的提取及扩增 乳制品中微生物组成复杂,且脂肪含量高,能够得到目标DNA 是后期试验的前提。采用CTAB 法提取样品总DNA,可以最大限度提取样品中基因DNA。以NL1 和LS2 为引物,扩增酵母菌26S rDNA 基因的D1 区,经1.0%的琼脂糖凝胶电泳检测,结果如图1所示。可看出,扩增产物片段大小为700 bp左右,是目标条带,符合后期DGGE 试验要求。
2.2.2 DGGE 图谱结果 酵母菌26S rDNA 的D1可变区PCR 扩增产物,经变性梯度凝胶电泳技术分离,由EB 染色后得到了清晰地条带,如图2所示。
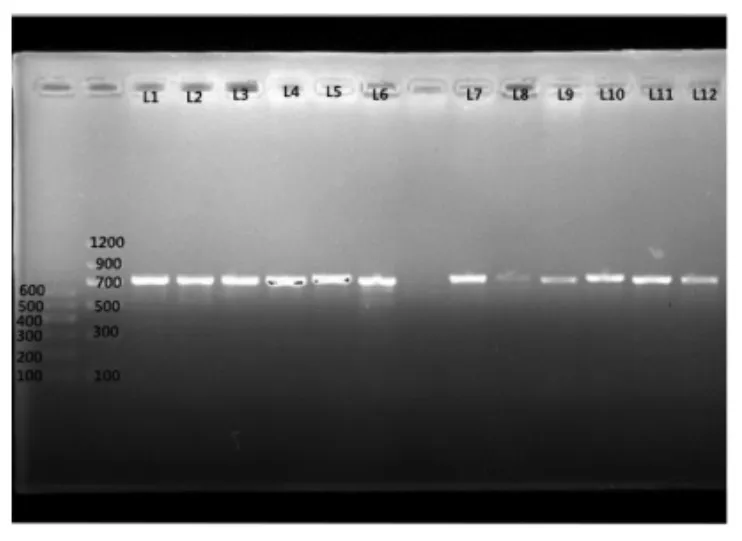
图1 PCR 扩增的26S rDNA 序列琼脂糖凝胶电泳图Fig.1 PCR amplification agarose gel electrophoresis of 26S rDNA partial sequence
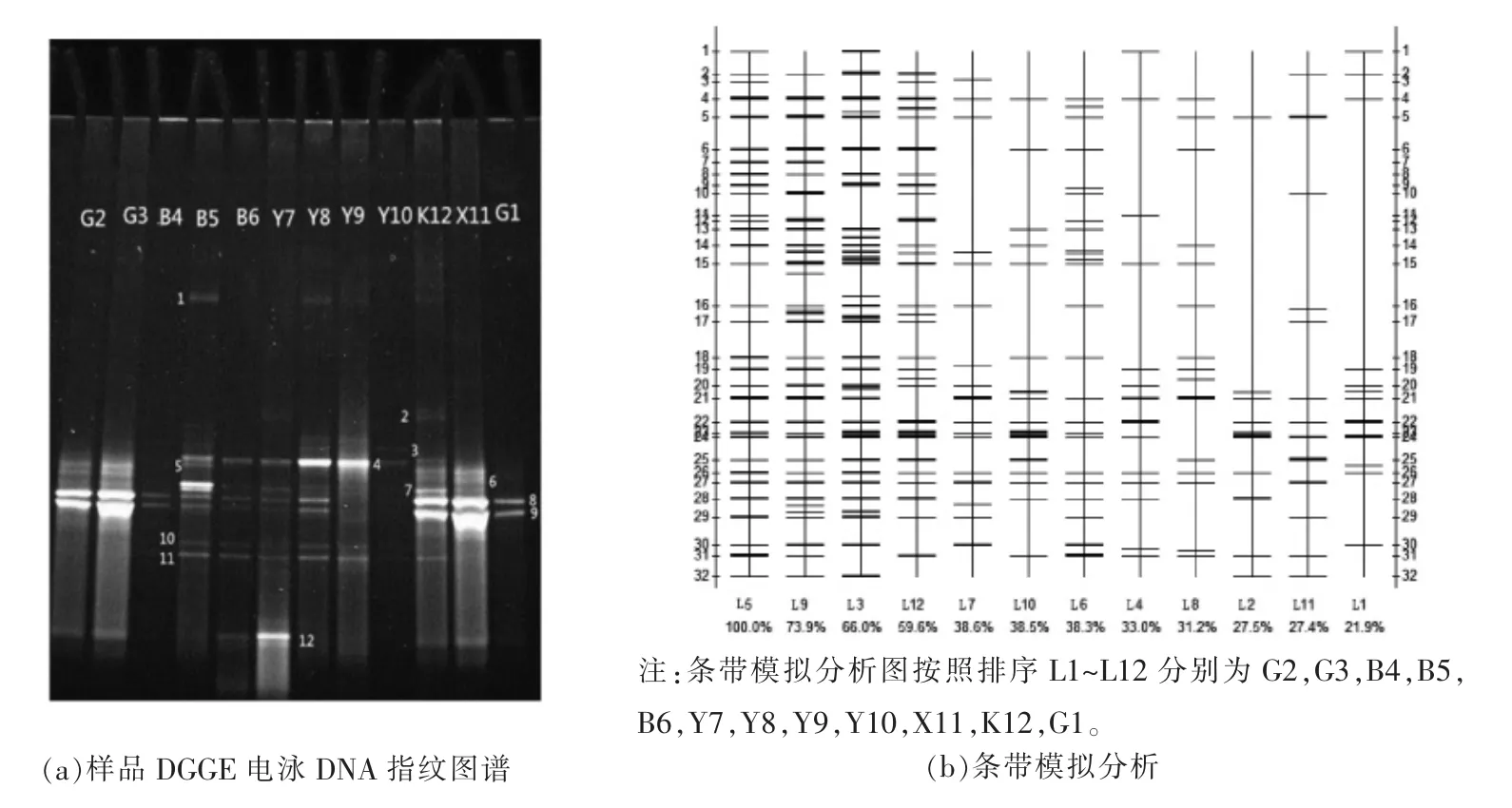
图2 DGGE 指纹图谱及Quantity One 软件分析结果图Fig.2 Profiles of PCR amplified 16S rDNA gene separated by DGGE and analyzed by quantity one software
从图2a 可以看出,不同发酵驼乳样品之间有一些共有条带,这些共有条带亮度不尽相同;所有样品之间没有公共条带。结果表明,不同样品之间在酵母菌种类存在差异性和共性,在种群丰度上也有一定的区别。
通过Quantity One 软件对电泳图谱中特异性条带数量、迁移位置以及相对强度进行分析,由图2b 可知,一共在32 个位点获得232 条条带,不同样品之间条带数量、种类及相对含量有很大差异;所有样品通过变性梯度电泳分离出的特异性条带数目在10~34 之间不等,说明样品酵母菌群落结构具有多样性,样品之间差异性明显。样品G1(L12)、B4(L3)和Y10(L9)所形成的泳道条带亮度很弱,而条带丰度高,说明该样品中酵母菌种类多而相对含量较少。
除Y9(L8)样品外,条带24 在其它样品中均有体现;条带26 在X11(L10)上不出现而在其余样 品中 出现。条 带4,5,6,14,15,16,18,21,22,27,28,30 和31 在绝大部分样品中都会显现;有些条带出现在少数样品中,如条带1 只在G2(L1)、B4(L3)、B5(L4)、和B6(L5)样品中出现;条带7 只在B6(L5)和Y10(L9)样品中出现。将DGGE 指纹图谱中清晰地特异性条带用无菌手术刀小心切胶,胶回收、连接、转化,选择阳性克隆子测序。将所得序列上传至NCBI 数据库,申请序列登录号,利用Blast 程序对序列进行同源性比对、分析,结果如表6所示。

表6 发酵驼乳样品中酵母26S rDNA 基因序列的分析结果Table 6 Results from 26S rDNA sequences analyze of yeast of samples
将条带的测序结果与GenBank 中已有酵母序列Blast 比对,下载同一种属且有代表性的标准序列,采用MEGA5.0 软件进行UPGMA 算法,构建系统发育树,自展值(boot strap)为1 000,结果如图3所示。
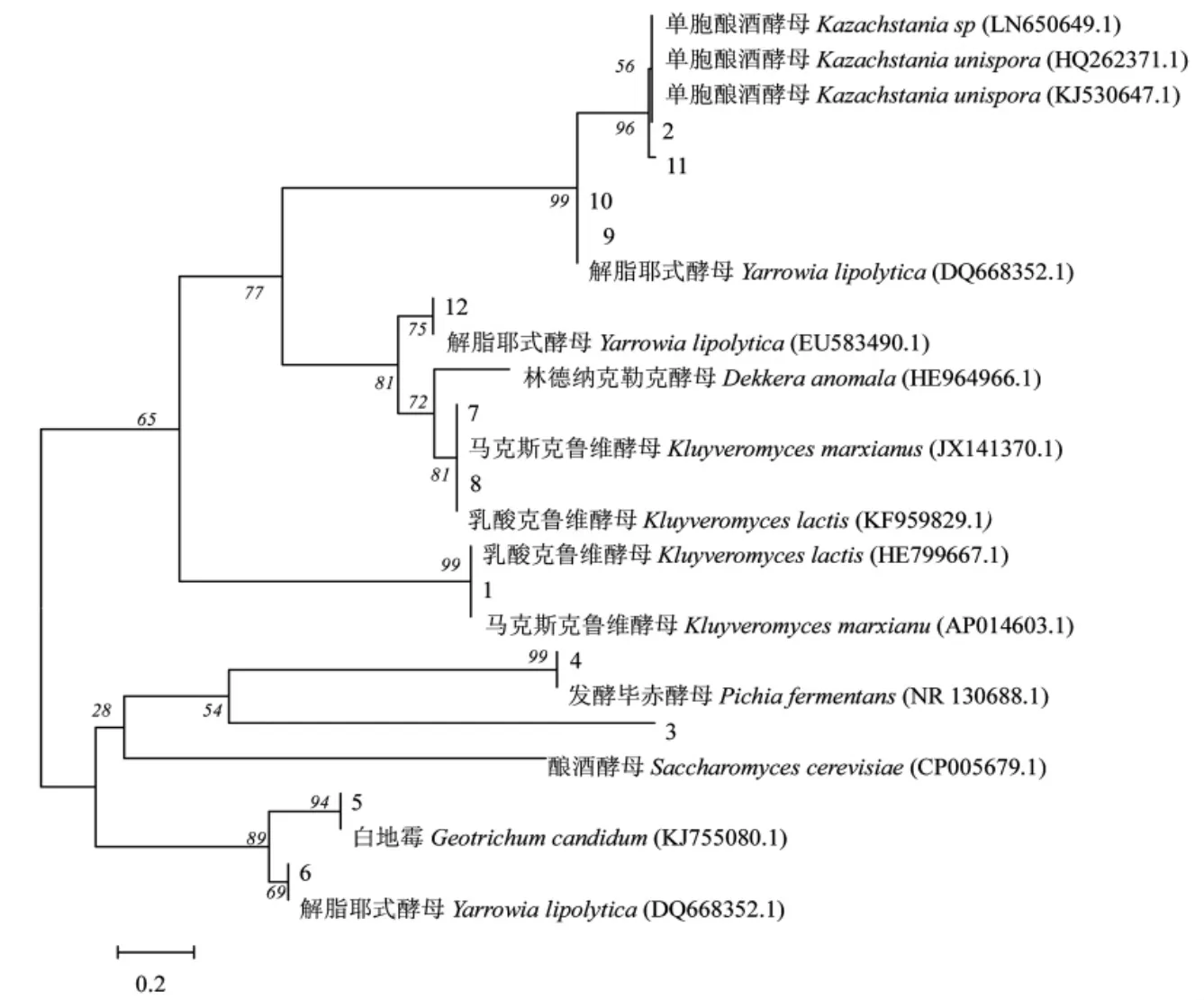
图3 DGGE 条带序列的系统进化树Fig.3 Phylogenetic tree of sequences derived from DGGE bands
2.2.3 样品中酵母菌群落相似性 利用Quantity One 对胶图读取条带信息,得到模拟条带分析图(图2b),统计DGGE 图谱中特异性条带数以及各样品间共有条带数目,计算酵母菌群落之间差异信息,从而得到酵母菌相似性结果(表7)和基于相似性的聚类分析结果(图4)。据表7看出,所有样品的酵母菌相似性系数在21.9%~73.9%范围之间,说明各样品间酵母菌的种群结构有较大差异。其中G2 和B6 之间相似性最低,相似性系数仅为21.9%;而相似性最高的是Y10 和B6,系数高达73.9%。
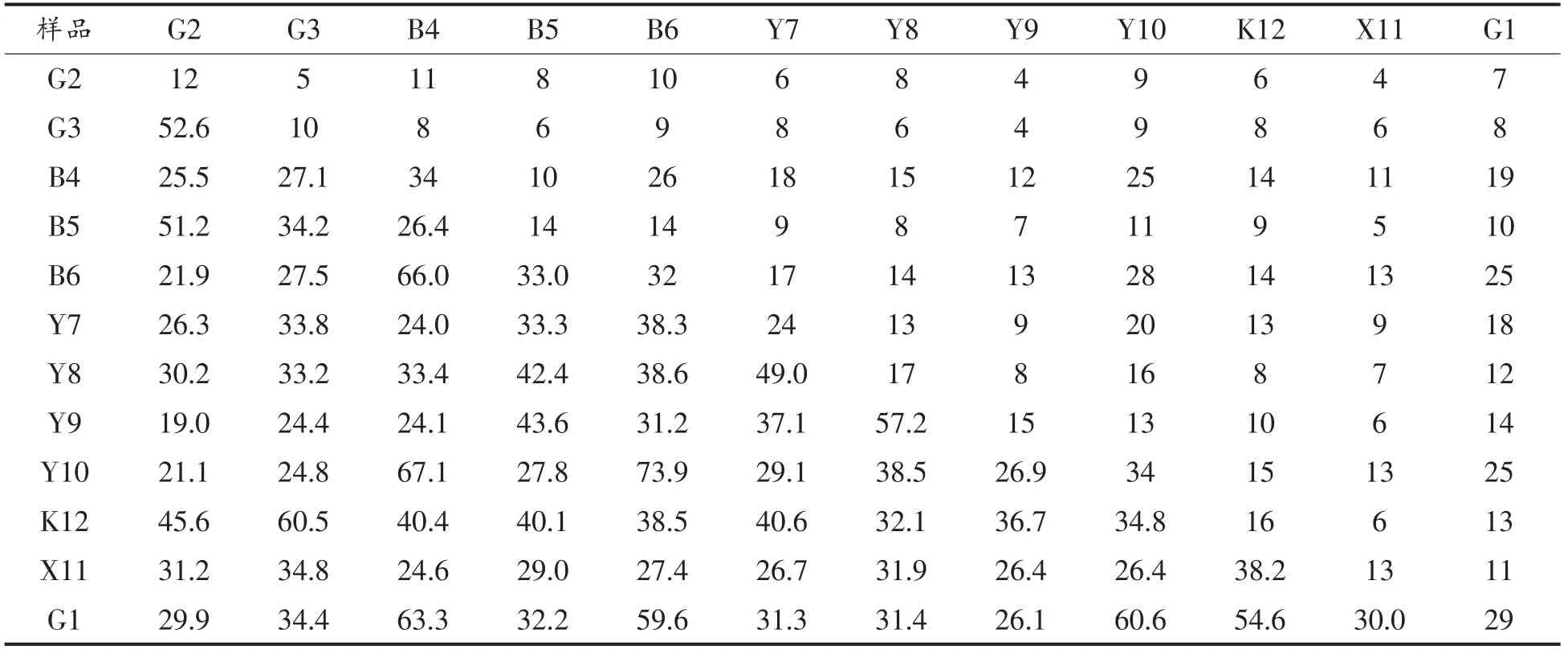
表7 样品酵母菌相似性分析Table 7 Similarity coefficients of yeast community in samples
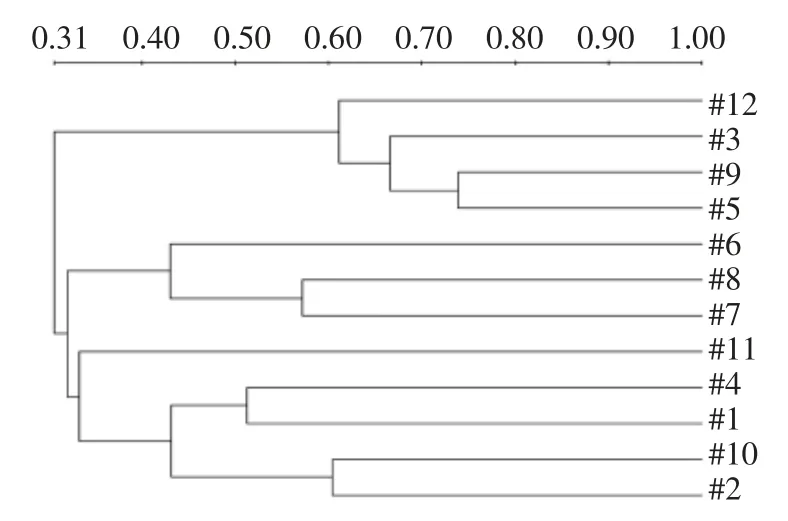
图4 样品中酵母菌群落结构相似性的聚类分析Fig.4 Cluster analysis of yeast community structure similarity in samples
据图4看出,所有样品在相似性40%水平上基本分为4 个类群,可知B4、B6、G1 和Y10 形成一类;Y7、Y8 和Y9 是第二类;G2、G3、B5 和K12构成第三类;X11 独自一类,不与任何一个样品聚为一类,这说明该样品有较为独特的种群结构,与其余样品的差异较大。来源于蒙古族牧民家庭的3 个发酵驼乳样品G1、G2 和Y7,分别在3 个类群里面,即使G1 和G2 来源于同一地区同种民族,相似性也仅为42%左右。采自不同地区维吾尔族牧民家庭的4 份发酵驼乳G3、B5、Y8 和Y10,B5和G3 相似性约为42%,Y8 和Y10 相似度小为24.2%。哈萨克牧民家庭的B4 和B6 之间相似性达到了66%,这可能是因为采样牧场接近且气候环境相近,也有可能是哈萨克牧民在制作发酵驼乳时有相似的处理过程(如发酵容器、发酵工艺和挤乳习惯等),导致相似性较高[25]。样品X11 采自精河小海子地区,与其余样品间酵母群落相似度极低,独成一类,这有可能与当地牧民保存酸乳“引子”的特别方式有关(在盐处理过的羊胃里保存数年),发酵历史远高于其它样品,这些原因造成酵母菌群的特殊性。B6 和Y10 相似性最高,达到73.9,二者采样地区不同,民族不同。总体来说,酵母菌群相似性与采样地区和民族之间的关系不是很大,发酵方式对其影响也不是很大。
2.2.4 多样性指标分析 变性梯度凝胶电泳得到的谱图中,条带数量是样品中酵母种类的一个表征,通过条带的相对亮度及迁移位置可计算多样性指数。根据DGGE 指纹图谱中条带的相对强度,分析样品中的酵母菌多样性指数(H)和丰富度(S)指标,分别见图5和图6。
由图5可知,不同样品之间酵母菌H 值有很大差异。Y10 样品的H 值最高,为3.41,表明其酵母菌种群多样性最高。而G3 样品的H 值最小,为1.92;G2 样品的H 值与G3 非常接近,为1.94。
由图6可知,各样品中酵母菌的丰富度S 值与H 值的变化趋势不完全一致,而H 值高的样品S 值也相对较高。Y10 样品的S 值最高为34,G3的S 值最低,仅为10。样品G2、G3、B4、B5 和X11的S 值比较接近,范围是10~14。
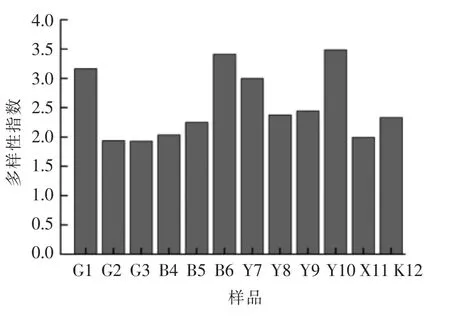
图5 不同样品DGGE 条带的多样性指数分布图Fig.5 Profiles of Shannon-Weaver index H for the samples

图6 不同样品的丰度指数分布图Fig.6 Profiles of S index for the samples
3 讨论
驼乳发酵过程中乳酸菌的乳酸发酵和酵母菌的酵母发酵不可或缺,乳酸菌在40 ℃左右最容易生长繁殖,而酵母菌在20~25 ℃的生长繁殖能力较强,因此温度低时酵母菌的酒精发酵占优势。而发酵驼乳酿制过程中往往在室温下进行,室温条件下酵母菌在驼乳发酵过程中占据优势。乳源酵母菌大多来源于原料乳,而环境、加工设备与周围环境中存在外源微生物[28]。乳是微生物最好的营养源,酵母菌来源复杂,它们可能对产品品质有加强作用,也可能对产品品质产生不好影响,同时有一部分又可能是致病菌。因此对牧民家庭生产的发酵驼乳中酵母菌分离、鉴定是抑制有害酵母,保证发酵驼乳安全并有利于有益酵母开发新产品的有效手段。
国内外关于发酵驼乳中优势酵母菌的报道不尽相同,刘玉华等[29]从新疆塔城和丰地区发酵驼乳中分离出东方伊萨酵母 (Issatchenkia orientails)、酿酒酵母;韩志国[30]从新疆乌鲁木齐市近郊5 份发酵驼乳分离发现发酵毕赤酵母为主要酵母菌。Lore 等[31]分离肯尼亚传统发酵驼乳中主要酵母菌为克鲁斯假丝酵母(Candida krusei);而倪慧娟 等[32]、Rahman 等[33]、Yam 等[34]分别从新疆伊犁、博州、巴州,新疆喀纳斯地区和伊朗传统发酵驼乳中分离出优势酵母菌株为马克斯克鲁维酵母和乳酸克鲁维酵母。
本试验利用PCR-DGGE 电泳技术发现马克斯克鲁维酵母(图2a 条带1)和单胞酿酒酵母(图2a 条带2)在全部样品(除K12)中都存在,而白地霉仅在B5 中存在。2014年,Akhmetsadykova 等[35]利用DGGE 电泳技术对哈萨克斯坦不同地区Shubat 酵母菌优势条带分析,不同地区的样品中都有单胞酿酒酵母(图2a 条带2),酿酒酵母(图2a 条带3)和马克斯克鲁维酵母(图2a 条带4),而布鲁塞尔德克酵母(Dekkera bruxellensis)和白地霉(图2a 条带5)只在一些样品中存在。由于新疆伊犁地区和哈萨克斯坦距离接近,环境气候相似,人文文化有一定的相通性,且发酵驼乳产地集中在这一地区,二者结果相似,说明试验结果可靠。
4 结论
1) 利用传统分离培养筛选出35 株酵母菌,生化鉴定结合形态观察,统计结果:8 株马克斯克鲁维酵母;15 株单胞酿酒酵母;9 株林德纳克勒克酵母;2 株酿酒酵母;1 株白地霉,其中单胞酿酒酵母是优势菌属。
2) DGGE 图谱中优势条带测序,经过比对知样品中蕴含马克斯克鲁维酵母、酿酒酵母、单胞酿酒酵母、乳酸克鲁维酵母、发酵毕赤酵母、解脂耶氏酵母和白地霉等酵母菌。
3) 对PCR-DGGE 指纹图谱分析可知,样品中酵母菌相似性范围是21.9%~73.9%,多样性指数H 在1.92~3.41 之间,丰度S 则在10~34 之间,在40%水平上样品基本聚为四簇。
