贮藏和解冻方式对大菱鲆嘌呤含量的影响
2020-08-03宋敏杰李婷婷任丽琨励建荣
宋敏杰 李婷婷 任丽琨 谢 晶 励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁省食品安全重点实验室 辽宁省高等学校生鲜食品产业技术研究院 辽宁锦州121013 2 大连民族大学生命科学学院 辽宁大连116600 3 上海海洋大学食品科技学院 上海201306)
人体嘌呤代谢紊乱或摄入量过多会使体内尿酸含量升高,从而引发高尿酸症,继而诱发痛风。近年来,由于生活水平的提高以及膳食结构的改变,我国痛风发病率逐年递增并向低年龄段发展[1-3]。研究表明,高尿酸症与高血压、高血脂等多种代谢紊乱综合症有密切联系[4]。痛风的治疗和预防,除服用药物外,最好的方法是通过控制饮食摄入来降低人体内的嘌呤含量,合理的饮食和健康的生活方式能够帮助缩短疗程[5]。此外,研究发现嘌呤每日摄入量<200 mg 的痛风治愈患者与每日摄入量>500 mg 的痛风治愈患者相比,前者2年内复发率远低于后者,表明痛风患者治愈后,长期低嘌呤饮食有助于预防痛风复发[6]。
大菱鲆是我国海水鱼类养殖的重要品种,养殖量已居世界第一[7]。研究表明,大菱鲆鱼体蛋白质中含8 种人体必需氨基酸,并且鱼皮中富含胶原蛋白,营养价值高,是优质的水产品[8-9]。李婷婷等[10-11]研究了-2 ℃微冻贮藏过程中大菱鲆品质的变化。结果显示,大菱鲆在微冻条件下货架期可达20 d;而在4 ℃冷藏过程中,货架期为12 d。井月欣等[12]探究冷冻解冻循环对大菱鲆品质的影响。王彩理等[13]通过研究发现混盐冰贮藏有良好的保鲜效果,在模拟冷链物流环节的动态条件下能够保持大菱鲆14~15 d 的货架期。不同的解冻方式对鱼肉有不同的影响[14-16]。目前针对不同贮藏和解冻方式对嘌呤含量的影响还没有深入的研究。本文研究贮藏和解冻方式对大菱鲆不同部位嘌呤含量的影响,旨在为痛风患者饮食提供参考,并为今后贮藏过程中嘌呤含量控制提供试验依据。
1 材料与方法
1.1 材料、试剂与仪器
大菱鲆,重(600±50)g,锦州林西水产市场。
腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤标准品(纯度均大于99.0%)、冰乙酸、三氟乙酸、甲酸、10%四丁基氢氧化铵均为色谱级,上海阿拉丁试剂有限公司;甲醇(色谱级),北京DIKMA 科技有限公司。
Agilent 1160 高效液相色谱仪,美国Agilent公司;DK-8D 型恒温水浴锅,上海一恒科技有限公司;分析天平,MET-TLER TOLEDO 公司;Milli-Q 超纯水系统,美国Millipore 公司。
1.2 试验方法
1.2.1 高效液相色谱分析条件的选择 参考崔素萍等[17]的方法稍作调整,色谱柱:Agilent ZORBAX Eclipse C18Plus(4.6 mm×250 mm×5 μm);流速:0.6 mL/min;柱温:24 ℃;进样量:6.0 μL;DAD 检测波长:254 nm。以四丁基氢氧化铵、冰醋酸、水以及甲醇的混合溶液作为流动相,将四丁基氢氧化铵、冰醋酸和超纯水按体积比1.5∶1.5∶997 混合,再将无水甲醇分别按体积分数0%,2.0%,3.0%,5.0%,7.5%,10.0%与其混合,研究不同甲醇比例对4 种嘌呤分离程度的影响,选择分离效果最优的比例,作为最终流动相。
1.2.2 嘌呤标准储备液的配制 用超纯水将4 种嘌呤标准样品配制成质量浓度为1 000 mg/L 的单一储备液(1 mol/L 的NaOH 助溶),等体积混合后稀释配制成250,125,50,25,5,0.5 mg/L 的6 个质量浓度,分别过0.22 μm 滤膜,在选定的色谱条件下测定嘌呤含量,得到峰面积。并以标准液质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.3 样品处理方法 参考凌云等[18]的嘌呤提取方法并稍作修改,具体操作如下:取0.2000 g 待测样品于试管中,按体积比加入三氟乙酸∶甲酸∶水=5∶5∶1,90 ℃水浴12 min,于80 ℃旋转蒸干,残余物用10 mL 流动相复溶。
1.2.4 精密度 对同一混标连续进样测定6 次,计算RSD,确定精密度。
1.2.5 重复性试验 将鱼肉绞碎,称取6 份,每份0.2000 g,按照1.2.3 节的方法处理,并采用1.2.1节的色谱条件上机检测,计算RSD。
1.2.6 方法回收率 采用已知浓度的样品,分别加入原浓度低倍、中倍和高倍3 个不同浓度的等体积嘌呤标准品,进行测定,并计算其添加回收率。
1.2.7 样品贮藏和解冻方法 将鲜活大菱鲆宰杀,取背部鱼肉、内脏、背部(深色一侧)及腹部(白色一侧)鱼皮4 种样品放入密封袋中。将这些样品分成3 组,每组包含背部鱼皮、腹部鱼皮、鱼肉和内脏。第1 组于4 ℃冷藏,第2、3 组于-18 ℃(模拟家用冰箱的贮藏温度)冰箱冷冻,并分别在第7 天和第14 天时将样品放在40 ℃水浴锅或15 ℃低速流水中解冻。测定第0 天、第7 天和第14 天3组样品中的嘌呤含量。
2 结果与分析
2.1 高效液相色谱条件的确定
通过探究不同甲醇含量对4 种嘌呤分离度的影响,确定当流动相为混合液(四丁基氢氧化铵∶冰醋酸∶超纯水=1.5∶1.5∶997,体积比)∶无水甲醇=95∶5 时,4 种嘌呤物质显著分离。
从图1a、b、c 中可看出腺嘌呤和鸟嘌呤峰面未完全分离,并且次黄嘌呤和黄嘌呤存在拖尾现象。当混合液与甲醇的体积比为95∶5 时,12 min内4 种嘌呤完全分离。随着甲醇体积分数提高,4种嘌呤峰保留时间缩短,峰高增加,分离度下降,出现杂峰。不同嘌呤的峰型差异明显,因此选择混合液与甲醇体积比95∶5 作为后续试验所用流动相的配比。
2.2 标准曲线
由图2~5 可知,该方法在0.5~250 mg/L 的范围内具有良好的线性关系,相关系数(R2)均大于0.999。
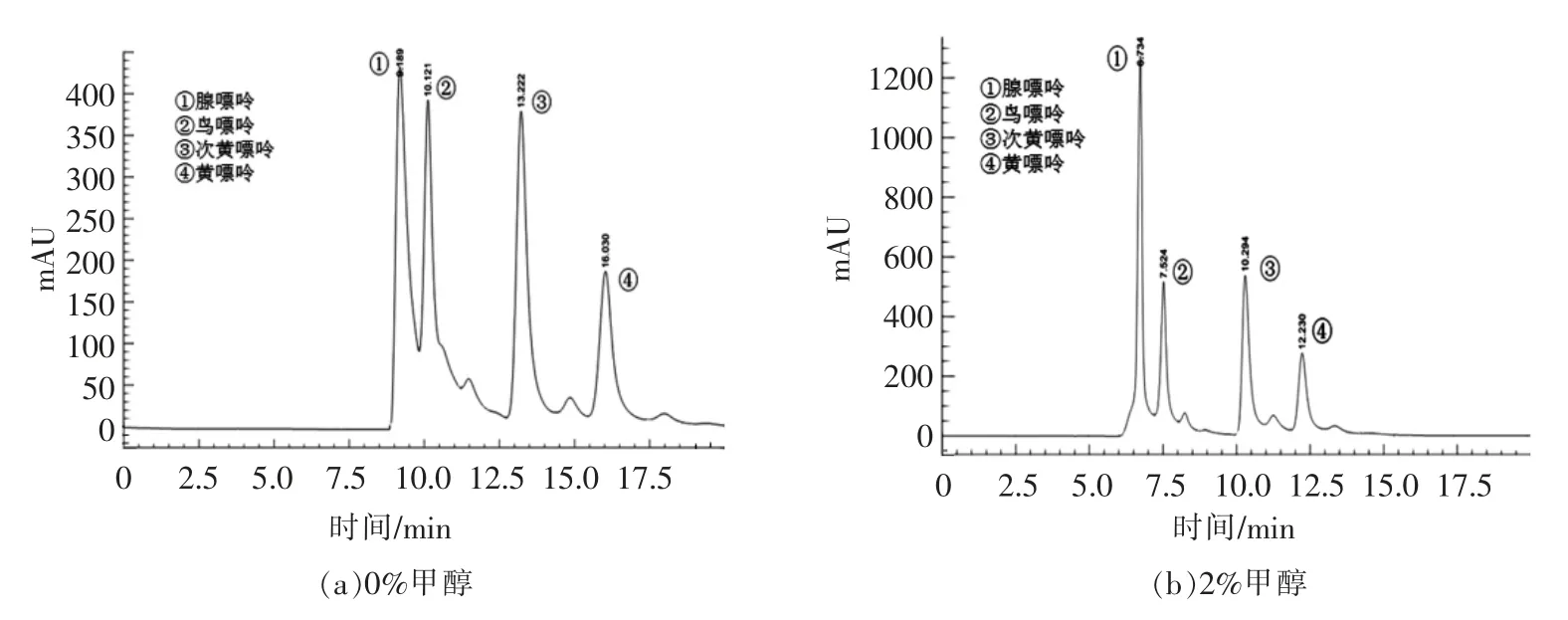
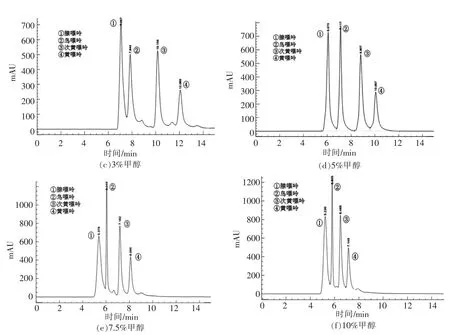
图1 不同体积分数甲醇对分离效果的影响Fig.1 Effects of different volume fraction of methanol on separation efficiency
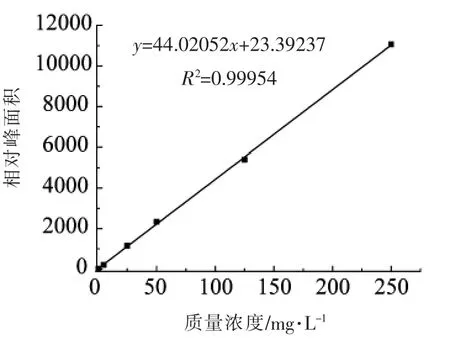
图2 腺嘌呤标准曲线Fig.2 Linear relationship of adenine
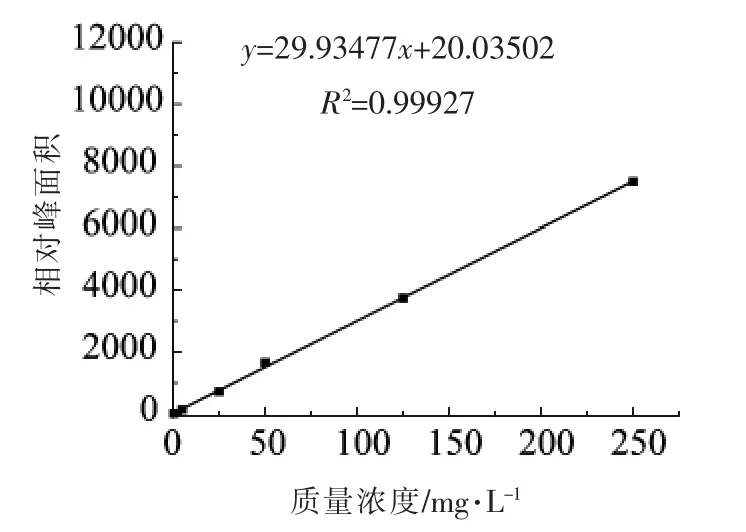
图3 鸟嘌呤标准曲线Fig.3 Linear relationship curve of guanine
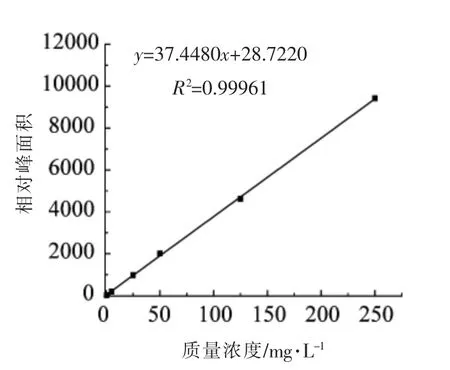
图4 次黄嘌呤标准曲线Fig.4 Linear relationship of hypoxanthine
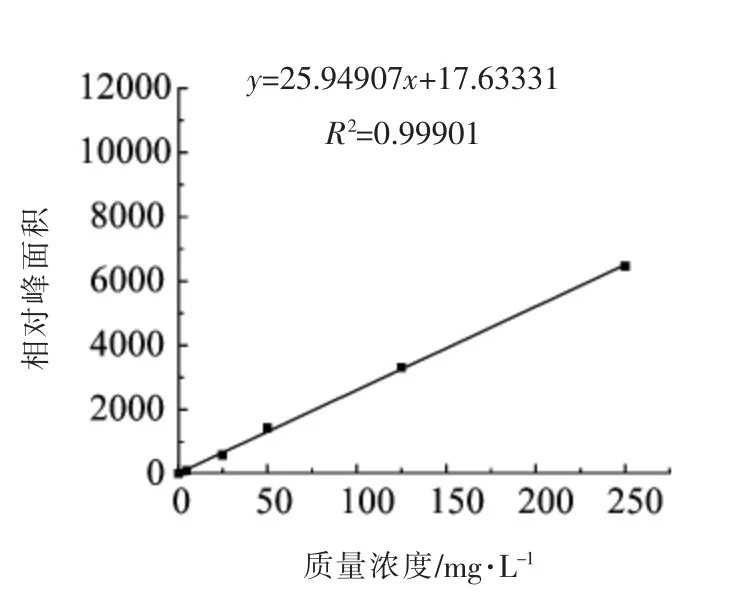
图5 黄嘌呤标准曲线Fig.5 Linear relationship of xanthine
2.3 方法精密度
对同一混标连续进样测定6 次,结果如表1所示,4 种嘌呤物质测得相对标准偏差(RSD)在0.25%~0.43%,表明仪器精密度良好。
2.4 方法重复性
重复性试验结果如表2显示,3 种嘌呤峰面积的RSD 分别为2.38%,4.81%,4.70%,0.00%,表明该方法重复性良好。
2.5 方法回收率
由表3可知,腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤的平均加标回收率依次为107.35%,97.71%,103.10%和98.31%,表明本试验所用的嘌呤提取方法样品损失少,准确度高。
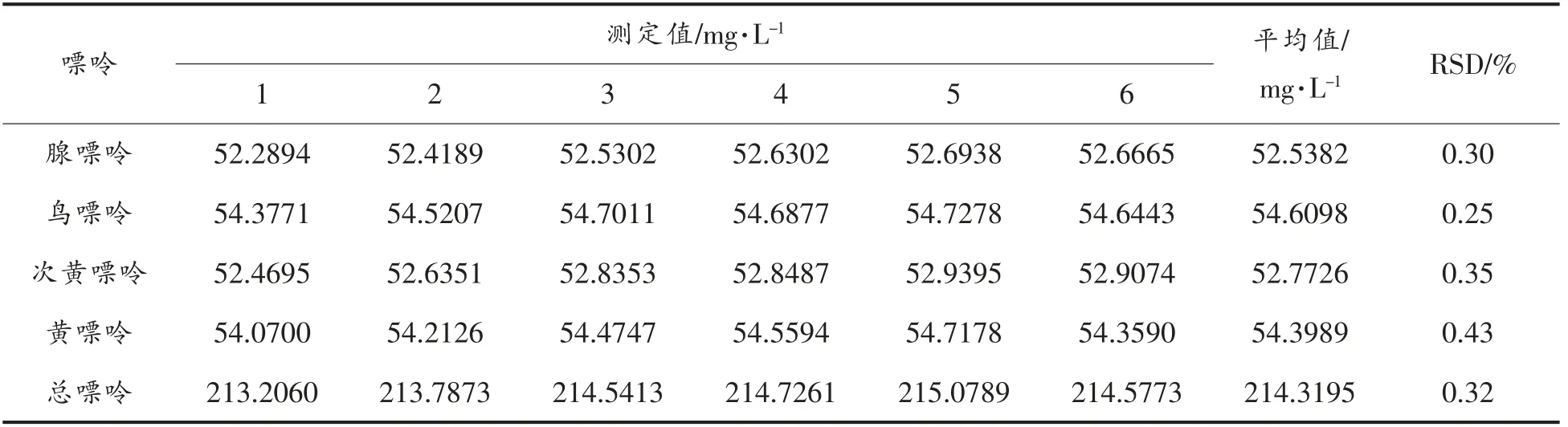
表1 精密度试验结果Table 1 The precision results
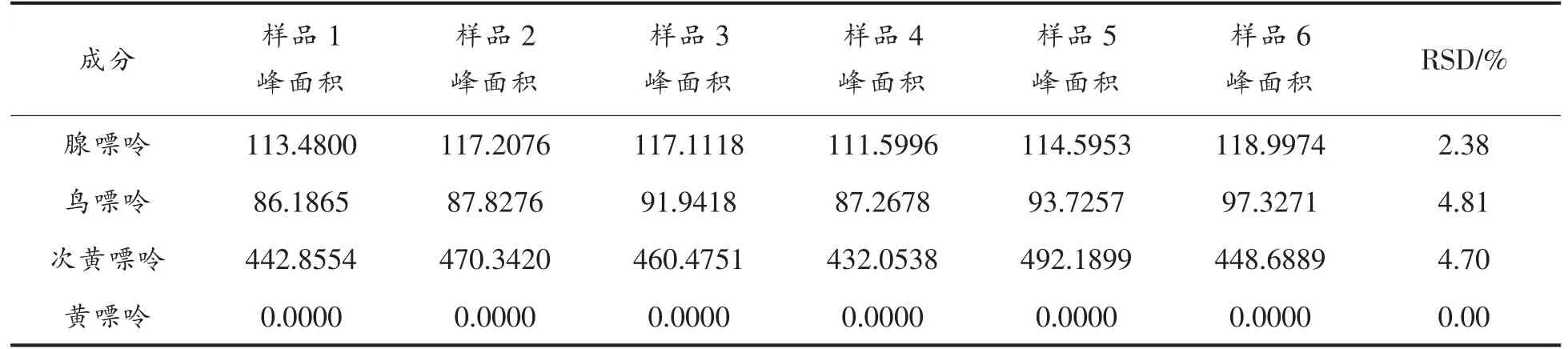
表2 重复性试验Table 2 Repeatability for four kind of purine
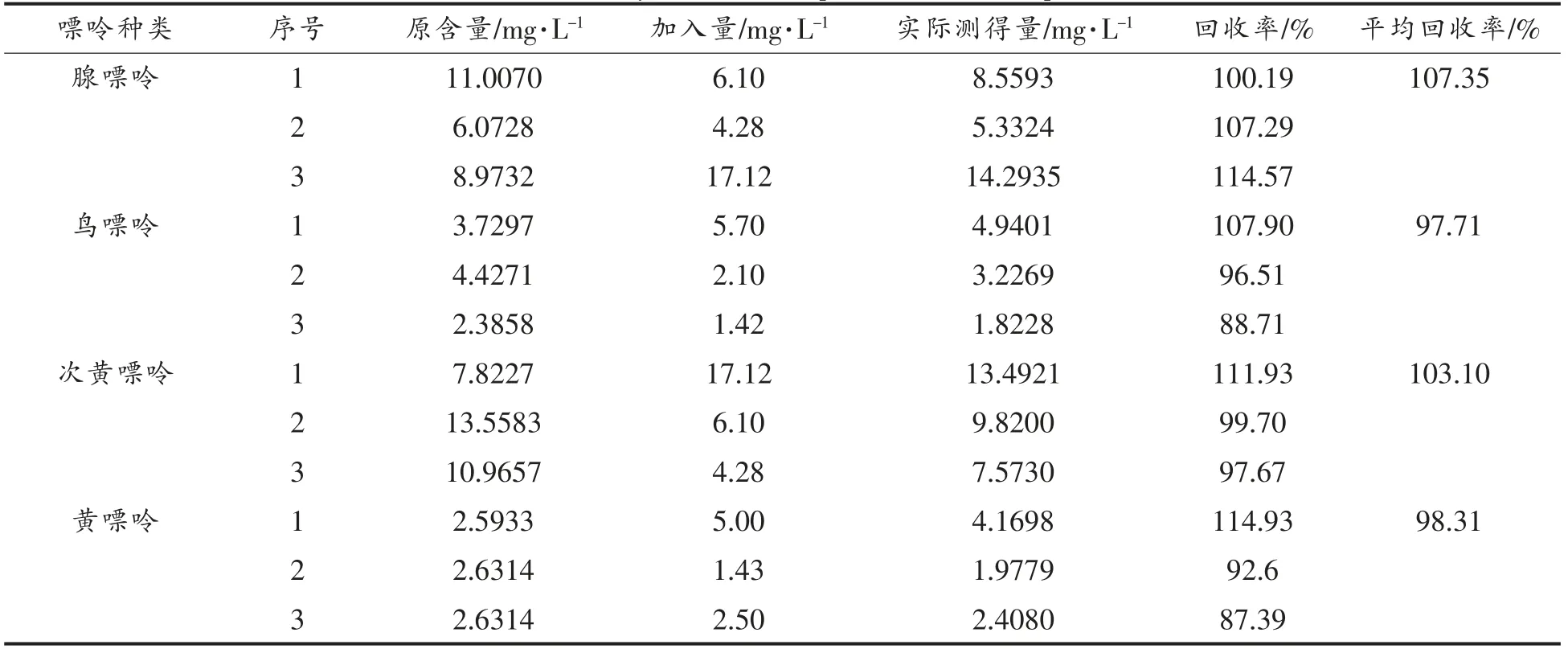
表3 加标回收试验结果表Table 3 Recovery rates of samples with added specimen
2.6 新鲜大菱鲆中各部位嘌呤含量
现有研究表明,腺嘌呤和次黄嘌呤是诱导痛风的主要嘌呤碱基[19]。由表4可知新鲜大菱鲆的鱼肉、鱼皮及内脏均未检测出黄嘌呤。此外,内脏和腹部鱼皮中未检测出次黄嘌呤。内脏中腺嘌呤含量高于其它部位,因此在食用时要彻底清除内脏。大菱鲆鱼皮含有丰富的胶原蛋白,有一定的抗疲劳作用[20],而其嘌呤含量较高,其中背部鱼皮嘌呤总含量高于腹部鱼皮。对于高尿酸血症及痛风患者而言,吃鱼的时候要避免食用鱼皮。新鲜鱼肉中的嘌呤总含量相对较低,为44.3853 mg/100 g。
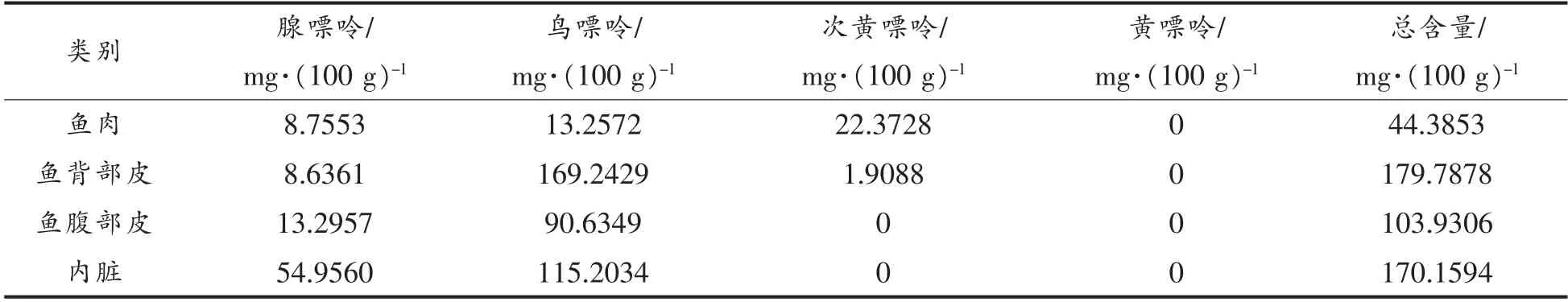
表4 新鲜大菱鲆中不同部位嘌呤含量Table 4 Purine content in different parts of fresh turbot
2.7 大菱鲆不同贮藏及解冻方式总嘌呤变化
如图6所示,不同贮藏温度及解冻方式下总嘌呤含量变化均呈先升后降的趋势,且经贮藏的鱼肉嘌呤总量比新鲜鱼肉高,其中流水解冻的鱼肉总嘌呤含量少于温水解冻。推测可能是由于流动水的渗入对鱼肉组织内部的嘌呤进行了稀释。此外,流动水的冲刷作用使鱼肉中的嘌呤不断向解冻环境中转移,导致样品中嘌呤含量减少。有研究表明,随着解冻温度的升高,鱼肉中肌纤维收缩,肌束空隙扩大,不易流动水向自由水转变,使肌肉组织中的自由水含量增大[21],从而转移了嘌呤,这也是40 ℃温水解冻鱼肉嘌呤含量减少的原因之一。
由图7~8 可知,鱼皮中的嘌呤含量始终呈下降趋势。如图8所示,4 ℃贮藏的大菱鲆腹部鱼皮中嘌呤总含量在第7 天的测试结果相比其它两组偏高。且由表4可知,鱼皮中嘌呤以鸟嘌呤为主,含有少量腺嘌呤。随着贮藏时间的延长,腹部鱼皮中出现次黄嘌呤和黄嘌呤,因此对鱼体内黄嘌呤的代谢需要进一步研究。
图9表示内脏中总嘌呤含量变化,结果表明4 ℃冷藏的内脏中嘌呤总含量较稳定,流水解冻样品在第7 天时总嘌呤含量减少,可能的原因是解冻过程中水分进入内脏导致嘌呤相对含量降低。研究发现,低温能够抑制酶活力,从而减缓嘌呤分解速度[22],这也可能是内脏中嘌呤含量增加的原因之一。
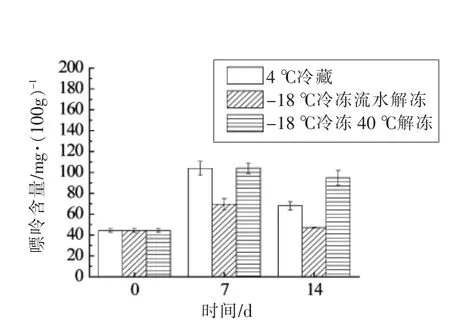
图6 鱼肉中的总嘌呤变化Fig.6 Total purine changes in the meat of fish
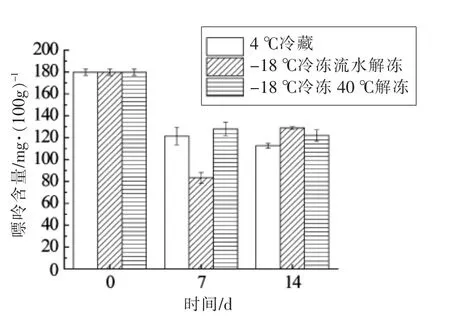
图7 背部皮中总嘌呤含量变化Fig.7 Total purine changes in fish’s dorsal skin
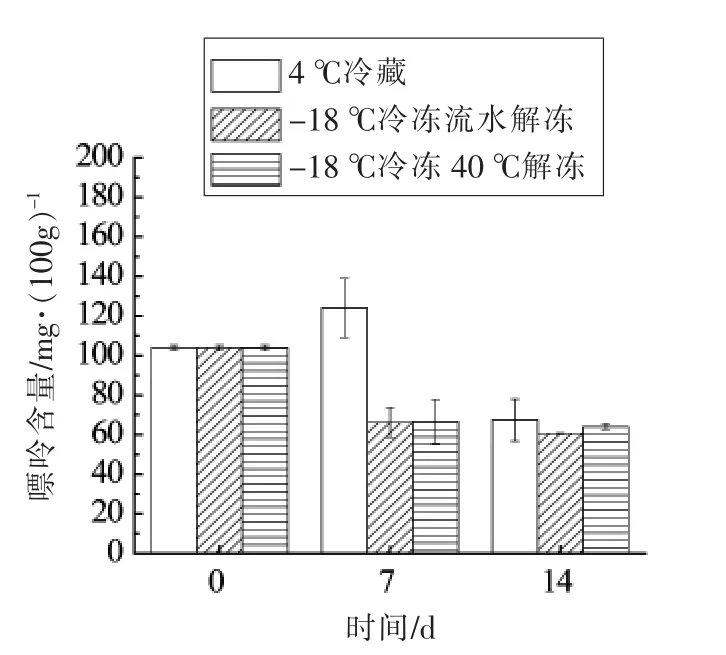
图8 腹部皮中总嘌呤含量变化Fig.8 Total purine changes in the abdominal skin of fish
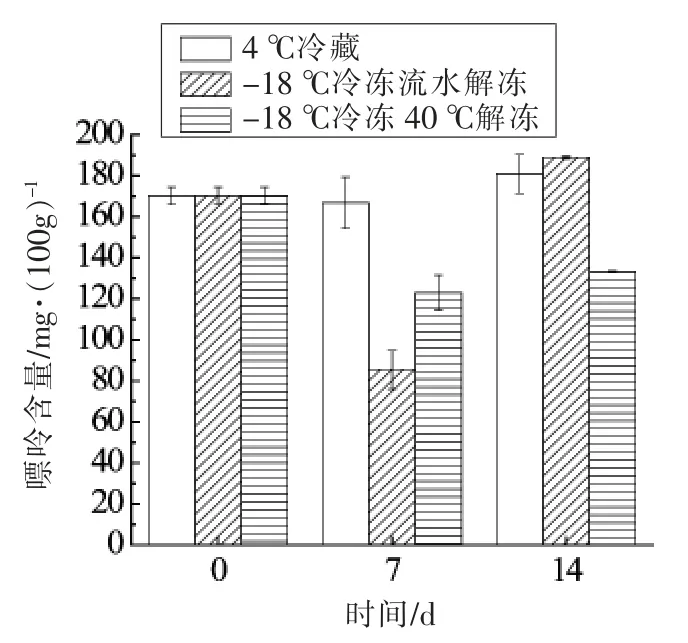
图9 内脏中总嘌呤含量变化Fig.9 Total purine changes in the viscera of fish
2.8 不同条件下鱼肉中4 种嘌呤碱基含量变化
大菱鲆鱼肉是其主要可食用部分,了解不同贮藏温度和解冻条件下嘌呤含量变化,有助于对冷藏时间进行控制,避开高嘌呤含量的时间段食用。如图10所示,4 ℃冷藏的鱼肉中,嘌呤总含量呈先增后减的趋势,变化最显著的是次黄嘌呤和黄嘌呤。第0 天的鱼肉中未检测出黄嘌呤,而冷藏7 d 后,黄嘌呤含量升高,可以推测其产生的主要阶段是鱼体死后的贮藏阶段。
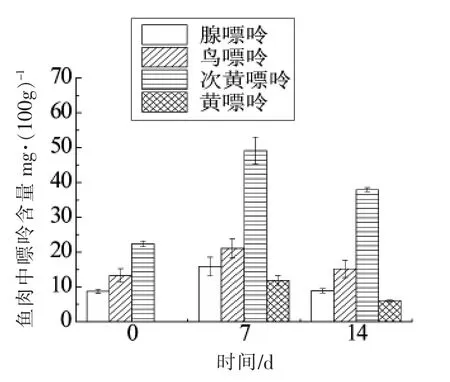
图10 4 ℃冷藏条件下鱼肉中4 种嘌呤变化情况Fig.10 Changes of four purines in the meat of frozen fish at 4°C
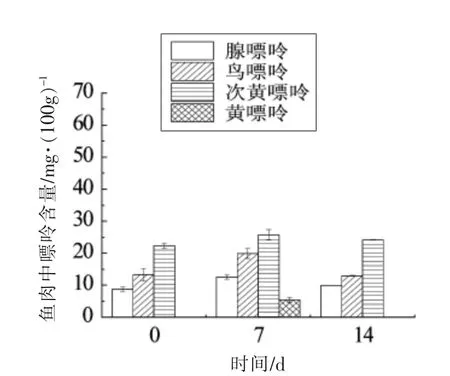
图11 流水解冻鱼肉中4 种嘌呤含量变化Fig.11 Change of four purines in the meat of fish by way of flowing water
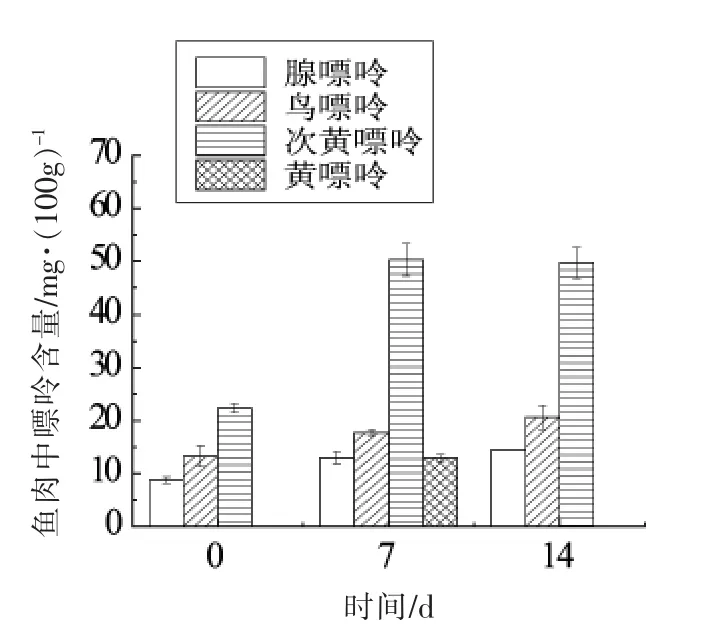
图12 40 ℃解冻条件下鱼肉中4 种嘌呤变化Fig.12 Changes of 4 purines in fish under thawing conditions at 40°C
由图11~12 可知,第7 天可检测出黄嘌呤,且黄嘌呤含量低于其它3 种嘌呤,第14 天未检测出黄嘌呤,可能是由于流水解冻使得嘌呤随着水分流失,致使测得含量减少。4 种嘌呤中次黄嘌呤含量较高,可能的原因是在低温环境下,鱼肉网状结构组织对Ca2+的吸收能力下降,使肌浆纤维内部的Ca2+浓度增加,Mg2+-ATP 酶被Ca2+离子激活,从而使ATP 加速降解[23],ATP 的一系列代谢会最终生成次黄嘌呤,致使次黄嘌呤含量上升。此外,经-18 ℃冷冻以及40 ℃温水浸泡解冻的鱼肉中黄嘌呤含量比流水解冻的鱼肉黄嘌呤含量高,推测温度与黄嘌呤生成有关。研究表明,黄嘌呤氧化酶是嘌呤代谢中的关键酶,其可催化次黄嘌呤向黄嘌呤转化。黄嘌呤氧化酶的最适温度为35 ℃左右[24-25],低温抑制了黄嘌呤氧化酶的反应活力,从而致使黄嘌呤含量降低。对比4 ℃贮藏的鱼肉,流水解冻的鱼肉中黄嘌呤含量较低也可进一步证实低温抑制黄嘌呤产生的推论。此外,对比图10和图11发现,-18 ℃冷冻的鱼肉在第7 天检测出的次黄嘌呤含量低于4 ℃贮藏的鱼肉,推测贮藏温度对次黄嘌呤有影响。经文献查阅发现,不同贮藏温度对次黄嘌呤含量的变化具有显著影响。温度越低,次黄嘌呤增加的速度越慢[26]。大菱鲆鱼肉是其主要可食用部分,了解不同贮藏温度和解冻条件下嘌呤含量变化,有助于对冷藏时间进行控制,避开高嘌呤含量时间段食用。
3 结论
本试验采用高效液相色谱法探究了不同甲醇配比对4 种嘌呤分离效果的影响,并确定最适流动相。检测了新鲜大菱鲆各部位的嘌呤含量,结果显示,鱼肉中的嘌呤含量低于大菱鲆鱼皮和内脏,新鲜鱼肉中嘌呤含量为44.3853 mg/100 g,相较其它可食用部分,鱼肉中的嘌呤含量最低。对冷藏和解冻方式进行初步研究发现,流水解冻在一定程度上抑制了黄嘌呤的生成,采用该方式解冻的鱼肉中黄嘌呤含量比温水解冻的鱼肉嘌呤含量低。随着贮藏时间的延长,鱼肉中的总嘌呤含量呈先上升后下降的趋势,鱼皮中总嘌呤含量随着冷冻时间的延长而减少,经过冷藏的鱼肉嘌呤含量高于新鲜鱼肉的嘌呤含量。因此为了降低高尿酸血症及痛风的发病率,建议消费者食用新鲜鱼肉或在-18 ℃冷冻条件下贮藏的鱼肉。
