耐盐促生菌筛选、鉴定及对盐胁迫小麦的效应
2020-08-03赵亚光张凤华
王 丹,赵亚光,张凤华
(石河子大学/新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832003)
土壤盐渍化是世界性问题,全球盐渍化土壤面积约为1×109hm2,而我国是世界盐碱地大国之一,盐渍化土壤总面积约为0.99×108hm2[1]。盐碱地由于含有大量硫酸盐、氯化物及重碳酸盐成分,导致土壤板结硬化、透水性差、肥力下降等而使农作物减产[2],已严重制约我国经济及农业的可持续发展。极端高盐、高碱环境导致动、植物难以生存,但却蕴藏着大量的耐盐碱、甚至嗜盐碱的微生物类群[3-5]。这些微生物的生命活动在改变盐碱地土壤理化性质的同时,也受土壤极端理化性质的影响,从而形成适应高盐碱环境的细胞结构、遗传特性和生理功能[6]。有些菌株除了具有耐盐碱能力之外并具有固氮、溶磷(无机磷、有机磷)、分泌植物激素的能力。例如丁琳琳等[7]从盐碱土中分离得到12株耐盐碱菌,发现这12株耐盐菌都具有产ACC脱氨酶、铁载体及溶磷能力,产IAA。许芳芳等[8]和Dai等[9]分别对内蒙古荒漠植物根际土壤和宁夏荒漠草原土壤进行耐盐碱细菌分离,发现所得耐盐碱细菌兼具固氮、解无机磷、产铁载体、产IAA、产ACC脱氨酶的功能特性。Komal等[10]从印度戈尔哈布尔盐渍化土壤中分离筛选出一株阴沟肠杆菌,该菌株在盐胁迫下可维持ACC脱氨酶活性,增溶磷酸盐,产吲哚乙酸、铁载体、氰化氢和胞外多糖。
小麦是全球主要粮食作物之一,盐胁迫可直接导致小麦品质和产量下降[11],Upadhyay等[12]和Pourbabaei等[13]研究表明,耐盐芽孢杆菌能提高盐胁迫小麦茎部及根系生物量。许芳芳等[8]将分离自荒漠地区的促生菌接种于盐胁迫处理小麦,发现其对小麦茎鲜重和干重有显著促进作用。李凤霞等[14]将耐盐促生菌株接种于小麦和燕麦种子,发现其对小麦、燕麦的根部具有明显促生长作用。马骢毓等[15]将从西藏阿里地区的披碱草根系及根际土分离筛选出的促生菌接种于披碱草,发现这些促生菌均在不同程度上增加了披碱草株高、根长及干重。赵龙飞等[16]研究发现,在250 mmol·L-1盐胁迫下,接种内生菌的小麦幼苗POD和CAT活性较对照均显著增加。以上研究表明,耐盐促生菌可以缓解作物盐毒害,对促进作物生产有着重要作用。因此,本研究拟从新疆玛纳斯河流域盐碱土壤中分离耐盐菌并将其接种于小麦,测定其在盐胁迫下对小麦生长及生理特性的影响,以期为耐盐促生菌的开发和小麦耐盐胁迫栽培提供参考依据。
1 材料与方法
1.1 菌株来源
土壤样品采集地点位于新疆玛纳斯河流域冲积扇缘地带十户滩镇(44°37′N,86°10′E),地处准噶尔盆地南缘,常年干旱少雨,蒸发强烈,年降水量约为110~200 mm,年蒸发量达1 500~2 000 mm,年平均气温6.6 ℃,≥ 10 ℃积温为 3 490 ℃,无霜期为148~187 d,属于典型的大陆性气候。于2018年4月以“五点法”进行取样,取样土层为0~20 cm,将采集土壤装入无菌自封袋中,低温保存迅速带回实验室。土壤类型为灰漠土,土壤基础养分状况见表1。

表1 供试土壤样品基础养分Table 1 Basic nutrient of soil samples tested
1.2 耐盐菌的分离与筛选
称取土样10 g放入含有玻璃珠的无菌水中,充分振荡使土颗粒分散,静置片刻。取上清用无菌水进行梯度稀释(1∶100;1∶1 000; 1∶10 000)后,吸取稀释液100 μL于含120 g·L-1NaCl的LB固体培养基上,涂布均匀于 30 ℃培养一周后,将形态不同的菌落在新鲜LB固体培养基平板上纯化,直至获得细菌纯培养物,并给菌株编码。
1.3 菌株促生性能测定及筛选
菌株分泌IAA能力测定采用Salkowski比色液法[17];溶磷能力采用钼锑抗比色法培养2 d后测定[18];铁载体能力测定采用CAS检测液法[19];固氮能力测定采用点接阿须贝培养基法[20]。 根据被测指标筛选目标菌。
1.4 菌株最佳培养条件的确定
将所筛选目标菌株接种于LB 液体培养基中培养16 h(30 ℃,180 r·min-1),作为种液。
1.4.1 最佳温度的确定
将种液按1%接种量接种于pH为7.0的LB液体培养基中,分别于24、27、30、33、36、39 ℃条件下,180 r·min-1培养24 h,以不接菌为对照,测定菌悬液在600 nm处OD值,3个重复。
1.4.2 最佳 pH的确定
将种液按1%接种量分别接种于pH值为6、7、8、9、10、11的LB液体培养基中,在最适温度条件下,180 r·min-1培养24 h,以不接菌为对照,测定菌悬液在600 nm处OD值,3个重复。
1.4.3 最佳 NaCl浓度的确定
将种液按1%接种量分别接种于NaCl浓度为4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%的LB液体培养基中,在最适温度、pH 条件下,180 r·min-1培养24 h,以不接菌为对照,测定菌悬液在600 nm处OD值,设置3个重复。
1.5 菌株形态、生理生化鉴定及菌株16S rDNA 序列分析
菌株形态观察及生理生化鉴定参考东秀珠[21]方法;菌株16S rDNA 序列分析参考马骢毓[18]方法。
1.6 小麦盐胁迫浓度的确定
小麦品种为新春5号,由石河子大学绿洲生态农业重点实验室提供。将清洗过的种子用0.1%的汞消毒5 min,并用无菌水冲洗5遍,用 5种不同浓度NaCl溶液(0、50、100、150、200 mmol·L-1)浸种8 h后,挑取大小均一的饱满种子排列在铺有滤纸的发芽盒(直径12 cm),3个重复,将其置于室温黑暗条件下萌发24 h,然后于14 h/10 h的光/暗条件下培养,7 d后测定幼苗地上及地下部分鲜重,以确定盆栽盐胁迫浓度。
1.7 菌株对盐胁迫下小麦生长的效应
将清洗过的种子用0.1%汞消毒5 min,并用无菌水冲洗5遍,挑取大小均一的饱满种子排列在铺有滤纸的发芽盒(直径12 cm),待露白后,将3粒种子播种于300 g无菌土(营养土∶蛭石为 3∶1)的花盆(上直径15 cm,下直径10 cm,高13 cm);向幼苗根部土壤中加入200 mL用1.6中确定的盐浓度稀释的菌悬液(108CFU·mL-1),每隔5 d加菌悬液一次,以不接菌的同样浓度盐处理为对照,5个重复,于25±2 ℃的人工气候室以14 h/10 h的光/暗条件培养,50 d后测植株株高、根长、株鲜重及根鲜重,并采用硫代巴比妥酸法测叶片脯氨酸(Pro)和根部丙二醛(MDA)含量[22],用氮蓝四唑光化还原法测定根系的超氧化物歧化酶(SOD)活性,用愈创木酚法测定根系的过氧化物酶(POD)活性[23],采用紫外分光光度计法测定根系的过氧化氢酶(CAT)活性[24]。
1.8 数据处理与分析
采用Excel 2016进行数据处理及制图表,采用 SPSS 20.0进行差异显著性分析。
2 结果与分析
2.1 耐盐菌的分离筛选及其促生特性
利用含120 g·L-1NaCl的LB固体培养基,从所采集的盐碱土壤样品中初步分离出12株耐盐菌,依次命名为wp-1、wp-2、…、wp-12。测定其生长特性及产吲哚乙酸(IAA)、铁载体、溶磷、固氮能力后发现,wp-8在含L-色氨酸的LB培养基中生长48 h后,其 IAA分泌量为15.90 mg·L-1;无机溶磷量和有机磷溶量分别为1.10 mg·L-1和0.34 mg·L-1;铁载体相对含量为0.68,接近0.5,说明其具有产铁载体能力;不具有固氮能力。确定 wp-8为耐盐高效促生菌。
2.2 菌株最佳培养条件的确定
2.2.1 最佳温度的确定
由图1可知,菌株wp-8在温度为24~39 ℃培养时,菌液OD600值呈先升后降趋势,以30 ℃时最大,且显著高于其他处理,确定其为最适生长温度。
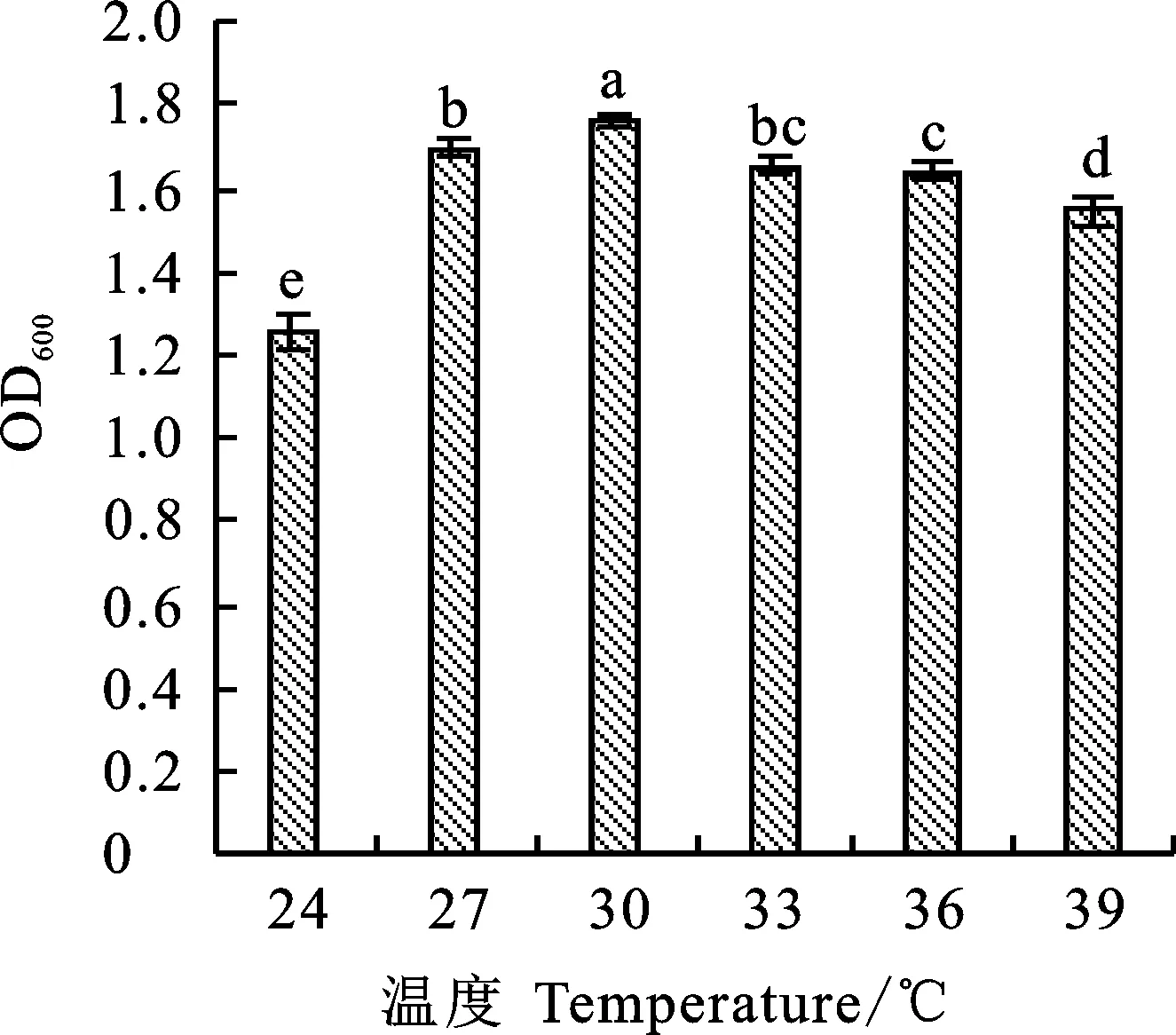
图柱上不同小写字母表示显著差异(P<0.05)。下同。
2.2.2 最佳 pH的确定
由图2可知,不同pH条件下,菌株wp-8菌液OD600值差异较大。当pH为6~11时,菌液OD600值随 pH升高先增后减,pH为9时最大,pH为10与pH为9时的差异不显著,确定最适生长pH为9~10。由此可知,wp-8在碱性环境下生长状况较佳。
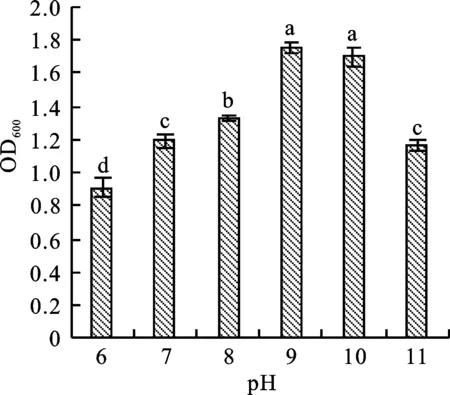
图2 pH对菌株生长特性的影响
2.2.3 最佳 NaCl浓度的确定
由图3可以看出,不同浓度NaCl对菌株wp-8生长影响较明显。当NaCl浓度为4%~7%时,菌液OD600值均大于1.8,以在5%和6% 的值较大,二者差异不显著;当NaCl浓度为7%~16%时,菌液OD600值下降趋势明显,当NaCl浓度为16%时,wp-8生长受到严重抑制或停止生长。说明菌株wp-8耐盐范围为4%~15%。
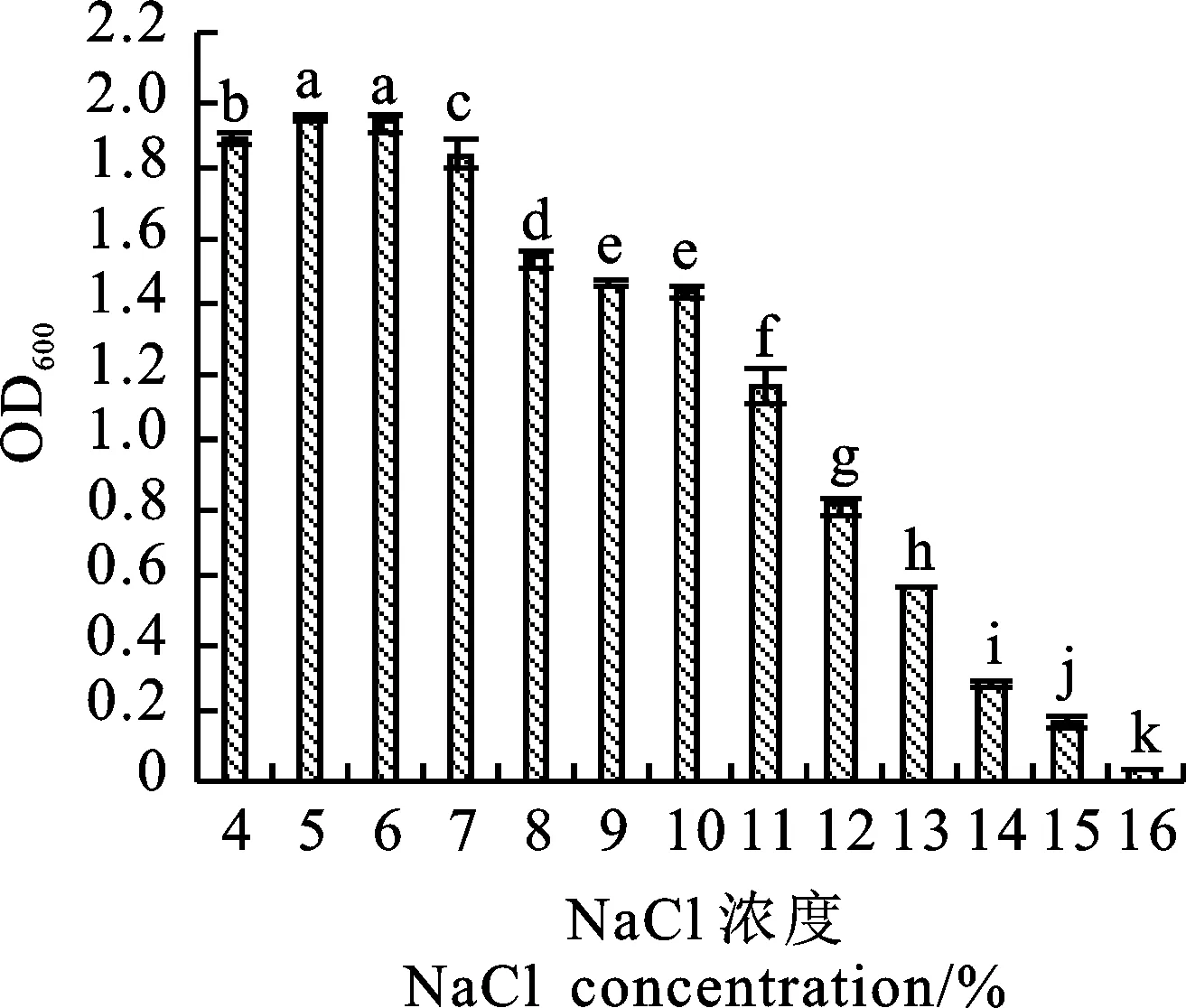
图3 NaCl浓度对菌株生长特性的影响
2.3 菌株wp-8形态、生理生化鉴定及菌株16S rDNA 序列分析
菌株wp-8菌体形态为球状,菌落直径约为1.0~1.2 mm,呈浅黄色,边缘整齐光滑,经革兰氏染色确定该菌株为革兰氏阳性菌。基于16S rDNA 基因序列片段比对(图4),菌株wp-8 与NesterenkoniarhizosphaeraeEGI 80099相似性达99%,表明其具有较高同源性,结合生理生化鉴定结果(表2)初步确定菌株wp-8为Nesterenkoniarhizosphaerae。
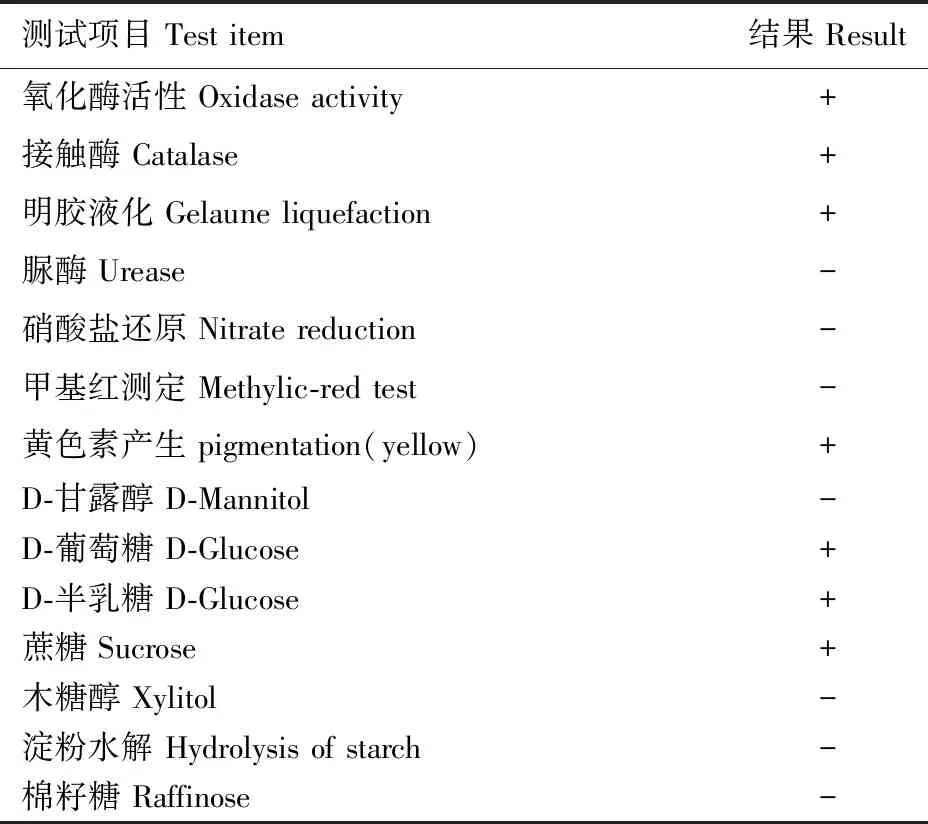
表2 菌株wp-8主要生理生化特征Table 2 Physiological and biochemical characteristics of wp-8
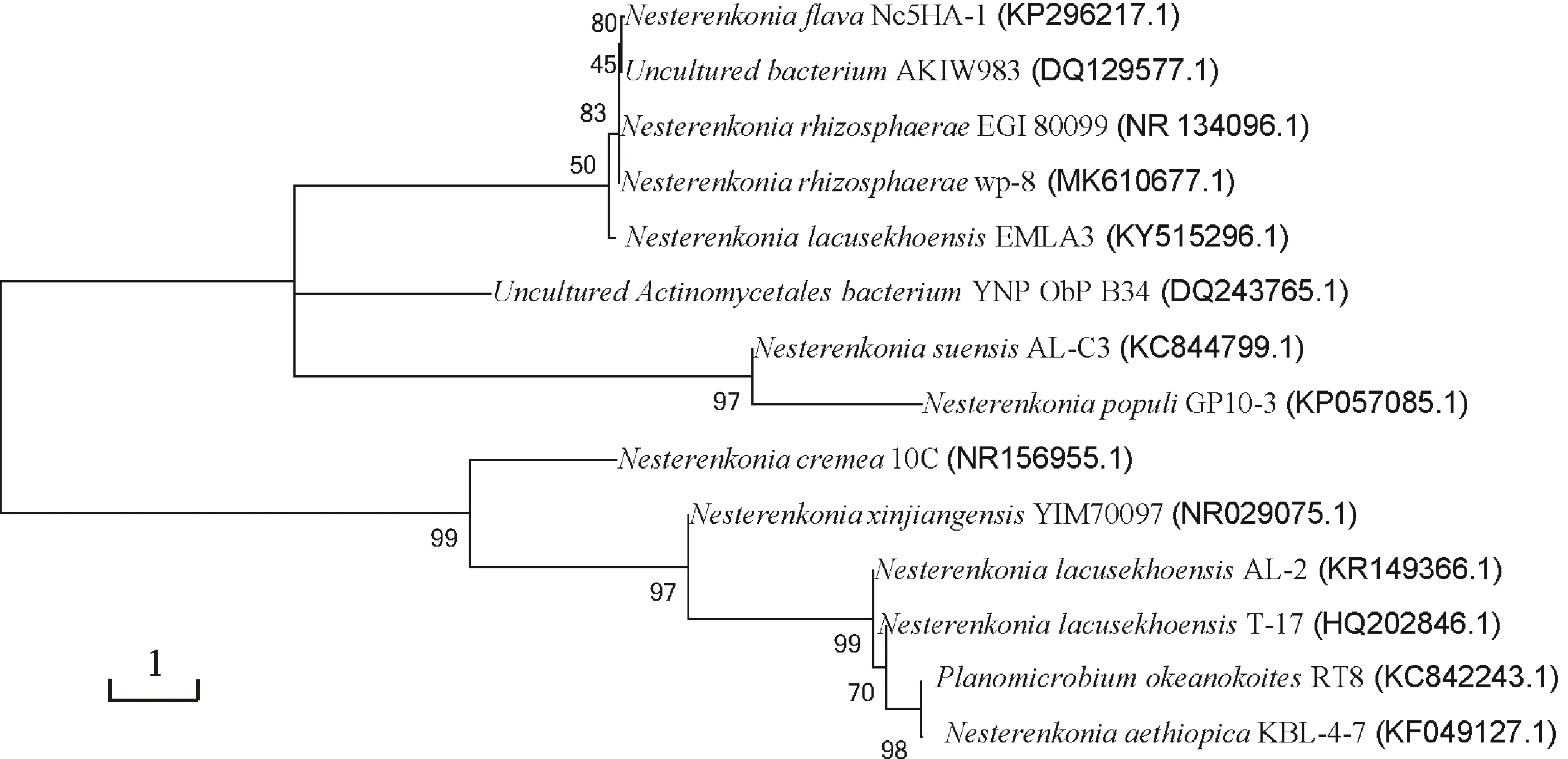
图4 菌株wp-8 16S rDNA系统发育树
2.4 最低盐胁迫浓度的确定
不同盐浓度处理小麦种子8 d后,幼苗鲜重结果如表3,在0~200 mmol·L-1盐浓度胁迫下,随着盐浓度的增加,小麦幼苗植株鲜重和根鲜重呈下降趋势。100 mmol·L-1与0 mmol·L-1处理间植株鲜重有显著差异,但根鲜重无显著差异,与50 mmol·L-1处理植株鲜重、根鲜重均无显著差异。150 mmol·L-1、200 mmol·L-1处理较50、100 mmol·L-1处理植株鲜重和根鲜重显著下降(P<0.05),而150 mmol·L-1、200 mmol·L-1处理间无显著差异。确定150 mmol·L-1NaCl为最低盐胁迫浓度。
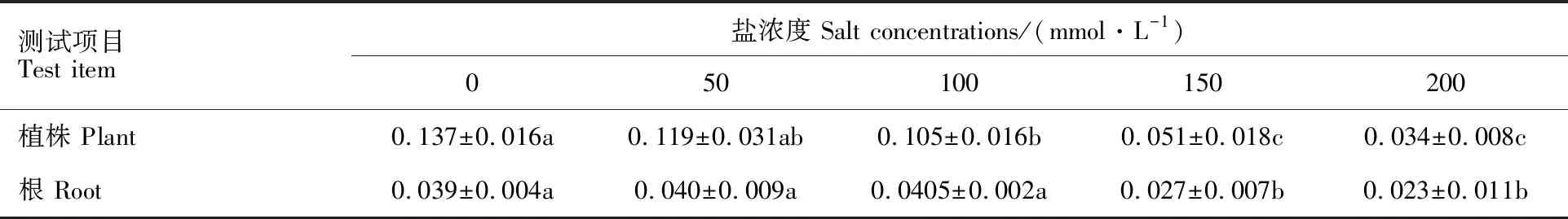
表3 不同盐浓度处理对小麦幼苗株鲜重及根鲜重的影响Table 3 Effects of different salt concentrations on fresh weight of wheat seedlings g·plant-1
2.5 盐胁迫下菌株wp-8对小麦幼苗生长特性的影响
由表4可知,150 mmol·L-1NaCl胁迫条件下,wp-8菌悬液处理的小麦幼苗在生长至50 d时,其株高、根长、根重均显著高于对照(P< 0.05),株高增加2.83 cm,提高9.35%;根长增加6.00 cm,提高27.15%;根鲜重增加0.06 g,提高150.00%。株鲜重有所提高,但差异不显著。说明菌株wp-8对小麦幼苗盐胁迫具有良好的缓解效应,尤其对根系的发育。

表4 菌株wp-8对150 mmol·L-1盐胁迫下小麦生长的影响Table 4 Effect of wp-8 strain on growth of wheat under 150 mmol·L-1salt stress
2.6 盐胁迫下菌株wp-8对小麦幼苗生理特性的影响
由表5可知,盐胁迫下接种菌株wp-8可显著降低小麦幼苗根部MDA含量,较对照下降 29.55%,说明接种菌株wp-8可以明显减缓盐胁迫对小麦幼苗膜系统的伤害程度;Pro含量较对照显著增加(P<0.05),提高了10.03%,表明菌株wp-8能够提高盐胁迫小麦幼苗的脯氨酸含量。菌株wp-8处理小麦幼苗根部的SOD、POD、CAT活性均显著高于对照(P< 0.05),分别较对照提高160.63%、30.41%、44.93%,其中SOD活性增加程度最大。说明菌株wp-8能够有效调节在一定的盐胁迫条件下小麦幼苗的保护酶系统,推测可缓解小麦幼苗受伤害程度。
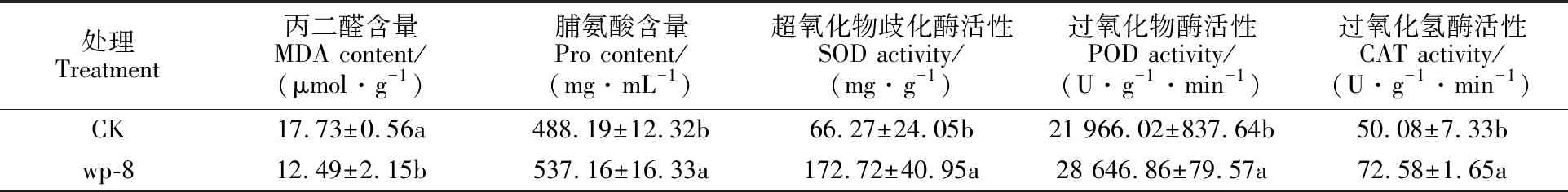
表5 菌株wp-8对150 mmol·L-1盐胁迫下小麦生理特性的影响Table 5 Effects of wp-8 strain on physiological characteristics of wheat under 150 mmol·L-1salt stress
3 讨 论
盐胁迫是盐碱地抑制植物生长、降低农作物产量的最常见非生物胁迫。从盐碱地挖掘耐盐促生菌种资源,利用其改良盐碱土壤、促进植物生长是解决盐碱地问题的有效途径之一。大量研究表明,来源于盐碱地的土壤微生物可以通过自身代谢产生植物激素,且具溶磷、固氮等促生特性[10, 25-26]。本研究从新疆盐碱土壤中筛选出耐盐度高达15%的菌株wp-8,该菌株具有部分促生特性,其吲哚乙酸分泌量为15.90 mg·L-1,铁载体相对含量为0.68,溶有机磷及无机磷量分别为0.34 mg·L-1和1.10 mg·L-1,鉴定该菌为Nesterenkoniarhizosphaerae。
促生菌(PGPR)在盐胁迫下通过诱导植物建立耐受机制,提高植物抗盐性,促进植物生长。研究发现,将产IAA的假单胞菌接种于盐胁迫下苗木种子后,芽长较对照增加52%,根长增加40%[27]。另外,IAA可以通过诱导 ACC 脱氨酶的活性,降低乙烯浓度,促进植物快速生长。将耐盐阴沟肠杆菌(Enterobactercloacae)接种于油菜,发现油菜体内 IAA量增加而乙烯量减少[28]。部分PGPR自身含有ACC 脱氨酶,可分解乙烯合成前体ACC,使植物抵抗盐损伤。将具耐盐性的阿氏芽孢杆菌(B.aryabhattai)接种于小麦,发现对小麦幼苗生长具有促进作用[29]。PGPR还可间接分泌铁载体减缓植物在盐逆境中毒害作用,同样其溶磷性能也是促进作物生长重要因素之一,通过溶解土壤中难溶性磷,提高植物对磷的吸收。将溶磷量达424.85 g·mL-1促生菌RW8接种白三叶种子,可显著增加白三叶幼苗鲜重和干重[30]。将具溶磷和产铁载体能力的PGPR接种于柠条种子,发现能显著促进柠条幼苗生长,尤其促进地下部的生长[31]。本研究发现,接种促生菌wp-8可显著提高小麦幼苗株高、根长、根重(P<0.05)。小麦幼苗地下部分(根长和根鲜重)的增长率均高于地上部分,这与Glick[32]研究结果一致,可能因为植物根部是在逆境中直接感受信号的部位,菌株wp-8通过分泌植物激素IAA促进小麦根系延伸,使根系吸收更多营养物质进而促进地上部分生长[33]。推测小麦抗盐性提高是菌株分泌生长素和溶磷能力的共同作用,但其促生作用是否与ACC 脱氨酶活性有关还有待研究。
盐胁迫下植物体内产生活性氧、营养平衡遭到破坏、胞内紊乱、细胞膜破裂等导致植物体内一些酶功能丧失,表现出植物生长缓慢、代谢受阻,严重时可造成叶片萎蔫甚至死亡[34]。研究表明,盐胁迫下促生菌(PGPR)通过分泌渗透保护物质提高植物抗盐性,脯氨酸含量变化最大,它可通过增加胞内溶质浓度、调节渗透平衡减缓盐对植物的毒害,并自身启动酶促系统(SOD、POD、CAT)以清除过多活性氧来抵御外界环境,有效改善盐胁迫下植物生长及生理代谢过程[35-37]。本研究中,菌株wp-8接种于盐胁迫小麦后,小麦幼苗MDA含量显著降低,脯氨酸含量及SOD、POD、CAT活性显著提高,该结果与国内外报道的接种促生菌可提高作物抗盐性、促进作物生长的结果一致[38-40]。但本研究仅说明在150 mmol·L-1NaCl浓度胁迫下接种wp-8可缓解小麦受氧化性损伤,在更高浓度盐胁迫下菌株wp-8是否发挥其保护功能有待进一步研究。
