小麦灌浆相关基因 TaGIF1的克隆及表达分析
2020-08-03田小萍王光浩吉万全
田小萍,王光浩,张 宏,2,吉万全,2
(1.西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.农业部作物基因资源与种质创制陕西科学观测实验站,陕西杨凌 712100)
小麦灌浆速率以及产量相关性状是由多个基因控制的复杂数量性状,利用现代分子生物学技术手段,对籽粒灌浆相关基因进行研究具有重要意义[1-2],但是对于小麦灌浆方面的研究进展较为缓慢。
蔗糖不仅是植物体内碳水化合物运输的主要形式,而且越来越多的证据表明,蔗糖可以在基因表达水平上对细胞内的代谢进行调控[3-4]。蔗糖只有被转化为己糖才能够被利用,这一过程主要受蔗糖合成酶(sucrose synthase,SS)和蔗糖转化酶(invertase,INV)的催化。INV根据其酸碱度及亚细胞定位可分成3类,即中性/碱性的细胞质蔗糖转化酶(cytoplasmic invertase,CIN),酸性的细胞壁蔗糖转化酶(cell wall intertase,CWIN)和液泡蔗糖转化酶(vacuole intertase,VIN)[5]。CWIN属于INV的一种,以离子键形式结合于细胞壁上,不可逆地催化蔗糖转化成果糖和葡萄糖,是蔗糖卸载的关键酶之一[6-7],同时,CWIN还决定了种子中碳水化合物的组成及其发育的命运[8]。因此,研究小麦中的INV基因对揭示小麦生长发育过程中的基因调控和小麦籽粒灌浆相关机制具有重要意义。
GIF1是首次从水稻中通过图位克隆获得的,参与水稻灌浆的关键基因[9]。该基因编码一个CWIN,在发育籽粒背部的维管束中特异表达,转基因结果表明该基因对水稻产量起正向调控作用[10]。GIF1基因在植物中通过调控胚和胚乳中糖的组分,决定种子发育最终的命运[8,11]。玉米CWIN活性调节因子ZMMRP-1特异表达于玉米胚乳转移层细胞,该过程主要通过糖来调控,从而调控下游转运基因[12],同时也是参与细胞壁组装和生长的关键酶[13];超表达该基因可使穗增大,籽粒直径增大,穗粒数增多,从而使玉米产量上升[14]。GIF1基因在水稻、玉米等作物中对调控籽粒灌浆有重要作用,而在小麦中未见报道。对小麦中TaGIF1基因的研究有利于进一步加深对小麦灌浆调控机制的了解。本研究首次在小麦中克隆得到TaGIF1-2A基因,通过比较不同大小粒小麦品种中TaGIF1-2A基因组序列,分析该基因单倍型,并对不同单倍型编码的蛋白质序列进行比对,以期为研究该基因表达调控机制提供依据;同时在大、小粒材料中分别克隆该基因启动子序列,进行启动子元件的分析;利用qRT-PCR技术检测了该基因在幼穗、籽粒及颖壳中的表达模式;通过构建PE-TaGIF1-GFP融合表达载体,观察基因亚细胞定位。对小麦大小粒材料中该基因可能发挥的功能进行了探讨,为深入研究TaGIF1基因在籽粒灌浆期的作用奠定了基础。
1 材料与方法
1.1 试验材料
全国不同地区大粒材料10份(品冬34、小偃54、西昌19、长麦5973、济麦22、中麦875、山农8355、西科麦6号、内乡5号、周8425B),平均千粒重大于50 g;小粒材料5份(陕麦159、合作4号、西农509、克丰3号、新冬26号),平均千粒重25 g左右,均由西北农林科技大学农学院提供。在2018年小麦生育期内,取大田种植的品冬34(千粒重74 g)和陕麦159(千粒重32 g)幼穗、籽粒和颖壳样品,所取幼穗的生育时期和大小包含拔节期1~2 cm、孕穗期4~7 cm、抽穗期;籽粒采自花后3、6、9、12和15 d(days after anthesis,DAA);颖壳样品包含3、6、12、15 DAA的组织。在冰上迅速剥离样品幼穗、籽粒和颖壳,在液氮中冷冻,-80 ℃保存备用,每个样品设置3次重复。本氏烟草,以及亚细胞定位载体PE-GFP由(西北农林科技大学)陈新宏老师实验室馈赠。
1.2 基因组DNA、总RNA的提取与cDNA的 合成
采用CTAB法[15]提取所有15份大小粒材料的基因组DNA。此外,利用TRIzol试剂盒提取品冬34和陕麦159的总RNA,经DNase I纯化后用灭菌的DEPC H2O溶解,利用1%琼脂糖凝胶电泳检测RNA的完整性,于-80 ℃保存备用。采用Takara公司产品PrimeScript II进行cDNA第一链的合成。
1.3 小麦 TaGIF1-2A基因的克隆
以大粒品种品冬34和小粒品种陕麦159的cDNA为模板,TaGIF1-F/R(表1)为引物,利用TaKaRa公司的PrimeSTAR HS高保真酶进行PCR扩增,反应程序为98 ℃ 10 s,58 ℃ 5 s,72 ℃ 3 min,循环34次,72 ℃延伸5 min。结合cDNA末端快速扩增技术(Rapid amplification of cDNA end,RACE),设计TaGIF1-3′GSP和TaGIF1-5′GSP特异引物,进行TaGIF1-2A基因cDNA全长扩增。以15份大、小粒小麦品种的基因组DNA为模板,利用TaGIF1-F/R(表1)引物和前反应程序一样,进行PCR扩增,用于TaGIF1-2A基因的单倍型分析。PCR产物的回收纯化、转化鉴定和测序等参照程 娇等[2]的方法 进行。

表1 试验所用引物Table 1 Primers used in experiment
1.4 TaGIF1基因启动子的克隆
利用测序获得的TaGIF1-2A序列,比对到URGI(Unité de Recherches en Génomique Info)数据库中对应的物理位置,选取起始密码子上游约2 500 bp的启动子序列,设计TaGIF1-promoter F/R引物分别以品冬34和陕麦159基因组DNA为模板进行扩增。PCR扩增反应程序为 98 ℃ 10 s,60 ℃ 5 s,72 ℃ 3 min,循环34次,72 ℃延伸5 min。
1.5 生物信息学分析
通过NCBI(https://www.ncbi.nlm.nih.gov)在线软件ORF Finder分析基因序列获得完整开放阅读框,使用Primer Premier 5.0软件翻译为氨基酸序列,登陆网站ExPASy Compute pI/Mw(https://www.expasy.org/resources)对编码蛋白的理化性质进行预测和分析;蛋白的保守结构域通过NCBI Conserved Domain Search分析获得;用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白质的二级结构分析;信号肽预测分析通过TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)和SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP- 3.0)进行;采用ProtScale(https://web.expasy.org/protscale)分析蛋白疏水性/亲水性;利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2)进行亚细胞定位预测;用NCBI的BLAST程序进行TaGIF1蛋白同源序列的比对搜索。使用MEGA 7.0软件中Cluster进行序列比对,然后用邻接法(Neighbor-Joining)构建系统进化树(BootStrap=1000)。通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行启动子顺式作用元件的预测。
1.6 实时荧光定量PCR
基于克隆得到的TaGIF1-2A以及URGI数据库中TaGIF1-2B、TaGIF1-2D同源基因序列,分别设计专化性定量引物进行qRT-PCR表达分析,内参基因使用持家基因TaActin(表1)。参照FastKing RT Kit(With gDNase)(TIANGEN公司)试剂盒说明书,采用两步法进行反转录合成cDNA。实时荧光定量PCR采用TIANGEN试剂公司的SuperReal荧光定量预混试剂盒(SYBR Green),于Q7实时定量PCR仪上进行操作。同时将TaGIF1-2A核酸序列提交至多倍体小麦表达分析数据库WheatExp中,以Zadoks[16]和Choulet等[17]方法计量小麦生育时期。最终分析TaGIF1-2A、TaGIF1-2B、TaGIF1-2D在小麦幼穗、籽粒及颖壳发育阶段的表达模式。基因的相对表达量使用2-△△Ct方法计算,将第一个取样时间点的相对表达量作为参照。
1.7 烟草转化法
用含有同源臂的GFP引物扩增TaGIF1-2A基因的全长CDS序列,并与用Spe I单酶切的线性化载体PE::GFP进行重组反应,转化至大肠杆菌DH5α感受态细胞,挑取阳性克隆进行小量培养,然后提取质粒转化至农杆菌GV3101(本实验室保存)。将含有重组质粒PE-TaGIF1-GFP的农杆菌28 ℃振荡培养至对数生长期,1 788.8 r·min-1离心5 min收集菌体,重悬于渗透缓冲液(10 mmol·L-1MgCl2,10 mmol·L-12-(N-吗啉代)乙磺酸,pH 5.6和200 μmol·L-1乙酰丁香酮)[18]中,调整菌液浓度使其达到OD600= 0.6左右,室温静置3 h。利用本氏烟草开展瞬时转化,48 h后在激光共聚焦显微镜下观察、照像,检测波长为488 nm。
2 结果与分析
2.1 目的基因的扩增及命名
以品冬34、陕麦159的cDNA为模板,利用特异引物序列TaGIF1-F/R(表1)对其进行PCR扩增,在2 000 bp处得到与预期大小一致的目的条带(图1-A)。经切胶回收测序,将所得序列与URGI中对应的TraesCS2A02G295400、TraesCS2B02G311900、TraesCS2D02G293200序列进行比对,结果显示与TraesCS2A02G295400最为接近,只存在4个SNP差异位点,相似度高达99.8%,将其命名为TaGIF1-2A。TaGIF1-2A与TraesCS2B02G311900、TraesCS2D02G293200通过比对分析,相似度分别为96.5%、97%,将其分别命名为TaGIF1-2B、TaGIF1-2D。基因结构分析表明,TaGIF1-2A编码区为1 986 bp,编码661个氨基酸残基,相对分子质量约为73.87 kD,等电点为9.14;TaGIF1-2B编码623个氨基酸,相对分子质量69.73 kD,等电点9.28;TaGIF1-2D编码620个氨基酸,相对分子质量 69.31 kD,等电点9.21。因A、B、D基因组中该基因都含有7个外显子和6个内含子(图1-B),且结构域高度保守,选取含有最长ORF的TaGIF1-2A基因,进一步利用其CDS序列设计TaGIF1-3′GSP、TaGIFI-5′GSP特异引物,利用RACE技术得到237 bp的 5′ UTR和262 bp的3′ UTR区,最终获得小麦TaGIF1-2A基因的全长cDNA序列。
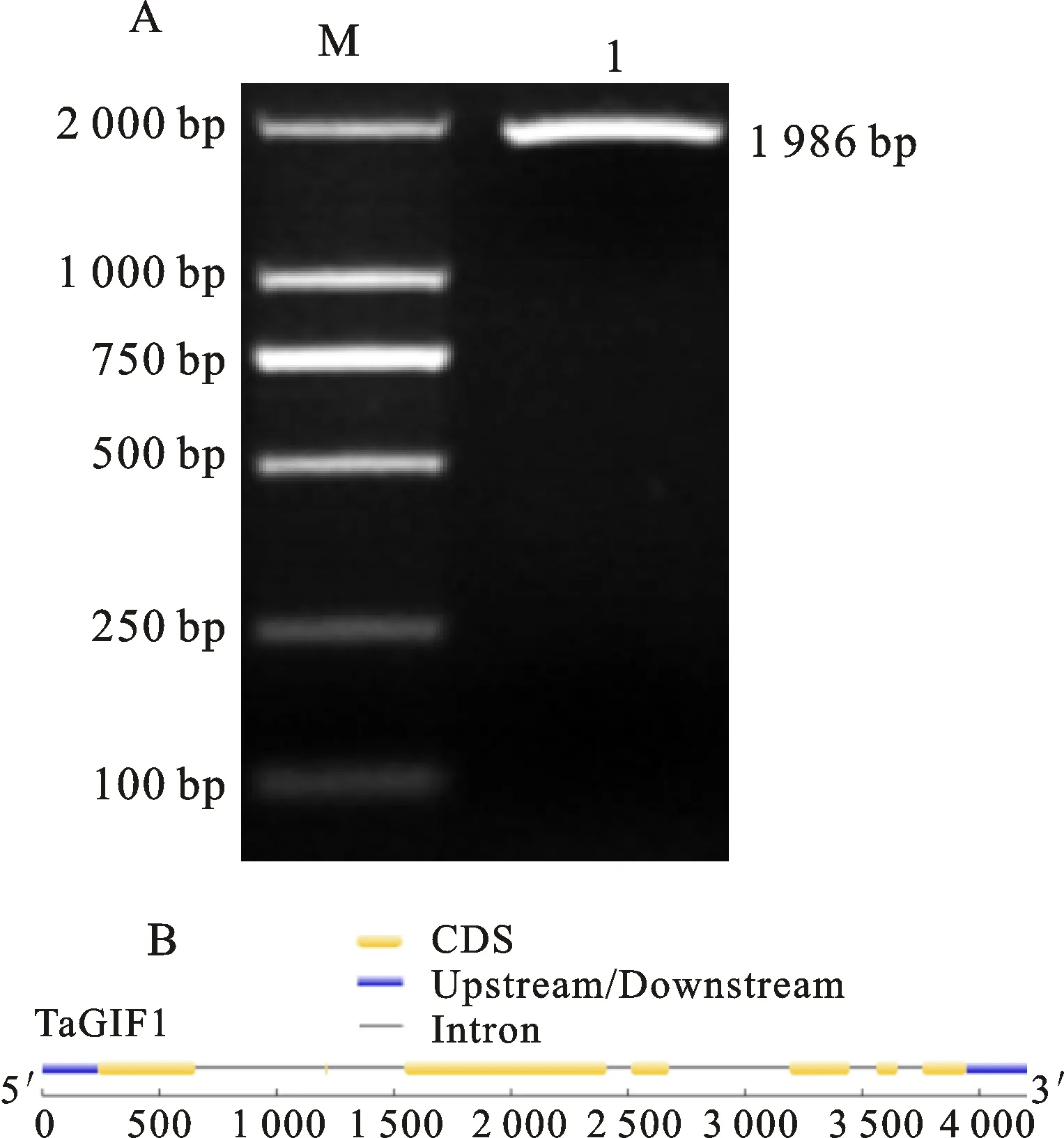
M:Marker DL2000; 1: TaGIF1-2A
2.2 TaGIF1蛋白理化性质和结构域分析
利用TargetP 1.1 Server和SignalP 3.0分析发现TaGIF1蛋白质无跨膜结构域和信号肽。蛋白疏水性/亲水性分析结果表明,位于多肽链的第87位的缬氨酸(Val)具有最高的分值2.444,疏水性最强;第368位的赖氨酸(Lys)具有最低的分值-2.656;其次是第367位的精氨酸(Arg),为-2.556,均属于亲水性氨基酸,多肽链整体上显示亲水性。进一步比较水稻(XP_015633534.1)、拟南芥(AT3G52600)中相应多肽链的亲水性和疏水性,结果均显示亲水特性。由此得出TaGIF1蛋白属于亲水性蛋白。
TaGIF1蛋白功能结构域预测结果表明,该蛋白含有1个典型的Glyco_32保守结构域(图2A),分布在129~612位氨基酸之间,TaGIF1-2B、TaGIF1-2D蛋白也含有该保守结构域,其与水稻、拟南芥[19]等植物中相应编码蛋白的保守结构域一致,均属于INV Glyco_32家族。SOPMA 预测结果表明(图2B),该蛋白二级结构主要由3种形式组成,其中,无规则卷曲所占比例达到 50.98%,延伸链占24.51%,α-螺旋占18.31%,β-折叠仅占6.20%。
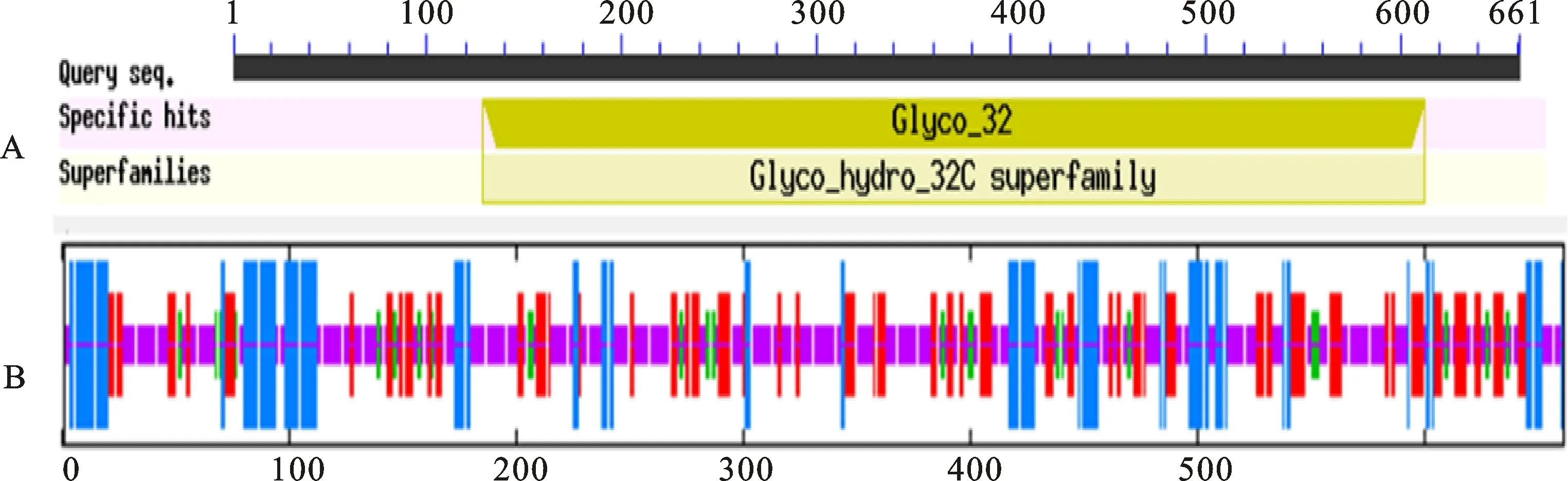
A:TaGIF1蛋白的保守结构域; B:TaGIF1蛋白二级结构预测。图中α-螺旋、延伸链、β-折叠和无规则卷曲结构分别用蓝、红、绿、紫色线表示。
为进一步分析TaGIF1基因的蛋白结构域,选取几种禾本科C3植物的CWIN蛋白序列,利用DNAMAN软件进行序列比对并分析。结果(图3)显示,TaGIF1蛋白含有典型的β-fructosidase结构域、Cys催化域和保守的糖基化位点。
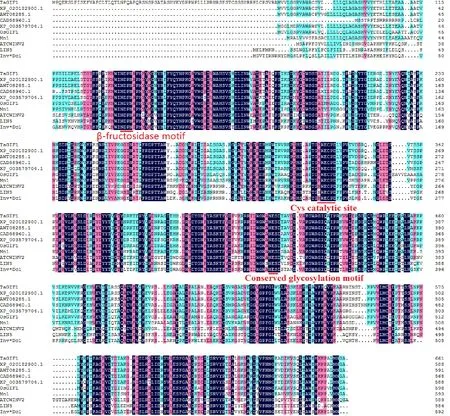
XP_020182900.1:Aegilops tauschii; AWT08285.1:Secale cereale; CAD58960.1:Hordeum vulgare; XP_003579704.1:Brachypodium distachyon; OsGIF1:Oryza sativa; Mn1:Zea mays; ATCWINV2:Arabidopsis; LIN5:Solanum lycopersicum;Inv*Dc1:Daucus L.
2.3 TaGIF1蛋白序列一致性分析
利用NCBI-BlastP进行序列一致性比对后发现,小麦TaGIF1-2A蛋白与其他物种的Glyco_32家族结构域高度同源,与粗山羊草(Aegilopstauschii)、黑麦(Secalecereale)、大麦(Hordeumvulgare)、二穗短柄草(Brachypodiumdistachyon)的氨基酸序列一致性在86%~97%之间,其中,与黑麦(AWT08285.1)和粗山羊草(XP_020182900.1)的序列一致性最高,为97%(图3)。系统发育分析表明(图4),普通小麦的TaGIF1-2A蛋白与黑麦、粗山羊草处于同一分支,其中与黑麦的亲缘关系最近;拟南芥(AT3G52600)、烟草(XP_019225095.1)等植物处于另一分支,普通小麦与其亲缘关系较远;与木本植物棉花(XP_012441627.1)、可可(XP_017976223.1)的亲缘关系最远。

图4 基于NJ法构建TaGIF1蛋白与其同源序列的系统发育树
2.4 TaGIF1基因单倍型分析
扩增产物经1.2%的琼脂糖凝胶电泳检测,得到一个3 000 bp以上的DNA片段,将PCR产物回收纯化后连接至pMD_19T Vector载体上,各挑取3个阳性克隆进行PCR鉴定。测序结果用软件BioEdit分析,最终得到3 708 bp的TaGIF1-2A基因完整gDNA序列。
通过比较15份小麦品种TaGIF1-2A基因组序列,共发现21个SNP差异位点,9个位于编码区,12个位于非编码区(表2)。SNP分组发现,15份小麦品种中TaGIF1-2A基因共存在8种单倍型。8种单倍型编码的氨基酸存在2个变异位点,氨基酸变异位点对应于第6和第7个SNP位点,其余SNP位点未引起氨基酸的改变。
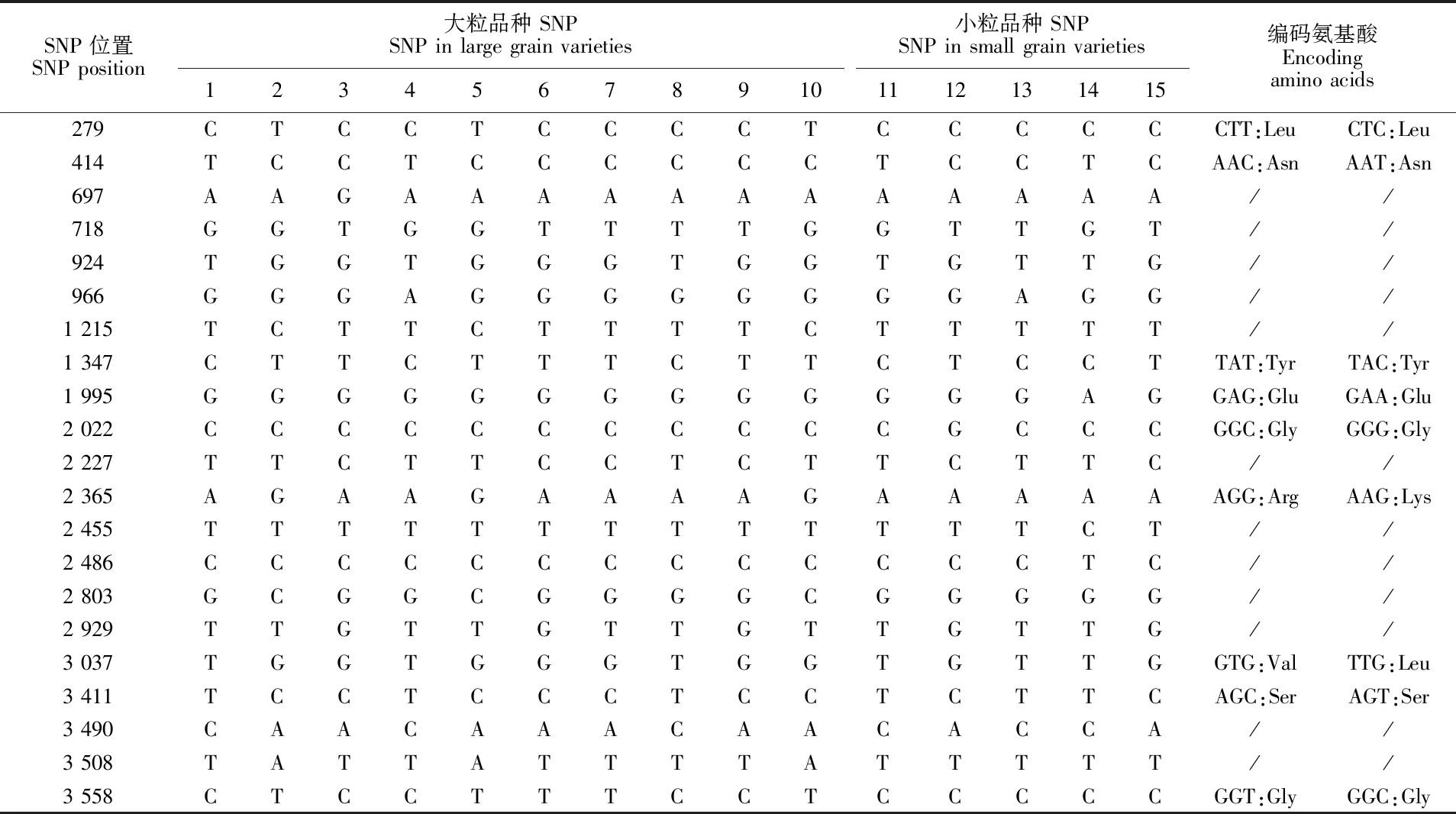
表2 单倍型多态性分析Table 2 Analysis of haplotype polymorphism
2.5 启动子序列的克隆与功能分析
以大小粒材料的基因组DNA为模板进行TaGIF1-2A基因启动子序列的克隆,PCR扩增产物经测序获得2 141 bp的序列。利用PlantCARE对品冬34和陕麦159启动子分析得出,序列中不仅含有启动子基本元件,如与真核生物RNA聚合酶Ⅱ识别和转录起始频率有关的TATA-box和CAAT-box,还包含多个顺式作用元件(图5)。品冬34和陕麦159都含有与激素相关的顺式作用元件ABRE、TATC-boxes、as-1、MYb,与生长发育有关的作用元件CGTCA-motif、TGACG-motif,对低氧特异诱导的GC-motif元件,与逆境响应相关的MYB、Myb-biding site、MYC、DRE、MBS元件,以及光响应元件chs-CMA2a、G-box(表3)。
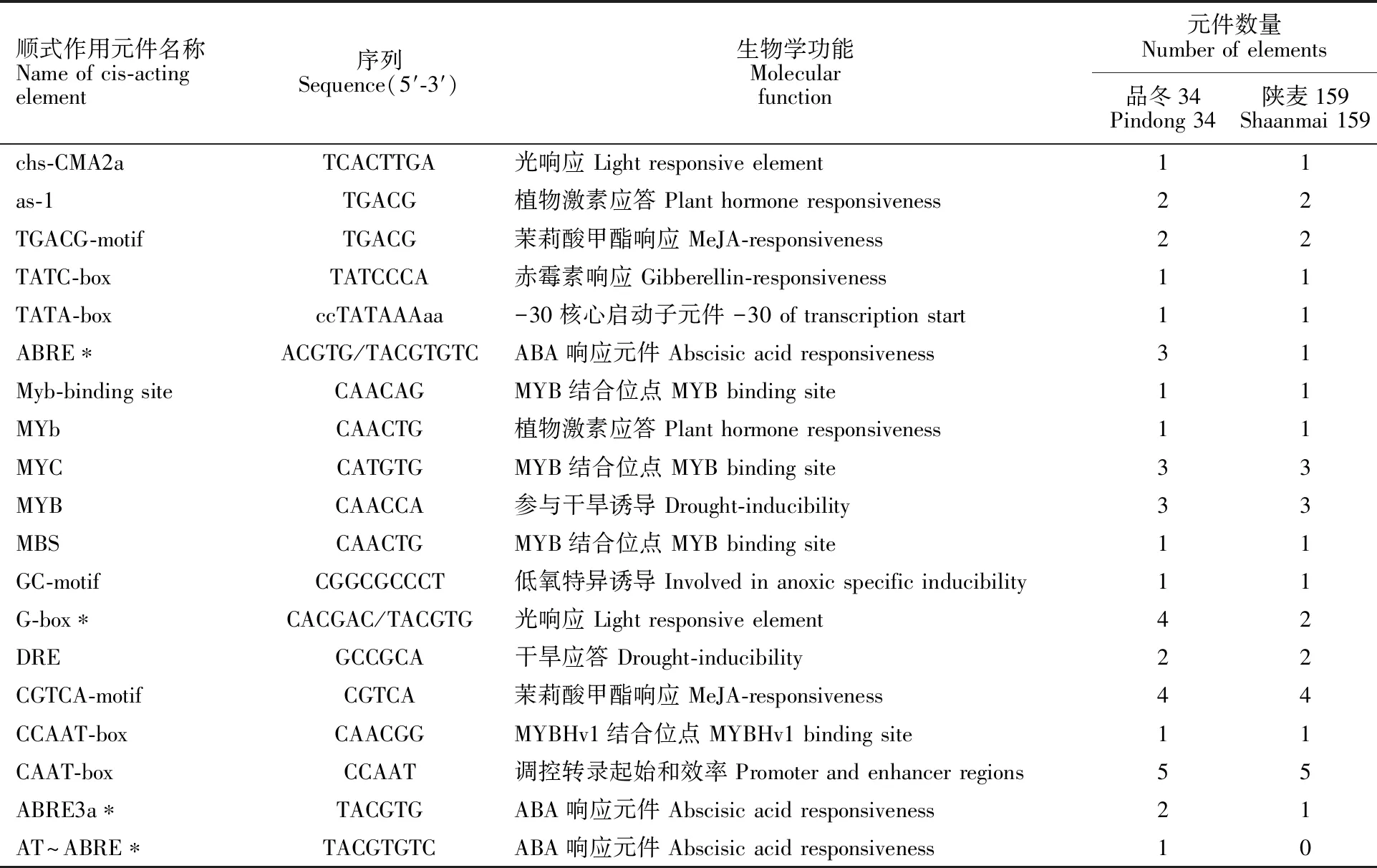
表3 启动子序列中的顺式作用元件及功能Table 3 Cis-acting elements and their functions in the promoter sequence
通过比对品冬34和陕麦159启动子区序列发现,两者共有19个SNP差异。品冬34顺式作用元件数量和种类较陕麦159多,如参与ABA响应的元件ABRE、ABRE3a,参与光响应的作用元件G-box,以及品冬34特有的参与ABA响应的作用元件AT~ABRE。该结果说明,参与小麦早期灌浆的TaGIF1-2A基因在大粒小麦品种中的活性可能强于小粒品种,即在早期灌浆阶段大粒品种中该基因的响应可能强于小粒。
2.6 TaGIF1灌浆期表达模式分析
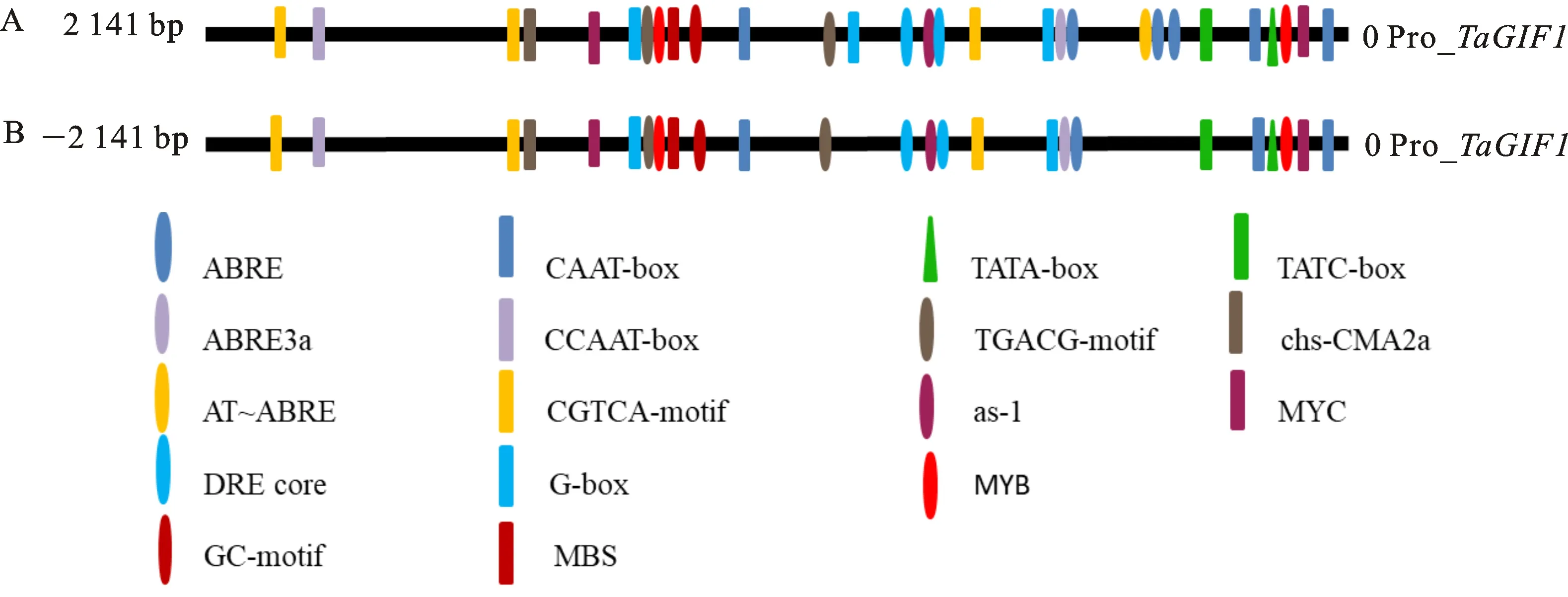
为进一步研究TaGIF1在小麦灌浆期发挥的作用,分别对品冬34与陕麦159中的TaGIF1-2A、TaGIF1-2B、TaGIF1-2D进行荧光定量表达分析。结果显示,在品冬34与陕麦159的不同时期,A组基因表达量均最高,其次是D组,B组表达量最低(图6)。从拔节期到抽穗期的幼穗中,品冬34(图6A)与陕麦159中(图6B)的TaGIF1-2A、TaGIF1-2D都呈现出逐渐上调的表达模式,而TaGIF1-2B的表达变化都不明显;另外,在陕麦159中,TaGIF1-2A、TaGIF1-2D表达量相近,而在品冬34中,TaGIF1-2A表达量明显高于TaGIF1-2D。
在3~15 DAA的籽粒中,品冬34与陕麦159 的TaGIF1-2A、TaGIF1-2B、TaGIF1-2D,都呈现逐渐下调的表达模式,其中,在3 DAA表达量最高,6 DAA其次,到9 DAA时,表达量剧烈下调,之后趋于平稳。品冬34中TaGIF1-2A的下调幅度高于陕麦159。无论大小粒品种,虽在不同时期表达量有差异,但TaGIF1-2A、TaGIF1-2B、TaGIF1-2D基因的整体表达模式都 相近。
A:品冬34;B:陕麦159。
在颖壳中,品冬34(图6C)的TaGIF1-2A、TaGIF1-2B、TaGIF1-2D在6 DAA有最高的表达量,然后下调表达;在陕麦159(图6D)中,TaGIF1-2A、TaGIF1-2B、TaGIF1-2D在3 DAA有最高表达,然后逐渐下调。虽然TaGIF1-2A、TaGIF1-2B、TaGIF1-2D在籽粒、颖壳中均表达,但其转录水平在各个时期并不相同,推测在不同生育期的物质合成过程中,TaGIF1-2A、TaGIF1-2B、TaGIF1-2D参与调控的作用可能不同。
将克隆得到的TaGIF1-2A核酸序列提交至多倍体小麦表达分析WheatExp转录组数据库中,采用Zadoks[16]方法计量小麦生育时期。选取中国春小麦基因Traes_2AL_6DEEE3C3E.2、Traes_2BL_3EDC425A7.2、Traes_2DL_1B3AD9F4E.1在不同生育时期的幼穗和籽粒中的相对表达量数据,进行该基因表达模式分析。结果显示在拔节期、孕穗期直至开花期,该基因呈逐渐上调的表达趋势;籽粒在2 DAA的表达量最高,在14~30 DAA表现为急剧下调的表达趋势。虽然Traes_2AL_6DEEE3C3E.2、Traes_2BL_3EDC425A7.2、Traes_2DL_1B3AD9F4E.1这3个基因的表达量有差异,但是表达趋势一致。该表达模式与大粒品种品冬34和小粒品种陕麦159的表达模式相同。
图A、B:品冬34与陕麦159开花前与开花后 TaGIF1-2A、 TaGIF1-2B、 TaGIF1-2D基因的相对表达量,其中JS、BS、HS分别表示小麦拔节期、孕穗期、抽穗期的幼穗,3~15 DAA表示开花后3~15 d的籽粒;图C、D: TaGIF1-2A、 TaGIF1-2B、 TaGIF1-2D基因在品冬34和陕麦159颖壳中的相对表达量。

z32、z39和z65对应的小麦生育时期分别为拔节期2节、孕穗期幼穗4~7 cm和开花期;z71、z75和z85对应的小麦生育时期分别为开花后2、14和30 d。
2.7 TaGIF1基因的亚细胞定位
采用在线软件Cell-PLoc 2.0预测发现,TaGIF1-2A作用于细胞壁上。进一步利用农杆菌介导的方法在本式烟草叶片细胞中表达PE-TaGIF1-GFP融合蛋白,48 h后在激光共聚焦显微镜下观察绿色荧光,对照为无定位功能的PE-GFP蛋白。结果如图8所示,与PE-GFP空载体对照相比,PE-TaGIF1-GFP融合蛋白主要在细胞膜或细胞壁上呈现明显的绿色荧光。综合前人在水稻[9]、拟南芥[19]植物中的定位以及网站预测结果,笔者认为TaGIF1蛋白定位在细胞壁上。
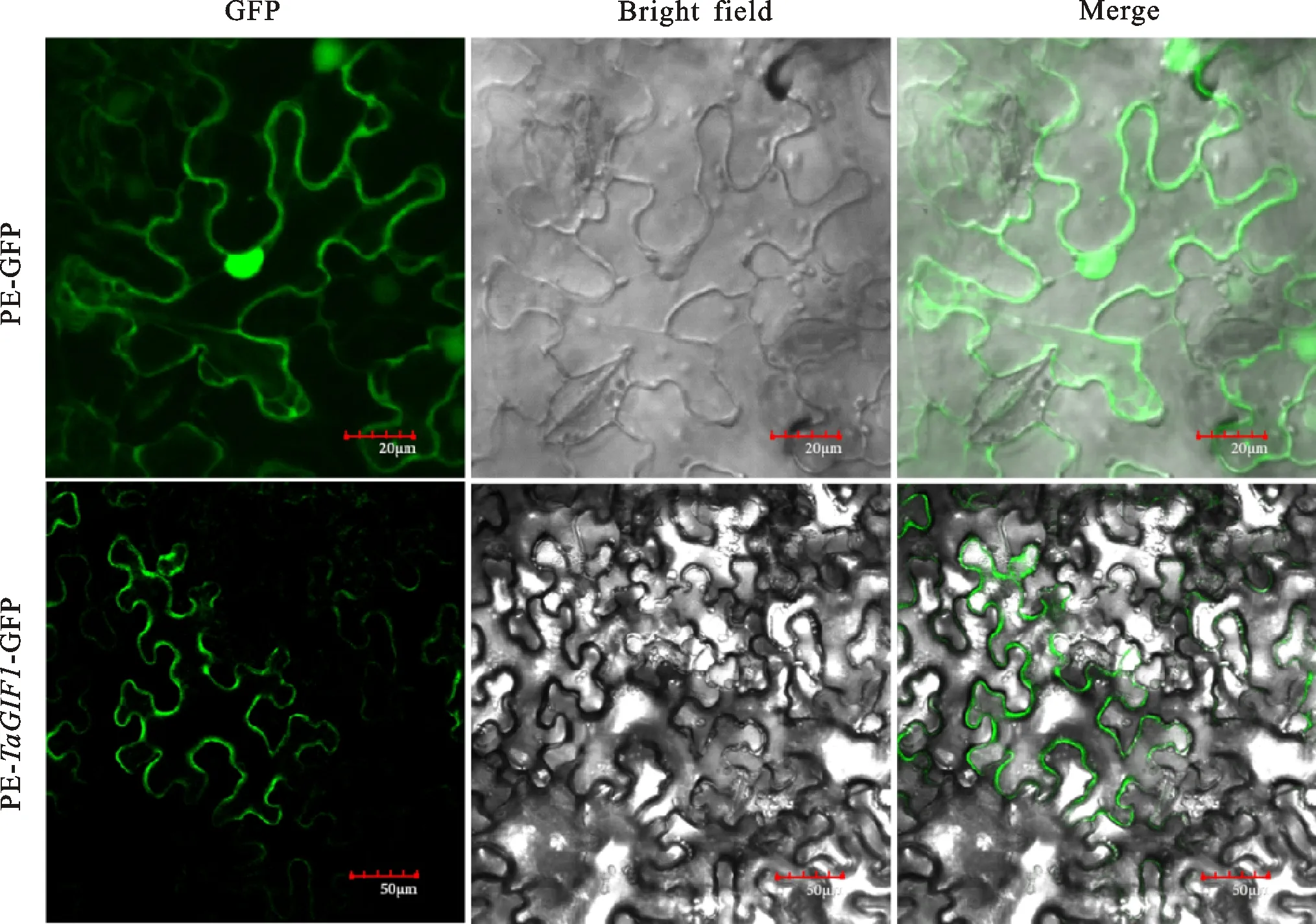
图8 TaGIF1在烟草表皮细胞中的亚细胞定位
3 讨 论
本研究根据水稻灌浆关键基因OsGIF1序列,利用同源克隆技术,首次在大粒与小粒的小麦品种中克隆出TaGIF1-2A基因的CDS全长序列。通过与其它物种的直系同源基因进行多序列比对,发现这些蛋白都含有保守β-fructosidase结构域、Cys催化域和保守的糖基化位点,说明在不同类型的植物中,该蛋白功能十分保守,这与前人在水稻中的研究结果[9]相一致。OsGIF1基因编码CWIN,在蔗糖卸载中起关键作用。所以根据其相似的结构,以及亚细胞定位结果,得出TaGIF1也是一种CWIN,可能参与调控籽粒灌浆的过程。系统发育分析表明,小麦TaGIF1-2A蛋白与黑麦的序列一致性最高,其次是粗山羊草;根据进化树拓扑结构可知,该基因编码的蛋白与单子叶禾本科植物关系最近,其次是双子叶草本植物,最远是双子叶木本植物。这说明该基因可能在单双子叶分化之前就已经产生,印证了该基因可能是一个不断通过人工选择驯化的基因[10]。
15份大小粒小麦品种TaGIF1-2A存在2个氨基酸变异位点,该变异是否影响TaGIF1-2A蛋白功能还有待进一步研究;未发现大小粒材料特有的SNP位点和氨基酸变化,说明在大小粒品种中该基因编码蛋白均存在高度保守性,也进一步表明了对TaGIF1-2A基因启动子调控功能研究的重要性。启动子元件分析表明:(1)TaGIF1-2A启动子中存在脱落酸应答元件、赤霉素应答元件,可能是诱导型启动子,多种激素可能参与TaGIF1表达调控。相关研究也表明,激素调控植物生长发育的整体进程,是重要的生理活性物质,小麦籽粒的形态建成、灌浆充实及最终产量都受到内源激素的调控[20]。(2)TaGIF1-2A启动子中存在低氧特异诱导应答元件和多个参与干旱诱导的顺式作用元件,可能与逆境胁迫信号途径有关。(3)TaGIF1-2A启动子可能通过与生长发育有关的茉莉酸甲酯作用元件CGTCA-motif和TGACG-motif,参与调控小麦籽粒灌浆或发育阶段。此外,虽然在元件种类和数量上有差异,但是在大、小粒以及WheatExp转录组数据库中该基因在小麦生育时期的表达模式却相似。由此推测,该基因不是导致大、小粒粒重差异的根本原因,可能通过调控启动子区元件影响早期籽粒灌浆。预测结果中还含有多种功能未知的顺式作用元件,也有待今后进一步的研究验证。
在不同籽粒大小的品种以及转录组数据库中得出,TaGIF1-2A、TaGIF1-2B、TaGIF1-2D在灌浆期都有相似的表达模式,这说明该基因在大小粒品种中发挥相同的作用,同时A、B与D组之间基因功能可能存在一些冗余。在A、B、D三个基因组中,A组基因的表达量明显高于D组,可能三个染色体组的基因功能有部分分化。在陕麦159中,该基因在籽粒与颖壳中共表达,而在品冬34中,该基因在6 DAA的颖壳中表达更高,说明在这一时期内,该基因在不同材料中可能通过转录水平的变化发挥了不同的作用。TaGIF1基因在开花前幼穗中的表达量相对较低,呈逐步递增趋势,而在3~6 DAA表达量较高,说明该基因在籽粒灌浆早期发挥作用,这一结果与前人对棉花(Gossypiumhirsutum)GhCWIN1[21]基因以及WheatExp转录组数据库[17]中TaGIF1基因在种子发育早期的时空表达模式相吻合。潘庆民等[22]研究表明,在7 DAA小麦籽粒中蔗糖含量最高,而后呈逐渐下降的趋势,这与TaGIF1基因在籽粒中的表达模式相同,说明在籽粒灌浆前期,小麦由于该基因主导蔗糖降解而维持着蔗糖较高的供应水平。
