辣木叶等配方提取物对酵母膏诱导小鼠高尿酸血症的影响
2020-07-29劳文艳赵建郭豫王一如赵晓红
劳文艳 赵建 郭豫 王一如 赵晓红
[摘 要]探讨含辣木叶等配方的袋茶提取物对高尿酸血症小鼠的作用及其机制。给正常实验用鼠连续14 d灌胃给予20 g/kg酵母膏诱导高尿酸血症,同时按人体推荐量10 g/d 的10倍、20倍、30倍,给予低(1.67 g/kg)、中(3.34 g/kg)、高(5.00 g/kg)三种剂量的袋茶水提溶液,采用试剂盒的方法分别测定血清尿酸(uric acid, UA)、黄嘌呤氧化酶(xanthine oxidase,XOD)、肌酐(creatinine,Cre)、血尿素氮(blood urea nitrogen, BUN)、炎性因子白细胞介素(interleukin-6,IL-6)和肿瘤坏死因子(TNF-α)的含量以及肝脏XOD酶活性。与高尿酸血症模型组比较,高剂量的袋茶提取物能显著或极显著降低高尿酸血症小鼠血清UA、XOD、Cre、BUN、IL-6、TNF-α的含量(P<0.01或P<0.05),抑制肝脏中XOD水平(P<0.05)。所用袋茶提取物在三种剂量下均可极显著降低高尿酸血症小鼠血清UA和XOD(P<0.01)的水平,同时可抑制肝脏XOD活性、降低血清中Cre的含量(P<0.05或P<0.01), 降低BUN含量(P<0.05)。结果表明,含辣木叶等成分的袋茶具有降尿酸作用,抑制 XOD 活性及炎性因子释放是其降低高尿酸血症小鼠血清尿酸水平的机制之一。
[关键词]高尿酸血症;黄嘌呤氧化酶;尿素氮;辣木叶配方
[中图分类号]R 285.5[文献标志码]A[文章编号]1005-0310(2020)03-0083-06
高尿酸血症是以机体尿酸生成过多或尿酸排泄减少引起的血中尿酸水平增高为特征的疾病,而且它是发展成痛风和许多其他疾病如心血管病、肾脏病、高血压和代谢综合症等的关键病因[1]。尿酸是嘌呤核苷酸分解的最终产物。肝脏中的黄嘌呤氧化酶是尿酸分解生成的关键酶,而肾脏中的尿酸盐转运蛋白是消除尿酸的主要转运蛋白[2-3]。随着人们生活水平的提高,饮食结构发生了明显变化,以高能量、高嘌呤类食物摄入显著增加为特征,由此引起高尿酸血症和痛风发病率呈逐年增加且年轻化的趋势。2013 年的《高尿酸血症和痛风治疗中国专家共识》中明确指出高尿酸血症与痛风之间密不可分,并且是糖尿病、代谢综合征、高脂血症、慢性肾病、心血管疾病与脑卒中的独立危险因素[4],高尿酸血癥被看成是继高血压、高血脂和糖尿病“三高”之后的第四个重要的危险因素[5],因此,其发病机理及治疗方法的研究备受世人关注。
临床治疗高尿酸血症,可采用抑制尿酸生成的药物或促进尿酸排泄的药物,前者如别嘌醇(allopurinol)[6-7],后者如苯溴马隆(benzbromarone)[8-9]等,但长期服用这些药物存在较为严重的不良反应[10-11]。近年来,应用天然产物作为补充或替代治疗高尿酸血症和痛风的报道越来越多[12],有研究发现,辣木叶、荷叶、枸杞、桑叶、蒲公英等的复方组合或单体提取物有降低血尿酸的作用[13-16]。本研究以辣木叶为主并含有白果、桑叶、枸杞子、甘草、蒲公英、菊花等组成的配方制成袋茶提取物作为研究对象,通过建立小鼠高尿酸模型,观察袋茶提取物是否具有降低尿酸含量的作用及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验动物:选用北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2016-0011)繁殖的18~22 g SPF级KM种健康雄性小鼠,饲养于北京联合大学应用文理学院保健食品功能检测中心SPF级动物室。实验动物使用许可证号:SYXK(京)2017-0038。维持饲料由北京科澳协力饲料有限公司(许可证号:SCXK(京)2014-0010)生产。
1.1.2 实验样品及制备
袋茶(深圳松乐生物科技有限公司提供),配方组成:辣木叶、白果、桑叶、枸杞子、甘草、蒲公英、菊花。
袋茶提取物的制备:常压条件下,用温度80 ℃~90 ℃的纯水浸泡袋茶60 min,水量为受试样品体积的10倍以上,提取2次,将其合并加热蒸发浓缩至0.5 g/mL,冷却后置4 ℃冰箱储存。
1.1.3 主要仪器与试剂
主要仪器:多功能酶标仪(美国 Thermo)、5840R 冷冻离心机 (德国 Eppendorf)、生化分析仪(美国Beckman)、BS223S电子天平(德国 Sartorius)、UV-2450 型紫外可见分光光度计(日本岛津)。
主要试剂:苯溴马隆(benzbromarone,BBR,日本东京化成株式会社);小鼠黄嘌呤氧化酶(xanthine oxidase,XOD)试剂盒(南京建成生物工程研究所),尿酸(uric acid,UA)试剂盒(南京建成生物工程研究所),小鼠黄嘌呤氧化酶XOD试剂盒(ELISA)(上海酶联生物科技有限公司)、TNF-α试剂盒(上海酶联生物科技有限公司)、IL-6试剂盒(上海酶联生物科技有限公司)、肌酐(creatinine,Cre)试剂盒(中生北控生物科技股份有限公司)、血尿素氮(blood urea nitrogen, BUN)试剂盒(中生北控生物科技股份有限公司)、尿酸(UA)试剂盒(中生北控生物科技股份有限公司)。
1.2 方法
1.2.1 动物分组与给药
动物分组:在动物房适应性喂养1周左右的KM小鼠按体重随机分6组,每组10只,分别为空白对照组(control),模型组(model),受试物按人体推荐量的10倍、20倍、30倍设3个剂量组(1.67 g/kg(LD组)、3.34 g/kg(MD组)、5.00 g/kg(HD组))和阳性对照组(苯溴马隆BBR,40 mg/kg)。
受试物配制:储存的0.5 g/mL的袋茶提取物原液为HD组受试物,取原液10.0 mL稀释成15.0 mL为MD组受试物,取原液5.0 mL稀释成15.0 mL为LD组受试物。
造模及给药:模型组、各受试物组及阳性对照(BBR) 组连续灌胃(ig)给予酵母膏(20 g/kg)造模,每日造模后1 h灌胃(ig)给予各受试物。空白对照组同时给予无菌水,灌胃体积为10.0 mL/kg。实验期间所有小鼠均正常饮食。给药14天后进行取材,取血前12 h禁食不禁水。
1.2.2 动物处理与样本采集
实验最后一次灌胃1 h后,摘眼球取血后处死小鼠。3 000 r/min离心15 min分离血清,测定相关指标。同时,冰浴取肝脏,称重、剪碎,加入5倍体积的80 mmol/L磷酸盐缓冲液(pH7.4),在冰浴中充分匀浆,4 ℃下3 000 r/min,离心10 min取上清液用于测定相关指标。
1.2.3 相关指标检测
小鼠血清UA、血清XOD 活性水平、Cre和BUN,用相应试剂盒检测;血清中IL-6、TNF-α以及肝脏匀浆中的XOD用相应的ELISA试剂盒检测。
1.3 数据处理
数据统计学处理采用IBM SPSS Statistics 19.0 软件,结果用mean±SE表示,多组均数比较采用单因素方差分析,组间比较方差齐时选用One-way LSD 法,方差不齐时选择 Dunnetts T3 法。
2 结果与分析
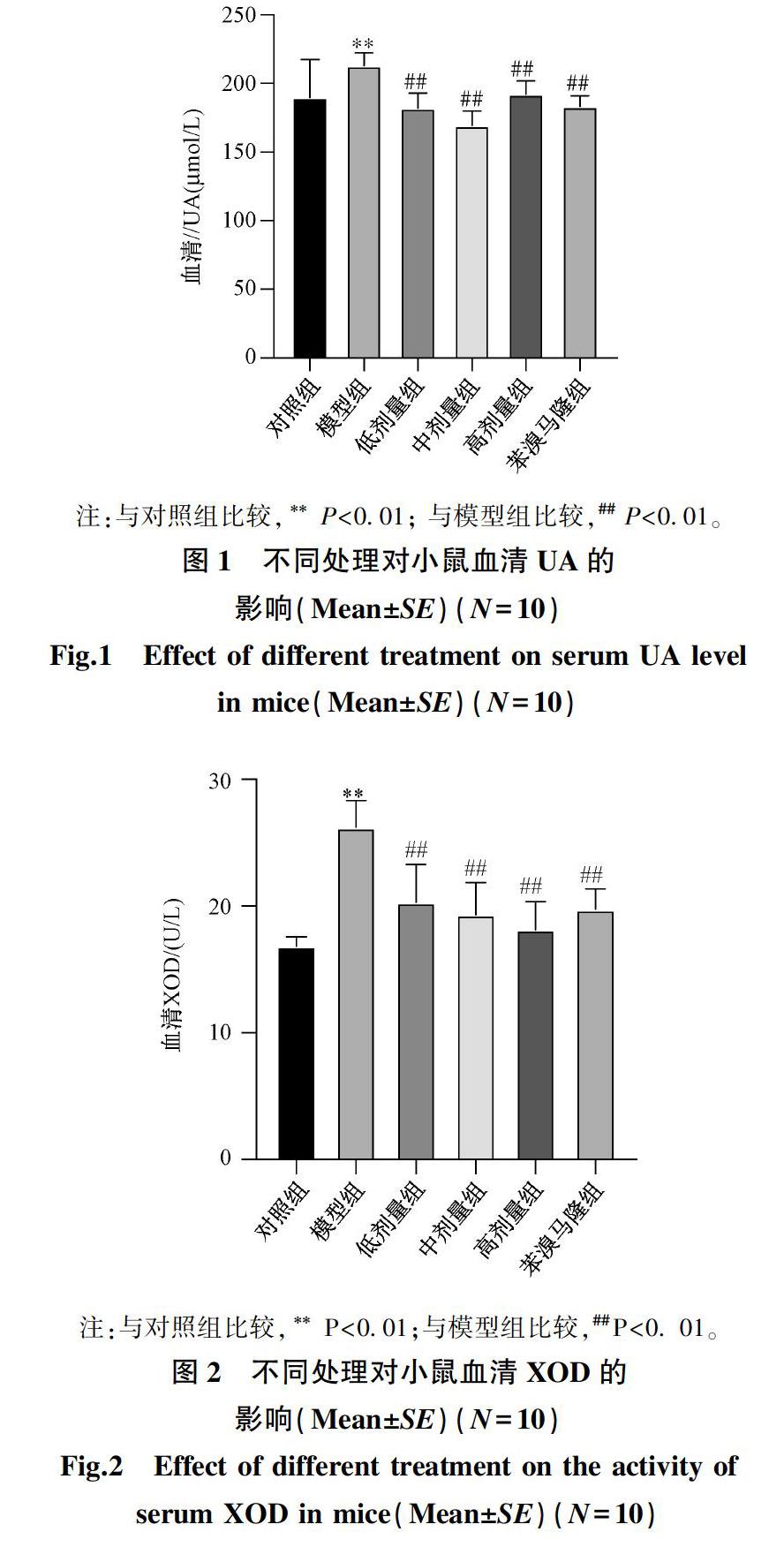
2.1 袋茶提取物对高尿酸血症小鼠血清尿酸和黄嘌呤氧化酶的影响
袋茶提取物对高尿酸血症小鼠血清尿酸和黄嘌呤氧化酶的影响
分别见图1、图2。
由图1、图2结果可见,与空白对照组相比,模型组小鼠血清UA和XOD 水平极显著增高(P<0.01),表明造模成功。与模型组比较,袋茶提取物低、中、高剂量组和阳性对照组的小鼠血清UA和XOD 水平均极显著降低(P<0.01),说明试验剂量的提取物具有降低小鼠血清尿酸及黄嘌呤氧化酶的作用。
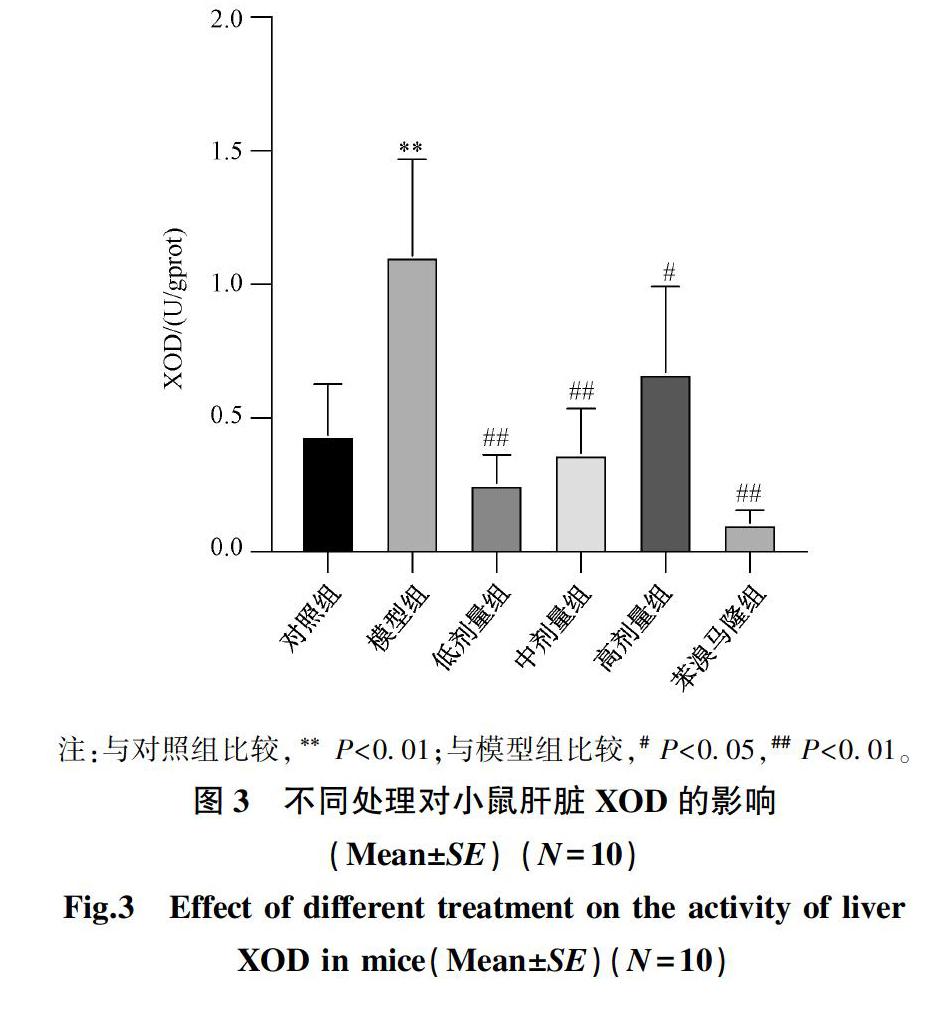
2.2 袋茶提取物对高尿酸血症小鼠肝脏黄嘌呤氧化酶的影响
袋茶提取物对高尿酸血症小鼠肝脏黄嘌呤氧化酶的影响见图3。
由图3结果可知,与空白对照组相比,模型组小鼠肝脏XOD 活性极显著增高(P<0.01),表明造模成功。与模型组比较,配方提取物低、中剂量组小鼠肝脏XOD 活性极显著降低(P<0.01),高剂量组的显著降低(P<0.05),说明提取物在低、中、高剂量下均能降低小鼠肝脏XOD 的活性。
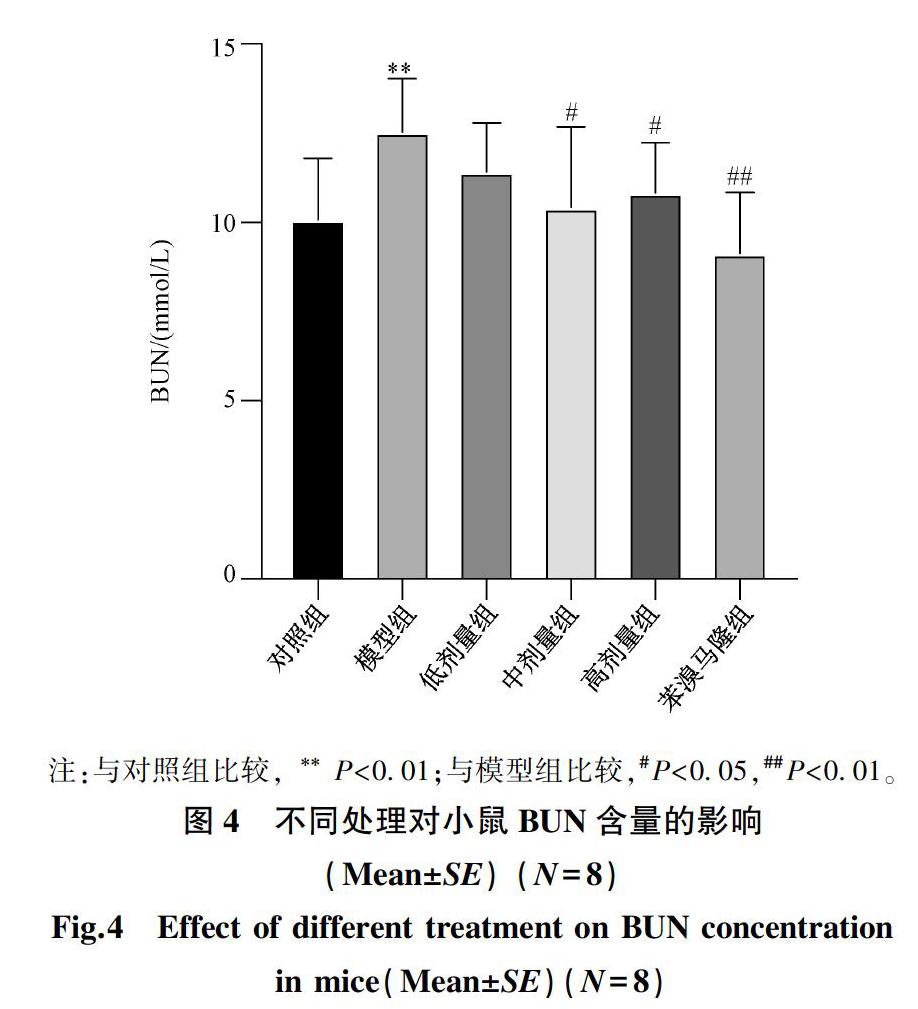
2.3 袋茶提取物对高尿酸血症小鼠血清BUN的影响
袋茶提取物对高尿酸血症小鼠血清BUN的影响结果如图4所示。
由图4 可知,与对照组比较,模型组BUN含量极显著增加(P<0.01);与模型组比较,提取物中、高剂量组血清BUN显著降低(P<0.05);阳性对照组与模型组比较,血清BUN含量极显著降低(P<0.01)。结果说明提取物在中、高剂量下可以降低小鼠血清中BUN的含量。
2.4 袋茶提取物对高尿酸血症小鼠血清Cre的影响
袋茶提取物对高尿酸血症小鼠血清Cre的影响如图5所示。
与对照组比较,模型组血清Cre含量无明显变化;与模型组比较,提取物中剂量组血清Cre极显著降低(P<0.01),高剂量组血清Cre显著降低(P<0.05),没有呈现剂量的相关性;阳性对照组与模型组比较,血清Cre无明显变化。推测中、高剂量组的提取物增强了肾脏清除Cre的功能。
2.5 袋茶提取物对高尿酸血症小鼠血清IL-6的影响
袋茶提取物对高尿酸血症小鼠血清IL-6的影响如图6所示。
由图6可见,与对照组比较,模型组IL-6含量明显增加(P< 0.05);与模型组比较,提取物仅高剂量组血清中IL-6含量明显降低(P<0.05),而中、低剂量组血清中IL-6含量无明显变化;阳性对照组与模型组比较,血清中IL-6含量极显著降低(P<0.01)。结果说明高剂量组提取物能够降低血清中IL-6含量。
2.6 袋茶提取物对高尿酸血症小鼠血清TNF-α含量的影响
袋茶提取物对高尿酸血症小鼠血清TNF-α含量的影响结果见图7所示。
由图7可见,与对照组比较,模型组TNF-α含量极显著增加(P<0.01);与模型组比较,提取物中、高剂量组血清中TNF-α含量明显降低 (P<0.05);陽性对照组与模型组比较,血清TNF-α含量极显著降低(P<0.01)。此结果说明中、高剂量组提取物能使血清中TNF-α含量降低。
3 讨论
人类体内并无尿酸酶,而啮齿类动物体内存在的尿酸酶极易将尿酸分解为尿囊素排出体外,高尿酸血症动物模型的制备比较困难。酵母膏是尿酸的前体物质,酵母膏可诱导小鼠高尿酸血症,也可一定程度上引起血清肌酐、尿素氮水平显著升高[17]。参考陈光亮[18]等的研究,通过饲喂酵母膏建立的高尿酸血症模型,造模组小鼠血清UA水平和XOD水平与空白对照组相比较有统计学差异,说明造模成功。与空白对照组相比,造模组血清BUN升高,说明酵母膏造模对小鼠肾功能产生了一定影响。炎症反应是临床上高尿酸血症引起损伤的主要病理特点,本研究模型组小鼠血清中的炎性标志物IL-6和TNF-α含量与空白对照组相比较有统计学差异,与Chi-Chang Huang[19]等的研究结果一致。
黄嘌呤氧化酶(XOD) 是嘌呤核苷代谢途径的限速酶, 是调控尿酸生成的最终环节,在高尿酸血症的发病中占主导地位。经口饲喂高、中、低剂量袋茶提取物,可使小鼠血尿酸水平降低,同时血清XOD和肝脏XOD活性水平也显著降低,说明袋茶具有抗高尿酸血症的作用,与其中的活性物质降低了血清和肝脏中的XOD水平有关[20-22]。
肾脏在尿酸排泄过程中起着重要作用,因此高尿酸血症常伴有肾功能损伤,血肌酐和尿素氮是检验肾功能的重要指标。袋茶提取物可使小鼠Cre和BUN含量显著降低,说明其有效减少肾脏因高浓度尿酸带来的病理损伤,对肾脏功能有一定的保护作用。而阳性对照物苯溴马隆也只能降低尿素氮的含量,对于Cre没有明显的抑制作用,即苯溴马隆对于血尿酸过高引起的肾损伤不能达到有效控制。据此推测,与用药物治疗相比较,袋茶提取物可通过早期干预降低血尿酸水平并达到保护肾脏功能的目的。
尿酸及其结晶产物可以诱导血管管壁发生炎症反应,刺激单核细胞生成IL-1β、IL-6以及TNF-α[23-24]。袋茶提取物可有效控制尿酸引起的IL-6以及TNF-α 的含量增加,从而减轻机体的炎性反应。由此可见,机体通过摄入一定量的袋茶提取物,在有效降低血尿酸水平的同时,达到了抗炎的目的。
以辣木叶、白果、桑叶、甘草[13-16,20-22]等为主成分组成的袋茶提取物在一定剂量下可以有效降低小鼠血清UA、血清XOD,对单一酵母膏诱发的高尿酸血症有一定疗效,从而达到保护机体的目的,通过降低肌酐、尿素氮的含量和IL-6、TNF-α的含量得到体现。但是,因其成分、作用机制复杂,对于起抑制作用的具体有效成分的分析及作用机理还有待进一步研究。
本研究过程中所用袋茶提取物可以有效降低高尿酸血症大鼠的血尿酸水平,作为改善高尿酸血症患者健康状况的保健食品,用于早期干预机体尿酸水平具有进一步研发的潜力和利用价值。
[参考文献]
[1]陈松婷,戴辉,林爱华. 中老年人群高尿酸血症与心血管危险因素关系[J]. 中国公共卫生, 2014, 30(2):144-148.
[2]HOU C W, LEE Y C, HUNG H F, et al. Longan seed extract reduces hyperuricemia via modulating urate transporters and suppressing xanthine oxidase activity[J]. The American Journal of Chinese Medicine,2012(40):979-991.
[3]ZHAO R, CHEN D, WU H. Pu-erh ripened tea resists to hyperuricemia through xanthine oxidase and renal urate transporters in hyperuricemic mice[J]. J Funct Foods, 2017(29):201-207.
[4]中华医学会内分泌学分会.高尿酸血症和痛风治疗中国专家共识[J].中华内分泌杂志,2013,29(11):913-920.
[5]郭立新.从《高尿酸血症和痛风治疗中国专家共识》谈高尿酸血症的治疗[J].药物与临床: 药品评价,2014,11(1):21-31.
[6]CHAO J,TERKELTAUB R. A critical reappraisal of allopurinol dosing, safety, and efficacy for hyperuricemia in gout [J]. Curr Rheumatol Rep, 2009,11 (2):135-140.
[7]CHOHAN S, BECKER M A, MACDONALD P A, et al. Women with gout: efficacy and safety of urate-lowering with febuxostat and allopurinol [J]. Arthritis Care Res(Hoboken),2012,64 (2): 256-261.
[8]KURAJOH M, KOYAMA H, SHOJI T, et al. Relationship between serum allantoin and urate in healthy subjects and effects of benzbromarone in gout patients [J]. International Journal of Clinical Pharmacology and Therapeutics, 2012, 50 (4): 265-271.
[9]宋艳玲.苯溴马隆治疗高尿酸血症和痛风的疗效观察[J].中国医药导刊, 2014, 16(5): 858-859.
[10]王春辉, 李松.黄嘌呤氧化酶抑制剂的研究进展 [J]. 国外医学(药学分册), 2006, 33(5): 351-353, 357.
[11]梁华玉, 王育琴. 苯溴马隆肝毒性机制的研究进展 [J].药物不良反应杂志, 2016, 18(4): 286-289.
[12]张雪, 周英, 管静, 等.5种中药材提取物对黄嘌呤氧化酶的抑制作用[J].山地农业生物学报, 2015, 34(4): 51-54.
[13]梁文娟, 和劲松, 田洋, 等. 辣木叶提取物降低高尿酸血症小鼠尿酸水平及机理研究[J]. 安徽农业科学, 2017, 45(17): 108-109.
[14]孙维华, 赵新芳, 甘霞. 参荷脂肝汤对非酒精性脂肪肝糖、脂、尿酸代谢的影响[J].中国实验方剂学杂志,2015, 21(1): 186-190.
[15]王珂, 王瑞坡, 李姣,等. 桑叶黄酮对腺嘌呤诱导大鼠高尿酸血症肾损伤的防治作用[J]. 天然产物研究与开发, 2012, 24(2): 172-175+202.
[16]邹传宗,王红娟,李纪纲,等.蒲公英对急性高尿酸血症大鼠的影响[J].中华中医药学刊,2020,38(4):170-172.
[17]肖为, 陶叶杏, 谷毅鹏,等. 全緣马尾藻提取物对酵母膏诱导小鼠高尿酸血症的拮抗效应[J].食品工业科技,2015,36(17):339-342.
[18]陈光亮, 张清林, 马晓芹, 等. 酵母致小鼠高尿酸血症模型 [J]. 中国药理学通报, 2003,19(4): 467-469.
[19]HUANG C C, LOU B S, HSU F L. Use of urinary metaboiomics to evaluate the effect of hyperuricemia on the kidney[J]. Food and Chemical Toxicology, 2014(74): 35-44.
[20]孙铭,刘春雨, 傅文绮, 等. 枸杞提取物对慢性高尿酸血症的治疗作用及机制研究[J]. 中国民族民间医药, 2017, 26(24): 35-37.
[21]唐夏莉, 陈素红, 吕圭源. 复方菊明提取物对高血压伴高尿酸血症模型大鼠尿酸的影响 [J]. 浙江中医药大学学报,2012,36(12): 1321-1324.
[22]程虹毓,朱继孝. 银杏叶提取物降尿酸及对黄嘌呤氧化酶抑制作用研究 [J].中药通报, 2013, 12(2): 61-63.
[23]余斌, 张亦工. 急性痛风性关节炎中白细胞介素类细胞因子的研究进展 [J]. 中国中医骨伤科杂志, 2005, 13(4): 56-58.
[24]王红梅, 杨中华, 张明, 等.急性痛风性关节炎的炎症机制研究进展 [J].国外医学(老年学分册), 2005, 26(3): 124-127.
(责任编辑 李亚青)
