BRAF V600E和TERT启动子突变与甲状腺乳头状癌临床病理特征的关系*
2020-07-27
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤中最常见的病理类型,占全部甲状腺癌的80%以上[1]。近年来,国内外甲状腺癌的患病率不断攀升,绝大部分甲状腺癌恶性程度较低,进展缓慢,经规范化治疗后患者预后良好,但约10%的甲状腺癌具有高侵袭性的生物学行为[2],早期即可侵犯喉返神经、气管和食管,并出现侧颈淋巴结转移,复发及死亡率高。对PTC患者进行个体化治疗,在早期及时干预以降低复发、死亡的风险和谨慎手术以避免术后相关并发症的出现之间找到平衡,是目前临床医师关注的重点。了解甲状腺癌的分子发病机制,筛选提示预后的分子标志物,对疾病进行风险分层可有效鉴别出预后较差的PTC患者,为选择精准的治疗方式提供依据。
BRAF基因突变发生于约29%~83%的甲状腺癌,是甲状腺恶性肿瘤中最常见的突变类型[3]。BRAF V600E突变激活RAS/RAF/促分裂原活化蛋白激酶途径从而引起细胞的恶性增殖,有研究认为携带BRAF V600E突变的PTC具有更高的侵袭性,提示肿瘤不良预后[4]。端粒酶逆转录酶(telomerase reverse transcriptase,TERT)是端粒酶的催化亚基,通过激活端粒酶来保持端粒的完整,使肿瘤细胞获得无限增殖的能力[5]。TERT启动子突变是肿瘤特异性的体细胞突变,在正常组织中未发现表达。TERT启动子区域最常见的突变位点位于5号染色体1295228C>T(C228T)和1295250C>T(C250T)。有研究报道其与肿瘤侵袭性密切相关,在恶性黑色素瘤、脑胶质瘤、膀胱癌中均有表达[6]。在甲状腺癌中,TERT启动子突变更常见于未分化癌、间变癌以及BRAF V600E突变型PTC中。提示BRAF V600E突变和TERT启动子突变可能具有某种协同作用,形成独特的遗传背景,PTC具有更强的侵袭性。基于此,本研究回顾性分析728例PTC患者的BRAF V600E和TERT启动子突变情况,及其与临床病理特征的关系,以期了解甲状腺癌的分子发病机制,筛选提示预后的分子标志物,对疾病进行风险分层,为患者选择精准的治疗方式提供依据。
1 材料与方法
1.1 一般资料
2014年12月至2016年12月共2 396例患者因甲状腺癌于山西省肿瘤医院行手术治疗。共728例PTC患者纳入本研究。纳入标准:1)初次行甲状腺癌手术;2)术后病理证实为甲状腺癌;3)可获取完整的临床病理学资料。排除标准:1)甲状腺转移癌;2)合并其他类型的甲状腺癌,如髓样癌、未分化癌等。
所有患者均接受甲状腺腺叶+峡部切除或全甲状腺切除,均行预防性或治疗性中央区淋巴结清扫,侧颈淋巴结仅行治疗性清扫。初次治疗后,728例患者均获得随访,截至2019年11月,随访时间为8~44个月。肿瘤直径、癌灶数量、腺外侵犯、中央区及侧颈淋巴结转移、病理亚型均由2位病理科医师独立报告,结果不一致时由第3位病理医师讨论并诊断。腺外侵犯定义为术中肉眼可见肿瘤侵犯带状肌、喉、气管、食管、喉返神经等和(或)镜下。肿瘤直径在多灶甲状腺癌中定义为最大癌灶的直径。肿瘤复发定义为组织学/细胞学/放射性碘显像证实的复发或肿瘤持续存在。随访时间的计算为从术后至发现肿瘤复发的时间间隔,无复发时从术后至最后一次随访的时间间隔。TNM分期的依据为美国癌症联合委员会(AJCC)第8版甲状腺癌分期。
1.2 DNA提取和突变分析
采用QIAGEN公司(德国)DNA FFPE Tissue Kit(QIAGEN)试剂盒提取新鲜PTC肿瘤组织DNA,严格按照说明书进行操作。采用紫外分光光度计测量DNA的浓度、纯度和波长在260 nm和280 nm的光密度(OD),经检验所有DNA样本的纯度均达到要求。
BRAF基因使用艾德生物(厦门)人类BRAF基因V600E突变检测试剂盒检测突变,TERT基因使用艾德生物TERT突变检测试剂盒检测突变。使用荧光定量PCR仪(型号:ABI 7000)进行PCR扩增。反应条件:第1阶段95℃5 min,1个循环;第2阶段95℃25 s,64℃20 s,72℃20 s,15个循环;第3阶段93℃25 s,60℃35 s,72℃20 s,31个循环。第3阶段60℃时进行信号收集。样本Ct值≥28,样本为阴性;Ct值<28,则样本为阳性。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。计量资料以表示,计数资料以百分率表示,采用χ2检验及Fisher 确切概率法进行单因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 PTC患者中BRAF V600E、TERT C228T 及TERT C250T突变情况
本研究共纳入PTC研究对象728例,其中男性141例(19.4%),女性587例(80.6%)。年龄13~82岁,平均年龄(43.6±8.6)岁,其中年龄<55岁567例(77.9%),≥55岁161例(22.1%)。平均肿瘤直径(1.58±0.25)cm,其中肿瘤直径≤2 cm 459例(63.1%),>4 cm 36例(4.9%)。在所有PTC患者中,经典型617例(84.7%),滤泡亚型72例(9.9%),高柱状型21例(2.9%),弥漫硬化型18例(2.5%)。发生腺外侵犯204例(28.0%),其中侵犯颈前带状肌42例(5.8%),侵犯喉返神经22例(3.0%),侵犯食管/气管19例(2.6%)。多灶性甲状腺乳头状癌256例(35.2%),PTC合并桥本甲状腺炎276例(37.9%),中央区淋巴结转移240例(33.0%),侧颈淋巴结转移86例(11.8%)。随访或就诊时发现远处转移37例(5.1%),随访期间发现复发39例(5.4%),出现残余甲状腺腺叶复发22例(3.0%)。侧颈及中央区淋巴结复发27例(3.7%),其中患侧淋巴结转移19例(2.6%),对侧颈部淋巴结转移3例(0.4%),双侧颈淋巴结转移5例(0.7%),仅发生中央区淋巴结转移12例(1.6%)。随访期间1例患者死于乳腺癌伴多脏器转移,1例死于重症肺炎,2例死于心力衰竭,无患者死于PTC。
本研究728例患者中,BRAF V600E突变型308例(42.3%)。TERT C228T突变型78例(10.7%),TERT C250T突变型4例(0.5%),两种突变相互排斥,不共存。TERT启动子突变82例(11.2%),其中59例合并BRAF V600E突变。BRAF V600E突变组中,TERT启动子突变率为19.2%;在BRAF V600E 野生型中,TERT启动子突变率为5.5%(P<0.001,图1)。
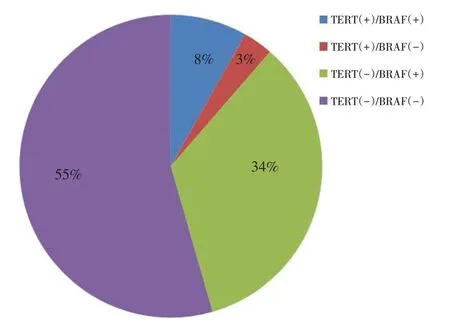
图1 BRAF V600E及TERT启动子突变占比
2.2 TERT启动子突变和BRAF V600E突变与PTC患者临床病理因素之间的关系
如表1所示,TERT启动子突变与患者发病年龄(P=0.034)、腺外侵犯(P=0.026)、肿瘤直径(P=0.028)、中央区淋巴结转移(P=0.012)、远处转移(P=0.001)、TNM分期(P<0.001)、病理亚型(P=0.003)以及肿瘤复发(P=0.002)显著相关。而与患者性别、多灶性、伴桥本甲状腺炎、侧颈淋巴结转移之间的关系差异无统计学意义(P>0.05)。
BRAF V600E突变与PTC患者的腺外侵犯(P=0.001)、肿瘤直径(P<0.001)、桥本甲状腺炎(P<0.001)、远处转移(P=0.010)、TNM分期(P=0.009)和肿瘤复发(P=0.001)显著相关。与患者年龄、性别、多灶性、中央区及侧颈淋巴结转移、病理亚型间的关系差异无统计学意义(P>0.05,表2)。
2.3 仅TERT启动子突变、仅BRAF V600E突变和TERT与BRAF V600E突变共存与PTC患者临床病理因素之间的关系
与无TERT启动子突变且无BRAF V600E突变组相比,仅携带TERT启动子突变与腺外侵犯(P=0.008)、肿瘤远处转移(P=0.003)、更高的TNM分期(P<0.001)及肿瘤复发(P=0.005)显著相关。与无突变组相比,仅携带BRAF V600E突变与腺外侵犯(P<0.001)、多灶性(P=0.041)、合并桥本甲状腺炎(P<0.001)、远处转移(P=0.003)、更高分期(P=0.011)及肿瘤复发(P<0.001)显著相关。同时伴有BRAF V600E和TERT启动子突变与发病年龄(P=0.024)、腺外侵犯(P=0.022)、合并桥本甲状腺炎(P=0.005)、中央区淋巴结转移(P=0.018)及更高临床分期(P=0.002)显著相关(表3)。
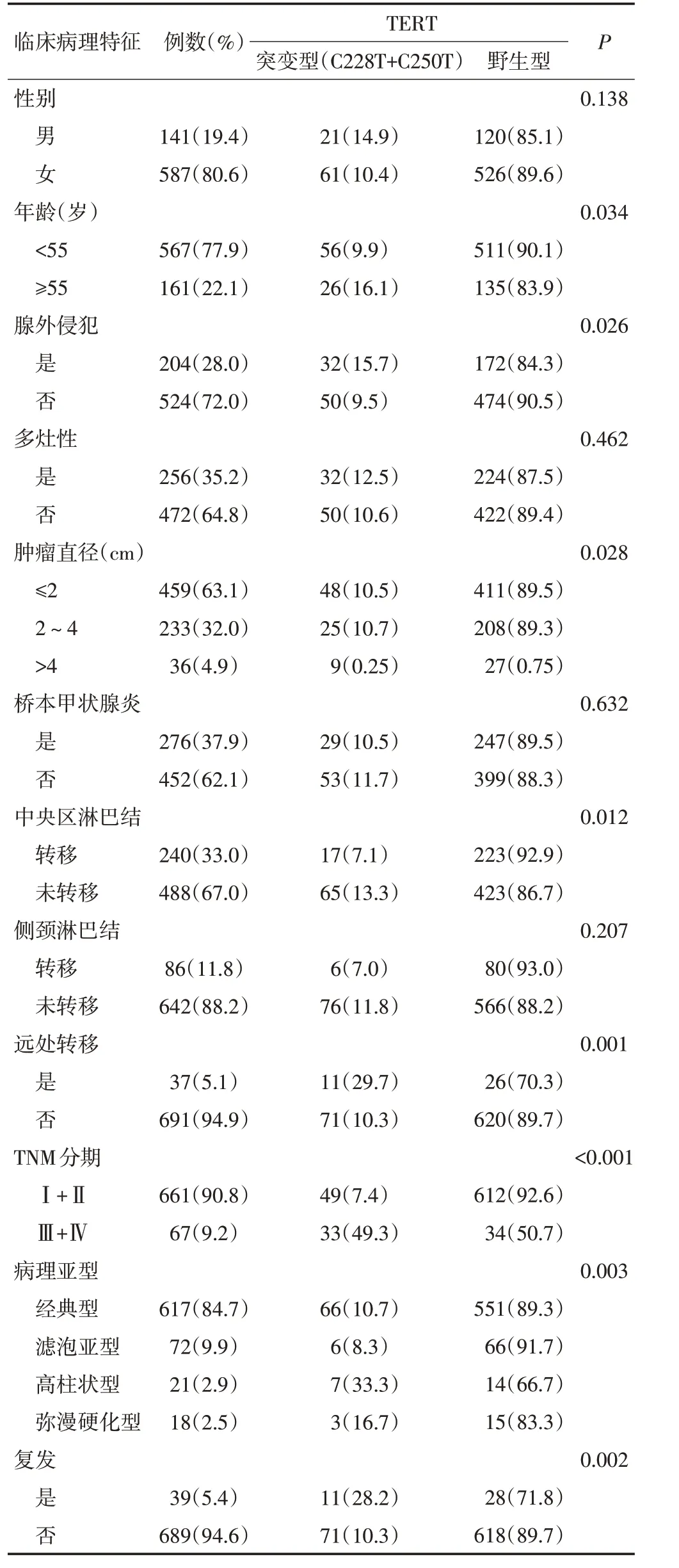
表1 TERT启动子突变与临床病理因素之间的关系例(%)
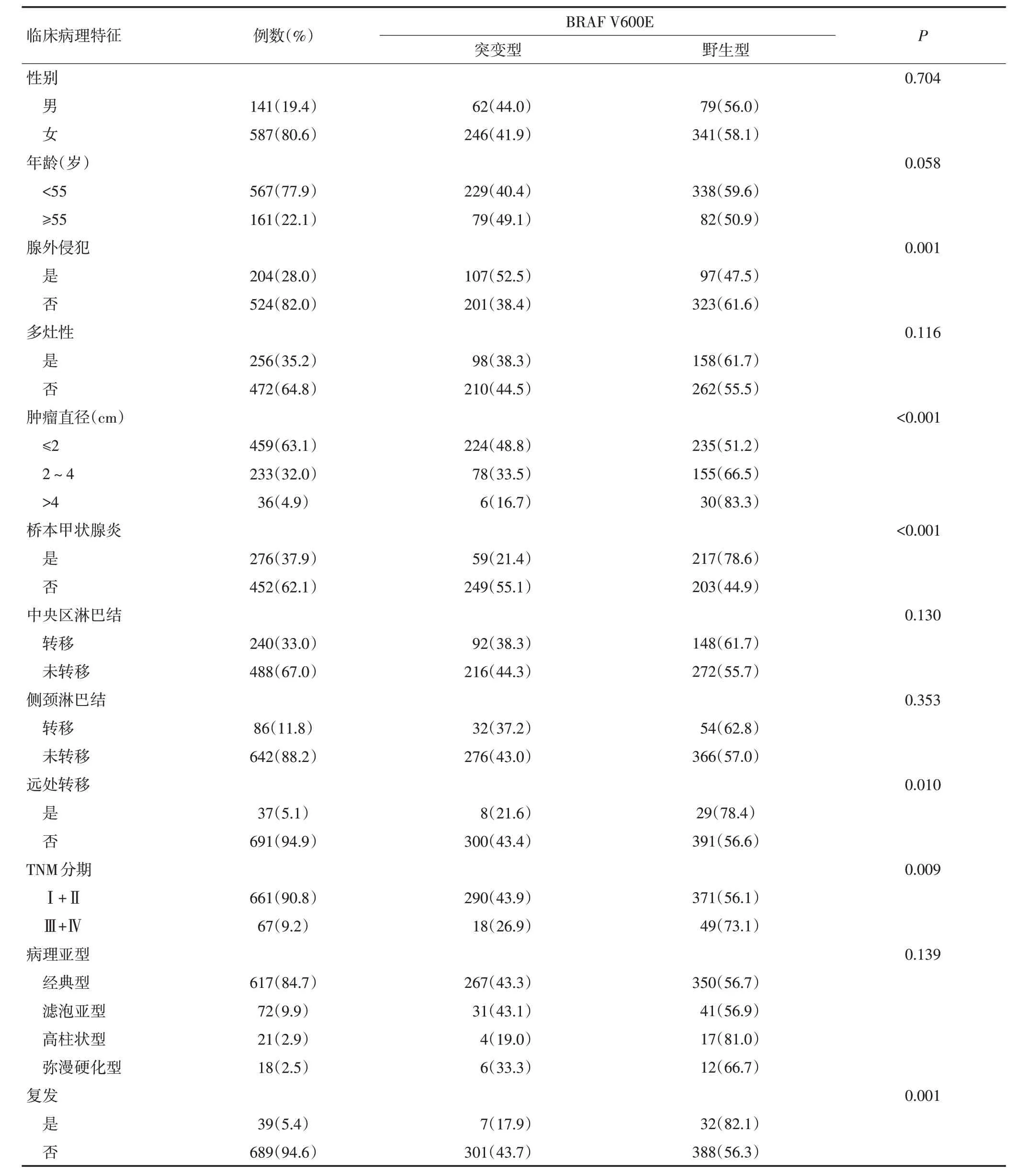
表2 BRAF V600E突变与临床病理因素之间的关系例(%)
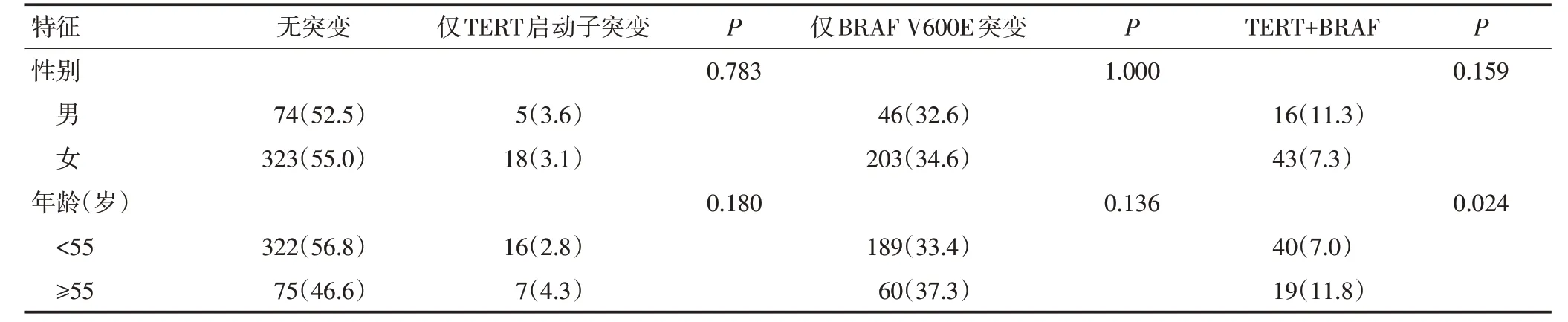
表3 仅TERT启动子突变、仅BRAF V600E突变和TERT与BRAF V600E突变共存与PTC患者临床病理因素之间的关系例(%)
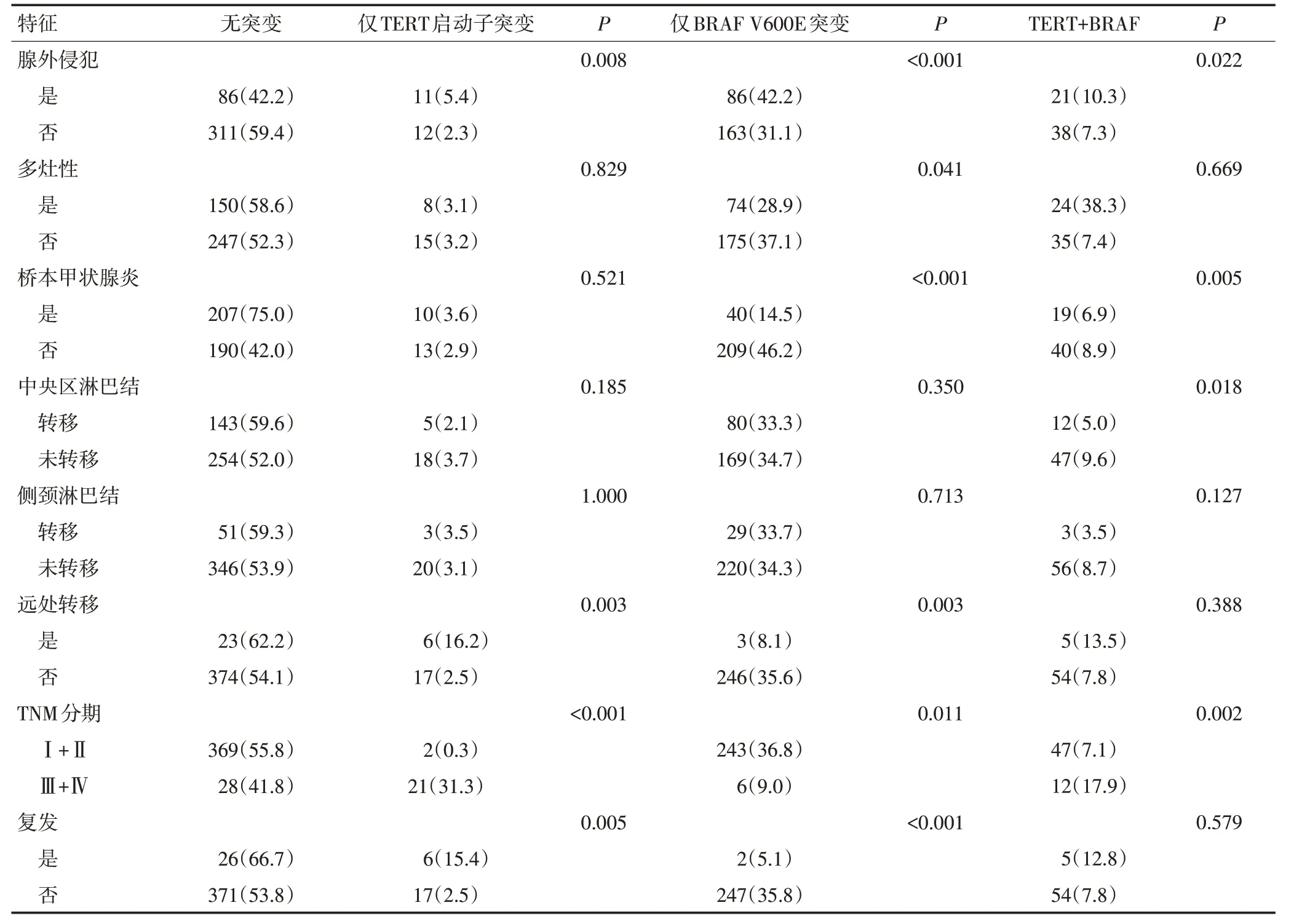
表3 仅TERT启动子突变、仅BRAF V600E突变和TERT与BRAF V600E突变共存与PTC患者临床病理因素之间的关系例(%)(续表3)
3 讨论
本研究为目前国内对PTC 中TERT启动子突变较大样本量的研究,证实TERT启动子突变对高侵袭性PTC 肿瘤的发生发展具有重要作用。目前国内外研究报道PTC患者中TERT启动子突变率约7.3%~25.5%[5,7-10],本研究中TERT启动子突变率为11.2%,较文献报道较低,可能因为TERT启动子突变更常发生在肿瘤晚期,而本研究中临床分期Ⅲ、Ⅳ期的患者仅占9.2%,但其突变率高达49.3%,说明TERT启动子突变对中晚期甲状腺癌具有深远的影响。本研究发现在PTC 不同的病理亚型中,高柱状细胞亚型TERT启动子突变率最高(33.3%)。高柱状亚型是一种相对罕见,但恶性程度较经典型和滤泡亚型均更高的病理亚型,表明TERT基因在高侵袭的病理亚型中可能扮演重要的角色,也再次说明TERT启动子突变对PTC 的进展与侵袭发挥重要的作用。目前BRAF V600E突变对高侵袭性甲状腺癌临床病理因素的关系尚存争议[11-12],本研究证实BRAF V600E 与PTC高侵袭性的特征显著相关,为之前的研究提供了有力的支持。
有多项报道PTC中BRAF V600E突变与TERT启动子突变之间的关联。有研究表明,BRAF V600E与TERT启动子突变存在协同作用,与PTC的不良预后密切相关[5,13]。然而也有研究认为BRAF V600E和TERT启动子突变无明显关联。但这些研究的样本量较少,其中TERT与BRAF突变的病例更少,以至于缺乏统计学效力。因此,此争议的解决依赖于大样本的研究。本研究发现BRAF V600E和TERT启动子突变之间的存在显著关联。
BRAF V600E与TERT启动子突变的协同作用可在分子水平得到解释。TERT通过添加端粒维持染色体的长度,促进细胞增殖减少细胞凋亡,使细胞获得永生性[8,14]。TERT启动子C228T和C250T突变通过产生E-twenty-six(ETS)转录因子的结合位点促进TERT基因的表达[5-6],一些ETS因子同时也是MAPK信号通路上的靶点。而BRAF V600E突变引起的MAPK信号通路异常激活在PTC发生发展中起到重要作用,因此TERT启动子突变可能与PTC发展中涉及MAPK信号传导的机制相关。TERT启动子突变产生ETS转录因子的结合位点,在被BRAF V600E促进MAPK信号传导激活后启动或增强表达[13,15]。TERT启动子和BRAF V600E突变之间的这种关联为TERT表达的扩增创造有利环境。本研究结果与上述假设一致,BRAF V600E突变组中TERT启动子突变率更高,反之亦然。
本研究中,仅发生TERT启动子突变和仅发生BRAF V600E突变的PTC 与肿瘤复发和远处转移显著相关,但同时伴有TERT和BRAF V600E突变与复发和转移的关系差异无统计学意义。分析其原因可能为本研究随访中位时间2年,随访时间较短,可能严重低估了TERT和BRAF 对患者复发的影响,需要更长时间的随访,对资料进行生存分析,以进一步证实TERT和BRAF基因对患者预后的影响。
本研究证实BRAF V600E和TERT启动子突变与高侵袭性的临床病理因素相关,BRAF V600E和TERT 存在协同作用,对于指导治疗和评估预后具有积极作用。
