NTRK突变肺癌患者的临床特征和预后分析*
2020-07-27
NTRK基因家族包括NTRK1、NTRK2、NTRK3,分别编码神经营养受体酪氨酸激酶TRKA、TRKB、TRKC,参与神经元发育与分化[1]。NTRK融合为罕见突变,在常见肿瘤类型如肺癌、胰腺癌、结直肠癌、黑色素瘤中发生率<1%,但在某些罕见的肿瘤类型,如分泌型乳腺癌和婴儿纤维肉瘤,发生率可高达90%,是多种肿瘤的致癌驱动因素[2]。临床研究显示,小分子神经营养受体酪氨酸激酶(TRK)抑制剂larotractinib和entrectinib治疗NTRK融合突变肿瘤具有快速且持久的临床反应和耐受性[3]。然而,获得性耐药不可避免,二代TRK抑制剂LOXO-195和repotrectinib在临床试验中展现出积极的抗肿瘤活性[4]。NTRK点突变、插入缺失已在多种肿瘤中被发现,包括肺癌、血液肿瘤和黑色素瘤,但NTRK点突变和拷贝数扩增在促进肿瘤发生和癌症进展中的作用尚未明确[5-8]。本研究回顾性分析28例NTRK突变肺癌患者的临床特征、治疗情况以及预后,以期为进一步研究奠定基础。
1 材料与方法
1.1 资料的收集
收集2016年10月至2019年11月就诊于华中科技大学同济医学院附属同济医院胸部肿瘤科且接受二代测序(next-generation sequencing,NGS)的肺癌患者314例,所有患者均经组织活检病理诊断为原发性肺癌,其中存在NTRK突变的患者共28例,纳入本研究。收集患者的临床资料,包括性别、年龄、吸烟史、病理类型、分期、NTRK突变类型、合并突变、程序性死亡配体1(programmed cell death ligand 1,PD-L1)表达水平、肿瘤突变负荷(tumor mutation burden,TMB)和治疗情况。
1.2 随访
采用电话和返院复查的方式进行随访,随访截至2020年1月。28例患者中,25例患者获得随访,随访成功率为89.29%,随访时间为1~52个月。无进展生存时间(progression-free survival,PFS)指从一线治疗开始至肿瘤进展或任何原因引起死亡的时间。随访截止时未进展患者以访视截止时间计算PFS。
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行统计学分析。采用Kaplan-Meier法进行生存分析,采用Log-rank检验比较两组患者间的差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 NTRK突变频率
收集2016年10月至2019年11月就诊于华中科技大学同济医学院附属同济医院胸部肿瘤科且行NGS的肺癌患者共314例,检测出NTRK突变的患者28例(8.92%)。其中外周血标本217例,组织标本175例,胸腔积液标本32例,脑脊液标本9例,NTRK突变阳性者分别为12例、16例、3例和2例,其中包括3例患者外周血和组织标本均为阳性,2例患者外周血和胸腔积液标本均为阳性。外周血NTRK突变率5.53%,组织NTRK突变率9.14%,组织标本阳性率高于外周血标本。28例患者中,NTRK1突变患者10例(3.18%),其中点突变4例、拷贝数扩增6例。NTRK2突变患者6例(1.91%),其中点突变4例、拷贝数扩增2例。NTRK3突变患者13例(4.14%),12例为点突变,其中1例合并NTRK2拷贝数扩增,另外1例为AEN-NTRK3基因融合突变。
2.2 临床特征
28例患者中,男性21例(75%),女性7例(25%);中位年龄62.5(34~84)岁;14例(50%)患者无吸烟史,另14例(50%)有吸烟史;27例(96.43%)患者诊断为Ⅳ期,1例(3.57%)患者诊断为ⅢC期(T4N3M0),基因检测结果示AEN-NTRK3(A1:N18)基因重排;腺癌17例(60.71%),鳞癌6例(21.43%),神经内分泌癌2例(7.14%),小细胞癌2例(7.14%),低分化癌1例(3.57%);19例(67.86%)患者合并其他致癌基因突变,其中合并EGFR 19del突变者6例(21.43%),合并EGFR 21L858R突变者5例(17.86%),合并EGFR 21L861Q突变者1例(3.57%),合并EGFR 21D837Y突变者1例(3.57%),合并ROS1融合者1例(3.57%),合并RET融合者1例(3.57%),合并KRAS G12D突变者2例(7.14%)(表1)。
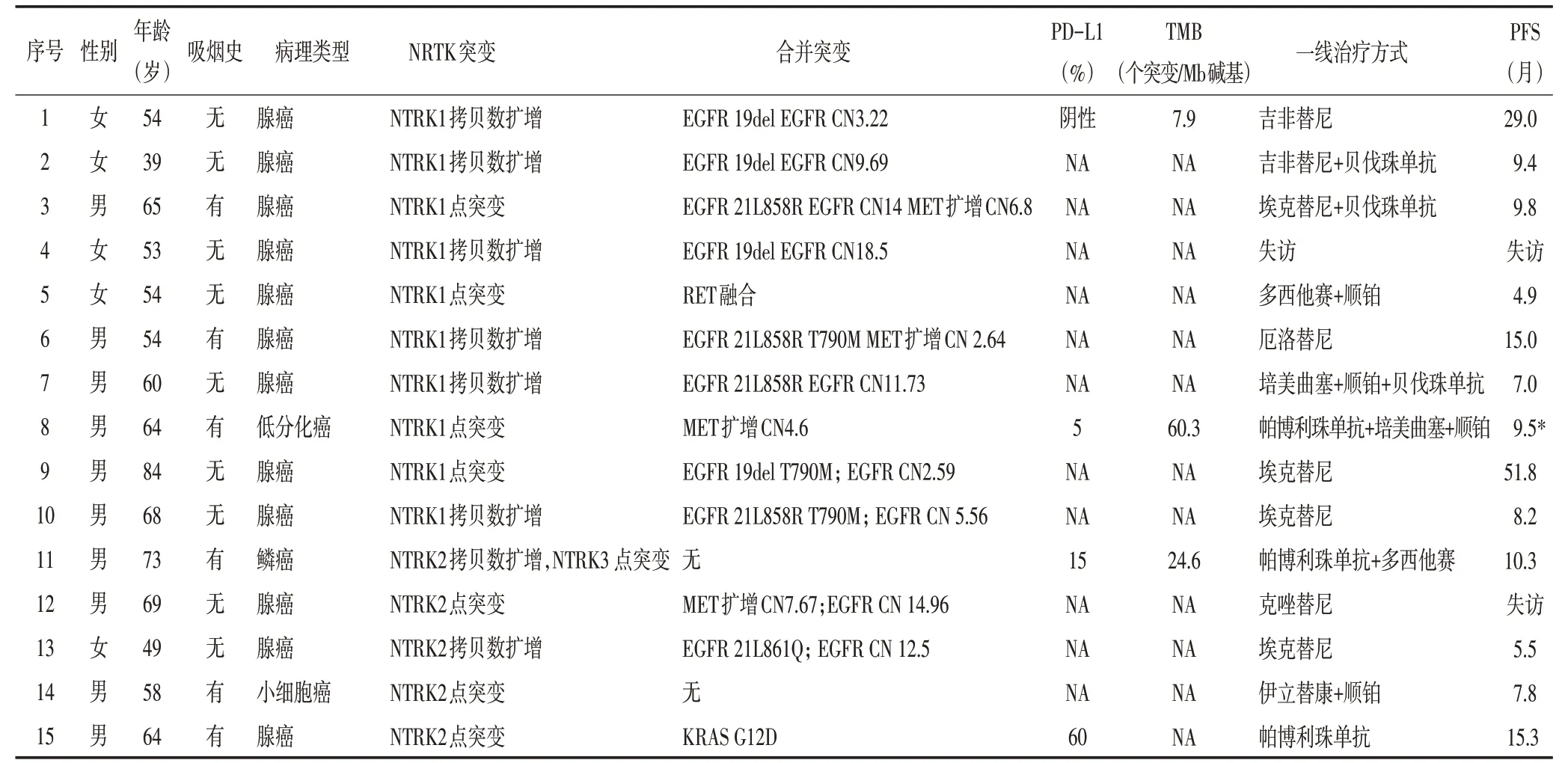
表1 NTRK突变患者临床资料
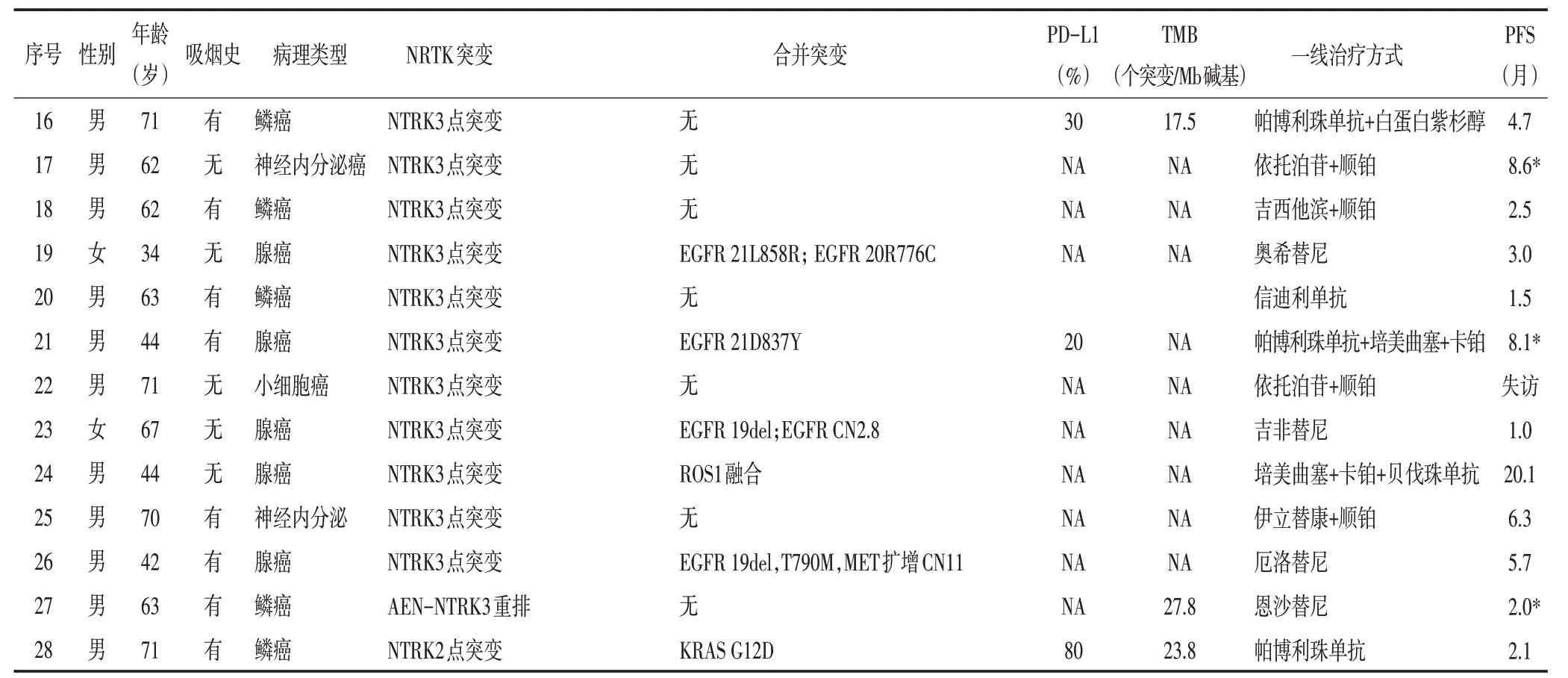
表1 NTRK突变患者临床资料(续表1)
2.3 治疗情况
28例患者的一线治疗方案中,12例为靶向治疗,6例为单纯化疗,2例为化疗联合抗血管治疗,3例为PD-1(programmed cell death 1,程序性死亡受体1)抑制剂治疗,4例为PD-1抑制剂联合化疗,1例患者失访,治疗情况不详(表1)。
2.4 生存分析
随访截至2020年1月(随访时间1~52个月),仍有4例患者一线治疗未进展。28例患者中3例失访,不纳入生存分析。单因素分析结果显示,接受一线治疗的NTRK突变肺癌患者PFS 与肿瘤组织病理类型相关,腺癌和鳞癌患者PFS分别为9.4个月和2.5个月(P<0.05,表2,图1),而与患者的年龄、性别、吸烟史、NTRK突变位点、NTRK突变类型、是否合并经典突变无关(均P>0.05,表2)。
纳入生存分析的25例患者中11例患者接受一线靶向治疗,中位无进展生存时间(mPFS)为9.4个月;5例患者接受一线化疗,mPFS为6.3个月;2例患者接受一线化疗联合抗血管治疗,mPFS为13.6个月;3例患者接受一线PD-1抑制剂治疗,mPFS为2.1个月;4例患者接受一线PD-1抑制剂联合化疗治疗,mPFS为10.3个月。将接受不同一线治疗方式的患者PFS 进行比较,是否接受靶向治疗、化疗联合或不联合免疫治疗、免疫治疗联合或不联合化疗、是否接受抗血管治疗,差异均无统计学意义(均P>0.05)。一线接受表皮生长因子受体酪氨酸激酶抑制剂(EG⁃FR-TKIs)治疗的NTRK突变合并EGFR突变患者有10例,其中NTRK1突变者6例,mPFS为12.4个月;NTRK2突变者1例,PFS为5.5个月;NTRK3突变者3例,mPFS为3.0个月。一线接受EGFR-TKIs 治疗的NTRK1突变和NTRK3突变患者的PFS差异具有统计学意义(P<0.05,表3,图2)。
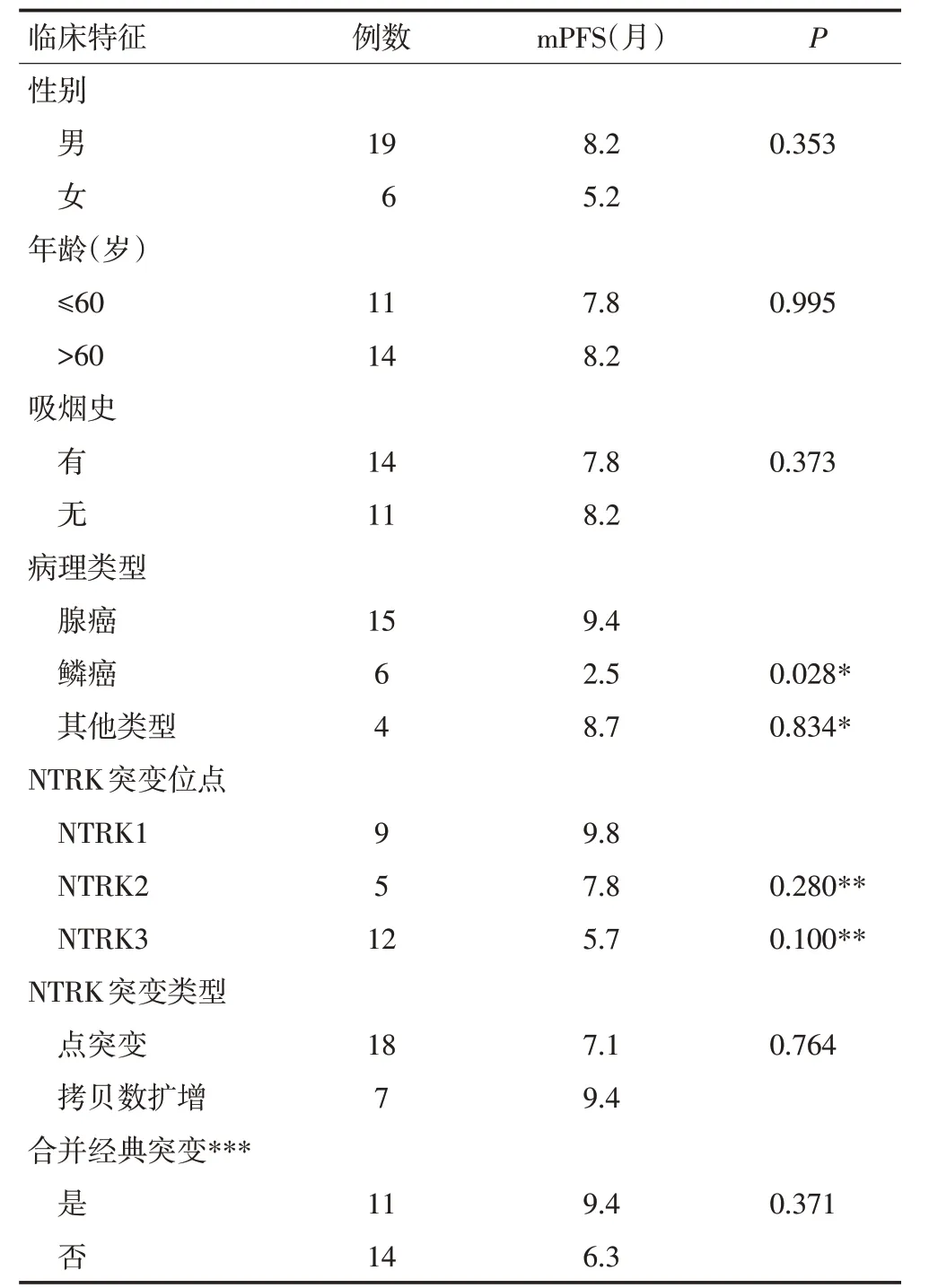
表2 不同临床特征NTRK突变患者的预后比较
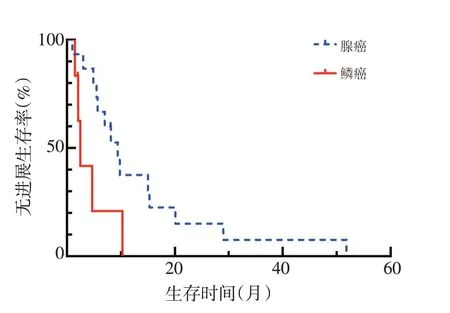
图1 NTRK突变肺腺癌与肺鳞癌患者PFS比较
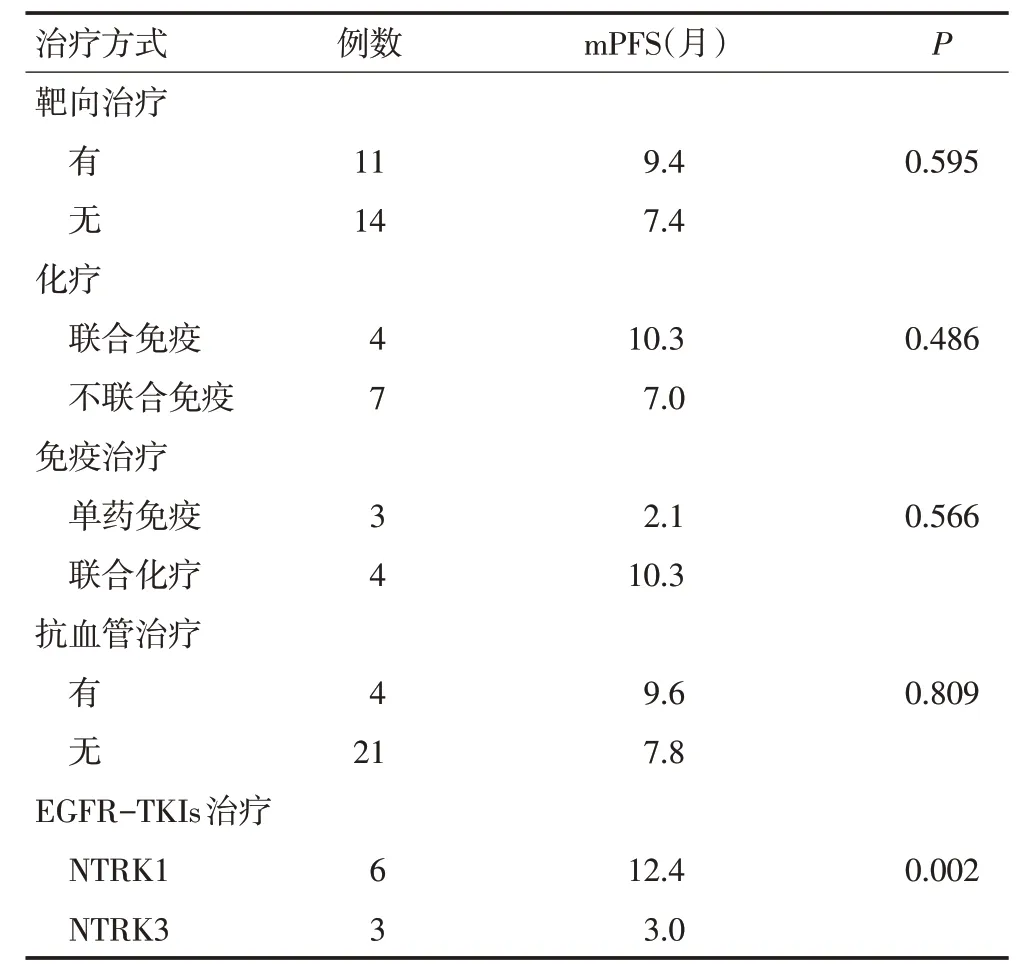
表3 不同治疗方式NTRK突变患者的预后比较

图2 NTRK突变合并EGFR突变患者接受EGFR-TKIs治疗PFS比较
3 讨论
目前美国国立综合癌症网络(NCCN)指南推荐肺癌患者进行检测的基因包括EGFR、ALK、ROS1、BRAF、NTRK、ERBB2、KRAS、MET、RET。随着NGS技术的发展,越来越多与肿瘤发生、发展、治疗或预后相关的基因被发现,相关靶向药物的研发使肿瘤患者的生存得以延长。目前对NTRK融合突变的研究取得了一定的进展,不论肿瘤组织类型,存在NTRK融合突变的患者使用第一代TRK抑制剂,如larotrectinib或entrectinib,治疗反应率>75%,且耐受良好[2]。但关于NTRK点突变、拷贝数扩增等其他突变的研究比较少,肺癌患者中NTRK突变的临床意义尚不明确。本研究回顾性分析28例NTRK突变肺癌患者的临床资料、基因检测结果、治疗情况以及PFS,探讨NTRK突变肺癌患者临床特征、基因突变情况与预后的关系。
本研究结果显示,接受一线治疗的NTRK突变肺癌患者PFS 与肿瘤组织病理类型相关,腺癌患者mPFS 优于鳞癌患者,分别为9.4个月和2.5个月。可能的原因有:1)肺腺癌患者合并EGFR突变的比例较高,接受靶向治疗的比例更高,可能提高患者PFS;2)未合并EGFR突变的腺癌患者在化疗的同时可联合使用抗血管治疗,可能提高患者PFS。但由于本研究样本量较小,未来需大样本研究进行验证。
目前,TRK抑制剂治疗NTRK融合突变的肿瘤患者已取得了较好的疗效[4]。但NTRK点突变或者拷贝数扩增的临床意义尚不明确,无相应的靶向药物,其治疗方案与是否合并经典突变有关,合并经典突变的患者可选择相应的靶向药物治疗,无经典突变患者主要的治疗方式为化疗或免疫治疗[9]。但是,当合并其他经典突变时,NTRK突变状态可能会影响经典突变靶向药物的疗效。有研究报道,NTRK1融合突变可能是EGFR-TKIs 的耐药机制之一,但具体分子机制尚不明确[10-11]。NTRK融合突变在肺癌中十分罕见,发生率不足1%。本研究收集的314例患者中仅1例NTRK融合,为AEN-NTRK3(A1:N18)基因重排,该患者目前正在接受临床试验药物ensartinib 治疗,临床疗效尚待进一步评估。NTRK点突变在肺癌中相对更为常见,有文献报道,NTRK2和NTRK3点突变在肺大细胞神经内分泌癌中发生率约为10%,但在其他的组织学亚型中尚未发现[8]。而Ding 等[12]的研究通过检测188例肺腺癌患者标本,发现其中20例存在NTRK点突变,NTRK突变阳性率为10.64%,提示NTRK突变不止存在于肺大细胞神经内分泌癌。本研究收集的314例患者中共检测出NTRK突变28例,突变率为8.92%,其中腺癌17例、鳞癌6例、神经内分泌癌2例、小细胞癌2例、低分化癌1例。由于NTRK突变属于少见突变,未来需要更大样本量的研究来证实不同病理类型中NTRK 的突变率。在本研究的28例NTRK突变患者中,合并EGFR突变且一线接受EGFR-TKIs 治疗的患者10例,均为非小细胞肺癌,其中NTRK1突变6例,mPFS为12.4个月;NTRK2突变仅1例,PFS为5.5个月;NTRK3突变3例,mPFS为3.0个月。NTRK3突变的肺癌患者接受EGFR-TKIs治疗的PFS明显短于NTRK1突变的肺癌患者,差异具有统计学意义。EGFR敏感突变非小细胞肺癌患者一线接受一代EGFR-TKIs的mPFS为9~13个月[13],接受第三代EGFR-TKI 奥希替尼治疗的mPFS为18.9个月[14]。本研究中EGFR敏感突变合并NTRK3突变的非小细胞肺癌患者接受EGFR-TKIs治疗后PFS 明显短于未经选择的EGFR 敏感突变的和合并NTRK1突变的非小细胞肺癌患者,由此推断NTRK3突变可能是EGFR突变非小细胞肺癌患者预后不良的因素之一。但由于本研究为小样本量的回顾性研究,存在一定的局限性,需大规模前瞻性临床研究来进一步验证NTRK3突变与EGFR-TKIs疗效的关系。
综上所述,随着NGS技术的发展,越来越多未知基因在肿瘤发生、发展以及治疗中的作用得以研究和发现。针对非小细胞肺癌患者进行大通量NGS检测有一定的临床意义。本研究首次报道NTRK3突变可能是EGFR 敏感突变非小细胞肺癌患者预后不良的因素之一,期待未来开展更多的基础和临床研究去证实。
