DDQ介导的新型3-吲哚烷酮及吡喃酮并[2,3-b]吲哚类化合物的合成
2020-07-22黄江坤
黄江坤,何 菱
(四川大学 华西药学院,四川 成都 610041)
吲哚是许多药物和天然活性化物的基本结构单元,吲哚衍生物具有广泛生物活性,如镇痛抗炎药吲哚美辛[1]、止吐药昂丹司琼[1]、具有抗乙酰胆碱酯酶和丁酰胆碱酯酶活性的天然毒扁豆碱和囊毒碱等[2-3](Chart 1)。吡喃酮是一种重要的活性结构单元,存在于多种具有生物活性的天然产物中,如母核结构为苯并吡喃酮的黄酮类和香豆素类化合物具有抗菌、抗肿瘤、抗凝血等生物活性[4-8]。吡喃酮并吲哚结构作为吲哚和吡喃酮的拼合结构也具有较好的生物活性,如郭博祥[9]等人合成了吡喃酮并[3,4-b]吲哚衍生物,发现其具有抗肿瘤、抗菌、消炎、抑制蛋白酶等生物活性。鉴于吡喃酮并吲哚衍生物具有潜在的生物活性和应用价值,但目前关于该类衍生物的合成还鲜有报道,因此有必要进一步开展该类化合物的合成研究。

Chart 1
本文以简单的1-(1H-吲哚-3-基)戊烷-3-醇(1a~1j)为底物,2,3-二氯-5,6-二氰基对苯醌(DDQ)为氧化剂,三氟甲磺酸铜为催化剂,甲醇为溶剂合成了5个氧化关环产物吡喃酮并[2,3-b]吲哚类结构和9个氧化未关环产物3-吲哚烷酮类结构(Scheme 1),其结构经1H NMR,13C NMR和HR-MS(ESI)表征。

Scheme 1
1 实验部分
1.1 仪器与试剂
Varian Mercury 400 MHz/600 MHz 型核磁共振仪(DMSO-d6,TMS 为内标);Bruker Daltonics Data analysis 3.2 mass spectrometer 型质谱仪。
1-(1H-吲哚-3-基)戊烷-3-醇及其衍生物(1a~1j)按文献[10]方法合成;所用试剂均为分析纯。
1.2 2a~2j,3a~3e的合成(以2a和3a为例)
称取1-(1H-吲哚-3-基)戊烷-3-醇(1a) 0.25 mmol,三氟甲磺酸铜 90 mg(0.25 mmol)和DDQ 170 mg(0.75 mmol)于10 mL圆底烧瓶中,将3.0 mL甲醇,45 μL(2.50 mmol)水先后加入,将该混合物于室温下搅拌30 min,再将3.0 mL饱和碳酸氢钠溶液加入搅拌10 min,用40 mL乙酸乙酯提取反应液,反应液用饱和氯化钠溶液(3×10 mL)洗涤、无水硫酸钠干燥、减压浓缩,残渣经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=4/1~1/1,V/V)纯化得化合物2a,3a。
用类似的方法合成2b~2j,3b~3e。
3-羟基-1-(1H-吲哚-3-基)戊烷-1-酮(2a):白色固体,收率59%;1H NMR(400 MHz,DMSO-d6)δ:11.92(s,1H),8.30(d,J=3.0 Hz,1H),8.20(dd,J=7.1 Hz,1.8 Hz,1H),7.46(dd,J=7.2 Hz,1.7 Hz,1H),7.18(pd,J=7.2 Hz,1.5 Hz,2H),4.56(d,J=5.2 Hz,1H),3.94(tq,J=7.4 Hz,5.1 Hz,1H),2.95(dd,J=14.4 Hz,7.6 Hz,1H),2.80(dd,J=14.4 Hz,5.0 Hz,1H),1.53~1.35(m,2H),0.89(t,J=7.4 Hz,3H);13C NMR(151 MHz,DMSO-d6)δ:194.8,137.0,134.7,125.8,123.1,122.0,121.8,117.6,112.5,69.5,47.3,30.5,10.5;HR-MS(ESI)m/z:Calcd for C13H15NO2Na{[M+Na]+}240.0995,found 240.0996。
2-乙基-2,3-二氢吡喃并[2,3-b]吲哚-4(9H)-酮(3a):淡黄色固体,收率30%;1H NMR(400 MHz,DMSO-d6)δ:11.97(s,1H),7.75~7.72(m,1H),7.25~7.21(m,1H),7.12~7.08(m,2H),4.75(dddd,J=12.3 Hz,7.1 Hz,5.3 Hz,3.5 Hz,1H),2.64(dd,J=16.8 Hz,12.3 Hz,1H),2.45(dd,J=16.8 Hz,3.5 Hz,1H),1.95~1.76(m,2H),1.03(t,J=7.4 Hz,3H);13C NMR(151 MHz,DMSO-d6)δ:185.6,162.8,132.4,124.0,122.6,122.5,119.9,111.9,96.4,84.6,41.9,27.8,10.1;HR-MS(ESI)m/z:Calcd for C13H14NO2{[M+H]+}216.1019,found 216.1010。
3-羟基-1-(1H-吲哚-3-基)丙烷-1-酮(2b):白色固体,收率65%;1H NMR(400 MHz,DMSO-d6)δ:11.93(s,1H),8.32(d,J=3.1 Hz,1H),8.24~8.14(m,1H),7.46(d,J=7.2 Hz,1H),7.24~7.12(m,2H),3.78(t,J=6.5 Hz,2H),2.98(t,J=6.4 Hz,2H);13C NMR(101 MHz,DMSO-d6)δ:194.6,137.1,134.6,125.9,123.2,122.1,121.8,117.4,112.5,58.2,43.0;HR-MS(ESI)m/z:Calcd for C11H12NO2{[M+H]+}190.0868,found 190.0872。
2,3-二氢吡喃并[2,3-b]吲哚-4(9H)-酮(3b):淡黄色固体,收率28%;1H NMR(400 MHz,DMSO-d6)δ:12.00(s,1H),7.75(dd,J=6.2 Hz,2.9 Hz,1H),7.25(dd,J=6.0 Hz,3.0 Hz,1H),7.14~7.06(m,2H),4.72(t,J=6.4 Hz,2H),2.60(t,J=6.4 Hz,2H);13C NMR(101 MHz,DMSO-d6)δ:185.2,162.4,131.9,123.8,122.4,122.2,119.7,111.6,96.5,71.1,36.6;HR-MS(ESI)m/z:Calcd for C11H10NO2{[M+H]+}188.0706,found 188.0697。
1-(4-(苄氧基)-1H-吲哚-3-基)-3-羟基戊烷-1-酮(2c):淡黄色固体,收率20%;1H NMR(400 MHz,DMSO-d6)δ:11.87(s,1H),7.99(d,J=3.0 Hz,1H),7.60(d,J=7.2 Hz,2H),7.38(t,J=7.7 Hz,2H),7.31(t,J=7.3 Hz,1H),7.15~7.02(m,2H),6.75(d,J=7.6 Hz,1H),5.20(s,2H),4.41(d,J=5.3 Hz,1H),3.90~3.79(m,1H),2.96(dd,J=15.0 Hz,7.7 Hz,1H),2.90(dd,J=15.1 Hz,5.1 Hz,1H),1.31(dt,J=12.7 Hz,8.0 Hz,2H),0.79(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:195.1,153.0,139.3,137.9,132.4,128.7,128.0,127.9,123.9,119.4,106.1,104.3,70.1,69.4,49.7,30.3,10.4;HR-MS(ESI)m/z:Calcd for C20H21NO3Na{[M+Na]+}346.1414,found 346.1416。
5-(苄氧基)-2-乙基-2,3-二氢吡喃[2,3-b]吲哚-4(9H)-酮(3c):淡黄色固体,收率51%;1H NMR(400 MHz,DMSO-d6)δ:12.02(s,1H),7.78(d,J=7.1 Hz,2H),7.37(t,J=7.5 Hz,2H),7.28(t,J=7.3 Hz,1H),7.03(t,J=8.0 Hz,1H),6.86(d,J=7.8 Hz,1H),6.75(d,J=8.0 Hz,1H),5.18(s,2H),4.77(ddt,J=11.9 Hz,8.4 Hz,4.6 Hz,1H),2.60(dd,J=16.7 Hz,11.7 Hz,1H),2.48(d,J=3.8 Hz,1H),1.90~1.80(m,1H),1.72(ddt,J=14.1 Hz,9.5 Hz,5.7 Hz,1H),1.57~1.43(m,2H),0.96(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:183.1,161.7,152.4,138.5,133.9,128.5,127.5,127.4,123.5,113.6,106.5,105.3,96.1,81.8,70.2,42.7,36.3,18.3,14.2;HR-MS(ESI)m/z:Calcd for C20H20NO3{[M+H]+}322.1438,found 322.1445。
3-羟基-1-(5-甲氧基-1H-吲哚-3-基)戊烷-1-酮(2d):白色固体,收率60%;1H NMR(400 MHz,DMSO-d6)δ:11.80(s,1H),8.24(d,J=2.6 Hz,1H),7.74(d,J=2.5 Hz,1H),7.36(d,J=8.8 Hz,1H),6.84(dd,J=8.8 Hz,2.6 Hz,1H),4.55(d,J=5.2 Hz,1H),3.94(tq,J=7.5 Hz,5.1 Hz,1H),3.78(s,3H),2.93(dd,J=14.4 Hz,7.5 Hz,1H),2.79(dd,J=14.4 Hz,5.2 Hz,1H),1.54~1.35(m,2H),0.90(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:194.8,155.8,135.0,131.9,126.6,117.5,113.2,113.1,103.5,69.6,55.7,47.2,30.5,10.5;HR-MS(ESI)m/z:Calcd for C14H17NO3Na{[M+Na]+}270.1101,found 270.1105。
2-乙基-6-甲氧基-2,3-二氢吡喃并[2,3-b]吲哚-4(9H)-酮(3d):浅黄色固体,收率25%;1H NMR(400 MHz,DMSO-d6)δ:11.81(s,1H),7.27(d,J=2.6 Hz,1H),7.12(d,J=8.6 Hz,1H),6.70(dd,J=8.7 Hz,2.6 Hz,1H),4.72(dddd,J=12.2 Hz,7.0 Hz,5.4 Hz,3.5 Hz,1H),3.75(s,3H),2.62(dd,J=16.8 Hz,12.2 Hz,1H),2.44(dd,J=16.8 Hz,3.5 Hz,1H),1.91~1.77(m,2H),1.03(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:185.3,162.5,155.7,126.4,124.5,112.3,110.4,103.2,96.3,84.1,55.8,41.5,27.4,9.7;HR-MS(ESI)m/z:Calcd for C14H16NO3{[M+H]+}246.1130,found 246.1121。
5-(苄氧基)-2-丙基-2,3-二氢吡喃并[2,3-b]吲哚-4(9H)-酮(3e):淡黄色固体,收率65%;1H NMR (400 MHz,DMSO-d6)δ:12.02(s,1H),7.78(d,J=7.1 Hz,2H),7.37(t,J=7.5 Hz,2H),7.28(t,J=7.3 Hz,1H),7.03(t,J=8.0 Hz,1H),6.86(d,J=7.8 Hz,1H),6.75(d,J=8.0 Hz,1H),5.18(s,2H),4.77(ddt,J=11.9 Hz,8.4 Hz,4.6 Hz,1H),2.60(dd,J=16.7 Hz,11.7 Hz,1H),2.48(d,J=3.8 Hz,1H),1.90~1.80(m,1H),1.72(ddt,J=14.1 Hz,9.5 Hz,5.7 Hz,1H),1.57~1.43(m,2H),0.96(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:183.1,161.7,152.4,138.5,133.9,128.5,127.5,127.4,123.5,113.6,106.5,105.3,96.1,81.8,70.2,42.7,36.3,18.3,14.2;HR-MS(ESI)m/z:Calcd for C21H22NO3{[M+H]+}336.1594,found 336.1610。
3-羟基-1-(4-甲基-1H-吲哚-3-基)戊烷-1-酮(2f):淡黄色固体,收率32%;1H NMR(400 MHz,DMSO-d6)δ:11.86(s,1H),8.26(d,J=3.2 Hz,1H),7.29~7.23(m,1H),7.08(dd,J=8.1Hz,7.2 Hz,1H),6.90(dt,J=7.1Hz,1.0 Hz,1H),4.53(d,J=5.3 Hz,1H),3.93(tq,J=7.6 Hz,5.0 Hz,1H),2.98(dd,J=14.5 Hz,7.7 Hz,1H),2.83(dd,J=14.5 Hz,5.1 Hz,1H),2.70(s,3H),1.52~1.35(m,2H),0.90(t,J=7.4 Hz,3H);13C NMR(151 MHz,DMSO-d6)δ:194.2,138.0,135.3,132.1,124.5,123.7,123.3,119.6,110.1,69.7,48.4,30.4,23.3,10.5;HR-MS(ESI)m/z:Calcd for C14H17NO2Na{[M+Na]+}254.1151,found 254.1156。
1-(5-氯-1H-吲哚-3-基)-3-羟基戊烷-1-酮(2g):白色固体,收率95%;1H NMR(400 MHz,DMSO-d6)δ:12.10(s,1H),8.38(s,1H),8.20(d,J=2.1 Hz,1H),7.49(d,J=8.6 Hz,1H),7.23(dd,J=8.6 Hz,2.2 Hz,1H),4.57(d,J=5.2 Hz,1H),3.95(tq,J=7.3 Hz,5.0 Hz,1H),2.96(dd,J=14.4 Hz,7.7 Hz,1H),2.80(dd,J=14.4 Hz,5.0 Hz,1H),1.53~1.35(m,2H),0.90(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:195.0,136.2,135.6,127.0,126.8,123.2,121.0,117.3,114.2,69.5,47.3,30.5,10.5;HR-MS(ESI)m/z:Calcd for C13H14NO2ClNa{[M+Na]+}274.0605,found 274.0607。
3-(3-羟基戊酰基)-1H-吲哚-5-甲腈(2h):白色固体,收率84%;1H NMR(400 MHz,DMSO-d6)δ:12.41(s,1H),8.62~8.43(m,2H),7.65(d,J=8.4 Hz,1H),7.59(dd,J=8.4 Hz,1.7 Hz,1H),4.60(d,J=5.3 Hz,1H),3.95(tt,J=9.8 Hz,3.8 Hz,1H),2.99(dd,J=14.5 Hz,7.8 Hz,1H),2.82(dd,J=14.4 Hz,4.8 Hz,1H),1.54~1.36(m,2H),0.90(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:195.2,139.0,137.0,126.9,126.2,125.7,120.7,117.9,114.1,104.4,69.4,47.5,30.5,10.5;HR-MS(ESI)m/z:Calcd for C14H14N2O2Na{[M+Na]+}265.0947,found 265.0952。
3-羟基-1-(6-硝基-1H-吲哚-3-基)戊烷-1-酮(2i):白色固体,收率85%;1H NMR(400 MHz,DMSO-d6)δ:12.54(s,1H),8.67(s,1H),8.37(d,J=9.1 Hz,2H),8.07(dd,J=8.8 Hz,2.2 Hz,1H),4.61(d,J=5.3 Hz,1H),3.95(qt,J=7.4 Hz,3.7 Hz,1H),3.00(dd,J=14.4 Hz,7.8 Hz,1H),2.83(dd,J=14.5 Hz,4.7 Hz,1H),1.54~1.37(m,2H),0.90(t,J=7.4 Hz,3H);13C NMR(101 MHz,Chloroform-d)δ:199.8,148.2,144.6,140.5,135.5,126.8,122.7,122.0,114.0,74.2,52.3,35.3,15.3;HR-MS(ESI)m/z:Calcd for C13H14N2O4Na{[M+Na]+}285.0846,found 285.0848。
3-(3-羟基戊酰基)-1H-吲哚-6-羧酸甲酯(2j):白色固体,收率96%;1H NMR(400 MHz,DMSO-d6)δ:12.40~12.15(m,1H),8.52(d,J=3.2 Hz,1H),8.29(d,J=8.4 Hz,1H),8.13~8.06(m,1H),7.80(dd,J=8.4 Hz,1.5 Hz,1H),4.58(s,1H),3.96(tt,J=7.5 Hz,4.9 Hz,1H),3.87(s,3H),2.99(dd,J=14.5 Hz,7.8 Hz,1H),2.82(dd,J=14.4 Hz,4.9 Hz,1H),1.55~1.38(m,2H),0.91(t,J=7.4 Hz,3H);13C NMR(101 MHz,DMSO-d6)δ:195.0,167.2,137.7,136.5,129.5,124.3,122.8,121.7,117.8,114.3,69.5,52.5,47.5,30.5,10.5;HR-MS(ESI)m/z:Calcd for C15H17NO4Na{[M+Na]+}298.1055,found 298.1051。
2 结果与讨论
2.1 反应条件选择
以2a,3a的合成为例:考察了催化剂、氧化剂、溶剂、催化剂的量对反应的影响。
(1) 催化剂
表1为催化剂的选择。由表1可见,Cu(OTf)2、Cu(NO3)2、AgOTf均能催化得到产物2a,其中以Cu(NO3)2的催化效果为最佳,但所有催化剂均无法催化得到目标产物3a。尽管如此,仍选用Cu(NO3)2做为催化剂做进一步反应的探索。
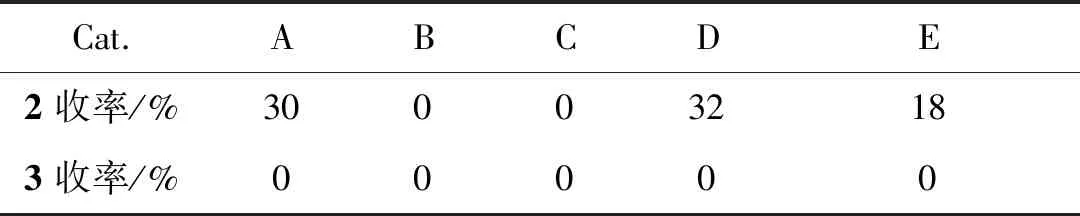
表1 催化剂的选择*Table 1 Selectivity of catalyst
(2) 氧化剂
表2为氧化剂的选择。由表2可见,只有DDQ作为氧化剂可以得到产物2a,其余所有氧化剂均不能得到目标产物3a。因此,选用DDQ作为氧化剂。
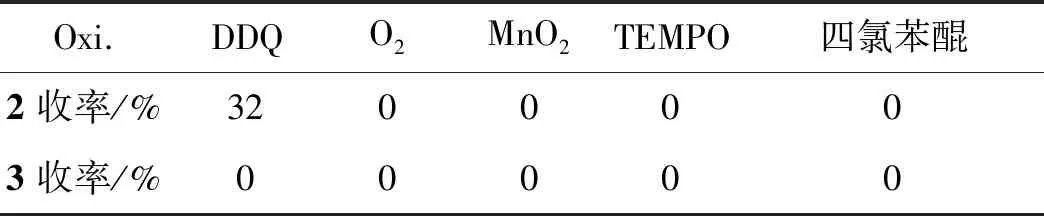
表2 催化剂的选择Table 2 Selectivity of oxidant
(3) 溶剂
表3为溶剂的选择。由表3可见,在一系列其它极性溶剂中2a的收率均比在乙腈中高,其中在甲醇中的收率高达80%,且只有以甲醇为溶剂能得到目标产物3a,故作者选择甲醇为溶剂。
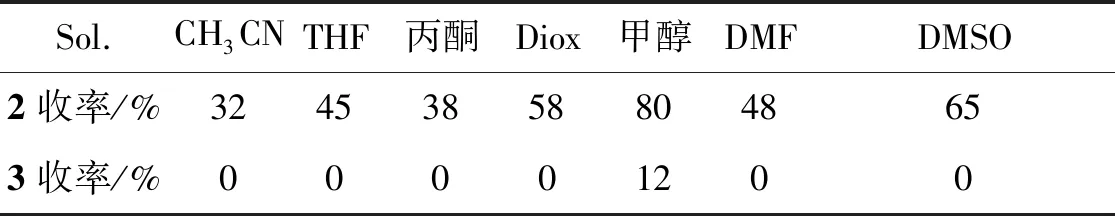
表3 催化剂的选择Table 3 Selectivity of solvent
(4) 催化剂量
表4为催化剂量的选择。由表4可见,同样量Cu(OTf)2的催化效果要略优于Cu(NO3)2,且随Cu(OTf)2的量增加,产物2a的收率降低,3a的收率增加,故作者选择100%mol Cu(OTf)2为催化剂。
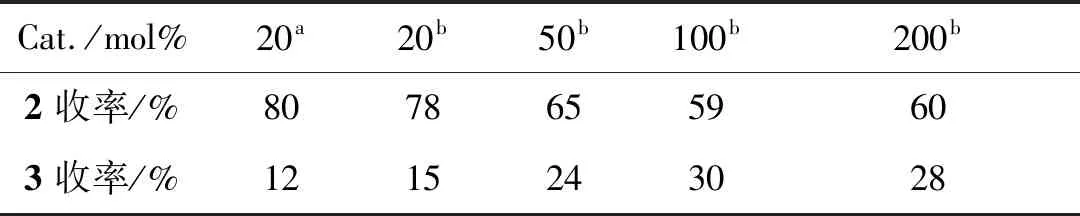
表4 催化剂量的选择Table 4 Selectivity of the amount of catalyst
综上,最终选择反应条件为:100%mol Cu(OTf)2为催化剂,DDQ(3.0 eq.)为氧化剂,水(10 eq.),甲醇为溶剂于室温反应30 min,2a收率为59%,3a收率为30%。
2.2 底物的拓展
在最佳反应条件下,对反应的普适性进行了研究。分别考察了吲哚苯环上的取代基和底物侧链的长度对反应的影响。当吲哚苯环上有供电子基时均可以获得目标化合物3,以4-位苄氧基取代的吲哚产率最高,当吲哚苯环上有吸电子基取代时均可以较高的收率得到化合物2,但遗憾的是无法得到目标化合物3,延长或缩短底物侧链的长度对反应的影响不大。
2.3 反应机理的推测
通过同位素实验及文献报道[11-15],推测了反应的机理。以1a为底物共进行了三组不同反应条件的实验进行反应机理的探究(Scheme 2),分别为隔绝氧气组、隔绝水组和H218O代替H216O参与反应组,通过高分辨质谱监测到产物2a分子量的变化与水分子量的变化同步,而与氧分子无关,且隔绝水组的收率远低于有水组的收率,因此推测产物中氧原子是来源于反应体系中的水分子。其可能的机理见Scheme 3:吲哚3-位苄基在DDQ作用下首先形成碳正离子A并经互变异构形成中间体B,B在水的亲核进攻下形成1,3-二醇结构C,C再在DDQ作用下形成碳正离子D,中间体D的互变异构体E直接经去质子化得到化合物2a,而当侧链醇羟基氧进攻吲哚2-位并通过进一步脱氢得到化合物3a。

Scheme 2
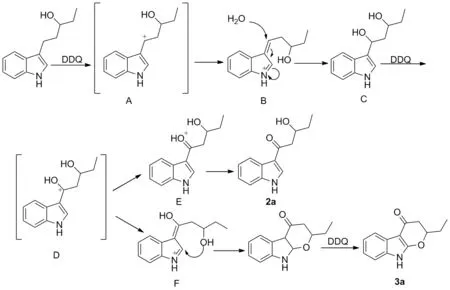
Scheme 3
以1-(1H-吲哚-3-基)戊烷-3-醇及其衍生物为底物,DDQ为氧化剂,甲醇为溶剂室温下反应,共合成了9个3-吲哚烷酮衍生物和5个吡喃酮并[2,3-b]吲哚衍生物。该方法具有反应条件温和、试剂廉价易得、方法简单等优点,为吡喃酮并[2,3-b]吲哚类结构进一步的生物活性研究提供了化合物来源。
