新型氨基嘧啶环戊并[b]吲哚衍生物的合成及抗肿瘤活性
2020-07-22彭玉洁郭振波李淑雅王立升
彭玉洁,郭振波,李淑雅,王立升
(广西大学 医学院,广西 南宁 530004)
在药物、生物碱和潜在治疗剂等材料中,与不同杂环缩合的吲哚衍生物具有较强的生理活性[1]。吲哚结构大量存在于的海洋生物碱中,包括咔唑、四氢咔唑、单吲哚生物碱和双吲哚生物碱[2]等,其衍生物通过作用于多个生物靶点如微管蛋白[3]、去乙酰化酶[4]和PIM[5]等大量应用于临床癌症治疗[6]。环戊并[b]吲哚也出现在大量生物碱中,包括结构复杂的吲哚二萜类天然生物碱如Paxilline[7],Penitrems[8],Lolitrems[9],Janthitrems[10]和Yuehchukene[11](Chart 1)。在生物碱中,含有环戊并[b]吲哚[12]单元的生物碱被发现具有抗菌[13]、抗炎、抗植入[14]、抗氧化、震颤[15]以及抗肿瘤活性[16-18]。而嘧啶作为碱性含氮杂环化合物,该类化合物及其衍生物具有较强的生物活性[19],是治疗领域中许多药物分子的重要组成部分。其中2-氨基嘧啶结构又是许多常见药物的必要结构,是最简单的单取代嘧啶结构,氨基基团在C2位上,能够有效改善抗癌活性[20],也是临床药物的重要中间体[21]。有关环戊并[b]吲哚类化合物和嘧啶类化合物的合成研究备受关注,但对它们之间的串联反应及生物活性研究较少。
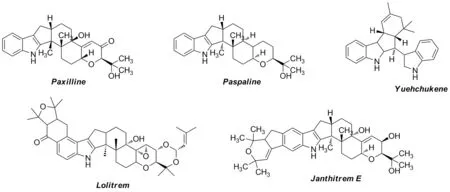
Chart 1
分析结构发现,4-甲基-1,4-二氢环戊二烯并[b]吲哚-3(2H)-酮是环戊并[b]吲哚类化合物的重要衍生物,可作为构建广泛的稠杂环化合物的重要前体,其衍生物具有重要药理活性[22]。此外环戊并[b]吲哚类化合物和醛类化合物反应得(E)-2-芳香基-1,4-二氢环戊二烯并[b]吲哚-3(2H)-酮与盐酸羟胺或丙二氰反应得到的杂环环戊并[b]吲哚衍生物对人子宫颈癌(Hela)细胞和人鼻咽癌(CNE-1)细胞具有较高的抑制活性[23]。根据药物拼合原理,本研究以环戊并[b]吲哚为母环,以4-芳香基嘧啶-2-胺为嫁接物,探索10-甲基-2-氨基-4-R-嘧啶并[4,5-a]环戊并[b]吲哚类化合物的高效合成方法。
本文以3-吲哚丙酸为原料,经环化、N-甲基化、Claisen-Schmidt缩合和环加成反应合成了新型氨基嘧啶环戊并[b]吲哚衍生物(6a~6j,Scheme 1),其结构经1H NMR、13C NMR及HR-MS(ESI)表征,采用MTT法筛选了它们对HepG-2(人肝癌细胞)、HeLa(人子宫颈癌)和CNE-1(人鼻咽癌细胞)的体外细胞活性。

Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker AvanceIII HD 600 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);UPLC I-CLASS-XE-VOG2-XSQTOF型超高效液相-质谱联用仪。
3-吲哚丙酸,多聚磷酸,氢化钠,碘甲烷,芳香甲醛类,盐酸胍均来自萨恩化学技术(上海)有限公司;人肝癌细胞(HepG-2)、人宫颈癌细胞(Hela)和人鼻咽癌细胞(CNE-1)购自美国细胞保存中心(ATCC),并由本课题组传代培养;其余所用试剂均为分析纯。
1.2 合成
(1)2的合成
称取3-吲哚丙酸5.2 g(27.5 mmol),加入到多磷聚酸25 g(74.0mol)的甲苯(75 mL)溶液中,110 ℃下回流反应4 h。冷却至室温,冰水淬灭反应,抽滤,烘干得化合物2,收率60%;1H NMR(600 MHz,CDCl3)δ:12.47(dt,J=8.1 Hz,1.0 Hz,1H,Ar-H),12.19(dt,J=8.3 Hz,1.0 Hz,1H,Ar-H),12.10(ddd,J=8.3 Hz,6.9 Hz,1.2 Hz,1H,Ar-H),11.88(ddd,J=8.0 Hz,6.9 Hz,1.0 Hz,1H,Ar-H),7.85~7.74(m,2H,CH2-H),7.70~7.59(m,2H,CH2-H),7.26(p,J=1.9 Hz,1H,NH-H)。
(2)3的合成
称取25.31 g(30 mmol) 溶解于150 mL DMF中,0 ℃下加入氢化钠1.5 g(36 mmol),继续搅拌15 min,滴加2.25 mL(36 mmol)碘甲烷,反应30 min(TLC监测)。升温至室温,冰水淬灭反应,用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/4,V/V)纯化得白色絮状固体3,收率87%;1H NMR(600 MHz,CDCl3)δ:7.71(dt,J=8.0 Hz,1.0 Hz,1H,Ar-H),7.49~7.41(m,1H,Ar-H),7.37(dd,J=8.5 Hz,1.0 Hz,1H,Ar-H),7.23~7.11(m,1H,Ar-H),3.91(s,3H,CH3-H),3.10~3.02(m,2H,CH2-H),3.01~2.95(m,2H,CH2-H)。
(3)5a~5j的合成(以5j为例)
取35 mmol 溶解于25 mL四氢呋喃中,冰浴下缓慢加入氢化钠0.3 g(7.5 mmol),随后加入3-噻吩甲醛(4j)6 mmol ,于0 ℃继续反应30 min(TLC监测)。加入冰水淬灭反应,过滤得淡黄色固体5j5.0 g,收率82%;1H NMR(600 MHz,CDCl3)δ:8.32~8.25(m,1H,8′-H),8.10~8.06(m,1H,5′-H),7.93~7.89(m,1H,1′-H),7.89~7.82(m,1H,4′-H),7.81~7.77(m,1H,3′-H),7.75(dd,J=8.8 Hz,7.3 Hz,1H,6-H),7.66(d,J=1.8 Hz,1H,14-H),7.54(dt,J=6.3 Hz,3.5 Hz,2H,6′,7′-H),7.47~7.43(m,1H,2-H),7.38(dd,J=8.4 Hz,7.2 Hz,1H,3-H),7.26~7.21(m,1H,1-H),4.00(s,3H,15-H),3.97(s,2H,12-H);13C NMR(151 MHz,CDCl3)δ:183.15(C10),144.60(C4),141.83(C8),140.31(C14),138.63(C11),133.39(C2′),133.36(C9′),133.02(C10′),131.71(C8′),131.04(C4′),128.55(C5′),128.44(C5),127.66(C9),127.07(C1′),126.89(C7′),126.76(C6′),126.57(C3′),123.99(C6),121.84(C2),120.54(C1),110.99(C3),30.29(C15),26.60(C12)。
(4)6a~6j的合成(以6g为例)
取5g0.27 mL(2 mmol),2.87 g(20 mmol)盐酸胍,2 g(50 mmol)氢化钠分别依次加入至20 mL甲苯溶液中,110 ℃下回流14 h,TLC监测反应结束。冷却至室温后减压除去甲苯,加入碎冰,用1mol/L的盐酸溶液处理反应混合物,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,过滤,减压除去溶剂,残余物用硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=2/7,V/V)纯化得淡黄色固体6g。
用类似的方法合成6a~6f,6h,6j。
6a:淡黄色固体,产率68%,m.p.223~227 ℃;1H NMR(600 MHz,CDCl3)δ:7.94~7.90(m,2H,2′,6′-H),7.69(dt,J=8.0 Hz,0.9 Hz,1H,6-H),7.43(dt,J=8.3 Hz,0.9 Hz,1H,3-H),7.37~7.32(m,3H,2,3′,5′-H),7.22~7.18(m,1H,1-H),5.12(s,2H,NH2-H),4.16(s,3H,17-H),3.85(s,2H,12-H),2.47(s,3H,CH3-H);13C NMR(151 MHz,CDCl3)δ:163.66(C16),162.57(C10),158.87(C14),143.32(C4),141.47(C8),139.68(C4′),135.35(C1′),129.28(2C,C3′,C5′),128.32(2C,C2′,C6′),128.31(C5),124.64(C6),123.62(C11),123.47(C9),120.08(C2),120.01(C1),110.45(C3),30.92(C17),28.03(C12),21.43(CH3);HR-MS(ESI)m/z:Calcd for C21H18N4{[M+Na]+} 326.40,found 349.22。
6b:淡黄色固体,产率63%,m.p.254~258 ℃;1H NMR(600 MHz,DMSO-d6)δ:8.08(dd,J=9.2 Hz,0.7 Hz,1H,8′-H),7.98~7.91(m,1H,5′-H),7.60(d,J=9.2 Hz,1H,6-H),7.58~7.54(m,2H,3,6′-H),7.46~7.42(m,1H,2-H),7.41~7.34(m,2H,2′,7′-H),7.30~7.24(m,1H,3′-H),7.12~7.05(m,1H,1-H),6.59(s,2H,NH2-H),4.17(s,3H,17-H),3.86(s,3H,OCH3-H),3.34(s,2H,12-H);13C NMR(151 MHz,DMSO-d6)δ:163.74(C16),162.47(C10),158.38(C14),154.04(C4′),143.20(C4),141.68(C8),132.28(C1′),130.64(C9′),128.81(C10′),128.43(C5),127.18 (2C,C7′,C8′),126.79(C6′),124.74(C2′),124.02(C5′),123.74(C6),123.61(C11),120.74(C9),120.40(C2),120.24(C1),114.21(C3′),111.38(C3),56.73(OCH3),31.30(C17),26.19(C12);HR-MS(ESI)m/z:Calcd for C25H20N4O{[M+H]+}392.46,found 393.25。
6c:淡黄色固体,产率47%,m.p.229~232 ℃;1H NMR(600 MHz,DMSO-d6)δ:7.74~ 7.68(m,3H,3,2′,5′-H),7.55(dt,J=8.4 Hz,0.9 Hz,,1H,6-H),7.31~ 7.26(m,1H,2-H),7.17~ 7.12(m,1H,1-H),7.10(d,J=8.9 Hz,1H,4′-H),6.52(s,2H,NH2-H),4.12(s,3H,17-H),3.93(s,2H,12-H),3.88(s,3H,OCH3-H),3.86(s,3H,OCH3-H);13C NMR(151 MHz,DMSO-d6)δ:163.35(C16),163.31(C10),158.11(C14),150.59(C5′),149.00(C4′),143.25(C4),141.55(C8),131.03(C1′),127.66(C5),123.69(C6),123.53(C11),122.52(C6′),121.92(C9),120.41(C2),120.24(C1),112.11(C2′),111.76(C5′),111.36(C3),56.08(OCH3),56.03(OCH3),31.16(C17),28.32(C12);HR-MS(ESI)m/z:Calcd for C22H20N4O2{[M+H]+}372.43,found 373.25。
6d:淡黄色固体,产率58%,m.p.233~238 ℃;1H NMR(600 MHz,CDCl3)δ:7.64(dt,J=8.0 Hz,1.0 Hz,1H,6-H),7.56(d,J=1.9 Hz,1H,6′-H),7.46~7.39(m,3H,3,3′,5′-H),7.37~7.33(m,1H,2-H),7.21~7.16(m,1H,1-H),5.11(s,2H,NH2-H),4.19(s,3H,17-H),3.57(s,2H,12-H);13C NMR(151 MHz,CDCl3)δ:163.42(C16),162.43(C10),157.65(C14),143.47(C4),141.11(C8),135.80(C4′),135.32(C1′),133.09(C2′),131.18(C3′),129.80(C6′),128.88(C5),127.37(C5′),126.81(C6),124.00(C11),123.47(C9),120.21(C2),120.16(C1),110.51(C3),30.99(C17),26.41(C12);HR-MS(ESI)m/z:Calcd for C20H14N4Cl2{[M+H]+}381.22,found 382.40。
6e:淡黄色固体,产率56%,m.p.225~229 ℃;1H NMR(600 MHz,DMSO-d6)δ:8.01~7.96(m,2H,3′,5′-H),7.71(dt,J=8.0 Hz,1.0 Hz,1H,6-H),7.53~7.49(m,2H,2′,6′-H),7.44(d,J=8.3 Hz,1H,3-H),7.38~7.33(m,1H,2-H),7.23~7.19(m,1H,1-H),5.08(s,2H,NH2-H),4.18(s,3H,17-H),3.87 (s,2H,12-H);13C NMR(151 MHz,DMSO-d6)δ:163.98(C16),162.57(C10),157.51(C14),143.42(C4),141.32(C8),136.64(C4′),135.64(C1′),129.72(2C,C2′,C4′),128.79(2C,C2′,C6′),128.41(C5),124.66(C6),123.84(C11),123.41(C9),120.14(2C,1,2-C),110.51(C3),30.94(C17),28.00(C12);HR-MS(ESI)m/z:Calcd for C20H15N4Cl{[M+H]+}346.82,found 347.22。
6f:淡黄色固体,产率45%,m.p.236~240 ℃;1H NMR(600 MHz,CDCl3)δ:7.83~ 7.80(m,1H,2′-H),7.74(dd,J=7.8 Hz,1.9 Hz,1H,6-H),7.71(dt,J=8.0 Hz,0.9 Hz,1H,6′-H),7.44(dt,J=8.4 Hz,0.9 Hz,1H,5′-H),7.37~ 7.32(m,1H,2-H),7.30(d,J=7.9 Hz,1H,3-H),7.23~ 7.17(m,1H,1-H),5.07(s,2H,NH2-H),4.18(s,3H,17-H),3.88(s,2H,12-H),2.41(s,3H,CH3-H),2.37(s,3H,CH3-H);13C NMR(151 MHz,CDCl3)δ:163.62(C16),162.55(C10),159.13(C14),143.31(C4),141.54(C8),138.39(C3′),136.90(C4′),135.77(C1′),129.78(C2′),129.49(C5′),128.27(C5),125.84(C6′),124.73(C6),123.59(C11),123.50(C9),120.10(C2),120.00(C1),110.45(C3),30.94(C17),28.06(C12),20.01(OCH3),19.75(OCH3);HR-MS(ESI)m/z:Calcd for C22H20N4{[M+H]+}340.43,found 341.29。
6g:淡黄色固体,产率68%,m.p.255~258 ℃;1H NMR(600 MHz,DMSO-d6)δ:8.66(d,J=1.7 Hz,1H,8′-H),8.22(dd,J=8.5 Hz,1.8 Hz,1H,5′-H),8.13(dt,J=8.8 Hz,3.1 Hz,1H,3′-H),8.07(d,J=8.6 Hz,1H,6-H),8.03~7.98(m,1H,1′-H),7.73(d,J=7.9 Hz,1H,3-H),7.63~7.59(m,2H,6′,7′-H),7.58(d,J=8.4 Hz,1H,4′-H),7.33~7.27(m,1H,2-H),7.16(t,J=7.5 Hz,1H,1-H),6.65(s,2H,NH2-H),4.15(s,3H,17-H),4.05(s,2H,12-H);13C NMR(151 MHz,DMSO-d6)δ:163.53(C16),163.48(C10),158.28(C14),143.38(C4),141.46(C8),135.86(C2′),133.80(C10′),133.19(C5′),129.22(C8′),128.51(C5),128.30(C6′),128.01(C7′),127.50(C4′),126.92(C1′),126.21,123.89(C8′),123.53(C6),123.44(C11),120.50(C2),120.35(C1),116.92(C9),111.44(C3),31.21(C17),28.13(C12);HR-MS(ESI)m/z:Calcd for C24H18N4{[M+H]+}362.44,found 363.29。
6h:淡黄色固体,产率56%,m.p.247~250 ℃;1H NMR(600 MHz,CDCl3)δ:8.76(d,J=5.3 Hz,2H,3′,5′-H),8.06~7.95(m,2H,2′,6′-H),7.70(dt,J=8.0 Hz,1.0 Hz,1H,6-H),7.55(dt,J=8.4 Hz,0.9 Hz,1H,3-H),7.36~7.24(m,1H,2-H),7.19~7.10(m,1H,1-H),6.72(s,2H,NH2-H),4.11(s,3H,17-H),3.94 (s,2H,12-H);13C NMR(151 MHz,CDCl3)δ:163.86(C16),163.58(C10),155.77(C14),150.50(2C,C3′,C5′),145.57(C1′),143.48(C4),141.10(C8),128.52(C5),124.11(C6),123.85(C11),123.40(C9),122.92(2C,C2′,C6′),120.54(C2),120.40(C1),111.46(C3),31.19(C17),27.69(C12);HR-MS(ESI)m/z:Calcd for C19H15N5{[M+H]+}313.36,found 314.27。
6i:淡黄色固体,产率67%,m.p.231~235 ℃;1H NMR(600 MHz,CDCl3)δ:8.07~8.00(m,2H,2′,6′-H),7.71(d,J=7.8 Hz,1H,6-H),7.53~7.48(m,2H,3′,5′-H),7.46~7.41(m,3H,9′,13′-H),7.40~7.32(m,2H,10′,12′-H),7.23~7.18(m,1H,2-H),7.16~7.12(m,2H,1-H),5.19(s,2H,7′-H),5.03(s,2H,NH2-H),4.19(s,3H,17-H),3.91(s,2H,12-H);13C NMR(151 MHz,CDCl3)δ:163.70(C16),162.51(C10),159.97(C14),158.34(C4′),143.31(C4),141.57(C8),136.73(C1′),130.95(C8′),129.91(2C,C10′,C1′2),128.66(2C,C2′,C6′),128.10(C5),128.08(C11′),127.49(2C,C9′,C13′),124.26(C6),123.57(C11),123.50(C9),120.06(C2),120.02(C1),114.91(2C,C3′,C5′),110.46(C3),70.09(C7′),30.93(C17),28.24(C12);HR-MS(ESI)m/z:Calcd for C27H22N4O{[M+H]+}418.50,found 419.13。
6j:淡黄色固体,产率54%,m.p.245~247 ℃;1H NMR(600 MHz,CDCl3)δ:8.29(dd,J=2.9 Hz,1.3 Hz,1H,4′-H),7.84(dd,J=5.0 Hz,1.2 Hz,1H,6-H),7.74~7.68(m,2H,3,4′-H),7.57(d,J=8.3 Hz,1H,5′-H),7.30(t,J=7.7 Hz,1H,2-H),7.16(t,J=7.5 Hz,1H,1-H),6.51(s,2H,NH2-H),4.12(s,3H,17-H),3.94(s,2H,12-H);13C NMR(151 MHz,DMSO-d6)δ:163.47(C16),163.32(C10),153.86(C14),143.31(C4),141.51(C8),140.73(C1′),127.91(C5),127.69(C4′),127.61(C5′),126.84(C2′),123.78(C6),123.54(C11),122.12(C9),120.35(C2),120.34(C1),111.44(C3),31.19(C17),28.06(C12);HR-MS(ESI)m/z:Calcd for C18H14N4S{[M+H]+}318.40,found 319.17。
1.3 体外抗肿瘤活性测试
将待测化合物用DMSO溶解后,稀释成五个浓度梯度。取对数生长期的细胞以5000个/孔的细胞密度接种于96孔板中,并设空白组、对照组及给药组(100 μL),每组设3个平行孔,于37 ℃培养24 h后弃去旧培养基,加入含不同浓度待测化合物的完全培养基,继续培养48 h后每孔加入5 mg/mL MTT培养液20 μL,于37 ℃孵育4 h。取出96孔板,弃去培养液,加入DMSO 150 μL,置于水平摇床上振摇10 min,使用酶标仪测定490 nm处吸光度OD值,计算细胞增殖抑制率。实验结果为至少两次以上独立重复实验所得的平均值。使用IBM SPSS Statistics 19软件对细胞生长率进行非线性回归拟合,并用Blies法计算出IC50值,P<0.05为具有显著性差异。
2 结果与讨论
2.1 合成
3-吲哚丙酸用PPA或者TFAA处理可以得到相应的环戊酮并[b]吲哚,以NaH为催化剂的反应条件下,吲哚环戊酮能够轻易地进行N-甲基化反应,后处理简易;使用K2CO3为催化剂,反应在常温下即可进行,不足是反应时间长,产率低。如文献中报道[24],环戊并[b]吲哚与芳香醛发生Claisen-Schmidt缩合反应只得到了E-异构体产物,这是由于C=O引起的去屏蔽效应,导致COC=CH中的乙烯基trans构型比cis构型更有利于结构的稳定,因此只有E-异构体。
文献报道中最后一步反应是以乙醇为溶剂,甲醇钠为催化剂[25],但是甲醇钠比较活泼,加热回流比较危险,所以选用NaH替代甲醇钠;乙醇为溶剂加热回流反应,反应产率很低,期间筛选了其他溶剂,最终确定甲苯作为反应溶剂,虽然产率相比苯稍低,但由于苯的毒性较高,故而将其排除在外。此外合成化合物6的反应步骤增加,时间延长,反应产率也略有提高。
2.2 体外抗肿瘤活性
采用MTT法测定了6a~6j化合物对人肝癌(HepG-2)、人子宫颈癌(Hela)和人鼻咽癌(CNE-1)瘤株的体外抑制活性并计算抑制率,以顺铂作为阳性对照,结果见表1。

表1 化合物的体外抗肿瘤活性Table 1 In vitro antitumor activities of the compounds
由表1可知,化合物6b对Hela和CNE-1细胞显示了较强的抑制作用,但是对HepG-2细胞的IC50大于50 μmol/L,说明化合物6b对某些肿瘤细胞具有选择抑制性。从表1的体外抗肿瘤活性也可得知,化合物6c、6d对Hela肿瘤细胞(6cIC50=22.4 μmol/L、6dIC50=20.1 μmol/L)和CNE-1肿瘤细胞(6cIC50=24.1 μmol/L、6dIC50=44.1 μmol/L)也具有选择性抑制活性,化合物6f对CNE-1细胞(IC50=37.6 μmol/L)具有选择性抗肿瘤活性,化合物6e对HepG-2细胞(IC50=35.9 μmol/L)具有选择性抗肿瘤活性。比较化合物6b和6g可以得出,当R为萘取代基时,4-甲氧基-1-萘取代基相比于2-萘取代基对化合物的抗肿瘤活性更强。从表1的体外抗肿瘤活性可进行初步的构效关系分析,苯环上的取代基的位置和种类,均可影响化合物的抗肿瘤活性。此外,将目标化合物中的苯环变成杂环(噻吩、吡啶)后,化合物的抗肿瘤细胞活性消失。
合成了10个新型的氨基嘧啶环戊并[b]吲哚衍生物,选用人肝癌(HepG-2)、人子宫颈癌(Hela)和人鼻咽癌(CNE-1)瘤株考察其体外抗肿瘤活性,其中化合物6b对这些肿瘤细胞的抑制活性最好,且对部分肿瘤细胞具有选择性。
