硫化镉量子点催化的光诱导肉桂酸脱羧二氟烷基化反应
2020-07-22陶婷婷刘文强裴孝俊朱天彩冯乙巳1b
陶婷婷,刘文强,裴孝俊,朱天彩,冯乙巳,1b*
(1.合肥工业大学 a.化学与化工学院;b.安徽省杂环实验室,安徽 合肥 230009)
烯丙基化合物广泛存在于药物分子中[1-4],在烯丙位引入含氟基团可显著提高母体化合物的生物活性。Tafluprost[5]作为新型的抗青光眼药物,在其烯丙位引入氟原子后显著的提高了药物的亲和力。在乙烯基中引入二氟烷基基团合成二氟取代的烯烃化合物,目前已报道的方法有:王细胜[6-7]、王锐[8]、黄精美[9-10]课题组分别报道了使用Ni、Cu、Pt催化的肉桂酸脱羧反应引入二氟烷基基团;刘雪原课题组提出了以[Ru(bpy)3]Cl2·6H2O和[Cu(MeCN)4]PF6作为双催化剂,并在蓝光诱导下进行肉桂酸脱羧二氟烷基化反应[11];Timothy提出了蓝光照射下fac-Ir(ppy)3催化肉桂酸与溴二氟乙酸乙酯进行反应[12];我们课题组报道了曙红催化肉桂酸的二氟烷基化反应[13]。已报道的方法中不足之处在于:Ni、Cu、Pt催化时需添加当量催化剂或添加配体且碘二氟乙酸乙酯价格较为昂贵;反应需要加热;Ru、Ir作为光催化剂制备过程复杂价格昂贵。
硫化镉量子点(CdS QDs)具有良好的光响应性,可吸收可见光激发原子产生自由基催化有机合成反应,具有微量高效等优点[14-17]。本文在光照条件下对硫化镉量子点催化肉桂酸脱羧引入二氟烷基的反应进行研究。以肉桂酸、溴二氟乙酸乙酯为原料合成乙基-4-苯基-2,2-二氟-3-烯酸甲酯类化合物(3a~3r,Scheme 1)。其结构经1H NMR,13C NMR和19F NMR确证。
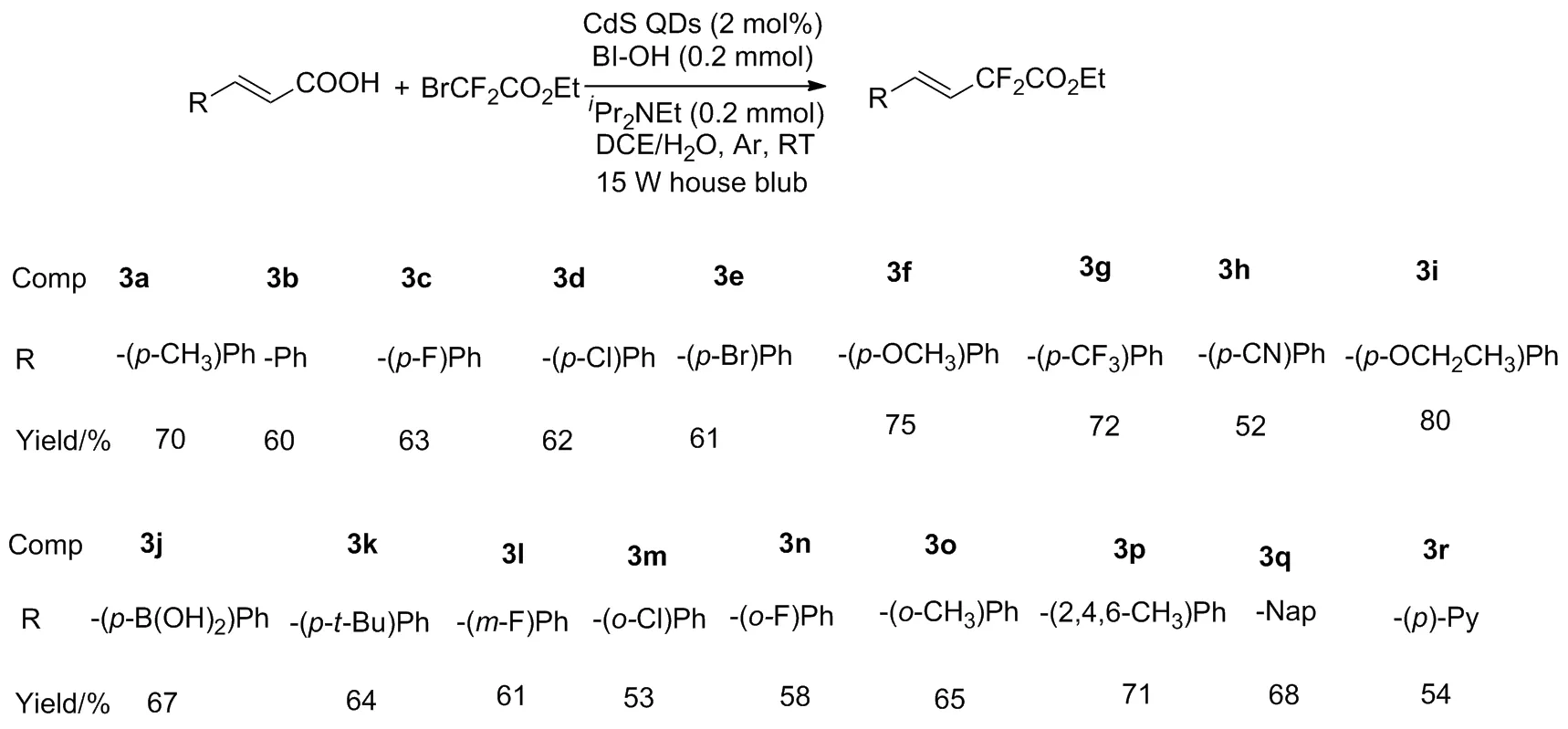
Scheme 1
1 实验部分
1.1 仪器与试剂
VNMRS600 MHz型超导核磁共振仪;Trace 1300ISQ型气相质谱联用仪。
CdS QDs以及高价碘试剂按文献[18-22]方法合成;其余所用试剂均为分析纯。
1.2 3a~3t的合成(以3a为例)
在Schlenk反应管中加入4-甲基肉桂酸(1a)16.3 mg(0.1 mmol),溴二氟乙酸乙酯(2a)30.4 mg(0.15 mmol),CdS QDs 2 mol%,BI-OH 52.8 mg(0.2 mmol),iPr2NEt(0.2 mmol)的DCE/H2O (1 mL/1 mL) 溶液在氩气保护下,15 W白光照射反应12 h后萃取,收集有机相,无水硫酸镁干燥,真空脱溶后经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=50/1,V/V)纯化得淡黄色液体3a16.8 mg,收率70%。
采用类似方法合成3b~3r。
乙基-4-(4-甲基苯基)-2,2-二氟-3-烯酸甲酯(3a):无色油状液体16.8 mg,收率70%;1H NMR(600 MHz,CDCl3)δ:7.34(d,J=8.0 Hz,2H),7.17(d,J=7.9 Hz,2H),7.07~6.99(m,1H),6.25(dt,J=16.2 Hz,11.5 Hz,1H),4.34(q,J=7.1 Hz,2H),2.36(s,3H),1.36(t,J=7.2 Hz,3H);13C NMR(151 MHz,CDCl3)δ:164.00(t,J=35.0 Hz),139.84,136.71(t,J=9.4 Hz),131.34,129.52,127.36,117.71(t,J=25.0 Hz),112.84(t,J=248.4 Hz),63.04,21.32,13.94;19F NMR(564 MHz,CDCl3)δ:-102.93(d,J=2.0 Hz)。
乙基-4-苯基-2,2-二氟-3-烯酸甲酯(3b):无色油状液体13.62 mg,收率60%;1H NMR(600 MHz,CDCl3)δ:7.45(dd,J=7.8 Hz,1.3 Hz,2H),7.39~7.34 (m,3H),7.08(dt,J=16.2 Hz,2.4 Hz,1H),6.30(dt,J=16.2 Hz,11.4 Hz,1H),4.35(q,J=7.1 Hz,2H),1.36(t,J=7.2 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.89(t,J=34.9 Hz),136.81(t,J=9.5 Hz),134.08,129.61,128.81,127.41,118.82(t,J=25.1 Hz),112.71(t,J=248.5 Hz),63.09,13.93;19F NMR(564 MHz,CDCl3)δ:-103.12(d,J=1.9 Hz)。
乙基-4-(4-氟苯基)-2,2-二氟-3-烯酸甲酯(3c):无色油状液体15.4 mg,收率63%;1H NMR(600 MHz,CDCl3)δ:7.33(dd,J=8.3 Hz,5.5 Hz,2H),6.95(dd,J=16.6 Hz,8.1 Hz,3H),6.14(dt,J=16.2 Hz,11.3 Hz,1H),4.25(q,J=7.1 Hz,2H),1.26(t,J=7.2 Hz,3H);13C NMR(151 MHz CDCl3,)δ:163.80 (t,J=34.8 Hz),163.42 (d,J=250.1 Hz),135.55 (t,J=9.5 Hz),130.28 (d,J=3.3 Hz),129.20(d,J=8.3 Hz),118.56(td,J=25.1,2.2 Hz),115.84(d,J=21.9 Hz),112.60(t,J=248.6 Hz),63.10,13.84;19F NMR(564 MHz,CDCl3)δ:-103.24(d,J=81.7 Hz),-111.00。
乙基-4-(4-氯苯基)-2,2-二氟-3-烯酸甲酯(3d):无色油状液体16.1 mg,收率62%;1H NMR(600 MHz,CDCl3)δ:7.35(dd,J=23.6 Hz,8.5 Hz,1H),7.03(d,J=16.2 Hz,1H),6.28(dt,J=16.2 Hz,11.3 Hz,1H),4.35(q,J=7.1 Hz,1H),1.36(t,J=7.1 Hz,1H);13C NMR(151 MHz,CDCl3)δ:163.67(t,J=34.7 Hz),135.49(t,J=8.5 Hz),135.42,132.55,129.00,128.60,119.42(t,J=25.0 Hz),112.49(t,J=248.8 Hz),63.13,13.86;19F NMR(564 MHz,CDCl3)δ:-102.69。
乙基-4-(4-溴苯基)-2,2-二氟-3-烯酸甲酯(3e):无色油状液体18.5 mg,收率61%;1H NMR(600 MHz,CDCl3)δ:7.50~7.47(m,2H),7.30(d,J=8.4 Hz,2H),7.01(dt,J=16.2 Hz,2.3 Hz,1H),6.30(dt,J=16.2 Hz,11.3 Hz,1H),4.35(q,J=7.1 Hz,2H),1.36(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.63(t,J=34.7 Hz),135.56(t,J=9.5 Hz),132.97,131.97,128.84,123.71,119.53(t,J=25.0 Hz),112.47(t,J=248.8 Hz),63.14,13.88;19F NMR(564 MHz,CDCl3)δ:-103.36。
乙基-4-(4-甲氧基苯基)-2,2-二氟-3-烯酸甲酯(3f):无色油状液体19.2 mg,收率75%;1H NMR(600 MHz,CDCl3)δ:7.38(d,J=8.6 Hz,2H),7.01(d,J=16.2 Hz,1H),6.89(d,J=8.7 Hz,2H),6.16(dt,J=16.1 Hz,11.5 Hz,1H),4.34(q,J=7.1 Hz,2H),3.82(s,3H),1.36(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:164.05(t,J=35.2 Hz),160.74,136.26(t,J=9.5 Hz),128.86,126.76,116.31(t,J=25.0 Hz),114.19,112.94(t,J=248.3 Hz),62.99,55.28,13.91;19F NMR(564 MHz,CDCl3)δ:-102.81(d,J=11.1 Hz)。
乙基-4-(4-三氟甲基苯基)-2,2-二氟-3-烯酸甲酯(3g):无色油状液体21.2 mg,收率72%;1H NMR(600 MHz,CDCl3)δ:7.63(d,J=8.2 Hz,2H),7.55(d,J=8.2 Hz,2H),7.12(d,J=16.2 Hz,1H),6.40(dt,J=16.2 Hz,11.2 Hz,1H),4.37(q,J=7.1 Hz,2H),1.37(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.57(t,J=34.5 Hz),137.50(d,J=0.9 Hz),135.33(t,J=9.4 Hz),131.32(q,J=32.7 Hz),127.65,125.79(q,J=3.8 Hz),123.84(d,J=272.1 Hz),121.50(t,J=25.1 Hz),112.31(t,J=249.0 Hz),63.27,13.88;19F NMR(564 MHz,CDCl3)δ:-62.86,-103.84(d,J=11.2 Hz)。
乙基-4-(4-氰基苯基)-2,2-二氟-3-烯酸甲酯(3h):无色油状液体13.1 mg,收率52%;1H NMR(600 MHz,CDCl3)δ:7.68(d,J=8.2 Hz,2H),7.55(d,J=8.2 Hz,2H),7.10(d,J=16.2 Hz,1H),6.42(dt,J=16.2 Hz,11.2 Hz,1H),4.37(q,J=7.1 Hz,2H),1.38(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.40(t,J=34.4 Hz),138.36,134.93(t,J=9.4 Hz),132.61,127.92,122.52(t,J=25.1 Hz),118.30,112.99,112.10(t,J=249.4 Hz),63.37,13.93;19F NMR(564 MHz,CDCl3)δ:-103.83~-104.06 (m)。
乙基-4-(4-乙氧基苯基)-2,2-二氟-3-烯酸甲酯(3i):无色油状液体21.6 mg,收率80%;1H NMR(600 MHz,CDCl3)δ:7.36(d,J=8.5 Hz,2H),7.00(d,J=16.2 Hz,1H),6.87(d,J=8.3 Hz,2H),6.15(dt,J=16.1 Hz,11.5 Hz,1H),4.33(q,J=7.1 Hz,2H),4.05~4.01(m,2H),1.41(t,J=7.0 Hz,3H),1.35 (dt,J=8.1 Hz,4.0 Hz,3H);13C NMR(151 MHz,CDCl3)δ:164.02(t,J=35.2 Hz),160.13,136.29(t,J=9.5 Hz),128.83,126.55,116.15(t,J=25.0 Hz),114.66,112.90(t,J=237.1 Hz),63.48,62.93,14.63,13.86;19F NMR(564 MHz,CDCl3)δ:-102.66。
乙基-4-(4-硼酸基苯基)-2,2-二氟-3-烯酸甲酯(3j):无色油状液体18.1 mg,收率67%;1H NMR(600 MHz,CDCl3)δ:8.20(d,J=8.0 Hz,2H),7.56(d,J=8.0 Hz,2H),7.15(d,J=16.2 Hz,1H),6.44(dt,J=16.2 Hz,11.3 Hz,1H),4.39(q,J=7.1 Hz,2H),1.40(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.80(t,J=34.8 Hz),138.04,136.53(t,J=9.3 Hz),136.05,131.26,126.97,120.45(t,J=24.2 Hz),112.56(t,J=248.9 Hz),63.27,13.97;19F NMR(564 MHz,CDCl3)δ:-103.57(d,J=10.9 Hz)。
乙基-4-(4-叔丁基基苯基)-2,2-二氟-3-烯酸甲酯(3k):无色油状液体18.0 mg,收率64%;1H NMR(600 MHz,CDCl3)δ:7.39(s,4H),7.06(dt,J=16.2 Hz,2.4 Hz,1H),6.26(dt,J=16.2 Hz,11.5 Hz,1H),4.34(q,J=7.1 Hz,2H),1.35(t,J=7.1 Hz,3H),1.32(s,9H);13C NMR(151 MHz,CDCl3)δ:163.99(t,J=35.1 Hz),153.04,136.58(t,J=9.4 Hz),131.33,127.21,125.76,117.96(t,J=25.0 Hz),112.84(t,J=248.4 Hz),63.02,34.76,31.15,13.93;19F NMR(564 MHz,CDCl3)δ:-102.96。
乙基-4-(3-氟苯基)-2,2-二氟-3-烯酸甲酯(3l):无色油状液体14.9 mg,收率61%;1H NMR(600 MHz,CDCl3)δ:7.34(dd,J=14.0 Hz,7.8 Hz,1H),7.22(d,J=7.7 Hz,1H),7.15(d,J=9.7 Hz,1H),7.05(dd,J=10.6 Hz,7.3 Hz,2H),6.31(dt,J=16.2 Hz,11.3 Hz,1H),4.36(q,J=7.1 Hz,2H),1.37(t,J=7.0 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.66(t,J=34.7 Hz),162.96(d,J=246.6 Hz),135.62(td,J=9.5 Hz,2.6 Hz),130.40,130.35,123.42(d,J=2.7 Hz),120.23(t,J=25.1 Hz),116.49(d,J=21.3 Hz),113.82 (d,J=22.1 Hz),112.41(t,J=248.8 Hz),63.20,13.90;19F NMR(564 MHz,CDCl3)δ:-103.59(d,J=11.0 Hz),-112.67(dd,J=14.6 Hz,8.6 Hz)。
乙基-4-(2-氯苯基)-2,2-二氟-3-烯酸甲酯(3m):无色油状液体13.8 mg,收率53%;1H NMR(600 MHz,CDCl3)δ:7.55(dd,J=7.0,2.4 Hz,1H),7.50(dt,J=16.2 Hz,2.6 Hz,1H),7.40(dd,J=6.6 Hz,2.7 Hz,1H),7.31~7.27(m,2H),6.32(dt,J=16.2 Hz,11.1 Hz,1H),4.37(q,J=7.1 Hz,2H),1.38(t,J=7.2 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.67(t,J=34.7 Hz),134.30,133.18(t,J=9.7 Hz),132.42,130.53,130.04,127.37,127.06,121.58(t,J=25.2 Hz),112.46(t,J=248.9 Hz),63.20,14.00,13.92;19F NMR(564 MHz,CDCl3)δ:-103.22。
乙基-4-(2-氟苯基)-2,2-二氟-3-烯酸甲酯(3n):无色油状液体14.2 mg,收率58%;1H NMR(600 MHz,CDCl3)δ:7.47(td,J=7.6 Hz,1.4 Hz,1H),7.33(ddd,J=7.3 Hz,5.3 Hz,1.5 Hz,1H),7.21(dt,J=16.4 Hz,2.5 Hz,1H),7.15(t,J=7.6 Hz,1H),7.11~7.06(m,1H),6.43(dt,J=16.4 Hz,11.3 Hz,1H),4.36(q,J=7.1 Hz,2H),1.37(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.74(t,J=34.7 Hz),160.91(d,J=252.6 Hz),131.08(d,J=8.7 Hz),129.74(td,J=9.9 Hz,3.1 Hz),128.69 ~ 128.34(m),124.37(d,J=3.7 Hz),122.04(d,J=11.8 Hz),121.46(td,J=24.9 Hz,6.6 Hz),116.08(d,J=21.9 Hz),112.53(t,J=248.8 Hz),63.15,13.91;19F NMR(564 MHz,CDCl3)δ:-103.74(d,J=97.6 Hz),-115.50~-116.15(m)。
乙基-4-(2-甲基苯基)-2,2-二氟-3-烯酸甲酯(3o):无色油状液体15.6 mg,收率65%;1H NMR(600 MHz,CDCl3)δ:7.36(d,J=7.7 Hz,1H),7.24(dt,J=16.1 Hz,2.5 Hz,1H),7.15(dd,J=7.5 Hz,6.5 Hz,1H),7.09(dd,J=14.4 Hz,7.5 Hz,2H),6.11(dt,J=16.1 Hz,11.3 Hz,1H),4.26(q,J=7.1 Hz,2H),2.28(s,3H),1.27(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.90(t,J=34.9 Hz),136.69,134.63(t,J=9.5 Hz),133.17,130.58,129.36,126.28,126.04(d,J=0.9 Hz),120.04(t,J=24.8 Hz),112.70(t,J=248.4 Hz),63.03,19.53,13.88;19F NMR(564 MHz,CDCl3)δ:-102.99(d,J=6.3 Hz)。
乙基-4-(2,4,6-三甲基苯基)-2,2-二氟-3-烯酸甲酯(3p):无色油状液体19.0 mg,收率71%;1H NMR(600 MHz,CDCl3)δ:7.12(d,J=16.5 Hz,1H),6.88(s,2H),5.88(dt,J=16.5 Hz,11.1 Hz,1H),4.36(q,J=7.1 Hz,2H),2.27(d,J=3.9 Hz,9H),1.36(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.95(t,J=35.0 Hz),136.87(d,J=259.1 Hz),135.07(t,J=9.6 Hz),130.77,128.86,124.23(t,J=24.7 Hz),112.48(t,J=248.5 Hz),62.98,20.93,20.59,13.93;19F NMR (564 MHz,CDCl3)δ:-103.79(dd,J=11.1 Hz,2.6 Hz)。
乙基-4-(4-萘基)-2,2-二氟-3-烯酸甲酯(3q):无色油状液体18.8 mg,收率68%;1H NMR(600 MHz,CDCl3)δ:7.84~7.79(m,4H),7.59(d,J=8.6 Hz,1H),7.49(dd,J=6.2 Hz,3.1 Hz,2H),7.26~7.21(m,1H),6.41(dt,J=16.1 Hz,11.4 Hz,1H),4.36(q,J=7.1 Hz,2H),1.37(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.94(t,J=35.0 Hz),136.89(t,J=9.4 Hz),133.82,133.24,131.50,128.76,128.61,128.32,127.72,126.93,126.65,123.22,118.97(t,J=25.0 Hz),112.81(t,J=248.6 Hz),63.12,13.95;19F NMR(564 MHz,CDCl3)δ:-102.87(d,J=7.5 Hz)。
乙基-4-(4-吡啶)-2,2-二氟-3-烯酸甲酯(3r):无色油状液体12.3 mg,收率54%;1H NMR(600 MHz,CDCl3)δ:8.65(d,J=4.9 Hz,2H),7.34(d,J=5.8 Hz,2H),7.05(dt,J=16.2 Hz,2.2 Hz,1H),6.52(dt,J=16.2 Hz,11.2 Hz,1H),4.37(q,J=7.1 Hz,2H),1.38(t,J=7.1 Hz,3H);13C NMR(151 MHz,CDCl3)δ:163.31(t,J=34.3 Hz),150.25,141.58,134.39(t,J=9.3 Hz),123.75(t,J=25.3 Hz),121.60,112.00(t,J=249.4 Hz),63.41,13.93;19F NMR(564 MHz,CDCl3)δ:-104.13(d,J=19.3 Hz)。
2 结果与讨论
2.1 反应条件优化
以1a和2a的反应为模型反应(Scheme 2),研究催化剂碱和溶剂对反应收率的影响,见表1。首先对催化剂进行了筛选,发现Ru(bpy)3Cl2作为催化剂时并无目标产物生成(No.1),而CdS作为催化剂时以15%的收率得到目标产物(No.2)。同时我们也做了对照实验发现不添加催化剂时反应无法进行。当反应在空气条件下也没有目标产物的生成(No.5)。进一步进行溶剂的优化,DMSO、1,4-dioxane作溶剂时仅少量目标产物(No.6和7),而DCE作溶剂时目标产物的收率显著提高到40%(No.4)。同时,对混合溶剂进行筛选,发现混合溶剂可提高反应收率(No.8和9)。确定DCE/H2O (V/V=1/1)为最佳溶剂,进行各种氧化剂筛选,BI-OAc、BI-OMe均对该反应起作用收率分别为30%和35%(No.8和12),但BI-OH效果最佳。另外,对光源进行筛选,在绿光和蓝光照射条件下的目标产物收率为42%和48%(No.12和13),但是副产物也随之增多。因此,15 W白炽灯为最佳光源。除此之外对反应物摩尔比进行优化,发现1a/2a=1/2时,2eq.的氧化剂效果最好。

表1 模型反应条件优化aTable 1 Optimization of the reaction conditions

Scheme 2
通过以上试验结果确定反应的最优条件为:4-甲基肉桂酸(0.1 mmol)、1-溴二氟乙酸乙酯(0.2 mmol)、硫化镉量子点(2 mol%)、iPr2NEt(0.2 mmol)、BI-OH(0.2 mmol),溶剂为二氯乙烷/水(V/V=1/1,2 mL),15 W的白炽灯作为光源,惰性气体保护反应12 h。
2.2 底物适应性
在最优反应条件的基础上,研究了不同取代基的肉桂酸与溴二氟乙酸乙酯进行脱羧二氟烷基化反应的适应性。在最优反应条件下,供电子基团(3a70%、3f75%、3i80%)与吸电子基团(3c63%、3e61%、3d62%、3g72%)的肉桂酸均可进行反应有良好的收率,并呈现出一定的规律性。首先供电子基团较于吸电子基团明显更具有优势,其反应收率大都在70%~80%,而吸电子基团收率在61%~72%。我们发现硝基取代的肉桂酸参与反应时通过TLC分析和GC-MS检测发现有少量目标产物,但是并未获得有效分离收率,其原因可能为硝基为强吸电子基团使烯基上的电子云密度降低不利于反应进行进而导致收率降低。当间位或对位取代基为卤素(氯或溴)时,均能较好的进行反应得到中等收率并且并不破环碳-卤键(3d、3e),其可继续通过碳-卤键活化进行官能团衍生化。因此,该体系在有机合成方面具有一定实用性。另外我们还对硼酸基团取代的肉桂酸进行了尝试发现其对该体系非常适用目标产物收率67%(3j),并且叔丁基取代的肉桂酸参与反应亦获得64%的良好收率,这表明空间位阻对该反应的影响并不明显(3k)。通过对底物适应性研究发现邻位和间位取代的肉桂酸在该体系中也有较好的反应效果。除了对单取代基肉桂酸进行探究外,我们还对多取代基烯酸进行了考察,选用2,4,6-三甲基肉桂酸与溴二氟乙酸乙酯进行脱羧二氟烷基化,最终分离出纯品,其收率为64%(3p)。实验结果表明该体系对多取代基肉桂酸也有很好的普适性。最后,对杂环类烯酸我们选用了萘环和吡啶环的烯酸进行反应。在最优条件下两者均给出了良好的反应效果 (3q68%、3r54%)。实验结果证明,该体系具有较好的官能团兼容性。
2.3 反应机理
根据模型反应优化试验结果和文献报道,推测该脱羧偶联反应可能涉及自由基反应机理。设计自由基捕捉实验进行验证。在最优条件下加入0.1 mmol 2,2,6,6-4-甲基哌啶氮氧化物(TEMPO)作为自由基捕捉剂,研究模型反应。
模型反应加入自由基捕捉剂后,GC-MS结果显示未监测到3a产物,该反应完全被抑制,并且捕捉到自由基中间体与自由基捕捉剂反应产物TEMPO-CF2COOEt。
结合文献[13,23],以及自由基捕捉实验的结果,我们提出了硫化镉量子点催化条件下,可见光诱导的的肉桂酸脱羧的二氟烷基化反应可能的反应机理(Scheme 3)。首先,当光照激发能量超过带隙时,CdS QDs吸收光子,电子从价带(VB)跃迁到导带(CB)。同时在VB中形成电子-空穴对,富含电子的三级胺iPr2NEt作为供电子体,提供循环。单个电子从CB转移到溴二氟乙酸乙酯(2)形成中间体α-二氟乙酸乙酯自由基B,同时肉桂酸与高价碘试剂BI-OH结合生成苯并碘代乙烯基羧酸络合物(BI-OOCCH=CHR)A。α-二氟乙酸乙酯自由基B加到A的α-位,生成中间体C。中间体C通过脱出CO2和苄基碘醚自由基D得到目标产物3。

Scheme 3
以廉价的BrCF2COOEt为氟源,在α,β-不饱和羧酸中引入二氟烷基构建二氟取代的烯烃化合物。硫化镉量子点作为有机合成光催化剂,具有优良的反应特性,在催化肉桂酸的脱羧二氟烷基化反应时,催化剂用量少,反应条件温和,底物适应范围广。本研究为构建二氟烯烃化合物提供了一种简单经济的新方法。
