LncRNA HOXC-AS3通过miR-15b-5p/E2F3生物学轴促进胃癌细胞的增殖和迁移
2020-07-21
安徽医科大学第一附属医院普外科,安徽 合肥 230022
胃癌是中国常见的恶性肿瘤之一,2015年国家癌症中心统计结果显示,中国的胃癌发病率约为31.28/10万,死亡率约为21.48/10万,发病率和死亡率在恶性肿瘤中均居第2位[1]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200 bp但不翻译成蛋白质的功能性RNA分子。LncRNA-HOXC-AS3(lnc-HOXC-AS3)是新发现的一种lncRNA,已有研究显示,lnc-HOXC-AS3可调控胃癌、胶质瘤、乳腺癌的肿瘤形成、侵袭和转移[2-3],但lnc-HOXC-AS3在调控胃癌的发生与进展方面的具体机制还需要深入的研究。另一方面,miRNA也是近年来研究的热点之一,主要通过直接或间接结合靶基因3’端非翻译区,导致靶mRNA的降解或低表达,从而发挥其抑癌或促癌的生物学作用,在疾病的发展过程中扮演重要角色[4]。同时,大量研究发现,lncRNA与miRNA的相互作用在癌症发生、发展过程中发挥重要作用[5-7]。miR-15b-5p已经报道在胃癌、膀胱癌、骨肉瘤和结直肠癌中异常表达,且可调控这些肿瘤中重要分子进而影响肿瘤的发生、发展[8-11]。本研究通过检测lnc-HOXC-AS3在胃癌组织样本及细胞系中的表达,通过生物信息学分析的方法预测lnc-HOXC-AS3可通过miR-15b-5p/E2F3调控胃癌细胞增殖和转移的作用机制,再经细胞实验进一步验证。
1 材料和方法
1.1 样本收集
收集2017年4月—2018年12月安徽医科大学第一附属医院收治并经病理学检查诊断为胃癌的患者,病理学资料及预后信息完整,共90例。纳入标准:①患者均经术后病理学检查确诊为胃腺癌;② 均为初次诊治,既往未接受过放化疗等治疗;③临床病理学及随访资料完整,患者及家属均知情同意并已签署知情同意书。排除标准:①合并其他恶性肿瘤病史;② 合并严重的心肺肝肾等脏器功能不全;③合并类风湿性关节炎等免疫系统疾病。其中男性54例、女性36例,年龄29~81(64.72±12.53)岁;伴淋巴结转移49例,无淋巴结转移41例;肿瘤直径:<5 cm 42例,≥5 cm 38例;肿瘤位置:贲门22例,胃体32例,胃窦36例;肿瘤TNM分期:Ⅰ期9例,Ⅱ期18例,Ⅲ期57例,Ⅳ期6例;组织学分化程度:高中分化47例,低分化43例。本研究经安徽医科大学第一附属医院伦理委员会批准且所有研究对象对本研究均签署知情同意书。分别获取患者胃癌组织及对应的癌旁组织(距离肿瘤组织边缘≥2 cm,且≤5 cm),取标本后一部分立即放入4%的中性甲醛溶液进行固定,用于后续的免疫组织化学检测。一部分放于RNA-later中,储存于-80 ℃条件下,用于后续的RNA提取。
1.2 细胞系细胞培养和转染
研究中涉及到的HTB-103、AGS和NCI-N87胃癌细胞系购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),MGC803、MKN45、MKN28、HGC27胃癌细胞系以及正常胃黏膜上皮细胞(GES-1)购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。HTB-103、AGS、NCI-N87、MKN45、MKN28和HGC27胃癌细胞系采用含10%胎牛血清的RPMI-1640培养液在37 ℃、CO2体积分数为5%的培养箱中常规培养。其他胃癌细胞系(GES-1和MGC803)采用含10%胎牛血清的DMEM培养液在37 ℃、CO2体积分数为5%的培养箱中常规培养。选取对数生长期的胃癌细胞,胰酶消化后,接种一定数量的胃癌细胞到6孔板,每孔添加2 mL的细胞培养液,并于37 ℃、CO2体积分数为5%的培养箱中培养,至细胞融合度达到70%时进行AVV/HOXC-AS3、HOXC-AS3/shRNA、miR-15b-5p mimics/inhibitor和E2F3 siRNA转染,病毒转染时参考腺病毒转染的方法。质粒以及小干扰RNA转染方法参考LipofectamineTM3000转染试剂说明书,转染48 h后于荧光显微镜下观察细胞转染效果。
1.3 实验试剂
RPMI-1640、DMEM和胎牛血清购自美国Gibco公司;LipofectamineTM3000购自美国Invitrogen公司,TRIzol试剂购自美国Invitrogen公司,用于组织和细胞RNA的提取。反转录试剂盒购自日本TOYOBO公司,用于将RNA反转录成cDNA。细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自南京建成生物工程研究所;Transwell小室购自美国Corning公司;组织和细胞蛋白裂解液(PMSF)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)快速制备试剂盒购自美国Bio-Rad公司;双荧光素酶报告基因试剂盒和报告基因载体购自北京索莱宝科技有限公司;蛋白质印迹法(Western blot)用到的抗体(抗E2F3抗体、抗E-cadherin抗体、抗N-cadherin抗体和抗Snail抗体)购自美国CST公司,二抗[IgG(H+L)]购自美国Proteintech公司。AAV/HOXC-AS3重组腺病毒及对照腺病毒,HOXC-AS3 干扰质粒(HOXCAS3/shRNA)及干扰对照(shNC),miR-15b-5p模拟物(miR-15b-5p)及相应的阴性对照(miRNC),miR-15b-5p抑制剂(anti-miR-15b-5p)及相应的阴性对照(anti-miR-NC),含miR-15b-5p结合位点的野生型HOXC-AS3荧光素酶报告质粒(HOXC-AS3/WT)和miR-15b-5p结合位点突变的突变型HOXC-AS3荧光素酶报告质粒(HOXCAS3/Mut,上海吉玛制药技术有限公司)。
1.4 RNA的提取
反转录和实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)用于组织RNA的提取,将储存于RNA-later中的胃癌组织及对应的正常组织取出,用磷酸盐缓冲液(phosphate-buffered solution,PBS)洗两遍,用液氮预冷研钵,组织样品放入加有液氮的研钵中,在液氮冷冻状态下把组织样品充分研磨成粉末。把样品粉末转入到装有TRIzol裂解液的2.0 mL Eppendorf试管中(每毫升裂解液可加50 mg组织样品)剧烈振荡,充分混匀,平放室温静置5~10 min。然后按照TRIzol裂解液使用说明书进行RNA的提取。取对数生长期的胃癌细胞系,弃去培养液,用PBS洗两遍,然后在培养瓶中直接加入1 mL的TRIzol裂解液,静止2 min,然后用移液器反复吹打,将混合液体转移到2.0 mL Eppendorf试管中,然后按照TRIzol裂解液说明书进行RNA的提取。成功提取组织和细胞RNA后,首先进行RNA质量和浓度的检测,进行定量,然后应用反转录试剂盒按照说明书操作合成cDNA。最后按照RTFQ-PCR试剂盒说明书检测miR-15b-5p和E2F3的表达水平。
1.5 细胞增殖实验
收集处于对数生长期且已转染了A AV/HOXC-AS3、AAV/CON、sh/HOXC-AS3和sh/HOXC-AS3的胃癌细胞(MGC803),用相应的培养液进行重悬,细胞计数,然后分别加入2×103个细胞至96孔板中,加相应培养液至体积为200 μL,等细胞完全贴壁后,各孔加入20 μL CCK-8试剂,在37 ℃、CO2体积分数为5%的培养箱中培养2 h,然后放到酶标仪中进行检测。其余的孔分别培养24、48、72、96和120 h,加入20 μL CCK-8试剂,培养在37 ℃、CO2体积分数为5%的培养箱中2 h,然后放到酶标仪中测定450 nm处的吸光度(D)值。实验重复3次。
1.6 Transwell实验
弃去原培养液,用无菌1×PBS洗涤以充分除去死亡细胞,以新鲜的无血清培养液重悬细胞并计数调整细胞悬液的浓度至105个细胞/mL,将transwell小室放置到24孔培养板中形成上下两室,胃癌细胞(MGC803)等悬液200 μL(2×104个细胞)加入上室内,在下室内加入800 μL的完全培养液后放入细胞培养箱,在37 ℃、CO2体积分数为5%的条件下培养24 h;取出小室除去上室液体并用棉签仔细擦净膜上未迁移的细胞,室温下结晶紫染料染色20 min后用棉签仔细擦净膜内面未迁移的细胞和染料,37 °C预温的1×PBS漂洗两次后棉签擦,显微镜下计数移行至小室背面的细胞,然后100倍光镜下随机选择5个视野计数取平均值。
1.7 Western blot检测
收集融合度达到90%的胃癌细胞,使用RIPA蛋白裂解液提取各组细胞总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)检测蛋白浓度,进行蛋白定量。然后加入loading buffer,100 ℃加热10 min。使用10%SDS-PAGE进行电泳分离目的蛋白,电转法转移蛋白至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,使用5%的BSA进行封闭,然后用洗膜缓冲液(tris-buffered saline Tween,TBST)清洗3遍,加入相应一抗,4 ℃过夜温育,洗涤后HRP标记二抗室温温育2 h,使用电化学发光(electrochemical luminescence,ECL)显色,最后在凝胶成像仪上扫描分析,采用Image J软件分析条带的灰度水平,进行统计。实验重复3次。
1.8 荧光素酶报告基因
使用生物信息学软件(starbase)预测HOXC-AS3靶基因,发现miR-15b-5p与HOXCAS3有互补结合位点。将HOXC-AS3的互补结合位点突变,并且构建突变型荧光素酶报告载体(MUT),与miR-15b-5p mimics和mimics control共转染到细胞中,同时构建没有突变的野生型荧光素酶报告载体(WT)与miR-15b-5p mimics和mimics control共转染。培养2 d后,利用荧光素酶活性检测试剂盒检测荧光素酶活性。
1.9 RNA荧光原位杂交
将细胞于4%多聚甲醛中固定10 min,然后用HOXC-AS3探针与细胞在37 ℃温育过夜。然后用3%BSA清洗和封闭细胞。用DAPI对细胞进行染色,用尼康DS-U3显微镜进行荧光成像。
1.10 统计学处理
采用SPSS 21.0统计软件进行独立样本t检验、单因素方差及LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Lnc-HOXC-AS3在胃癌组织和胃癌细胞中的表达
前期我们通过生物信息学分析的方法(circlncRNAnet,http://app.cgu.edu.tw/circlnc/)预测了在胃癌组织中异常表达的lncRNA,结果发现,lnc-HOXC-AS3在胃癌组织中表达异常(log2Foldchange=6.02,图1A)。因此,我们选择lnc-HOXC-AS3作为下一步研究的重点。同时,我们基于GEPAI数据库(http://gepia.cancerpku.cn)对lnc-HOXC-AS3在胃癌中的表达进行分析,首先我们可以看到,在乳腺癌、宫颈癌、食管癌、嗜铬细胞瘤、副神经节瘤及胃癌中,相较于对应的正常组织均高表达(图1B)。进一步通过对408例胃癌组织和211例非匹配的正常组织[基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库]中lnc-HOXC-AS3的表达进行了分析。结果表明,lnc-HOXC-AS3在胃癌组织中的表达较正常组织明显升高(图1C)。为了验证生物信息学分析的可靠性,采用RTFQ-PCR检测lnc-HOXC-AS3在胃癌组织中具体的表达情况,结果显示,lnc-HOXC-AS3在胃癌组织的表达(-2.907±0.124)明显高于癌旁组织(-6.720±0.207)(n=90,P<0.001,图1D)。同时我们也检测了lnc-HOXC-AS3在胃癌细胞系中的表达,发现相较于正常的胃黏膜上皮细胞GES-1,大部分胃癌细胞均呈高表达[SUN-1(1.236±0.131),HGC27(0.569±0.057),MGC803(0.587±0.034),MKN 45(0.328±0.060),MKN 28(0.645±0.070),NCI-N87(0.843±0.038),GES-1(0.843±0.053);图1E]。其中MGC803细胞中lnc-HOXC-AS3的表达处于中等水平,我们也因此选择MGC803进行后续实验。为了明确lnc-HOXC-AS3在胃癌细胞中的定位情况,利用RNA荧光原位杂交(fluorescencein situhybridization,FISH)的方法检测lnc-HOXC-AS3在MGC803中的表达情况,结果如图1F,lnc-HOXC-AS3在胃癌细胞的细胞质和细胞核中均有表达。这提示lnc-HOXC-AS3可能在胃癌的进展中发挥重要作用。
2.2 Lnc-HOXC-AS3对胃癌细胞增殖和迁移能力的影响
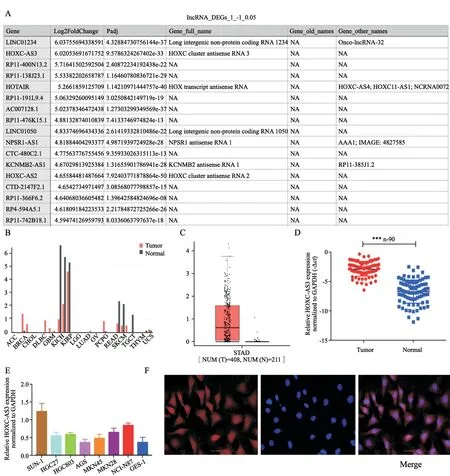
图1 Lnc-HOXC-AS3在胃癌组织和胃癌细胞系中高表达Fig.1 Lnc-HOXC-AS3 was highly expressed in gastric cancer tissues and cell lines
Lnc-HOXC-AS3在MGC803胃癌细胞系中的表达处于中等水平,所以我们选择MGC803胃癌细胞系进行下一步实验。首先我们在MGC803中进行了lnc-HOXC-AS3过表达和敲低质粒的转染,经过RTFQ-PCR对转染lnc-HOXC-AS3过表达和敲低质粒后的效果进行了检测,可以明显看到lnc-HOXC-AS3敲低的质粒能明显稳定地下调lnc-HOXC-AS3的表达(0.601±0.056vs0.245±0.039,P=0.0065)。同样,lnc-HOXCAS3过表达的质粒能明显稳定地上调lnc-HOXCAS3的表达(0.513±0.034vs0.892±0.044,P=0.0038,图2A)。通过transwell实验检测lnc-HOXC-AS3对胃癌细胞系迁移能力的影响,结果显示,过表达lnc-HOXC-AS3的MGC803的迁移能力(203.700±6.360)高于MGC803/NC细胞(105.700±2.906)(P=0.0002),相反敲低lnc-HOXC-AS3的MGC803(MGC803/sh-Lnc-HOXC-AS3)的迁移能力(25.330±1.453)明显低于MGC803/shNC细胞(122.000±2.082)(P<0.001,图2B~C)。另一方面,我们通过CCK-8实验检测lnc-HOXC-AS3对胃癌细胞系增殖能力的影响,结果显示,过表达lnc-HOXCAS3的MGC803的增殖能力明显高于MGC803/NC细胞,相反敲低lnc-HOXC-AS3的MGC803(MGC803/sh-Lnc-HOXC-AS3)的增殖能力明显低于MGC803/shNC细胞(图2D)。由于前面我们发现lnc-HOXC-AS3可以促进胃癌细胞的迁移,而上皮-间质转化(epithelial-mesenchymal transition,EMT)的改变是上皮肿瘤细胞失去黏附能力,获得间充质细胞迁移能力以促进转移的主要表型变化。因此我们也通过Western blot检测了lnc-HOXC-AS3对细胞EMT的影响。本研究证实过表达lnc-HOXC-AS3可以显著抑制MGC803细胞上皮细胞标志物E-cadherin的表达,上调MGC803细胞间质细胞标志物N-cadherin的表达,促进Snail的表达(图2E~F)。相反,敲低lnc-HOXC-AS3可以显著促进MGC803细胞上皮细胞标志物E-cadherin的表达,下调MGC803细胞间质细胞标志物N-cadherin的表达,抑制Snail的表达。总的来说,我们发现lnc-HOXC-AS3可以促进胃癌细胞的增殖、迁移及EMT。
2.3 Lnc-HOXC-AS3与E2F3的表达的相关性
本研究已初步证实lnc-HOXC-AS3可促进胃癌细胞的增殖和迁移。目前内源竞争RNA(competing endogenous RNAs,ceRNA)的机制是lncRNA发挥生物学功能最重要的途径,因此本研究首先通过Starbase(http://starbase.sysu.edu.cn/index.php)进行预测。miR-15b-5p是lnc-HOXC-AS3最可能的靶基因之一,预测序列见图3A。为明确lnc-HOXC-AS3与miR-15b-5p结合之后,影响了miR-15b-5p与哪个靶基因的结合,本研究通过Starbase(http://starbase.sysu.edu.cn/index.php)对miR-15b-5p的靶基因进行了预测。结果发现,E2F3是miR-15b-5p最有可能的靶基因,其预测结果见图3B。E2F3是E2F转录因子家族中重要的成员之一,本研究首先通过生物信息学方法(基于GEPIA数据库)对E2F3在GEPIA数据库已有癌种中的表达进行了预测,结果发现,E2F3大部分癌种中,肿瘤组织较正常组织都呈高表达(图3C)。进一步分析结果发现,E2F3在胃癌组织(n=408)中的表达高于正常组织(n=211)(基于TCGA和GTEx数据库,P<0.05,图3D)。采用生物信息学的方法(http://www.kmplot.com/analysis/index.php?p=service&cancer=gastric)对胃癌患者的预后进行分析(基于TCGA数据库),发现E2F3高表达的胃癌患者预后较差,生存率明显低于E2F3低表达的胃癌患者(图3E)。本研究采用RTFQ-PCR对90例胃癌患者进行了检测,结果发现,E2F3在胃癌组织的表达(-2.775±0.174)明显高于癌旁组织(-6.925±0.194)(P<0.001,图3F)。本研究进一步分析了lnc-HOXC-AS3与E2F3在表达上的相关性,结果显示,两者存在着明显的正相关(r=0.702,P<0.001,图3G),该结果与我们生物信息学方法预测的结果一致(r=0.300,P<0.001,图3H)。
2.4 miR-15b-5p与lnc-HOXC-AS3和E2F3靶向的关系
我们检测了MGC803细胞系中lnc-HOXCA S 3 对miR-15b-5p 表达情况的影响,通过RTFQ-PCR实验,我们发现过表达lnc-HOXCAS 3 可以显著减少miR-15b-5p 的有效表达(P<0.005),相反,敲低lnc-HOXC-AS3可以提高miR-15b-5p的有效表达(P<0.005,图4)。另一方面,我们也发现过表达miR-15b-5p可以显著减少lnc-HOXC-AS3的有效表达,相反,抑制miR-15b-5p的表达可以明显提高lnc-HOXC-AS3的有效表达(图4B)。除此之外,本研究也检测了lnc-HOXC-AS3与miR-15b-5p在临床胃癌样本中表达的相关性,我们通过检测RTFQ-PCR检测了临床样本中miR-15b-5p的表达,并与之前lnc-HOXC-AS3的表达进行相关性分析,我们可以看到lnc-HOXC-AS3与miR-15b-5p在临床上呈明显的负相关(r=-0.5644,P<0.001,图4C)。进一步,我们通过双荧光素酶报告基因实验验证miR-15b-5p与lnc-HOXCAS3结合的可靠性。结果显示,过表达miR-15b-5p可以使荧光素酶活性显著下降。而共转染miR-15b-5p mimics和靶向位点发生突变的pGL3-Lnc-HOXC-AS3-Mut载体,miR-15b-5p对荧光素酶活性的抑制作用丧失(图4D)。Lnc-HOXCAS3通过与miR-15b-5p的结合,可能影响miR-15b-5p与其靶基因的结合。在前面的结果中,我们预测了miR-15b-5p的靶基因,我们发现E2F3可能是miR-15b-5p的一个靶基因,而且我们的结果也显示,lnc-HOXC-AS3与E2F3存在表达上的相关性。那么miR-15b-5p是否可与E2F3结合呢?首先我们通过RTFQ-PCR检测在MGC803胃癌细胞系中miR-15b-5p对E2F3有效表达水平的影响,结果表明,过表达miR-15b-5p可以显著减少E2F3的有效表达,相反,抑制miR-15b-5p的表达可以明显提高E2F3的有效表达(图4E)。进一步,我们通过Western blot检测MGC803胃癌细胞系中miR-15b-5p对E2F3蛋白水平的影响,从图4F~4G中同样可以发现,过表达miR-15b-5p可以减少E2F3蛋白的表达。除此之外,关于miR-15b-5p与E2F3在临床上的相关性,我们通过检测RTFQPCR检测了临床样本中E2F3的表达,并与之前miR-15b-5p的表达进行相关性分析,我们可以看到miR-15b-5p与E2F3在临床上呈明显的负相关(r=-0.5757,P<0.001,图4H)。最后,我们通过双荧光素酶报告基因的方法验证了miR-15b-5p可以结合E2F3(图4I)。
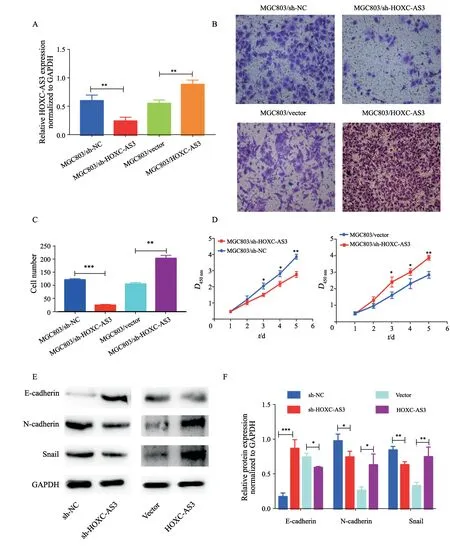
图2 Lnc-HOXC-AS3促进胃癌细胞的增殖和迁移能力Fig.2 Lnc-HOXC-AS3 overexpression promoted the proliferation and migration of gastric cancer cells
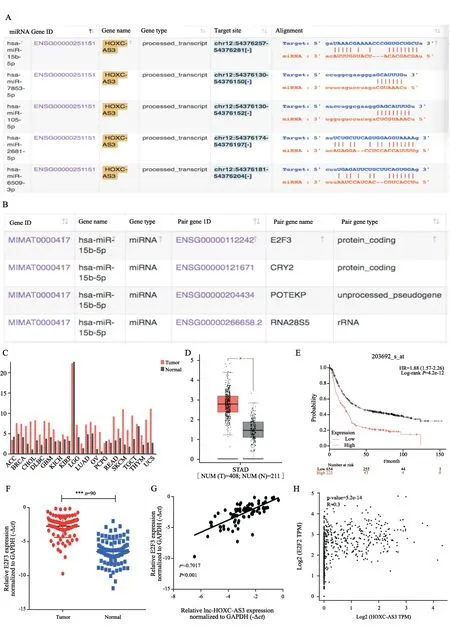
图3 E2F3在胃癌组织中高表达且与lnc-HOXC-AS3呈正相关Fig.3 E2F3 was highly expressed in gastric cancer and positively correlated with lnc-HOXC-AS3
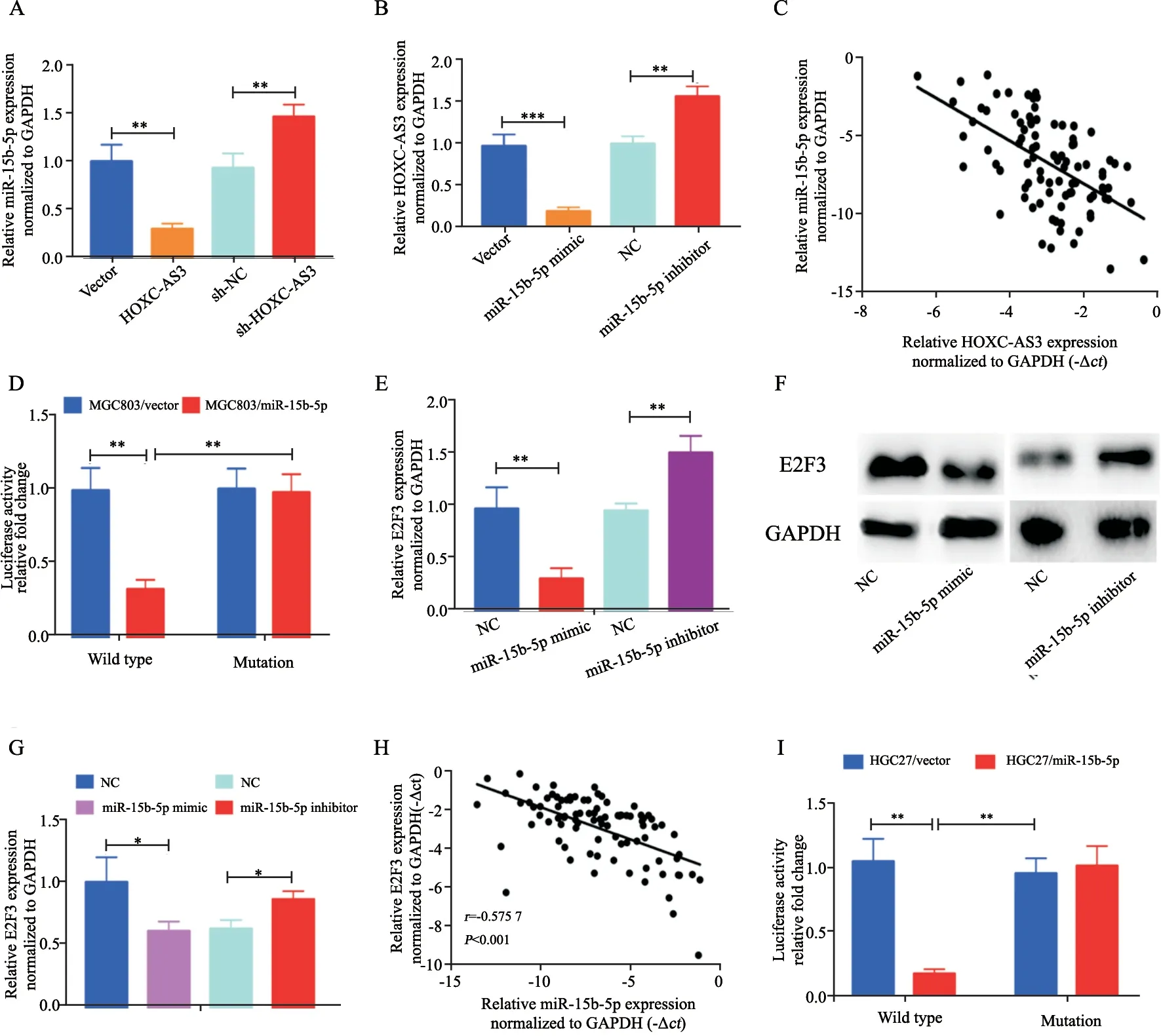
图4 Lnc-HOXC-AS3,miR-15b-5p和E2F3之间的结合关系Fig.4 Regulatory relationship between lnc-HOXC-AS3,miR-15b-5p and E2F3
2.5 Lnc-HOXC-AS3通过miR-15b-5p/E2F3生物学轴调控胃癌细胞的增殖和转移
我们通过RTFQ-PCR,证实敲低miR-15b-5p可显著下调MGC803细胞中miR-15b-5p的表达水平,而同时敲低lnc-HOXC-AS3的表达则可以逆转miR-15b-5p抑制剂的作用,但是同时敲低E2F3则对miR-15b-5p的表达没有明显的影响。Western blot检测结果也显示,敲降miR-15b-5p可显著上调E2F3的表达水平,而同时敲低lnc-HOXC-AS3则可以逆转miR-15b-5p对E2F3的抑制作用(图5B)。然后,我们进一步通过CCK-8实验对lnc-HOXC-AS3是否通过miR-15b-5p/E2F3生物学轴促进胃癌细胞的增殖和转移进行检测。敲低miR-15b-5p后可以抑制MGC803胃癌细胞系的增殖能力,然而在敲低miR-15b-5p的同时敲低lnc-HOXC-AS3,则可以明显逆转miR-15b-5p对MGC803胃癌细胞系增殖能力的抑制作用,进一步敲低E2F3后,MGC803胃癌细胞系增殖能力又明显受到抑制。而transwell实验结果发现,敲低miR-15b-5p后可以抑制MGC803胃癌细胞系的迁移能力,然而在敲低miR-15b-5p的同时敲低lnc-HOXC-AS3,则可以明显逆转miR-15b-5p对MGC803胃癌细胞系迁移能力的抑制作用,进一步敲低E2F3后,MGC803胃癌细胞系迁移能力又明显受到抑制(图5E~F)。

图5 Lnc-HOXC-AS3经由miR-15b-5p/E2F3生物学轴促进胃癌细胞的增殖和迁移Fig.5 Lnc-HOXC-AS3 promoted the proliferation and migration of gastric cancer cells via miR-15b-5p/E2F3 axis
3 讨 论
同源盒(homeobox,HOX)基因是一类特殊的转录调节因子,在胚胎发育、细胞生长、分化、迁移等生理性调节机制中起到重要作用。HOXC属于同源盒基因家族(homeobox family)成员,在个体生物的生长发育、细胞分化、增殖、凋亡和血管生成等调节中起关键作用[12],且很多研究结果证明,HOXC基因也参与人类多种实体肿瘤的发生、发展[13-15]。而且,近年来,关于HOXC的反义RNA也有很多报道,例如,HOXC-AS3被发现在乳腺癌、胶质瘤等肿瘤中都显著的异常表达,而且可以促进肿瘤细胞的增殖、凋亡和迁移等[16-17]。在本研究中,我们通过生物信息学方法寻找到lnc-HOXC-AS3,并通过RTFQ-PCR实验初步分析了90例胃癌组织中lnc-HOXC-AS3的表达情况,结果显示,lnc-HOXC-AS3在胃癌组织中的表达明显高于癌旁组织)。在后续的实验中我们希望能进一步获取lnc-HOXC-AS3在胃癌中的全长序列(RACE实验),然后根据这个序列进一步对lnc-HOXCAS3的编码能力进行准确的分析,并且可以依照这个全长序列设计特异性的探针,同时利用以前的组织芯片(n=189),扩大样本量,采用RNAFISH技术,继续检测lnc-HOXC-AS3在胃癌组织中的表达,以深入了解lnc-HOXC-AS3的功能和机制。
在对lnc-HOXC-AS3的功能进行分析时,我们通过CCK-8和transwell实验发现,过表达lnc-HOXC-AS3能明显促进胃癌细胞的增殖和迁移能力。EMT是细胞迁移能力发生改变时主要特征,我们通过Western blot实验也证实lnc-HOXC-AS3可以调控胃癌细胞的EMT。基于这些研究结果,我们可以初步证实lnc-HOXC-AS3在胃癌的进展中发挥重要的作用。但是我们只是初步检测了胃癌细胞的增殖和迁移能力的改变,在下一步实验计划中,我们需要关注其他的功能学改变,比如细胞周期和凋亡有没有发生改变。除此之外,在检测过表达和敲低lnc-HOXC-AS3时胃癌细胞主要蛋白改变时,我们主要检测了与迁移能力密切相关的EMT相关蛋白,并没有检测增殖相关的蛋白,这也是我们下一步研究的重点。
目前关于lncRNA发挥作用的机制,研究较多的是lncRNA作为ceRNA发挥作用,ceRNA可以通过竞争性地结合miRNA来调节基因表达。目前有关lnc-HOXC-AS3的研究,在机制方面,主要是研究lnc-HOXC-AS3与蛋白YBX1的结合,调控YBX1的表达,进而促进胃癌的发生[18],但是lncRNA作为ceRNA发挥作用的机制并没有得到研究。所以接下来,我们在探索lnc-HOXCAS3调控胃癌增殖与迁移具体机制时,主要是探索lnc-HOXC-AS3作为ceRNA发挥作用。前期我们通过生物信息学分析的方法预测了与lnc-HOXC-AS3可能存在相互作用的miRNAs,从中我们依据排名,选中了miR-15b-5p作为下一步研究的miRNA。进一步我们通过荧光素酶报告基因实验也证实了lnc-HOXC-AS3可以结合miR-15b-5p,而且RTFQ-PCR实验也表明lnc-HOXC-AS3调控miR-15b-5p的有效表达。通过生物信息学的方法分析发现,miR-15b-5p在胃癌组织中的表达是升高的,而且高表达miR-15b-5p的胃癌患者预后较差。我们进一步对miR-15b-5p的靶向RNA进行分析,我们并没有按照目前已经研究证实的miR-15b-5p的靶基因进行后续实验,而是首先通过网站预测miR-15b-5p可能的靶基因,以此来寻找新的靶基因,探索miR-15b-5p发挥作用的新机制。通过生物信息学预测,结果发现,E2F3是miR-15b-5p的一个新的靶基因,并且通过双荧光素酶报告基因实验也证实miR-15b-5p是可以结合E2F3的。同时,本研究在分析lnc-HOXC-AS3与E2F3表达的相关性的时候,发现两者存在明显的正相关,而且在胃癌细胞中,过表达lnc-HOXC-AS3时,E2F3的表达也是明显升高的。最后通过挽救实验发现,lnc-HOXC-AS3可以恢复miR-15b-5p对E2F3的抑制作用。这些结果表明,lnc-HOXCAS3在胃癌中可通过ceRNA机制调控miR-15b-5p/E2F3分子轴。E2F3属于E2F转录因子家族的一员,参与细胞生长、分化等过程,从而调控肿瘤的发生、发展。目前,有文献报道E2F3在胃癌中表达明显增高,其表达与分化程度、TNM分期
和淋巴结转移密切相关,然而,E2F3在胃癌中的功能,以及E2F3在胃癌中是否通过调控Snail的表达来促进胃癌的EMT的改变,这些都需要进一步研究。除此之外,本实验主要在体外细胞实验的层面证实lnc-HOXC-AS3通过miR-15b-5p/E2F3分子轴调控胃癌的侵袭和迁移,缺乏体内实验,在后续的实验中,我们将利用裸鼠腹腔移植瘤模型进一步探索lnc-HOXC-AS3能否通过miR-15b-5p/E2F3生物学轴促进胃癌细胞的腹腔播散,这将更加明确lnc-HOXC-AS3/miR-15b-5p/E2F3生物学轴在胃癌的侵袭和转移中的作用,并对以lnc-HOXC-AS3/miR-15b-5p/E2F3生物学轴为靶向分子在胃癌靶向治疗中的价值进行探索。
综上所述,我们通过生物信息学分析和一系列实验证实lnc-HOXC-AS3在胃癌组织中表达升高,并且通过miR-15b-5p/E2F3生物学轴调控胃癌细胞增殖和迁移。但是miR-15b-5p/E2F3生物学轴具体是如何调控胃癌细胞的增殖和迁移的,miR-15b-5p/E2F3生物学轴下游的作用分子是什么?我们的研究对临床上靶向治疗有没有帮助,这都是我们下一步研究的重点。
