PI3K/AKT通路通过Nrf2途径调控PD-L1在非小细胞肺癌中的表达
2020-07-21
福建医科大学附属厦门弘爱医院肿瘤科,福建 厦门,361009
程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)是一种相对分子质量为4×104的跨膜蛋白,由CD274基因编码[1]。早期被发现在机体某些特殊时期增量表达,如妊娠、自身免疫性疾病及各种病毒感染等[2-3]。近年研究发现,PD-L1在多种肿瘤细胞中均呈高表达,参与对机体的免疫抑制[4-5]。PD-L1可以与免疫T细胞表面的程序性死亡[蛋白]-1(programmed death-1,PD-1)结合,致使T细胞失去免疫识别活性,无法杀伤肿瘤细胞[6-7]。肿瘤的发生、发展一方面与其自身恶性程度有关,另一方面也决定于其对免疫系统的破坏能力[8-9]。因此,PD-L1的表达水平直接影响患者的预后,通过人工干预降低其在肿瘤细胞中的表达,也成为促进免疫系统恢复、遏制肿瘤的潜在手段之一[3,10-11]。AKT又名蛋白激酶B(protein kinase B,PKB),其活性受磷脂肌酰醇-3-激酶(phosphoinositide 3-kinase,PI3K)调控,同时又调控着细胞多条信号通路,在细胞存活和凋亡中起重要作用。多项研究发现,AKT在许多肿瘤细胞中处于较为活跃的状态,其异常活性常引起多条信号通路的异常激活,并赋予肿瘤细胞异于正常细胞的能力,包括无限增殖、侵袭、抗逆性及抗免疫等[12-13]。
前期实验中,我们发现非小细胞肺癌A549细胞在经PI3K抑制剂wortmannin处理后,细胞中PD-L1的表达与AKT去磷酸化出现同步下调,根据AKT在细胞通路中的作用关系网,我们推测这种下调可能是通过抑制某些转录因子的活性而实现的。基于以上假设,我们通过短发夹RNA(short hairpin RNA,shRNA)技术同时构建了一些A549细胞和H460细胞的转录因子缺陷株,这些转录因子均被报道受AKT调控,如HeLa细胞系E-box结合蛋白(HeLa E-box binding protein,HEB)、螺旋环螺旋转录因子4(helixloop-helix transcription factor 4,HTF4)、NF-E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)及叉头盒蛋白O3(forkhead box O3,FOXO3a)等,以明确AKT通过转录因子调控PD-L1在肿瘤细胞内表达的机制。
1 材料和方法
1.1 试剂与仪器
实验所用人非小细胞肺癌A549及H460细胞及pGL3-basic载体均由本实验室保存。细胞培养在含10%灭活胎牛血清的RPMI-1640(购自美国Gibco公司)培养基中,细胞共培养所有培养基Lonza X-VIVO™ 15购自美国Lonza公司;人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)购自美国ZenBio公司;用于基因沉默的shRNA(HEB、HTF4、Nrf2及FOXO3a)均购自美国Santa Cruz Biotechnology公司。用于抑制PI3K活性的抑制剂wortmannin购自美国MedChemExpress公司。所用一抗为鼠抗,分别为抗Nrf2、抗pNrf2、抗PD-L1、抗AKT、抗pAKT(Ser473)购自美国Cell Signaling公司;二抗为兔抗鼠抗体,购自美国DAKO公司。用于流式细胞术分析的FITC标记PD-L1由本实验室自行偶联;蛋白质印迹法(Western blot)所用试剂购自美国Bio-Rad Laboratories公司。采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR),使用的Quant One Step RTFQ-PCR kit检测试剂盒及反转录试剂盒均购自天根生化科技(北京)有限公司;ROS探针检测试剂盒购自美国AAT Bioquest公司,用于检测PD-L1转录水平的RTFQ-PCR引物购自美国Thermofish公司;Dual-Luciferiase Reporter Assay System购自美国Promega公司;FuGENE[sup]®[/sup]6转染试剂盒购自美国Promega公司;SYBR green染料购自生工生物工程(上海)股份有限公司;Dynabeads®人CD3/CD28 T细胞激动剂购自美国Life Technology公司。
报告基因及细胞ROS反应检测采用美国PE公司生产的EnVision多功能酶标仪,RTFQ-PCR检测仪器为美国ABI公司的Stepone plus型RTFQ-PCR仪,Western blot定量分析软件为Image J 2.0。
1.2 转录因子敲除细胞株构建
A549细胞和H460细胞分别以3×106个/mL接种于含10%灭活胎牛血清的RPMI-1640培养基中,培养24 h后更换为不含血清的RPMI-1640培养基继续培养2~3 h。取3 μL浓度为 0.1 μg/μL的FuGENE[sup]®[/sup]6加入到的97 μL无血清培养基轻轻混匀,于室温下静置5 min,加入2 μL 浓度为1 μg/μL的shRNA-plamid(用于HEB、HTF4、Nrf2及FOXO3a等转录因子敲除)到试管中,用移液器混匀,室温放置20 min。用100 μL枪吸出转染液,均匀的滴入含10%灭活胎牛血清RPMI-1640的培养皿中,于CO2培养箱中培养6~8 h,待后续实验检测。
1.3 PD-L1基因的luciferin双报告基因体系构建
据美国国家生物技术信息中心(NCBI,National Center for Biotechnology Information)基因数据库查验设计引物。顺义链为5’-TCACCGAAGGTCAGAAAGTCCAACGC-3’,反义链为5’-GGAGCCTCGGGGAAGCTGCGCAGAACTG-3’。通过PCR扩增方法获得PD-L1基因启动子,并与pGL3-basic载体进行连接后转化入大肠杆菌中扩增,挑选菌落PCR为阳性克隆送测序。构建成功后,表达载体与海肾荧光素酶基因以1000∶1的比例共转染A549细胞和H460细胞,同时以pGL3-basic空载体作为对照。转染48 h后,使用Promega的Dual-luciferase报告基因检测试剂盒验证PD-L1启动子活性。
1.4 PD-L1的转录水平检测
根据mRNA提取试剂盒说明,提取A549细胞总RNA,并使用反转录试剂盒获得cDNA文库。据NCBI基因数据库查验,设计PCR引物。顺义链为5’-TGTACCACGTCT CCCACATAACAG-3’,反义链为5’-ACCCCACGATG AGGAACAAA-3’。以β-actin为内参,顺义链为5’-TGCTGACAGGATGCAGAAGGA-3’;5’-CGCTCAGGAGGAGCAATGAT-3’。对RTFQPCR实验数据采用2-△△Ct法进行分析。
1.5 Western blot检测
分别收集实验组和对照组细胞,加入事先预冷至4 ℃的洗板裂解液[(裂解液:50 mmol/L Tris,pH为7.4;150 mmol/L NaCl溶液;1%Triton X-100;1.0%脱氧胆酸钠,0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),以及10 mmol/L 的PMSF,10 mmol/L氟化钠],10 mmol/L EDTA,0.1%的亮抑蛋白酶肽)5~10 min后收集于1.5 mL离心管中,冰浴超声裂解细胞。将裂解液于4 ℃、11000×g离心10 min,取上清液测定蛋白质浓度,调整各组蛋白浓度一致后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。将电泳后的SDS-PAGE胶经过100 V电转1 h至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,将膜置于5% BSA室温封闭1 h,一抗(体积比1∶8000 稀释)室温温育2 h,TBST洗涤3次,每次10 min。二抗(体积比1∶10000稀释)室温温育1 h,用TBST洗涤。最后PVDF膜用增强型化学发光剂(ECL)溶液浸润,显影观察。
1.6 PBMC细胞与肿瘤细胞共培养
将A549细胞与H460细胞及其对应的人工构建基因缺陷株以每孔6×103个肿瘤细胞的量接种,并培养于10%灭活胎牛血清的RPMI-1640培养基中,培养于CO2体积分数为5%、37 ℃的条件下。待细胞增殖16~18 h后,去掉细胞上清液,加入适量的Lonza X-VIVO™ 15无血清细胞培养基继续培养48 h后加入适量的PBMC细胞共培养2 h。按说明书要求加入适量的免疫因子刺激剂CD3和CD28单抗刺激剂,通过流式细胞术检测免疫细胞对A549细胞、H460细胞及其基因缺陷株的杀伤效应。
流式细胞术检测方法:待检测细胞经胰酶消化后,在2000×g的离心力下离心分离3 min,使用预冷的PBS重悬细胞。加入FITC标记Annexin-Ⅴ及PI,轻轻混匀,与4 ℃冰箱中避光温育60 min。温育完成后,在2000×g的离心力下离心分离3 min弃去上清液,加入一定量PBS洗涤并继续离心,重复洗涤3遍后上机检测。
1.7 统计学处理
数据处理运用SPSS 20.0软件,采用t检验方法,实验结果用表示。方差齐性者采用方差分析法进行分析,方差不齐者进行秩变换后具备方差齐性,然后进行方差分析。P<0.05为差异有统计学意义。组间数据相关性分析采用Pearson相关系数,并在显著性水平为0.05区间内进行双尾检验。
2 结果
2.1 Insulin调节A549及H460细胞内PD-L1的表达水平
首先检测insulin的刺激对A549及H460亲本细胞内PD-L1的影响。结果显示,细胞经10 μg/mL的insulin刺激后,两株细胞内AKT的磷酸化水平出现显著增加,伴随着PD-L1基因的转录(图1A、B)和表达水平(图1C、D)较阴性对照组而言,也出现显著的增强。接着,我们继续检测了在敲除特定转录因子的缺陷株中,insulin是否仍然能保持着对PD-L1表达的刺激效应。结果如图1A、图1B显示,相同剂量的insulin,对A549HEB-、H460HEB-、A549HTF4-、H460HTF4-、A549FOXO3a-及H460FOXO3a-细胞中PD-L1的转录水平影响显著(P<0.001),但在A549Nrf2-、H460Nrf2-两株细胞株中PD-L1在刺激前后转录水平无明显变化(P>0.05)。另外,Nrf2敲除后与亲本株比较,的A549Nrf2-、H460Nrf2-细胞株中PD-L1的表达水平的变化和转录水平变化完全一致(P>0.05,图1C、D)。

图1 Insulin对A549、H460细胞亲本株和转录因子缺陷株中PD-L1的转录和表达的调节作用Fig.1 Insulin regulated the transcription and expression of PD-L1 in A549 and H460 cell lines and their transcription factor-deficient strain
2.2 ROS反应经Nrf2调节PD-L1的转录与表达
我们发现,AKT的激活可以显著地提高PD-L1在A549细胞和H460细胞内PD-L1蛋白的转录和表达水平,且这种促进作用与转录因子Nrf2有着重要的联系。为进一步验证Nrf2在PD-L1表达中的作用,我们使用ROS诱导法来破坏细胞中Keap与Nrf2的结合,促进Nrf2入细胞核发挥作用。结果显示,两株细胞株对isoproterenol的刺激,均表明出了PD-L1增量表达的效应,且呈浓度依赖性(图2)。
Isoproterenol提高PD-L1表达的作用,可以被ROS清除剂NAC解除(图3)。

图2 Isoproterenol通过ROS途径上调A549细胞及H460细胞内PD-L1的转录和表达水平Fig.2 Isoproterenol up-regulates the transcription and expression of PD-L1 via ROS pathway in A549 and H460 cell lines
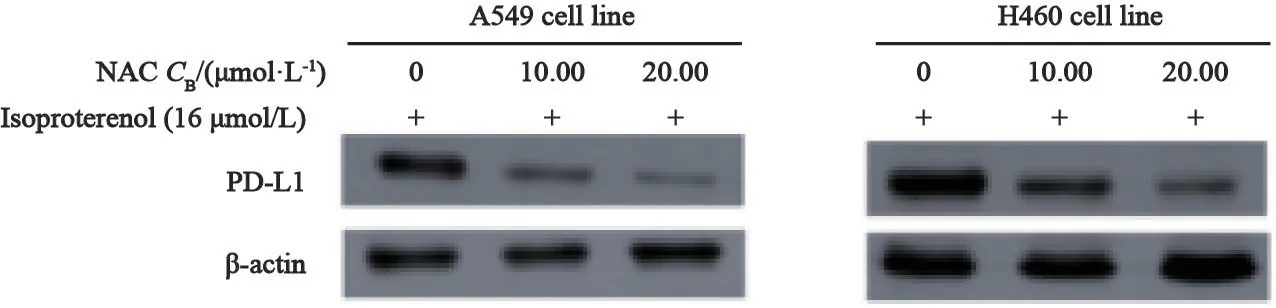
图3 NAC阻断isoproterenol在A549细胞及H460细胞内引起的PD-L1表达上调Fig.3 Up-regulation of PD-L1 transcription and expression in A549 and H460 cell lines could be blocked by NAC
2.3 PI3K/AKT抑制下调PD-L1表达水平
Insulin作为已知的PI3K/AKT通路激动剂,能引起AKT在细胞内的过度活化[14-15]。之前我们发现insulin的这种促进活化AKT作用,可以显著地提高PD-L1在A549和H460两株细胞系中的表达。为进一步验证这种促表达作用是否与AKT的过度磷酸化有关,我们接着使用PI3K的抑制剂wortmannin来调节AKT的磷酸化水平,并使用荧光素酶双报告基因体系评估PD-L1的转录水平是否与AKT磷酸化水平改变有同步效应。实验结果表明,wortmannin能逆转insulin刺激引起的AKT磷酸化水平增加,磷酸化的AKT随着抑制剂浓度的增加呈现梯度降低。与此同时,A549细胞株(图4A)和H460细胞株(图4B)内PD-L1的转录水平也逐渐降低(P<0.01),经关联性分析,AKT的磷酸化程度和PD-L1在细胞内的表达量呈正相关关系,相关系数r分别为0.95和0.93,该数据表明AKT的激活程度能直接影响PD-L1蛋白在细胞内的表达水平。
2.4 PI3K/AKT通路干预对Nrf2磷酸化水平的影响
Nrf2作为转录因子,其促进靶蛋白的转录通常是从其入核并结合靶基因的启动子开始的[16-17]。前述研究中我们证明,ROS反应可以提升PD-L1的表达量,同时AKT的过磷酸化也能增加PD-L1的表达,因此,我们推测AKT是通过磷酸化Nrf2促进其发挥功能。为验证以上假设,我们通过Western blot继续检测Nrf2在细胞内的磷酸化水平,并与AKT的磷酸化水平进行相关性分析。结果显示,A549、H460细胞株中的Nrf2磷酸化水平,在insulin和wortmannin的干预下,出现了先升后降的趋势。首先随着insulin浓度的增加,Nrf2磷酸化水平出现了明显的增加,随后在保持10 μg/mL的insulin体系下,加入0.01~1.00 μmol/L的wortmannin,Nrf2的磷酸化水平则依剂量浓度开始出现下降。同时,我们还同步监测了AKT磷酸化水平的变化,并进行了两者的相关性分析。结果显示,在A549和H460细胞株中,两者的磷酸化水平变化趋势相关系数分别为0.86和0.93,为强正相关(图5)。
2.5 Nrf2缺陷促进PBMC杀伤A549及H460细胞
为进一步观察Nrf2转录因子在肿瘤抵抗免疫系统中的作用,我们将构建好的Nrf2缺陷细胞株A549Nrf2-、H460Nrf2-细胞株与PBMC进行共培养,以其亲本细胞A549和H460细胞为阴性对照,检测共培养后PBMC细胞对两种野生型亲本细胞株和缺陷型细胞株的杀伤作用。结果显示,在加入免疫刺激因子CD3和CD28单抗刺激剂后,A549和H460细胞与PBMC细胞培养后,肿瘤细胞凋亡数量有所增加,A549细胞系的凋亡比例从原来的6.3%±0.8%提升为8.9%±0.6%(P<0.05,图6A),H460细胞系的凋亡比例从原来的9.5%±0.7%提升为13.5%±1.2%(P<0.05,图6B);而另一组缺陷株中,A549Nrf2-、H460Nrf2-细胞株对CD3和CD28的刺激就表明得非常显著,A549细胞系的凋亡比例从原来的10.5%±1.1%提升为32.5%±1.5%(P<0.001),H460细胞系的凋亡比例从原来的15.3%±0.7%提升为41.2%±1.2%(P<0.001)。该结果表明,Nrf2在肿瘤细胞抵抗免疫杀伤中有着重要的作用。
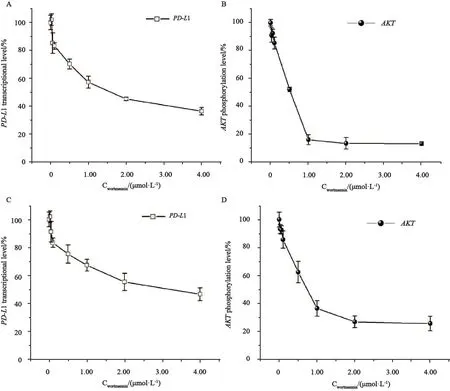
图4 Wortmannin能通过抑制AKT的磷酸化水平而降低A549细胞及H460细胞内PD-L1的转录水平Fig.4 Wortmannin down-regulates the transcription of PD-L1 via inhibiting phosphorylation level of AKT in A549 and H460 cell lines
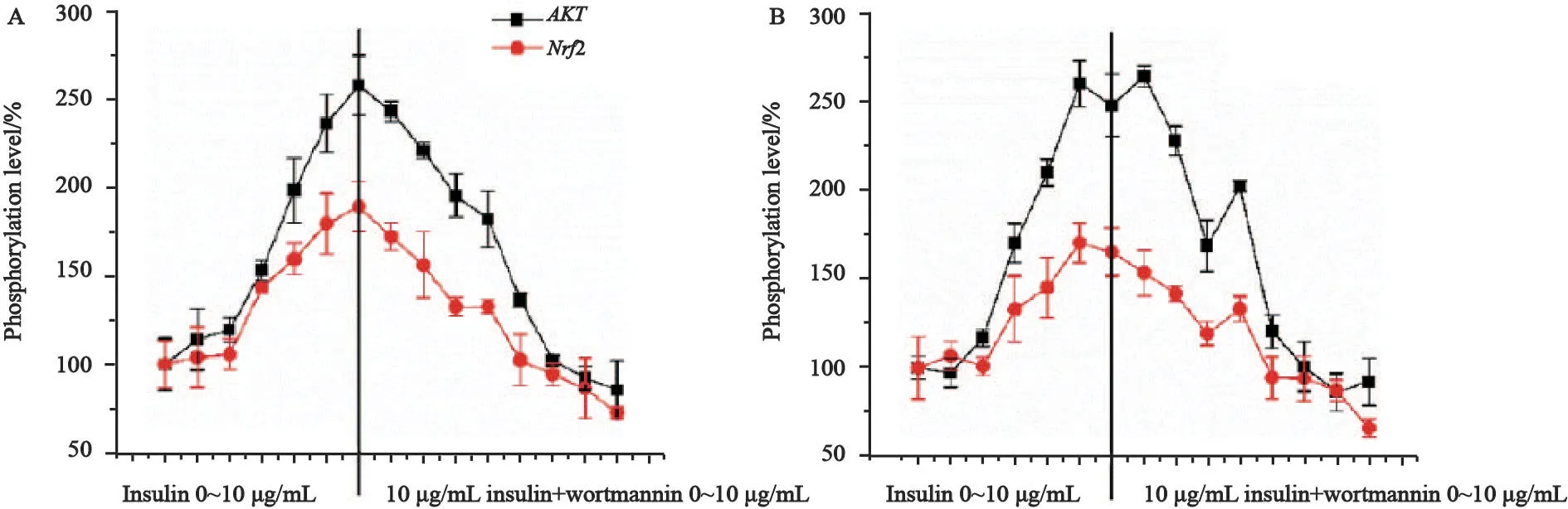
图5 Insulin与Wortmannin对A549细胞及H460细胞内Nrf2磷酸化水平的正负调控Fig.5 Positive and negative feedback regulation phenomenon which caused by insulin and wortmannin in A549 and H460 cell lines
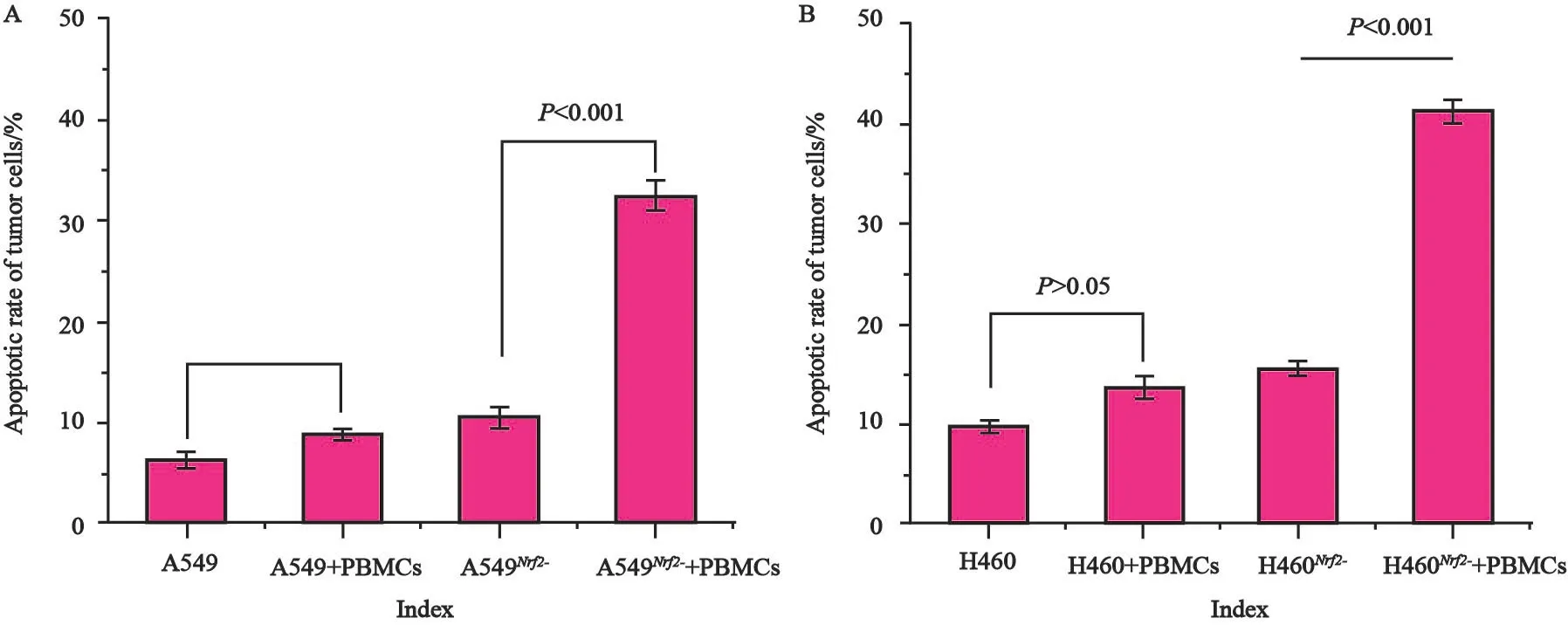
图6 转录因子Nrf2具有协助A549细胞及H460细胞系逃逸免疫细胞PBMC杀伤的作用Fig.6 Transcription factor Nrf2 was able to assist the tumor cells A549 and H460 in escape from by immune cell PBMC
3 讨 论
PD-L1/PD-1通路是免疫系统的一个关键检查节点,它调控着免疫系统对自身组织的识别,同时也成为被肿瘤细胞所利用的逃逸通路之一[18]。PD-L1/PD-1免疫检查点阻断为癌症的免疫治疗开启了新的革命式的发现,大量临床报道完全肯定了阻断该通路在肿瘤临床治疗的可行性[19-20]。PD-L1高表达是大多数实体瘤的重要特征[21],本文实验研究中也证实A549细胞和H460细胞中存在广泛的PD-L1表达现象。现今治疗方案主要是通过抗原抗体反应法,选择性地阻断PD-L1与PD1的接触,重启免疫系统,本研究拟从源头上阻断PD-L1的表达,减少肿瘤对免疫系统的抑制,以期为临床的靶向治疗与免疫治疗联用提供新的思路和理论基础。
本研究中发现,PD-L1的表达与一种同样活跃于各种实体瘤的蛋白AKT的活化程度有着重要的联系。PD-L1能受AKT的激活剂insulin影响,即insulin可以在促使AKT磷酸化的同时显著地提高PD-L1在肿瘤细胞的表达;而另一方面,这种促进作用可以为PI3K基因的抑制剂wortmannin所逆转。众所周知,PI3K基因是激活关键且为核心的环节之一,它的抑制能直接导致细胞内AKT的失活,进而促使凋亡。实验中我们发现,PD-L1基因的转录水平,也严格的受wortmannin调控,其下降水平与AKT去磷酸化同步发生,二者相关性分析提示,AKT的磷酸化水平与PD-L1的转录水平有重要的联系。这种转录水平的调控又是如何实现的?进一步研究发现,一种名为Nrf2的转录因子,在此通路中发挥着重要的作用。我们分别研究了Nrf2缺陷株对AKT调控的敏感性以及ROS反应触发Nrf2活性,发现Nrf的确是PD-L1正常表达的关键蛋白。与此同时我们还发现,AKT对Nrf2的调控与Nrf2的磷酸化有着紧密的联系,即AKT的激活与抑制,能同步影响Nrf2的磷酸化程度,这可能也是Nrf2启动PD-L1转录的关键因素之一。实验的最后,我们还检测了免疫细胞对Nrf2缺陷株的杀伤作用,并与其亲本株的反应作了比对。结果如同预期那样,敲除Nrf2的A549细胞系和H460细胞系对免疫细胞的敏感性显著性提高,在免疫因子刺激后,出现了大量的凋亡。
本研究发现AKT通路可能是通过Nrf2转录因子调控PD-L1蛋白在肿瘤细胞的表达,但还有部分情况仍未探明——AKT是否直接作用于Nrf2导致其磷酸化,这也是我们下一步研究要深入探究的课题。基于抑制PI3K/AKT通路以辅助PD-1/PD-L1免疫治疗,在非小细胞肺癌中也许具有良好的应用前景。
