Sema3A通过调控上皮-间质转化/基质金属蛋白酶-2参与上皮性卵巢癌转移
2020-07-21
复旦大学附属上海市第五人民医院妇产科,上海 200240
卵巢癌是常见的妇科恶性肿瘤之一,是全球第5大导致女性死亡的肿瘤相关性疾病。卵巢癌高死亡率是因为该病在确诊时70%的患者已是晚期,疾病的范围已经超出卵巢而扩散到腹腔和腹膜后淋巴结,而晚期卵巢癌的5年生存率约为30%[1]。上皮性卵巢癌(epithelial ovarian cancer,EOC)是最常见的卵巢癌组织学类型,其发病具有隐蔽性,缺乏有效的早期筛查方法,大多数患者确诊时已发生远处腹腔转移[2]。上皮-间质转化(epithelialmesenchymal transition,EMT)是上皮细胞失去其顶端-基底极性和细胞-细胞间黏附,成为更具侵袭能力的梭形间充质细胞。大量研究发现,EMT在EOC的侵袭转移中起关键作用,促进肿瘤细胞向远端散播[3-5]。
Sema家族参与肿瘤细胞增殖、迁移和血管新生,且在肿瘤侵袭及转移中起重要作用。Sema3A是Sema3家族中最典型和最先被确定的神经导向因子,其基因被认为是候选的抑癌基因[6]。研究[7]发现,低水平的Sema3A与EOC患者的不良预后有关,提示Sema3A可能参与EOC的发生、发展,然而Sema3A与EOC转移的研究少见报道。本研究首先检测腹腔转移和无腹腔转移的EOC卵巢组织中Sema3A的表达,再通过慢病毒感染的方式,构建Sema3A过表达和沉默的卵巢癌细胞系,体外实验分析Sema3A与卵巢癌细胞侵袭迁移的关系,并探讨其可能机制,为EOC的治疗提供潜在的分子靶点。
1 资料和方法
1.1 临床资料
选取2018年3月—12月于复旦大学附属上海市第五人民医院妇产科住院初治的20例腹腔转移的EOC患者(转移组)和20例无腹腔转移的EOC患者(非转移组)的卵巢组织蜡块标本。各组病例年龄在40岁~60岁。纳入标准:①经病理学检查和术中证实为腹腔转移EOC和无腹腔转移EOC;② 不合并其他肿瘤;③均为第1次接受手术治疗,术前无放疗和化疗史。排除标准:①其他病理学类型的卵巢癌;② 合并其他肿瘤;③术前行其他特殊治疗。所有患者均签署知情同意书,且经伦理委员会批准。
1.2 主要试剂和细胞系
人类卵巢癌细胞系来自复旦大学附属上海市第五人民医院中心实验室;HEK-293T细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),Sema3A cDNA和Sema3A shRNA质粒购自上海吉凯基因化学技术有限公司,RPMI-1640培养基和胎牛血清购自美国Sigma公司,胰酶购自美国Gibco公司,培养皿、培养板购自美国Corning公司,苏木精染液购自珠海贝索生物技术有限公司,TRIzol购自美国Invitrogen公司,PrimeScriptTMRT reagent kit with gDNA Eraser购自宝生物工程(大连)有限公司,FastStart Universal SYBR Green Master(Rox)试剂购自瑞士Roche公司,BCA蛋白浓度分析试剂盒购自上海碧云天生物科技有限公司,transwell培养板购自美国Costar公司,Sema3A抗体(ab23393)购自英国Abcam公司,E-cadherin抗体(60335-1-Ig)和N-cadherin抗体(22018-1-AP)均购自美国Proteintech公司,ZO-1抗体(8193S)、Slug抗体(9585S)和β-actin抗体(4790S)均购自美国CST公司,MMP-2抗体(sc-10736)购自美国Santa Cruz公司,HRP标记的山羊抗兔、抗鼠二抗均购自北京中杉金桥生物工程有限公司。
1.3 卵巢癌细胞的培养
从液氮中取出冻存的卵巢癌细胞系迅速复苏,用含有10%胎牛血清RPMI-1640培养基于CO2体积分数为5%、37 ℃条件下培养,每24 h更换1次培养基,当细胞密度达到80%~90%时,细胞状态良好,进行细胞传代。
1.4 构建Sema3A过表达和沉默细胞系
准备6 cm培养皿,铺种1.2×106个HEK-293T细胞,培养过夜。利用LipofectamineTM2000脂质体转染试剂将Sema3A-cDNA和病毒包装质粒psPAX2和pVSVG(或Sema3A shRNA和病毒包装质粒psPAX2和pMD2.G)按一定的比例导入HEK-293T中,培养48 h后,收集细胞上清液,经0.45 μm滤器过滤后分装备用。
于6孔板中分别铺种卵巢癌细胞系A2780和SK-OV-3,培养过夜后,分别加入上述病毒液及polybrene(8 μg/mL)。其中A2780中加入Sema 3A cDNA,SK-OV-3中加入Sema 3A shRNA。继续培养48 h后,换新鲜培养基,并加入puromycin(1 μg/mL)进行药筛,48 h后,降低药物浓度,继续药筛两周后得到稳定转染Sema3A cDNA和Sema3A shRNA的卵巢癌细胞株。对照组中按上述步骤导入空载质粒(vector)和Luciferase shRNA(shLuc)。
1.5 免疫组织化学法
将转移组和非转移组卵巢癌组织经10%甲醛溶液固定,常规石蜡包埋后进行4 μm连续切片。常规脱蜡水化后,利用抗原修复液(pH为9.0 EDTA)进行抗原修复,利用3%双氧水室温温育20 min,TBST冲洗3次;用10%山羊血清室温封闭20 min;每个组织滴加100 μL Sema3A兔多克隆抗体(稀释比1∶50),4 ℃温育过夜;次日室温放置15 min,TBST冲洗3次;每张切片滴加100 μL山羊抗兔二抗,室温温育45 min,TBST冲洗3次;每张切片滴加100 μL DAB,镜下观察,自来水终止显色。苏木精复染,盐酸乙醇分化,返蓝液返蓝。最后干燥封片,显微镜下观察拍照。加入磷酸盐缓冲液(phosphate-buffered solution,PBS)代替一抗做为阴性对照组。
免疫组织化学结果判定:Sema3A定位于细胞质,阳性为棕黄色。染色强度评分:0分(阴性),1分(弱),2分(中),3分(强)。染色阳性率评分:0分(阴性),1分(1%~20%),2分(21%~40%),3分(41%~60%),4分(61%~80%),5分(81%~100%)。以“染色强度评分”和“染色阳性率评分”的乘积为总评分进行分组,平均值6.25分,≤6.25分为低表达组,>6.25分为高表达组。
1.6 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
TRIzol法提取细胞总RNA,利用反转录试剂盒(PrimeScriptTMRT reagent kit with g DN AEraser)将RNA反转录成cDNA。以cDNA为模板采用RTFQ-PCR试剂盒[FastStart Universal SYBR Green Master(Rox)]进行扩增检测。引物如下:Sema3A上游引物为5’-GTGCCAAGGCTGAAATTA TCCT-3’,下游引物为5’-CCCACTTGCATTC ATCTCCTTCT-3’;G APDH上游引物为5’-AGGTCGGAGTCAACGGATTTG-3’,下游引物为5’-GTGATGGCATGGACTGTGGT-3’。分析Sema3A相对mRNA的表达水平,以GAPDH为内参,使用2-ΔΔCt方法分析结果,公式为:ΔCt=CtSema3A-CtGAPDH。所有实验均重复3次。
1.7 Transwell侵袭实验
取对数生长期的各组卵巢癌细胞制备单细胞悬液,接种于transwell小室的上室中。每个小室接种2×104个细胞于200 μL无血清培养基中。在transwell小室的下室中加入500 μL含10%FBS的RPMI-1640培养基,37 ℃温育20 h。用PBS洗去培养基后将小室置于4%多聚甲醛中固定15 min,用0.1%结晶紫染色10 min,并用棉签将残留在上室中的细胞擦除干净。然后用双蒸水将小室残留的结晶紫染液洗涤干净,在显微镜下观察,随机选取5个视野中的细胞进行拍照和计数。所有实验均重复3次。
1.8 划痕迁移实验
取对数生长期的各组卵巢癌细胞系,以5×104个/孔的密度培养至细胞铺满单层,用10 μL移液器吸嘴沿培养板底部垂直划线,用PBS冲洗3次,在显微镜下拍照记录两组细胞划痕宽度。更换无血清培养基,并在37 ℃的培养箱中再培养24 h,记录两组细胞划痕宽度。使用Image-J软件评估24 h时间点与零时间相比伤口闭合的百分比。
1.9 蛋白质印迹法(Western blot)检测
收集各组卵巢癌细胞,并用预冷的PBS洗涤两次。用RIPA裂解液裂解细胞30 min,然后12000×g离心15 min,将上清液转移至新的Eppendorf试管中,全程需保持4 ℃以防蛋白降解。使用BCA蛋白浓度分析试剂盒进行蛋白质定量。取20 μg总蛋白进行SDS-PAGE凝胶电泳,并将蛋白从胶上转移至PVDF膜上,将膜置于5%的脱脂牛奶中室温封闭1 h,并用相应的一抗温育过夜,经TBST洗涤3次后,加入二抗室温下温育1 h,TBST洗涤3次后加入显色液进行显色及曝光。
1.10 统计学处理
采用SPSS 17.0软件进行分析,Sema3A阳性率与病理学参数的相关性采用t检验,计量资料以x±s表示。采用Graphpad Prism 5.0进行数据统计及作图,两组间比较采用独立t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 转移组和非转移组卵巢癌组织中Sema3A的表达情况
免疫组织化学法检测转移组和非转移组卵巢癌组织中的Sema3A表达水平分别为2.73±2.61和7.27±3.61。转移组的Sema3A表达水平低于非转移组,差异有统计学意义(P<0.05,图1)。

图1 Sema3A在腹腔转移和非腹腔转移的上皮性卵巢癌中的表达情况Fig.1 Expression of Sema3A in epithelial ovarian cancer tissues with peritoneal metastasis and non-peritoneal metastasis
2.2 分析转移组中Sema3A与临床病理参数间的关系
转移组中Sema3A表达与患者年龄、病理学类型、肿瘤大小无关(P>0.05),而与国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、有无淋巴结转移相关(P<0.05,表1)。
2.3 Sema3A在卵巢癌细胞系中的表达及构建稳定转染细胞株
Western blot和RTFQ-PCR检测5种常见卵巢癌细胞系HEY、OVCA429、SK-OV-3、OVCA433和A2780中Sema3A蛋白和mRNA水平,发现其在A2780中表达水平较低,而在SKOV-3中表达水平较高(图2A~B)。因此,我们在A2780中导入vector和Sema3A cDNA,构建对照组(A2780 vector)和过表达Sema3A的A2780细胞株(A2780 Sema3A);在SK-OV-3中导入shLuc和Sema3A shRNA,构建对照组(SKOV-3shLuc)和沉默Sema3A的SK-OV-3细胞株(SK-OV-3 shSema3A)。Western blot和RTFQPCR检测Sema3A的表达,发现导入Sema3AcDNA后,Sema3A的表达明显升高;导入Sema3A shRNA后,Sema3A的表达明显下降(图2C~D),说明过表达和沉默Sema3A卵巢癌细胞株构建成功,可用于下一步实验。

表1 Sema3A 的表达与腹腔转移上皮性卵巢癌患者临床参数间的相关性分析Tab.1 Correlation analysis between the expression of Sema3A and clinical parameters in patients with peritoneal metastatic epithelial ovarian carcinoma[n (%)]
2.4 Sema3A抑制卵巢癌细胞的侵袭和迁移能力
进一步通过transwell实验和划痕实验检测Sema3A表达水平的变化是否引起卵巢癌细胞侵袭、迁移能力的改变。Transwell侵袭实验结果显示,过表达组侵袭的细胞数显著低于对照组(P<0.05),沉默组侵袭的细胞数显著高于对照组(P<0.05,图3A~B);划痕实验结果显示,24 h后过表达组细胞划痕宽度百分比显著高于对照组(P<0.05),沉默组细胞划痕宽度百分比显著低于对照组(P<0.05,图3C~D),表明Sema3A抑制卵巢癌细胞的侵袭和迁移行为。
2.5 Sema3A抑制卵巢癌转移的可能机制
为了研究Sema3A是否调控EMT相关蛋白和MMP-2的表达,我们通过Western blot发现过表达组较对照组的E-cadherin和ZO-1表达水平升高,而N-cadherin、Slug和MMP-2表达水平降低;沉默组较对照组的E-cadherin和ZO-1表达水平降低,而N-cadherin、Slug和MMP-2表达水平升高(图4),提示Sema3A通过下调EMT/MMP-2途径从而抑制卵巢癌细胞的侵袭和迁移能力。
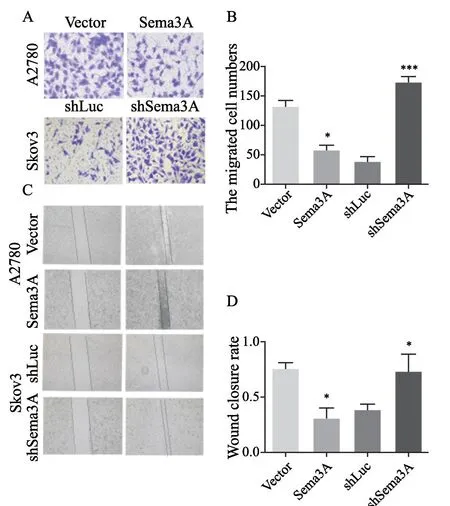
图3 Sema3A抑制卵巢癌细胞侵袭和迁移Fig.3 Sema3A inhibits invasion and migration in ovarian cancer cells

图4 Sema3A通过EMT/MMP-2途径抑制卵巢癌细胞转移Fig.4 Sema3A inhibits metastasis through EMT/MMP-2 in ovarian cancer cells
3 讨 论
Sema3A在包括不同类型的肿瘤中均处于低水平,被认为是候选的抑癌基因。例如,在头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)患者中,Sema3A的低表达与其短生存期相关,过表达Sema3A蛋白抑制细胞增殖和集落形成,诱导细胞凋亡,并伴有细胞周期蛋白的减少,此外,通过抑制NF-κB和Snail2从而抑制HNSCC的EMT[8]。在胃癌中,Sema3A的低表达与组织低分化、浸润深度、血行转移及TNM分期有关,是一个独立的生存不良的预后因素。此外,在胃癌的体外研究中,Sema3A过表达可抑制细胞增殖和迁移[9]。在前列腺癌中,肿瘤细胞中Sema3A的表达与良好预后相关,如较低的病理分期和较低的术前PSA水平[10]。另一方面,前列腺癌细胞中Sema3A水平的减少也被发现是对激素治疗抵抗的预测因子[11]。研究发现,在卵巢癌中,Sema3A的低表达与FIGO分期、分级和远处转移的存在显著相关,与肿瘤的组织学类型或大小无关[7]。而该研究仅对Sema3A与卵巢癌临床病理学特征及预后进行分析,并未对其是否影响EOC转移以及分子机制进行深一步研究。
本研究从临床标本中发现,Sema3A可能参与EOC腹腔转移,且与肿瘤的恶性程度有关,提示Sema3A可能是EOC转移的抑制剂。为进一步证明Sema3A抑制EOC的转移能力,我们在细胞水平上研究过表达和沉默Sema3A基因对卵巢癌细胞的侵袭和迁移行为能力的影响。结果发现,过表达Sema3A基因下调卵巢癌细胞的侵袭和迁移能力,沉默Sema3A上调卵巢癌细胞的侵袭和迁移能力,提示Sema3A参与卵巢癌细胞的转移。
EMT是上皮细胞上皮样特征减少,而间充质特性增加的生理过程[12]。EMT被认为是胚胎发育过程以及器官纤维化和癌症转移中的关键步骤。因此,EMT有助于肿瘤获得侵袭性、异质性和耐药性[13]。EMT的一个关键特性是上皮中间丝蛋白和基因下调而波形蛋白(vimentin)和基质金属蛋白酶(matrix metalloproteinase,MMP)上调[14]。此外,细胞-细胞和细胞-基质黏附分子如整联蛋白、E-cadherin和N-cadherin也在EMT中发挥重要作用[15]。体外实验发现,在永生化卵巢上皮细胞中导入E-cadherin基因能诱导细胞黏附形成,调控细胞的形态和迁移活动[16]。Quattrocchi等[17]发现,在高级别浆液性卵巢癌中,N-cadherin高表达与低生存率呈正相关。这些研究均说明卵巢癌患者E-cadherin的下调和N-cadherin的上调与转移相关。MMP-2是MMP家族的重要成员,协同肿瘤细胞扩散转移,与卵巢癌生长、转移和预后密切相关,对EMT起重要调节作用。已在卵巢癌、乳腺癌和胃癌等多种肿瘤中发现,细胞黏附破坏导致细胞外基质降解并释放MMP,介导蛋白酶水解E-cadherin从而促进肿瘤细胞侵袭转移[13]。本研究结果显示,Sema3A上调后,增加了E-cadherin和ZO-1的表达,而降低了N-cadherin、Slug和MMP-2的表达,Sema3A下调后,降低了E-cadherin和ZO-1的表达,而增加了N-cadherin、Slug和MMP-2的表达说明Sema3A介导卵巢癌的发病与转移可能通过调控EMT/MMP-2途径。
综上所述,Sema3A可作为EOC早期诊断的肿瘤标志物,其参与EOC的发病与进展可能通过影响EMT/MMP-2的途径。Sema3A对EOC的早期诊断、治疗、评价可能具有重要价值,有望成为预测EOC转移和预后的生物标志物。
