沉默信息调节因子过表达或谷氨酰胺剥夺对肾透明细胞癌细胞凋亡、增殖的影响
2020-07-21
复旦大学附属肿瘤医院检验科,复旦大学上海医学院肿瘤学系,上海 200032
肾癌是泌尿系统的常见肿瘤之一,肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)占肾癌的70%~75%[1]。局限性ccRCC手术后尚无标准辅助治疗方案,同时转移性ccRCC无标准的治疗方案,通常采用以内科为主、外科手术为辅的综合治疗,因此寻求新的治疗手段迫在眉睫。谷氨酰胺(glutamine,Gln)是动物组织中重要的氮源。在肿瘤细胞中,Gln代谢处于高水平[2],也会与宿主细胞竞争血液循环中的Gln,并引起Gln代谢重编程[3]。Gln代谢产生谷胱甘肽、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phostate,NADPH)等还原性物质抵抗细胞凋亡,抗氧化物质含量的变化会引起微环境的改变,进而影响ccRCC对铂类等细胞化疗药物的敏感性[4],因此调控谷氨酰胺代谢可成为治疗ccRCC的新手段。
沉默信息调节因子4(silent information regulator 4,SIRT4)位于线粒体基质,调节多种代谢酶活性和参与氧化应激的过程[5],可以通过ADP-核糖基化抑制谷氨酰胺脱氢酶活性[6],抑制谷氨酰胺代谢,因此被认为是“glutamine gatekeeper”[7]。现有研究[8]表明,SIRT4作为一个抑癌基因参与肿瘤的发生过程。在人类癌症和小鼠肿瘤模型中发现SIRT4具有肿瘤抑制作用[9-10]。此外,在正常细胞中,DNA损伤时Gln代谢明显降低,通过控制周期停滞来限制危害,但是如果SIRT4缺失或低表达,这种保护性限制将会被打破,促进肿瘤的发生、发展[11]。虽然在SIRT4在肝癌[12]、非小细胞肺癌[13]等癌种中可抑制肿瘤进展,但SIRT4对ccRCC发生、发展的影响尚不清楚,本研究探讨SIRT4是否通过抑制谷氨酰胺代谢影响ccRCC增殖、凋亡。
1 材料和方法
1.1 材料
1.1.1 细胞系
Caki-2细胞由复旦大学附属肿瘤医院泌尿外科赠送。
1.1.2 主要试剂
抗体SIRT4(sc-135797)、caspase-3(sc-56053)、caspase-9(sc-133109) 购自美国Santa Cruz公司,抗体Bax(50599-2-ig)、蛋白质印迹法(Western blot)二抗(SA00001-1、SA00001-2)购自美国Proteintech公司,蛋白marker(#26616)购自美国Thermo Fisher公司,cocktail(P8340)购自美国Sigma公司,HRP-ECL曝光液(36208ES60)购自上海翊圣生物科技有限公司,酮戊二酸(α-K G,CAS#328-50-7)、青-链霉素(15140122)购自美国Gibco公司,LipofectamineTM2000购自美国Invitrogen公司,PrimeScript®RT reagent Kit购自宝生物工程(大连)有限公司,ROS检测试剂2’,7’-dichlorofluorescein-diacetate(DCFH-DA,HYD0940)、线粒体膜电位检测试剂盒(C2006)购自上海碧云天生物技术有限公司。细胞计数试剂盒(cell counting kit-8,CCK-8)检测试剂(CK04)购自东仁化学科技(上海)有限公司。
1.2 实验方法
1.2.1 SIRT4和SIRT4-H161Y过表达慢病毒液生产
从HEK-293T细胞系中提取RNA,反转录为cDNA后,用相应引物扩增为双链DNA,经双酶切装载于pCDH-CMV-MCS-EF1-Puro,连同辅助质粒psPAX2、pMD2按照4∶3∶1一起转染HEK-293T细胞,48 h后收取病毒液,0.45 μm滤过器过滤。
1.2.2 稳定细胞株的获得和细胞培养
Caki-2细胞用含有10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640(购自美国Gibco公司)培养于CO2体积分数为5%、37 ℃的温箱中。利用0.25%胰酶(购自美国Gibco公司)进行细胞传代。用病毒液感染Caki-2细胞24 h后,用1~2 μg/mL的嘌呤霉素筛选1周后获得稳定表达的细胞系。
1.2.3 细胞增殖检测
将细胞以1000个/孔的密度种于96孔板中,在检测时间点更换新的培养基,并在每孔加入10 μL CCK-8检测试剂(CK04),37 ℃温育2 h后,在450 nm波长读取吸光度(D)值。
1.2.4 细胞克隆形成
将细胞按照1000个/孔种于6孔板种,用含有10%FBS的RPMI-1640培养基培养10~14 d后,4%多聚甲醛固定10 min后用1%的结晶紫染色,进行细胞克隆计数。
1.2.5 细胞凋亡检测
Caki-2细胞用0.25%胰酶消化后,400×g离心5 min,用磷酸盐缓冲液(phosphate-buffered solution,PBS)洗涤2次,Annexin V-FITC和碘化丙啶(propidium iodide,PI)染色15 min,用BD流式细胞仪检测凋亡情况。
1.2.6 细胞线粒体膜电位检测
细胞按照2×104个/孔种于24孔板中,用不同培养基培养48 h。取1个孔细胞用CCCP处理30 min作为阳性对照,所有待检测细胞中加入500 μL JC-1工作液处理37 ℃处理30 min,PBS洗涤2次。JC-1单体的激发波长为529 nm,而JC-1二聚体的激发波长为590 nm。通过流式细胞仪或激光共聚焦显微镜检测细胞线粒体膜电位的改变。
1.2.7 NADPH含量检测
当细胞长满约1×106个细胞时,吸净培养液,用移液器加入200 μL的NADP+/NADPH提取液,裂解细胞。13500×g,4 ℃离心5~10 min,取上清作为待测样品备用。配置NADPH标准品和标准曲线,加入检测样品,37 ℃避光温育10 min,终止显色,测量450 nm处的吸光度。
1.2.8 细胞内ROS检测
细胞用10 μmol/L DCFH-DA工作液37 ℃处理30 min,PBS洗涤1次,胰酶消化,BD流式细胞仪用538 nm发射波长检测。
1.2.9 蛋白质印迹法(Western blot)检测
将细胞用IP裂解液加入cocktail和PMSF在冰上裂解30 min,4 ℃ 360×g离心10 min,取上清,用BCA试剂盒(P0010,购自上海碧云天生物技术有限公司)蛋白定量后,加入上样缓冲液,100 ℃煮样5 min。将等量的蛋白样品进行聚丙烯酰胺凝胶电泳,通过电印记法转移到PVDF膜上,10%的脱脂牛奶封闭1 h后,按照目的条带大小切割温育一抗4 ℃过夜。第2天用对应属性的二抗室温温育1 h,用HRP-ECL荧光法检测目的蛋白的水平。
1.3 统计学处理
采取GraphPad Prism 6或SPSS 16.0进行统计分析,两组之间比较用t检验,多组之间统计用ANOVA,ROS检测后分析用FlowJo。P<0.05为差异有统计学意义。
2 结果
2.1 SIRT4过表达或Gln剥夺对Caki-2细胞增殖、生长的影响
Western blot结果表明,构建的SIRT4和SIRT4-H161Y(SIRT4功能突变体)载体能够过表达相应蛋白(图1A)。CCK-8检测结果表明,Gln剥夺48 h能够显著降低Caki-2细胞的增殖速度(P<0.001);正常Gln培养时,SIRT4过表达(overexpression,OE)能抑制细胞增殖(P<0.05,图1B)。为进一步探索SIRT4抑制Gln在Caki-2细胞增殖中的作用,我们分析了SIRT4突变体H161Y以及回补Gln代谢产物α-KG后细胞增殖的变化,结果表明,在正常Gln培养时,过表达突变体不能抑制细胞增殖;另外,Gln剥夺组回补α-KG后,即使过表达SIRT4也不能抑制细胞增殖(图1C)。正常Gln培养时,SIRT4-OE能够减少细胞克隆数目,与对照组相比,差异有统计学意义(P<0.05),而SIRT4-H161Y组却无明显差异。但如果长期缺乏Gln,Caki-2细胞无法生长,无克隆形成(图1D)。以上结果表明,SIRT4可通过抑制谷氨酰胺脱氢酶(glutamate dehydrogenase,GDH),减少Gln的摄入量,从而抑制Caki-2细胞增殖;在Gln剥夺后其细胞增殖抑制作用更为明显。
2.2 Gln代谢生成NADPH影响细胞内ROS
由于Gln代谢过程中会产生相当比例的NADPH,可作为抗氧化分子中和细胞内ROS,进而抵抗凋亡。因此NADPH含量检测显得尤为重要,检测结果表明,Gln剥夺48 h后NADPH生成量显著减少。另外,正常Gln培养的Caki-2细胞,SIRT4-OE组NADPH生成量比pCDH-con和SIRT-H161Y组减少(图2A)。氧化应激微环境是影响肿瘤生长、细胞凋亡的重要因素,为进一步探索SIRT4抑制Gln代谢对Caki-2细胞内ROS的影响,我们用DCFH-DA检测ROS水平,结果发现,正常Gln培养的Caki-2细胞中,SIRT4-OE组ROS水平较其他两组比明显升高;但细胞Gln剥夺后均会产生高水平的ROS,pCDH-con、SIRT4-OE和SIRT-H161Y这3组间差异无统计学意义(P>0.05,图2B)。

图1 SIRT4过表达和Gln剥夺均能抑制细胞增殖Fig.1 SIRT4 overexpression and glutamine deprivation inhibit cell proliferation

图2 SIRT4-OE或Gln剥夺使得NADPH生成减少,ROS水平增高Fig.2 SIRT4-OE or glutamine deprivation reduces NADPH production and increases ROS levels
2.3 过表达SIRT4或Gln剥夺对Caki-2细胞凋亡的影响
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,非Gln剥夺的细胞,过表达SIRT4后,绿色荧光(JC-1)/红色荧光(JC-1 aggregates)比例升高,意味着线粒体膜电位下降。同时Gln剥夺后pCDH-con、SIRT4-OE、SIRT-H161Y此3组细胞的线粒体膜电位都有明显下降(图3A)。此外,凋亡检测结果表明,正常Gln培养时,pCDH-con、SIRT4-OE和SIRT4-H161Y细胞凋亡比例分别是2.777%、7.143%和2.363%,SIRT4过表达引起细胞凋亡增加(P<0.05);Gln剥夺引起各组细胞凋亡大幅度增加(图3B)。Bax、caspase-3、caspase-9均是凋亡相关蛋白,我们采用Western blot检测这些蛋白的表达变化来进一步探索SIRT4或Gln剥夺对凋亡的影响。结果显示,非Gln剥夺的Caki-2细胞,SIRT4过表达凋亡相关分子表达量都增加,同时Gln剥夺使得这些分子增加更为明显(图3C)。
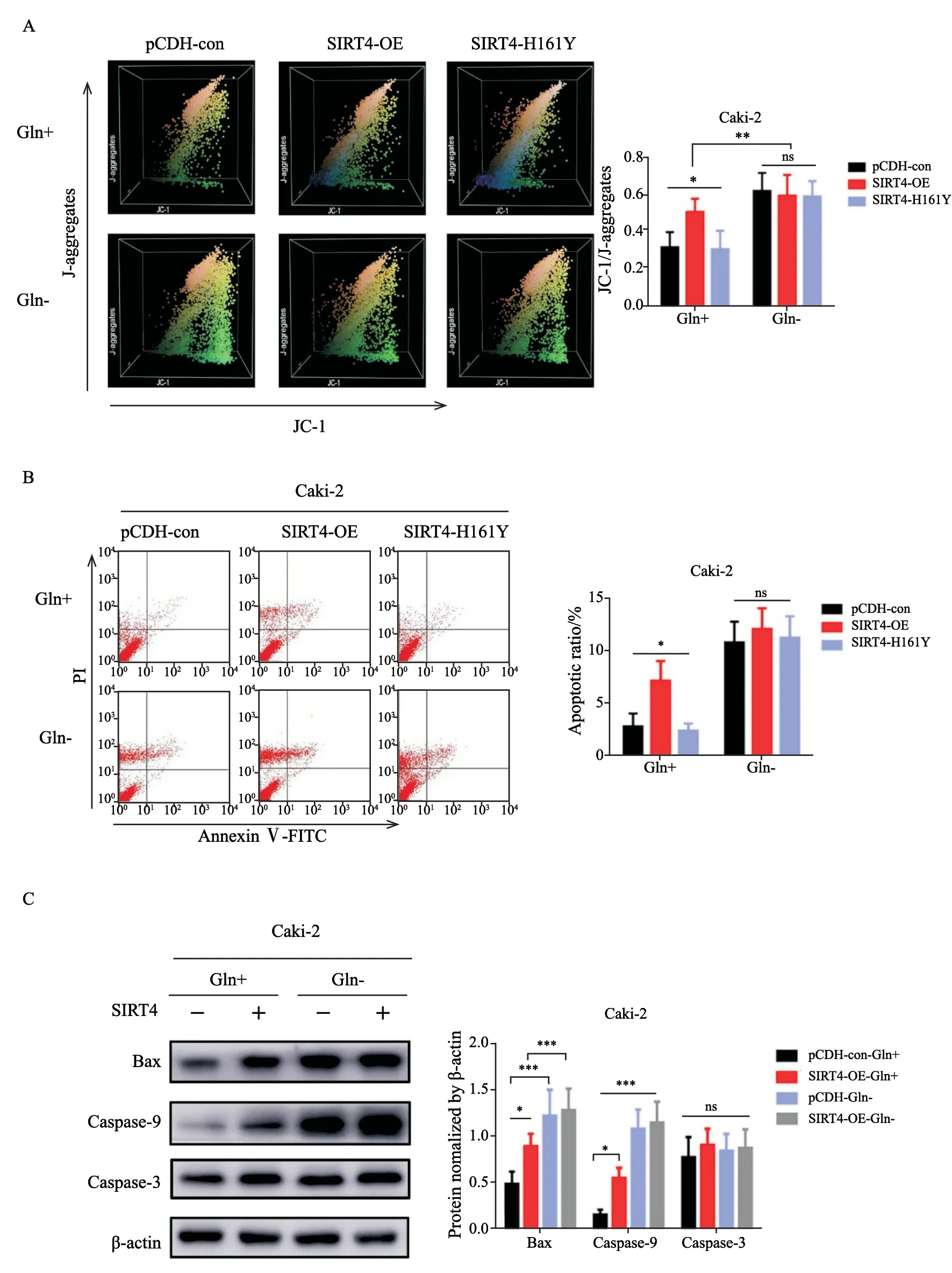
图3 SIRT4-OE或Gln剥夺促进细胞凋亡Fig.3 SIRT4-OE or Gln deprivation promotes apoptosis
3 讨 论
ccRCC具有明显的代谢重编程特征,与葡萄糖、谷氨酰胺、脂肪酸等代谢途径发生改变有关。可利用改变的代谢途径作为潜在的治疗策略,SIRT4就是一个控制Gln代谢的重要分子。现有研究[8]表明,SIRT4作为一个抑癌基因参与肿瘤的发生、发展过程。在人类癌症和小鼠肿瘤模型中,SIRT4可以通过影响Gln代谢发挥其抑制肿瘤的作用[9-10],目前尚无SIRT4在ccRCC中作用的研究。本研究发现,Gln剥夺对ccRCC细胞Caki-2的增殖、凋亡影响最为明显。然而,谷氨酰胺被众多细胞途径所利用,包括核苷酸的产生[14],DNA[15]和RNA[16]的合成,虽然肿瘤细胞对Gln十分依赖,存在“谷氨酰胺成瘾”现象,同时除了葡萄糖以外,Gln也是哺乳动物细胞用于生长和增殖的主要元素之一,对正常细胞同样是必不可少的,因此彻底剥夺Gln是对肿瘤细胞最有效却并非是一个最好的治疗方法。如果能够增加SIRT4在ccRCC肿瘤组织中的表达量(如SIRT4激活剂)就能减少肿瘤细胞Gln的利用,发挥抑制肿瘤生长、促进凋亡的作用。除此之外,抑制Gln代谢减少NADPH生成使得ROS显著升高,肿瘤细胞比正常细胞对高浓度的ROS更敏感,会因细胞结构不稳定等原因导致肿瘤细胞走向凋亡坏死。综上所述,SIRT4对ccRCC而言是一个有利分子,或将成为阻止肿瘤摄取Gln潜在的治疗靶向分子。
