乳腺肿瘤心脏病学的研究现状与争议
2020-07-21殷咏梅
,殷咏梅,2
1.南京医科大学,江苏 南京 210029;
2.南京医科大学第一附属医院肿瘤科,江苏 南京 210029
从2005年到2015年,癌症的发病率增加了33%。2015年全世界共有17500000例癌症患者,乳腺癌是女性最常见的恶性肿瘤,也是女性癌症死亡主要的原因[1]。随着疾病谱的转变,癌症的发病率将继续上升。Abdel-Qadir等[2]的一项随访至2013年12月的大型队列研究发现,特别是在年长的早期乳腺癌患者和合并心血管系统疾病的早期乳腺癌患者中,心血管系统疾病超过乳腺癌本身,成为导致其死亡的主要原因。在这种形势下,旨在通过肿瘤科与心脏科临床与科研的跨学科合作,改善患者预后的肿瘤心脏病学(cardio-oncology/onco-cardiology)应运而生。
1 乳腺肿瘤心脏病学的研究现状
Minotti[3]指出肿瘤心脏病学是一门研究抗肿瘤药物引起的心血管毒性及其机制、临床表现、诊断、治疗和预防的学科。乳腺癌治疗手段多样,其心脏毒性也不容忽视(表1)。
1.1 化疗相关心脏毒性
化疗相关的心力衰竭大致分为两种不同的临床类型:Ⅰ型和Ⅱ型。Ⅰ型以蒽环类药物为代表,主要对心肌细胞产生氧化应激导致自由基产生和细胞凋亡,这通常是不可逆的,活检常发现显著的超微结构的改变。Ⅱ型以曲妥珠单抗为代表,通常导致可逆的心功能障碍[4],而非结构性改变[5]。而这两种药物的组合在同一个乳腺癌患者的治疗方案中十分常见,因此这两种药物导致的心功能障碍也可以出现在同一位患者身上。Thavendiranathan等[6]的回顾性研究发现,2007—2012年的早期乳腺癌患者使用基于曲妥珠单抗的辅助化疗,心脏毒性风险升高。与一般人群相比,主要心血管事件的累积发病率更高。接受蒽环类药物和曲妥珠单抗序贯治疗的患者风险最高。
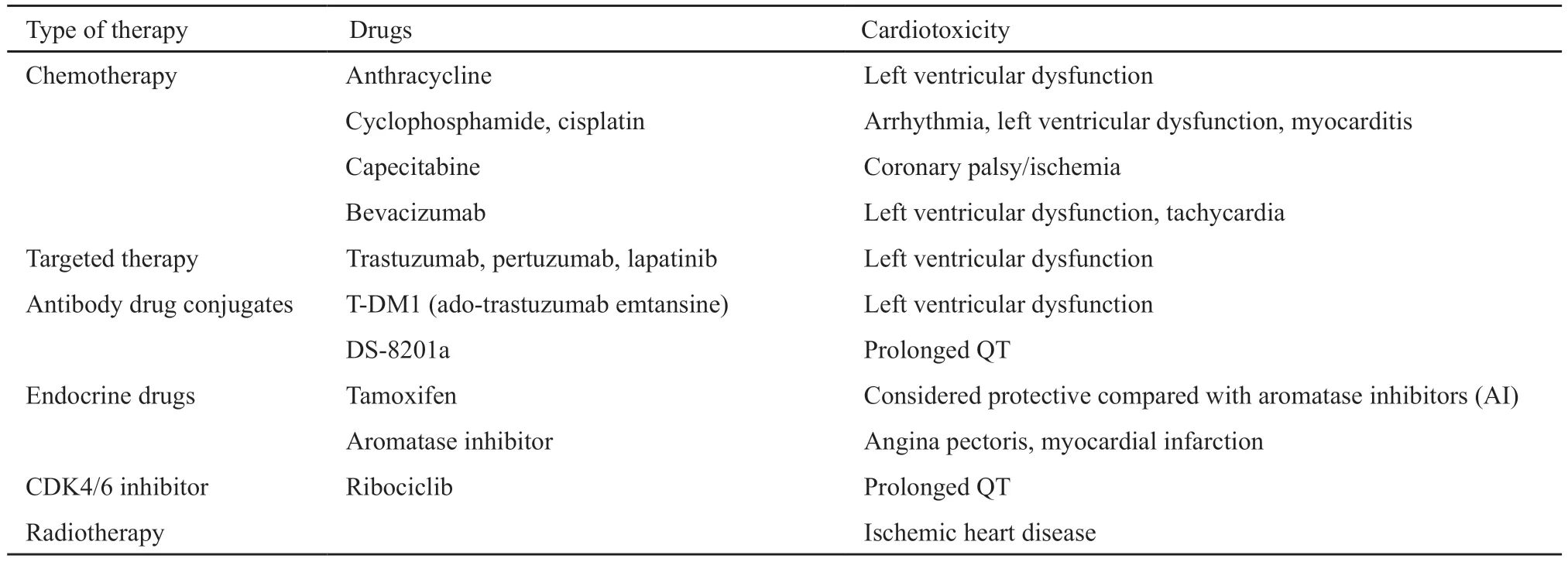
表1 乳腺癌治疗方式及相应的心脏毒性Tab.1 Breast cancer treatment and its corresponding cardiotoxicity
BCIRG-006研究[7]发现,AC-TH(多柔比星联合环磷酰胺序贯多西他赛联合曲妥珠单抗)和TCbH(多西他赛与卡铂联合曲妥珠单抗)方案的有效性无显著差别,但无蒽环类药物的TCbH方案可明显降低有症状的心力衰竭的发生率,且左心室射血分数下降超过10%的发生率是前者的一半。BCIRG 001[8]、GEICAM/2003-02[9]等研究也证实了蒽环类药物的心脏毒性。
1.2 靶向治疗相关心脏毒性
除了曲妥珠单抗,乳腺癌的靶向治疗药物还有拉帕替尼、帕托珠单抗等。对比拉帕替尼联用卡培他滨与卡培他滨单药治疗曲妥珠单抗进展后的乳腺癌患者的研究[10]中,未发现有症状的左心室收缩功能下降,且无因此停药的情况,两组左心室收缩功能无显著差别。其他研究[11-12]也同样证实了拉帕替尼较低的心脏毒性。
NeoSphere[13]、CLEOPATRA[14]、TRYPHAENA研究[15]发现,在化疗联合曲妥珠单抗的基础上加用帕托珠单抗,心脏毒性无显著增加,左心室收缩功能障碍和充血性心力衰竭发生率低,且大多为无症状、可逆、无任何后遗症。
1.3 抗体偶联药物治疗相关心脏毒性
新型的抗体偶联药物曲妥珠单抗-美坦新衍生物DM-1的偶联物(Ado-trastuzumab emtansine,T-DM1)因其曲妥珠单抗的成分,其心脏相关毒性也一直为众人所重视。对比T-DM1与卡陪他滨联合拉帕替尼用于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性治疗进展的晚期乳腺癌患者的EMILIA研究[16]发现,T-DM1组和对照组严重心衰的发生率均小于1%。TH3RESA研究[17]显示,T-DM1组与用医师选择其他治疗方式的对照组相比,两组左心室射血分数低于50%且幅度大于15%的发生率相同(2%),且左心室射血分数均没有低于40%的情况,与Krop等[18]的结论相同。
DS-8201a是由抗HER2的人源抗体和I型拓扑异构酶抑制剂组成的新型抗体偶联药物,目前其Ⅰ期临床试验仅发现少数患者出现轻度的QT间期延长,且无患者出现心脏射血分数下降[19]。
1.4 内分泌治疗相关心脏毒性
既往NATO[20]、TEXT&SOFT联合分析[21]、ATAC[22]等多项研究证实了他莫昔芬及芳香化酶抑制剂降低激素受体阳性乳腺癌患者复发风险的有效性。Khosrow-Khavar等[23]的研究发现,芳香化酶抑制剂可增加心血管疾病的发生风险,而他莫昔芬对心脏有保护作用。更进一步的研究[24]发现,他莫昔芬可增加静脉血栓风险,而芳香化酶抑制剂增加了患者心肌梗死和心绞痛的发生风险[25]。
1.5 细胞周期依赖性激酶4/6抑制剂相关心脏毒性
与单药内分泌治疗相比,联合CDK4/6抑制剂(细胞周期依赖性激酶4/6抑制剂)极大改善了激素受体阳性、HER2阴性晚期乳腺癌患者的预后。MONALEESA-7研究[26]发现,瑞博西尼(ribociclib)治疗组患者心电图的QT间期延长,且与联合使用芳香化酶抑制剂的患者相比,ribociclib联合他莫昔芬的患者QT间期延长的发生率更高,但无相应的临床症状或心律失常。在其他两种CDK4/6抑制剂palbociclib和abemaciclib中尚未发现类似的心脏毒性[27]。
1.6 免疫治疗相关心脏毒性
近年来,免疫治疗逐渐受到人们的重视,成为继手术、放疗、化疗及分子靶向治疗之后的第五大治疗方式。一项主要包括黑色素瘤、肺癌等瘤种的Meta分析发现,在所有免疫检查点抑制剂引起的不良反应中,心肌炎的致死率最高,并有升高的趋势[28]。虽然乳腺癌的免疫治疗才开始起步,但相关的临床研究层出不穷[29],其安全性资料相继为我们所知,大型临床研究,如探寻阿特珠单抗联合白蛋白结合型紫杉醇治疗晚期三阴性乳腺癌疗效的IMpassion130研究[30]和探究程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂治疗晚期三阴性乳腺癌安全性及有效性的KEYNOTE-012研究[31]中未报道致命性的心血管系统相关不良反应。但鉴于免疫治疗在其他瘤种中的心脏毒性,乳腺癌患者心脏损伤相关的监测也不容忽视。
1.7 放疗相关心脏毒性
放疗一方面大大延长了乳腺癌患者的生存时间,另一方面放射相关心血管疾病不容忽视。2005年一项Meta分析[32]发现,接受放疗的乳腺癌患者与未放疗的患者相比,其增加的死亡率主要源自心脏病和肺癌。随着设备的更新和技术的发展,Darby等[33]2013年的一项研究发现,乳腺癌患者放疗可增加其缺血性心脏病的发生率,而先前有心脏危险因素的女性,放疗风险更大。
2 乳腺肿瘤心脏病学的争议
以往的研究多仅局限于乳腺癌患者的队列且多关注的是心血管疾病的发生率,而和一般人群心血管疾病病死率的比较知之甚少。而且尽管随着医疗技术的发展,心血管系统疾病依旧是世界上导致人类死亡的首要原因[34]。前文所述的Thavendiranathan等[6]研究发现,心血管死亡事件发生的差异与使用不同的化疗方案(使用有蒽环类药物无曲妥珠单抗的方案,或使用有曲妥珠单抗无蒽环类药物的方案,或两者序贯方案,或其他化疗方案)没有显著相关性。
Weberpals等[35]的一项队列研究发现,与一般人群相比,接受放疗和化疗的乳腺癌患者的心脏特异性死亡率并没有增加。此外,HER2阳性与HER2阴性的乳腺癌患者相比,其心脏特异性死亡率也并没有增加[35-36]。Boekel等[37]的研究发现,除了心脏瓣膜病的死亡率稍高,与一般人群相比,乳腺癌患者心血管疾病死亡率更低。Goldvaser等[38]的研究发现,乳腺癌患者在完成5年芳香化酶抑制剂辅助治疗后,继续延长其使用时间与停止内分泌治疗或使用安慰剂组相比,心血管事件的发生率有所增加,但心血管事件相关死亡率无显著增长。NSABP-9831研究的长期随访发现,在蒽环类药物和紫杉类药物辅助化疗的基础上加用曲妥珠单抗,不会导致心功能恶化[39]。
年龄的增长是心血管疾病发病率和死亡率增加的一个重要驱动因素,且肿瘤科医师在进行有心脏毒性药物的化疗前,通常常规进行筛选,排除具有高心血管风险的患者。因此,乳腺癌患者因化疗导致的心血管事件的风险虽然可能增高,但经过筛选之后的患者相应的心血管疾病病死率却并不一定高。
3 结语与展望
肿瘤心脏病学的目的是通过多学科合作预防和控制心血管系统疾病的发生、发展,使得抗肿瘤治疗发挥应有的疗效,从而改善患者的预后。
通过改变生活方式、预防使用药物可以帮助我们将肿瘤治疗相关心血管疾病的发生率降到最低。2017年的研究[40]预测乳腺癌放疗相关心脏病死亡率,吸烟者约为1.0%,非吸烟者为0.3%。Lee等[41]的一项研究发现,对6个月之内刚结束早期乳腺癌治疗的超重患者进行16周运动干预,预测其10年发生心血管疾病的风险比对照组降低。
近年来有研究探索在乳腺癌治疗中,使用如β 受体阻滞剂、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)、血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)之类的药物预防化疗相关心血管系统疾病的效果。PRADA研究[42]发现,在辅助治疗包含蒽环类药物的患者中,同时使用坎地沙坦可以预防左心室射血功能的早期下降。MANTICORE等研究[43-44]发现,ACEI和ARB对药物左心室射血分数下降有保护作用。ICOSONE研究[45]更进一步地探索了在蒽环类药物化疗开始前即服用依那普利与化疗等肌钙蛋白升高后再用依那普利相比,其预防心脏毒性的效果没有明显差别。将来的研究当给予患者更密切的检测和护理,以便于及时识别心衰高危患者,并制定肿瘤心脏病学科的治疗策略。
随着影像学的发展,新的诊断手段相继出现,从而帮助我们更早地发现乳腺肿瘤治疗相关心血管系统疾病。基于超声心动图的应变成像(strain imaging)可以发现在左心室射血分数发生显著改变之前,心肌发生的形变[46-48]。心脏磁共振成像可提供更准确的左心室射血分数,以确定是否需要终止化疗。新的磁共振成像技术(如T1 mapping[49])和正电子发射断层显像(positron emission tomography,PET)可以帮助我们更好地理解心功能不全及血清标志物升高相关的心肌结构、病理和代谢变化,评估肿瘤治疗相关的心血管并发症。负荷超声心动图、负荷心脏磁共振成像、计算机断层扫描(computed tomography,CT)和PET都是评估患者缺血情况的很好的手段[50]。血清标志物的升高,如肌钙蛋白Ⅰ和髓过氧化物酶的早期升高对多柔比星和曲妥珠单抗的心脏毒性可能有提示意义[51],而肌钙蛋白T和脑钠肽前体可能无法早期预测靶向药物的心脏毒性[52]。希望在不久的将来,影像学和放疗技术的发展除了提高肿瘤治疗相关心血管系统疾病的诊断率,也可以进一步降低放射相关心脏病的发生风险。
最近,PERSEPHONE研究[53]发现,曲妥珠单抗辅助治疗6个月的效果不劣于传统12个月,且心脏毒性及严重不良反应的发生率更低。此项研究结果预示着缩短辅助曲妥珠单抗疗程的可能性,也将引发人们关于化疗疗程更多的思考与争议。
目前的研究发现,抗肿瘤药物没有显著增加乳腺癌患者心血管疾病的死亡率,然而时至今日,随着新药、新治疗的出现,乳腺癌患者的生存时间逐渐延长,减少心血管疾病的发生、延缓心衰的进展,从而保证抗肿瘤治疗的疗程和效果、提高患者的生活质量是我们更应该追求的目标。
肿瘤心脏病学作为新兴领域,逐渐受到人们重视的同时,其相应的临床研究也层出不穷,然而我们应当仔细比较不同研究的研究类型、研究对象、治疗方式、心脏毒性的定义,谨慎对待其研究结论,也期待未来有证据级别更高的临床研究得以指导临床。
