丹参酮IIA对神经性痛大鼠脊髓背角Bcl-2和Bax表达的影响❋
2020-07-17游明灿申采薇徐玉英任秀花游言文
游明灿,申采薇,徐玉英,任秀花,游言文△
(1. 河南中医药大学人体解剖学教研室,郑州 450008; 2. 郑州大学人体解剖学教研室,郑州 450001)
神经病理性疼痛由神经系统的损伤或功能障碍所致[1]。课题组前期研究显示,其发病机制与内质网应激介导的神经元凋亡相关,且丹参酮IIA(tanshinone IIA,TSA)对神经痛模型大鼠有镇痛作用[2-3],但其镇痛机制尚不清楚。丹参为双子叶植物唇形科鼠尾草植物丹参(Salvia miltiorrhiza Bge.)的根茎及干燥根,有化瘀止痛、活血调经、清心除烦、养血安神等作用。丹参酮IIA是丹参中脂溶性成分的代表,具有抗氧化和抗炎等作用[4]。文献研究表明,B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关的X 蛋白(Bcl-2-associated X protein,Bax)和神经病理性疼痛密切相关[5-6]。为进一步研究丹参酮IIA的镇痛机制,该研究在前期研究的基础上,观察Bcl-2、Bax和Caspase-3蛋白表达与其镇痛作用之间的关系。
1 材料与方法
1.1 动物实验
本实验已通过河南中医药大学实验动物伦理委员会审查。
1.1.1 模型制作 雄性清洁级SD大鼠45只,体质量200~220 g,由郑州大学实验动物中心提供。随机分为sham组(假手术组)15只和模型组30只。所有实验大鼠在同一实验室按照清洁级标准饲养,在实验期间饮水、进食自由。模型建立参照Bennett和Xie等[7],10%水合氯醛(3 ml/kg)腹腔注射麻醉,常规备皮、消毒、铺洞巾,一次切开皮肤、筋膜,分离骨骼肌,用6.0尼龙非吸收外科缝线结扎右侧坐骨神经(左侧不结扎),间隔1~2 mm,在主干部位系4个结。术后肌注青霉素8 U。sham组仅暴露右侧坐骨神经干,不予结扎。建立成功模型的标准是术后出现自发性痛表现,如舔足、咬足或甩足、热痛阈和机械痛阈明显降低等表现[8]。
1.1.2 鞘内注射丹参酮IIA 鞘内注射是先将实验组大鼠用10%水合氯醛麻醉,在腰4、5或腰5、6椎间隙,常规剪毛、消毒皮肤;在显微解剖镜下用微量注射器刺入蛛网膜下腔,穿刺成功后将药物注入大鼠蛛网膜下腔。45只制备成功的模型大鼠采用随机数字表法分为处理组(TSA组)15只和生理盐水组(NS组)30只,分别在模型组大鼠鞘内注射丹参酮IIA 20 mg/kg或生理盐水0.1 ml,自手术当日开始每日1次,连续注射14 d。
1.2 实验试剂
兔单抗Bax和Bcl-2以及鼠单抗Caspase-3均购自Abcam公司;丹参酮IIA注射液(批号H31022558,购自上海第一生化药业有限公司。丹参酮ⅡA的提取:丹参加乙醇→加热回流1.5 h→收集粗提取液体→分子蒸馏工艺 (脱溶剂乙醇) →丹参酮ⅡA[9]。由FITC标记的山羊抗兔IgG(Bcl-2),由TRITC标记的羊抗兔IgG(Bax)和由TRITC标记的山羊抗鼠IgG(Caspase-3),均购自北京中杉金桥生物技术有限公司。
1.3 机械痛阈的测定
采用von Frey丝(Stoelting公司,美国) 测定3组实验大鼠的机械痛敏(paw withdrawal threshold,PWT),刺激大鼠足底皮肤,观测大鼠是否出现舔足、甩腿等反应,测量3次取平均值,实验时每次刺激大鼠间隔时间不低于5 min(实验大鼠轮流检测,有序记录)。
1.4 热痛阈的测定
热刺激潜伏期(paw withdrawal thermal latency, PWTL)测定[9],将大鼠置于有机玻璃格子内,先让实验大鼠适应5 min,待大鼠安静后热源放在实验大鼠足底,间隔玻璃格子的底部打开开关仪器开始加热,观察大鼠是否出现缩足逃避反射。根据前期经验,刺激时间不超过20 s,同一部位2次热刺激之间的时间间隔不低于5 min(实验大鼠轮流检测,有序记录),连续测量3 次取平均值。
1.5 脊髓组织的获取
在术后第14天,3组实验大鼠先进行麻醉,腹腔注射10%的水合氯醛常规灌注,处死大鼠暴露并分离实验大鼠第3~5腰椎脊髓节段,脊髓组织完整取出后放-80 ℃保存,用于后续Bcl-2蛋白、Bax蛋白和Caspase-3蛋白的检测。
1.6 免疫荧光组织化学染色
第3~5腰椎脊髓背角组织进行石蜡包埋,切片后脱蜡,PBS浸洗后修复,再进行PBS洗涤;每张切片加入 0.3%H2O2后PBS洗涤;血清封闭后分别加入一抗(稀释倍数为1∶300),37 ℃孵育后PBS洗涤。每张切片分别加入二抗(FITC标记Bcl-2,TRITC标记Bax和Caspase-3),羊抗兔和羊抗鼠IgG,二抗稀释比例为1∶100。37 ℃孵育后PBS浸洗,最后在荧光显微镜下观察。
每张切片依次进行荧光显微镜拍照和图像分析。在暗室中(整个拍照过程)使用荧光正置显微镜进行拍照(20×),选取照片随意划取照片的5个区域,采用ImageJ(NIH)软件计算平均荧光强度。
1.7 统计学方法

2 结果
2.1 行为学改变
所有实验大鼠无死亡,30只模型大鼠术后健康状况良好,进食、饮水正常,体质量无减轻,体毛有光泽。模型组大鼠均出现避免损伤侧的负重行为,如自发抬起手术侧肢体,舔足、咬足或甩足等行为,足趾出现手术侧的轻微外翻或/和足趾并拢现象。假手术组大鼠未出现上述现象。
2.2 热痛阈和机械痛阈的变化
图1、2示,3组大鼠手术前、假手术组大鼠手术前以及手术后的热痛阈和机械痛阈比较差异无统计学意义。与假手术组比较,在术后各时间点,生理盐水组的热痛阈和机械痛阈均明显下降。术后第7、14天与生理盐水组比较,处理组的热痛阈和机械痛阈均明显上升,但与假手术组比较各值仍较低,差异有统计学意义(P<0.05)。
2.3 Bcl-2、Bax和Caspase-3蛋白的表达
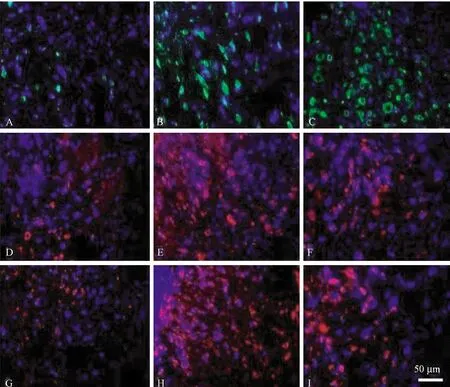
1.A、D、G:假手术组;2.B、E、H:生理盐水组;3.C、F、I:处理组图3 各组大鼠脊髓背角中Bcl-2(A~C)、Bax(D~F) 和Caspase-3 (G~I) 的表达(20×)
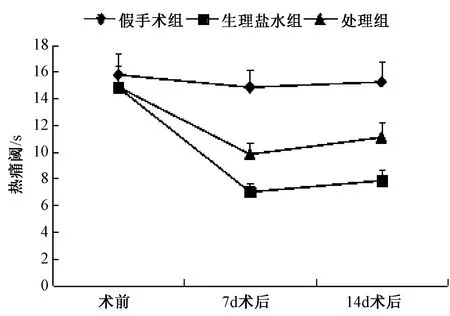
注:与假手术组比较:﹡P<0.01;与假手术组和生理盐水组比较:△P<0.05图1 热痛阈的变化

注:与假手术组比较:﹡P<0.01;与假手术组和生理盐水组比较:△P<0.05图2 机械痛阈的变化
图3、4示,脊髓背角内 Bcl-2主要分布在细胞质、细胞膜和核膜,Bax和Caspase-3主要分布在细胞质。大鼠脊髓背角内可见,Bcl-2蛋白、Bax蛋白和Caspase-3蛋白在假手术组仅有少量表达;与假手术组比较,Bcl-2、Bax和Caspase-3阳性细胞的荧光强度及数量在生理盐水组均明显增多,Bcl-2/Bax比值下降;与生理盐水组比较,处理组Caspase-3和Bax阳性细胞的荧光强度及数量明显减少,但Bcl-2阳性细胞的数量及荧光强度明显增多;Bcl-2/Bax比值较假手术组和生理盐水组明显升高,以上比较差异有统计学意义(P<0.05)。
3 讨论
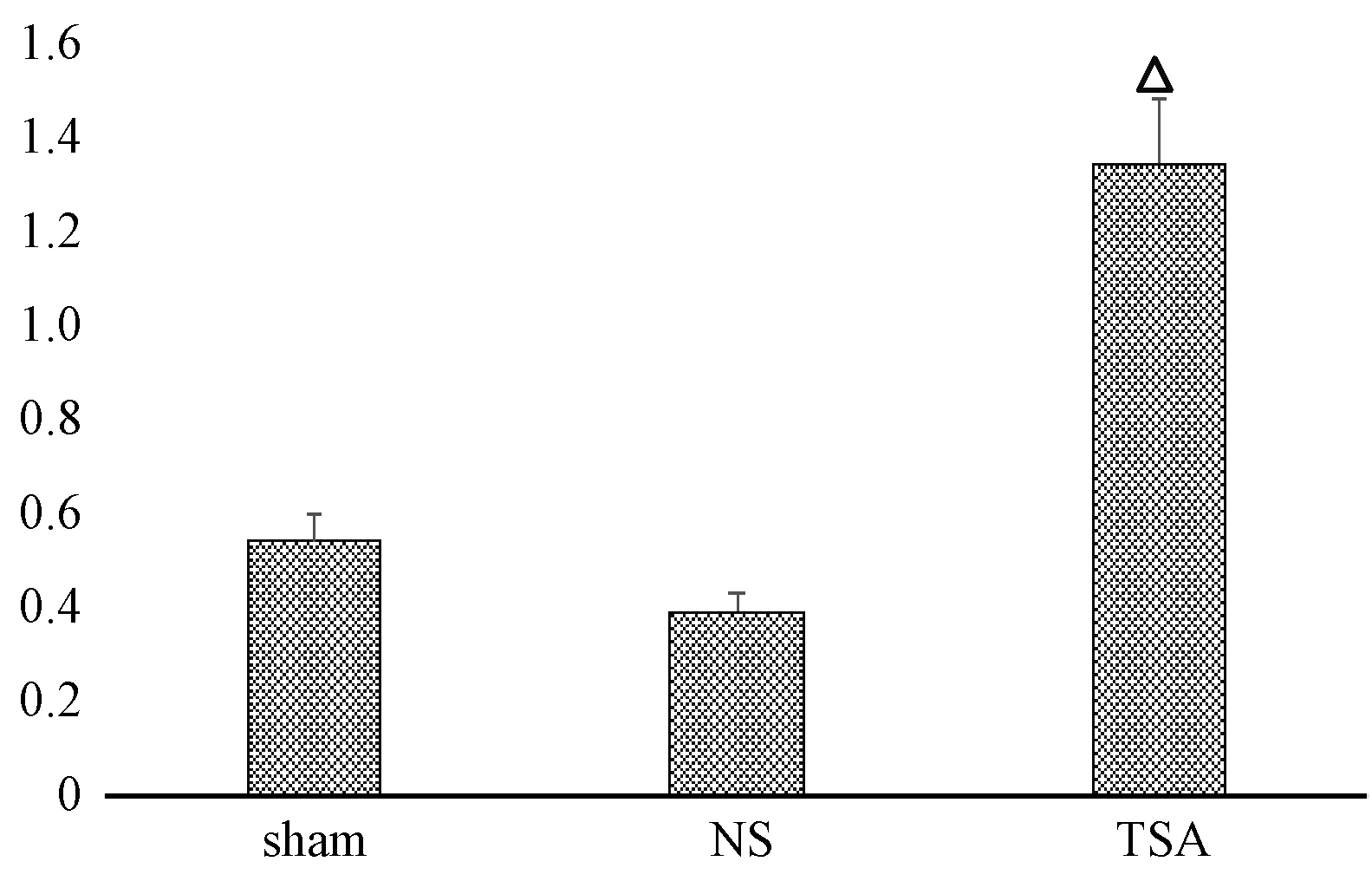
注:与假手术组和生理盐水组比较:△P<0.05图4 各组大鼠脊髓背角Bcl-2/Bax比值的比较
神经病理性疼痛给患者带来痛苦的同时,还给护理人员和社会造成巨大负担,主要由疾病和创伤造成的周围神经系统或中枢神经系统损伤后产生[10]。目前治疗神经性疼痛的药物很少,且药物的副作用可能会使症状进一步恶化[11]。有研究报道,神经病理性疼痛的发病机制与Bcl-2、Bax和Caspase-3相关[12-13]。前期研究显示,丹参酮IIA有镇痛作用[3],但其镇痛机制尚不清楚。神经病理性疼痛的发生与神经元凋亡相关[2]。Kandhare AD等[7]报道,神经病理性疼痛模型大鼠坐骨神经中神经元凋亡数目增加,Bax和Caspase-3 mRNA表达水平明显增加,而Bcl-2 mRNA表达水平明显降低。Bcl-2对细胞的发育、组织内稳态至关重要,是细胞凋亡的关键调节因子,其通过抑制能够分解细胞的蛋白酶(caspases)活性以促进细胞的存活[14]。Bax是Bcl-2氨基酸同源性家族中的一员, Bcl-2是抗凋亡蛋白,Bax是促凋亡蛋白,细胞凋亡过程中由于线粒体的变化,特别是细胞色素C的释放导致Caspase-9和Caspase-3的激活,从而促成死亡细胞的有效分解[15-16]。在已知的细胞凋亡调节因子中,最显著的是Bax与 Bcl-2的比值,由于Bcl-2的下调,当Bax与 Bcl-2的比值明显增大时,随后细胞色素C的释放,导致Caspase-3激活,使细胞凋亡率增加[16-17]。
丹参具有祛瘀生新、活血化瘀、调经止痛等功效[5]。丹参酮IIA磺酸钠(sodium tanshinone IIA sulfonate,STS)是二萜醌类化合物丹参酮IIA 经磺化而得到的水溶性磺酸盐,具有抑制细胞凋亡的作用,其作用机制与Bcl-2的表达升高有关[18]。丹参酮IIA能通过抗脑水肿、抗氧化、抗凋亡等对脑缺血再灌注损伤大鼠起到较好的神经保护作用[19]。在本研究中,神经病理性疼痛的发生是模型大鼠外周神经受到损伤,鞘内注射丹参酮IIA后,随着脊髓背角内Bcl-2的表达增多,Bax和Caspase-3的表达下降,Bcl-2/Bax比值增大,机械痛阈和热痛阈的升高,因此丹参酮IIA的镇痛作用可能与增加脊髓背角Bcl-2的表达、降低Bax和Caspase-3的表达相关,但其镇痛作用的具体机制尚需进一步的研究。
