白木通果胶的结构和流变特性
2020-07-08汪新洁罗君兰杨晨希
汪新洁 罗君兰 杨晨希 赵 强 熊 华
(南昌大学食品科学与技术国家重点实验室 南昌330047)
果胶是一种结构和功能复杂的多糖, 主要存在于植物细胞的细胞壁中[1]。果胶分子主要由3 部分构成:同型半乳糖醛酸聚糖(Homogalacturonan,HG)、Ⅰ型鼠李糖半乳糖醛酸聚糖(Rhamnogalacturonan Ⅰ,RG-Ⅰ)和Ⅱ型鼠李糖半乳糖醛酸聚糖(Rhamnogalacturonan Ⅱ,RG-Ⅱ)[2]。 果胶具有多种生理功能,被广泛应用于食品、医药和化工领域。 如在食品工业中,果胶常被用于糖果产品(如果酱、果冻、蜜饯)[3]、饮料[4-5]和冷冻食品[6]的生产;在制药行业, 果胶常被用来控制血液中胆固醇的含量,治疗肠胃疾病[7]或作为控制药物持续释放的胶囊剂;化工行业,如用于水/油乳液的稳定剂、可食用薄膜、纸张替代品、泡沫和增塑剂等[8]。
果胶的性质主要表现为凝胶特性, 其凝胶特性通常受到多种因素的影响,如果胶浓度、温度、金属离子种类和强度以及溶液中其它溶质等。Chou 等[9]研究了番茄酱、苹果和柑橘果胶的流变性质, 结果表明每一种果胶凝胶系统均表现出无规则盘绕行为,并且加工后果胶的黏度易受到pH值、浓度和剪切速率的影响。 Han 等[10]研究了果胶浓度、蔗糖浓度、Ca2+等对LMP 的影响,研究结果表明果胶浓度、 蔗糖含量和Ca2+的增加都会导致凝胶强度增加。 Huang 等[11]研究了果胶和MTGase酶复合改性的鱼明胶的流变性特性及凝胶特性,通过试验发现, 可以观察到0.8 g/100 mL 果胶凝胶强度和熔化温度的最高值。然而,在最高果胶浓度1.6 g/100 mL 下, 复合改性明胶的凝胶强度和熔融温度都降低。 Koocheki 等[12]研究了果胶浓度、温度、pH、 盐浓度和蔗糖浓度对香雪球种子黏液流变学特性的影响,结果表明,果胶浓度的增加和温度的降低导致果胶的假塑性和黏度的增加。
近年来, 随着人们对优质膳食多糖营养性的关注,有关果胶的研究报道越来越多。 然而,目前商业化的果胶一般都从桔皮或苹果渣中提取,市场为少数国际企业所掌控, 亟待开发新的果胶资源。白木通是一种木通科木通属植物,又称八月瓜藤、地海参,其果皮中含有丰富的果胶。 本课题组前期研究了其基本理化性质[13],尚未研究其流变学特性。 本试验中采用盐酸和柠檬酸从白木通果皮中提取果胶,通过扫描电镜(Scanning Electron Microscope,SEM)、 傅里叶变换红外光谱仪 (FTIR)、X-衍射(XRD)对其结构进行表征,研究其流变学特性。
1 材料与方法
1.1 材料与设备
成熟的白木通果,采摘于江西庐山种植基地。其它试剂均为国产分析纯。
BS 224S 电子分析天平, 上海奕宇电子科技有限公司;磁力搅拌水浴锅,金坛市良友仪器有限公司;DHG-9240 恒温鼓风干燥箱,上海柏欣仪器设备厂;FD-1 真空冷冻干燥机, 北京神泰伟业仪器设备有限公司;RW 20 机械搅拌器、RV 10 旋转蒸发仪,德国IKA 公司;JSM 6701F 场发射扫描电镜,日本电子公司;Nicolet 5700 傅里叶变换红外光谱仪, 美国Thermo 公司;D8 FOCUS 粉末衍射仪,德国Bruker 公司;DHR-2 流变仪,美国TA公司。
1.2 试验方法
1.2.1 果胶的制备 果胶的前处理参照Jiang[13]的方法。 将已烘干的果皮粉碎后过60 目筛,装袋密封,在4 ℃下储存备用。 根据Taboada 等[14]的方法提取果胶,稍作修改。 10 g 果皮粉加入到300 mL 0.05 mol/L 的盐酸/柠檬酸溶液中,搅拌均匀,85 ℃水浴条件下机械搅拌提取1.5 h,用200 目纱布趁热过滤,冷却后,滤液用2 倍体积100%的乙醇进行沉淀, 边加边搅拌, 使乙醇的最终体积分数为67%。 滤液于4 ℃下静置1 h 后,用200 目纱布进行过滤, 依次用65%,85%,95%,100%的乙醇洗涤。 将醇洗后的果胶进行反复的复溶旋蒸以除去多余的乙醇。 样品冻干后,用袋封装,保存在-18℃冰箱中。 盐酸和柠檬酸提取的果胶分别记为HEP 和CEP。
1.2.2 微观形态观察 采用场发射SEM 对2 种果胶的微观形态进行研究。 用双面胶将样品黏在循环样品台上,喷金后上机,在电压5.00 kV 和电流10 μA 的条件下进行观察。
1.2.3 红外光谱分析 采用FT-IR 对果胶进行研究。 取少量果胶冻干样品与溴化钾混合, 研磨均匀, 然后压片, 测定FTIR。 扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数32 次。 果胶酯化度的计算根据Manrique[15]的FT-IR 光谱方法。
1.2.4 X-衍射分析 采用XRD 测定样品的结晶性能。 衍射条件为:Cu ka 辐射,电压为40 kV,电流为40 mA,2θ 范围为5°~50°。
1.2.5 流变性质的测定 样品制备:(1)准确称取2 种果胶,配制成1,3,6 和10 g/100 mL 的果胶溶液, 静置4 h 后测试;(2)取相同体积的5 g/100 mL 的果胶溶液,经不同温度(35,55,75,95 ℃)处理10 min,将其冷却至室温后测试;(3)取相同体积的5 g/100 mL 的果胶溶液,经95 ℃处理不同时间(5,10,15,20 min)后,将其冷却至室温后测试;(4)将2 mL 5 g/100 mL 的果胶溶液与1 mL 不同质量分数(5,10,15,20 g/100 mL)的蔗糖溶液进行混合,摇匀后测试;(5)将2 mL 5 g/100 mL 的果胶溶液中加入1 mL 不同质量浓度 (1,2,3,4 g/100 mL)的CaCl2溶液进行混合,摇匀后测试。
采用DHR-2 流变仪对两种果胶的静态流变学性质进行测定。平板直径为40 mm,板间距离为1 000 μm。静态测试剪切速率范围设置为0.1~200 s-1,温度设置为(25±0.1)℃。
1.3 试验数据处理
采用origin 8.0 软件进行数据分析。
2 结果与分析
2.1 扫描电镜分析
图1 为2 种白木通果胶在放大500 倍和5 000 倍下的微观形态。 从图中可以看出,HEP 和CEP 的表观形态具有一定的差异性。 HEP 呈多层重叠的片状结构,表面比较平整,结构紧致,从高倍图可以看出,其表面粗糙,有很多颗粒状和块状的分子;CEP 和HEP 的表面形态有些相似, 也是呈多层的片状结构,但其形状不规则,片层零散且较薄,从高倍图上看,CEP 表面比较平滑,呈褶皱状, 并且有一些块状的凸起。 本试验得到的SEM结果与Jiang[13]报道的不同,这可能是由于果胶提取条件的不同导致其表观形态出现差异。
2.2 红外光谱分析

图1 白木通果胶的表观形态Fig.1 Morphology of the two Akebia pectins
图2 为两种白木通果胶的红外光谱图。 从图中可以看出,两种果胶的光谱图大体相似。 3 420 cm-1处的宽吸收峰是由-OH 伸缩振动引起的,2 930 cm-1处的吸收峰是-CH2中的C-H 伸缩振动引起的,2 360 cm-1被认为是三键或累积双键的伸缩振动。1 740 cm-1处的吸收峰是甲酯化的羧基的伸缩振动引起的,而1 430 cm-1和1 630 cm-1处的吸收峰分别是由O=C-O 结构的对称和非对称振动引起的。1 235 cm-1处的吸收峰是S=O 的伸缩振动引起的,表明白木通果胶中可能存在硫酸根。1 150~1 010 cm-1区域有3 个吸收峰,表明果胶以吡喃糖形式存在。1 147 cm-1处的吸收峰表明果胶分子可能在脂肪环二级醇上存在-CH-OH 结构。1 102 cm-1和1 102 cm-1处的吸收峰表明两种果胶均富含糖醛酸。 由于两种果胶在891 cm-1处无吸收峰且在760 cm-1处有吸收峰, 可初步判断这两种果胶均为α-异构体D-吡喃糖[16]。 该图谱与Jiang[13]和Liang[17]的报道相似,而且其吸收类型也与商业果胶相似,证明所提取物确实为果胶。
通过红外图谱表征羧基基团区域(1 740 cm-1和1 630 cm-1)酯化羧基和自由羧基的峰面积可以计算果胶的甲酯化度[15]。 根据标准曲线MED=124.7R+2.2013(r2=0.9967),算出HEP 和CEP 的酯化度分别为94.89%和54.03%,该结果表明从白木通果皮中提取的果胶均为高酯果胶, 与Jiang[13]报道的白木通果胶的酯化度59.10%和81.42%的结果有明显差异,这可能和白木通的种植地点、采摘季节以及果胶的提取方式不同有关。同时,低酯化度的果胶具有更好的溶解性[18],由此可知CEP的溶解性应该优于HEP。
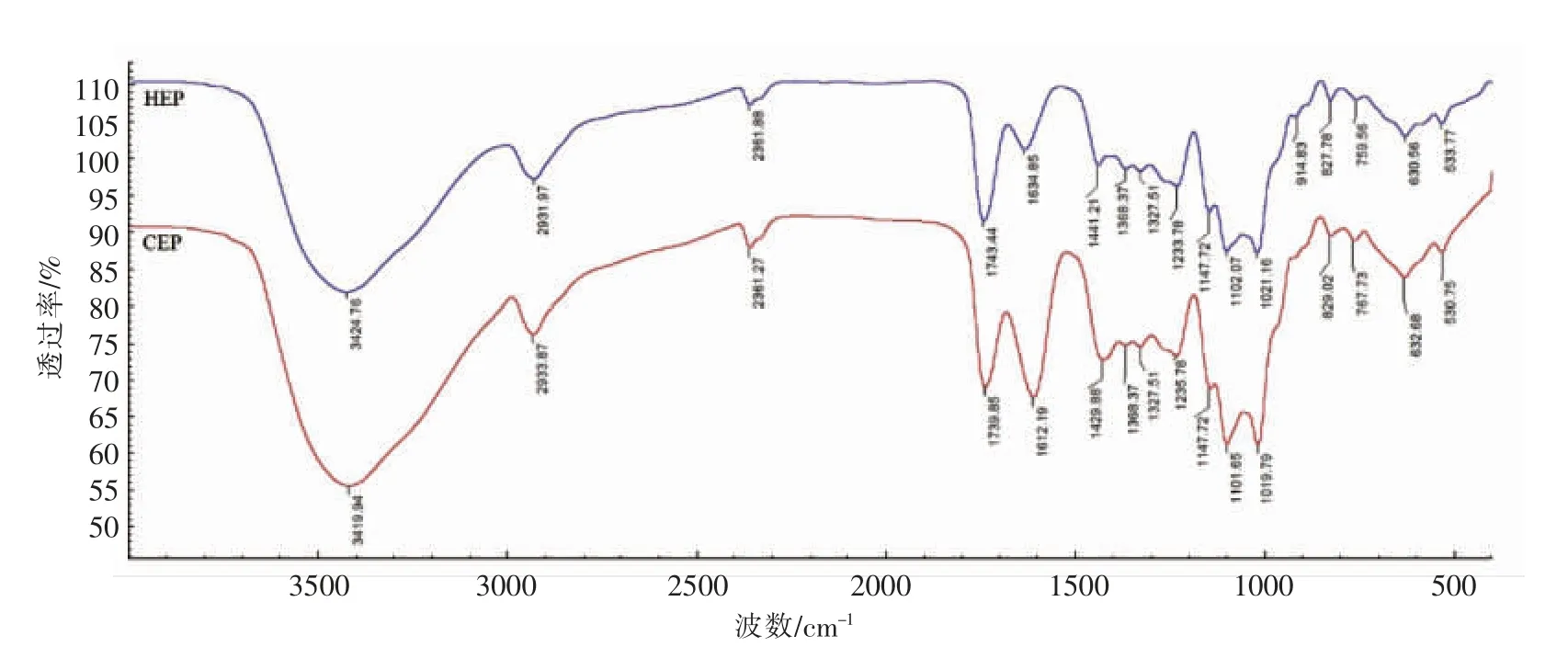
图2 两种白木通果胶的红外光谱图Fig.2 FT-IR spectra of the two Akebia pectins
2.3 X-衍射分析
图3a 和图3b 分别显示了HEP 和CEP 的晶体形貌。如图所示,两种果胶都存在一定程度的结晶。 HEP 特征峰所在角度为12.93°(2θ)和42.11°(2θ),CEP 特征峰所在角度为42.73°(2θ),HEP 的峰强度大于CEP。 X-衍射结果与样品的溶解性优劣存在很好的一致性,结晶度越高,样品溶解性越差。 从结果上看,CEP 的溶解性要优于HEP,这与FT-IR 结果相符合。

图3 两种白木通果胶的X-衍射图谱Fig.3 X-ray diffraction patterns of the two Akebia pectins
2.4 静态流变性分析
2.4.1 果胶浓度的影响 图4a 和图4b 显示了不同浓度的HEP 和CEP 溶液表观黏度和剪切应力随剪切速率的变化情况。 如图所示,在0.1~200 s-1的剪切速率范围内, 两种果胶的黏度随着果胶浓度的增加而增加。 这可能是因为果胶浓度增加使得果胶链之间交联区的数量的增加和果胶分子中羧基基团数量的增加, 果胶分子间作用力增大并且形成网状结构,使得流体流动阻力增大,从而使表观黏度增大[16]。 许多文献报道也证明了果胶的凝胶强度强烈依赖于果胶的浓度[19-20]。对比两种果胶, 在相同浓度和相同剪切速率下,CEP 比HEP表现出了更大的黏度值,其中,10%的CEP 溶液表现出了最大的黏度值和明显的假塑性流体特征。结合放大图和应力图可以看出,6%的CEP 溶液也表现出了明显的假塑性流体特征,10% HEP 溶液表现出了较弱的假塑性流体特征。 而其它浓度下的样品, 其流动行为更接近于理想状态的牛顿流体——随着剪切速率的增大, 溶液表观黏度基本不变。 这说明CEP 的凝胶能力要好于HEP,这可能是因为相比于HEP,CEP 的溶解性更好,果胶分子更容易和水分子结形成氢键,更容易形成凝胶。
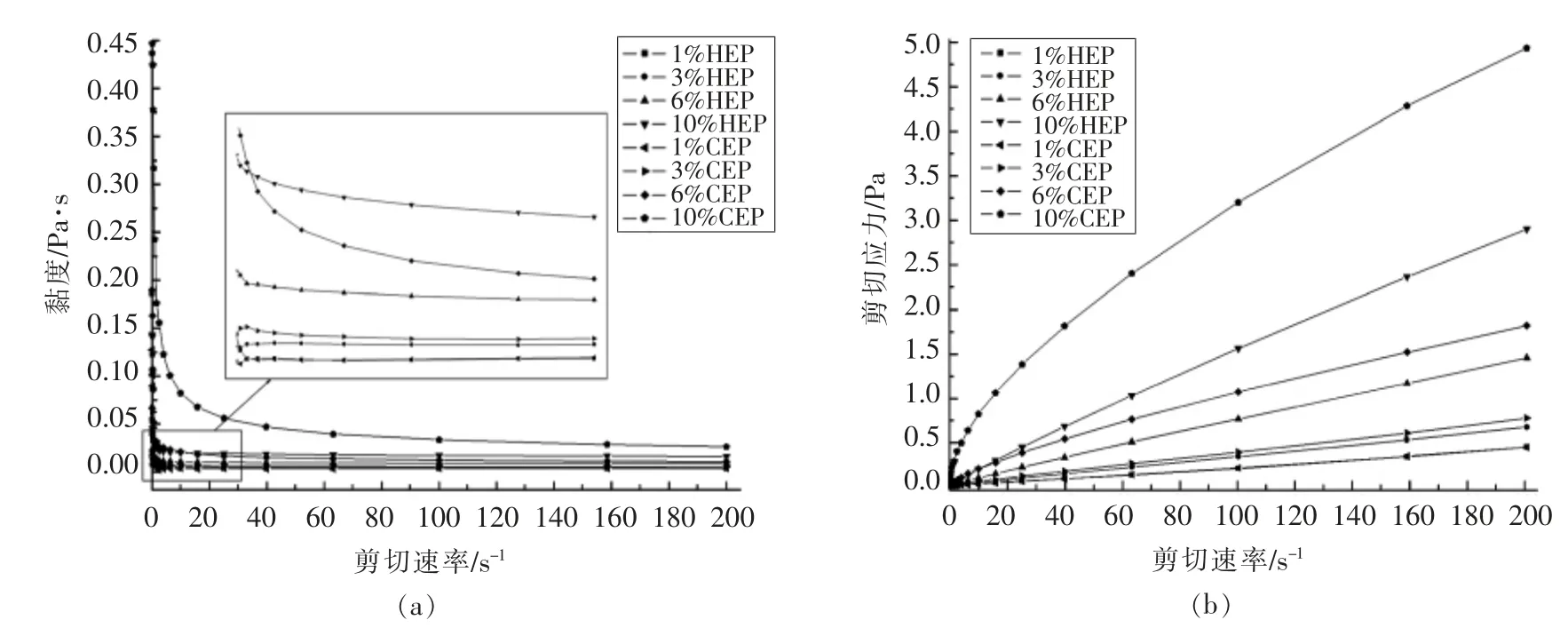
图4 不同浓度的HEP 和CEP 溶液的黏度(a)和剪切应力(b)随剪切速率的变化曲线Fig.4 Curves of viscosity (a)and shear stress (b)vs. shear rate for HEP and CEP solutions with different concentrations
2.4.2 钙离子浓度的影响 图5a 和图5b 显示了不同钙离子浓度的HEP 和CEP 溶液黏度和剪切应力随剪切速率的变化情况。从图中可以看出,所有的果胶溶液都表现出了假塑性流体的特征,并且相比于CEP,HEP 的假塑性特征更为明显。在相同剪切速率下, 加入Ca2+后的HEP 的黏度要比CEP 大,这可能是因为HEP 果胶分子中含有更多的羧基基团,可以与Ca2+发生交联反应,形成“蛋盒”模型,增强了溶液中的果胶网络[21]。 试验还发现,对于单独的HEP 和CEP 溶液,加入2%的Ca2+时, 果胶溶液表现出最大的黏度值, 而继续增加Ca2+浓度,果胶的黏度反而减小。 这可能是因为一方面在过量的Ca2+加入时果胶溶液中的羧基基团与Ca2+的结合已经达到饱和状态,继续增加Ca2+浓度,反而使得溶液中分子间的斥力增大,使得溶液的黏度减小,果胶的凝胶性减弱,另一方面Ca2+的过量加入使得果胶溶液发生了盐析效应, 溶液中产生了沉淀,使得果胶的凝胶性减弱[22]。

图5 不同Ca2+浓度的HEP 和CEP 溶液的黏度(a)和剪切应力(b)随剪切速率的变化曲线Fig.5 Curves of viscosity (a)and shear stress (b)vs. shear rate for HEP and CEP solutions with different Ca2+ concentrations
2.4.3 蔗糖浓度的影响 图6a 和图6b 显示了不同蔗糖浓度的HEP 和CEP 溶液黏度和剪切应力随剪切速率的变化情况。 在加入不同浓度的蔗糖溶液之后,果胶溶液的黏度相差并不大,这说明较低蔗糖浓度对高酯果胶总体的凝胶性的影响可能较小。从放大图可以看出,在低剪切速率下(0.1~5 s-1),两种果胶的黏度突然减小,这可能是因为果胶分子物理交联点被破坏的速度大于重建的速度,使黏度下降。 从图6a 放大图中可以看出,在加入蔗糖的条件下,CEP 表现出了较明显的剪切稀化特性,而HEP 则表现出了剪切增稠特性。 在剪切速率>10 s-1时,加入20%的蔗糖溶液的CEP 和HEP 溶液表现出最大的表观黏度, 这说明蔗糖浓度的增加在一定程度上增加了果胶的凝胶性。 蔗糖分子对果胶的这种作用, 可归因于糖分子和果胶分子中的羧基和甲酯基基团发生了分子间的缔合,使得果胶的凝胶性增强[23]。

图6 不同蔗糖浓度的HEP 和CEP 溶液的黏度(a)和剪切应力(b)随剪切速率的变化曲线Fig.6 Curves of viscosity (a)and shear stress (b)vs. shear rate for HEP and CEP solutions with different sucrose concentrations
2.4.4 热处理时间的影响 图7a 和图7b 显示了不同热处理时间的HEP 和CEP 溶液黏度和剪切应力随剪切速率的变化情况。如图所示,随着剪切速率的增加, 两种果胶都表现出了明显的剪切稀化现象,且HEP 比CEP 剪切稀化程度更高。 对于两种果胶,在相同剪切速率下,随着热处理时间的增加,溶液的黏度越来越小。这可能是因为在加热条件下, 果胶发生了降解反应, 而热处理时间越长,果胶分子降解程度越高,分子运动也越剧烈,使得溶液的黏度减小[24]。对于单独的HEP 和CEP,增加热处理时间,HEP 的黏度值相差不大,而CEP黏度值变化较为明显。 这种结果表明热处理时间对CEP 的影响可能更大。 有研究表明,果胶的酸水解速度受果胶的甲酯化水平影响, 较高的甲酯化程度使得果胶酸水解速率降低[25],这可能是导致CEP 比HEP 黏度值变化更为明显的原因,相比于CEP,HEP 甲酯化程度更高,酸水解速率更慢。

图7 不同热处理时间的HEP 和CEP 溶液的黏度(a)和剪切应力(b)随剪切速率的变化曲线Fig.7 Curves of viscosity (a)and shear stress (b)vs. shear rate for HEP and CEP solutions with different treatment time
2.4.5 热处理温度的影响 图8a 和图8b 显示了不同热处理温度对HEP 和CEP 溶液表观黏度和剪切应力随剪切速率的变化情况。如图所示,两种果胶也都表现出了表观黏度随剪切速率增大而减小的剪切稀化现象。原因和图7 可能相似,温度升高, 导致果胶分子运动加剧, 果胶链柔顺程度增强,流动性增大[24];分子间氢键被破坏,果胶分子降解,也导致果胶分子间的交联作用逐渐减小,从而导致了溶液的黏度减小[26]。 从图中可以看出,在相同剪切速率(0.1~200 s-1)下,随着热处理温度的增加,CEP 溶液的黏度逐渐增大, 而HEP 溶液黏度先增大后减小,CEP 比HEP 表现出更高的黏度值,对于HEP,温度越高,其剪切稀化程度越明显,95 ℃处理的HEP 果胶的剪切稀化程度最高;对于CEP,温度升高,对其剪切稀化程度影响并不大,95 ℃处理的CEP 果胶表现出最大的黏度值。 这可能是因为HEP 果胶的分子链更长,在较高的温度处理下, 果胶链断裂越多, 剪切稀化程度也越明显,而对于CEP,温度升高,使得其分子运动加剧,果胶分子之间的作用更频繁, 网状结构不断被破坏和重建,反而使得溶液的黏度增加。
3 结论

图8 不同热处理温度的HEP 和CEP 溶液的黏度(a)和剪切应力(b)随剪切速率的变化曲线Fig.8 Curves of viscosity (a)and shear stress (b)vs. shear rate for HEP and CEP solutions with different treatment temperature
本研究采用盐酸和柠檬酸溶液从白木通果皮中提取了两种不同的白木通果胶, 并对其结构特性和流变学特性进行了表征和研究。 试验结果表明, 所得的果胶结构和流变性质因所采取的提取方法的不同而异。 SEM 结果表明,HEP 结构比较紧致、CEP 结构比较松散。 FT-IR 结果表明,两种果胶均为α-异构体D-吡喃糖且富含糖醛酸,HEP比CEP 具有更高的酯化度。 X-衍射结果表明,HEP 比CEP 结晶度高,而结晶度越低,溶解性越好,该发现与红外光谱结果相符合。静态流变学结果表明,在相同剪切速率下,两种果胶的黏度随着果胶浓度的增加而增加,在相同浓度下,CEP 表现出比HEP 更高的表观黏度;在加入不同浓度Ca2+的条件下, 所有的果胶溶液都表现出了假塑性流体的特征,相比于CEP,HEP 的假塑性特征更为明显。 对于单独的两种果胶,加入2%的Ca2+时,果胶溶液都表现出了最大的黏度值; 在加入不同浓度的蔗糖溶液之后, 果胶溶液的黏度总体相差并不大,在剪切速率>10 s-1时,加入20%的蔗糖溶液的CEP 和HEP 溶液表现出最大的表观黏度;对于不同热处理时间处理的样品,随着剪切速率的增加,两种果胶都表现出了明显的剪切稀化现象,且HEP 比CEP 剪切稀化程度更高。对于单独的HEP和CEP,增加热处理时间,CEP 黏度值变化更为明显;对于不同温度处理的样品,随着剪切速率的增加, 两种果胶也都表现出了剪切稀化现象, 并且95 ℃处理的HEP 果胶的剪切稀化程度最高。综合来看,HEP 和CEP 的这种流变性的不同, 可能是由于它们结构的差异所导致。
