红毛藻多糖的化学组成及其体外免疫诱导活性研究
2020-07-08宋田源姜泽东刘光明
余 刚 蔡 薇 宋田源 姜泽东,3* 倪 辉,3 刘光明,4
(1 集美大学食品与生物工程学院 福建厦门361021 2 厦门市疾病预防控制中心 福建厦门361021 3 福建省食品微生物与酶工程重点实验室 福建厦门361021 4 厦门市海洋功能食品重点实验室 福建厦门361021)
海藻多糖具有多种优良的生物活性, 如免疫调节、降血脂、降血压、抗凝血、抗氧化、抗肿瘤、抗病毒、抑菌活性等[1-8],特别是其免疫调节活性,在功能食品和医药品领域有重要的开发和应用价值。 目前已有多种海藻多糖被发现具有强效的免疫调节活性,如岩藻聚糖、泡叶藻聚糖、紫菜多糖、龙须菜多糖等[3,9-10]。 随着对海藻多糖活性研究的深入, 海藻多糖的作用机理和功效关系已成为多糖领域的研究热点之一。
红毛藻(Bangia fusco-purpure)是我国东南沿海特有的经济红藻资源,又称红毛菜、红棉藻等,属红藻门,原红藻纲,红毛菜目,红毛菜科,红毛菜属,在福建沿海分布较广,莆田市南日岛镇是其主要产地之一。相关研究和民间应用实践表明,红毛藻具有提高免疫力、降血压、降血脂、滋阴祛火和防止动脉粥状硬化等心血管疾病的食、药用功效,而对其作用机理尚不明确。 多糖是红毛藻藻体的主要结构物质之一, 同时也是主要的生物活性成分之一,目前关于红毛藻多糖的结构、生物活性及活性机理鲜有报道[11-13]。
通过热水抽提和乙醇沉淀的方法提取红毛藻粗多糖[14],用阳离子交换柱层析和葡聚糖凝胶过滤柱层析对粗多糖进行初步纯化, 获得红毛藻多糖BFP。 Jiang 等[15]研究表明BFP 是一种硫酸化多糖,主要由半乳糖、糖醛酸和硫酸基团组成;本研究采用DEAE-cellulose52 阴离子交换柱层析的方法分级制备红毛藻多糖3 个组分F1、F2 和F3,对其进行单糖组成及化学组成分析, 明确其多糖的基本组成特征。 利用小鼠巨噬细胞RAW264.7 模型,围绕红毛藻多糖BFP 及其分级纯化多糖组分F1、F2、F3 的诱导RAW264.7 细胞活化释放免疫因子,包括一氧化氮(nitric oxide,NO)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和活性氧簇(reactive oxygen species, ROS)的活性(体外免疫诱导活性检测指标)展开研究[16-17],旨在明确其免疫调节活性和相关机理, 阐明红毛藻具有提高免疫力功效的作用机制, 为红毛藻及其多糖组分在食品和医药领域的开发和应用提供科学依据。
1 材料与方法
1.1 材料和试剂
红毛藻藻体,采集于福建省莆田市南日岛海域。
小鼠巨噬细胞系RAW264.7, 购自中科院上海细胞库。
胎牛血清(FBS),中国赛默飞世尔科技公司;100X 青链双抗溶液, 美国sigma 公司; 高 糖DMEM培养基, 美 国Hyclone 公 司;噻唑蓝(MTT),美国sigma 公司;四唑氮蓝(NBT),美国sigma 公 司;Mouse TNF-α Colorimetric ELISA kit, 美 国Thermo Fisher Scientific 公司;DEAEcellulose 52 填料, 美国Whatman 公司;Sephadex G-75 葡聚糖凝胶层析柱和Superdex 75 10/300 GL 凝胶层析柱, 瑞典GE 公司; 牛血清蛋白(BSA),美国Sigma 公司;标准单糖和内标:D-阿拉伯糖(Ara)、D-半乳糖(Gal)、L-木糖(Xyl)、L-岩藻糖(Fuc)、D-甘露糖(Man)、D-葡萄糖(Glc),美国Sigma 公司;1-苯基-3-甲基-5-吡唑啉酮(PMP), 阿拉丁试剂 (上海)有限公司; 抑制剂SB203580,SP600125,U0126,美国Sigma 公司;抑制剂PDTC,碧云天生物技术研究所;其余试剂均为国产分析纯。
1.2 仪器和设备
Avanti J26XP 高速冷冻离心机, 德国贝克曼公司;Free Zone 6 plus 真空冷冻干燥机, 美国Labconco 公司;BioTek Cytation-5 细胞成像多功能检测系统,美国伯腾仪器有限公司;1360 Infinity 超高压高效液相色谱仪(配有可变波长紫外检测器和Inert SustainRC18 色谱柱), 中国安捷伦科技有限公司;iS50 FT-IR 红外光谱仪,中国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 红毛藻多糖的提取及纯化 预处理: 红毛藻藻体洗净,烘干,经粉碎后过100 目筛网得到藻粉。 准确称取50 g 干燥藻粉,加入300 mL 甲醇,搅拌后浸泡过夜以除去醇溶性色素和杂质, 反复抽提3 次后,烘干备用。
多糖提取[18]:称取50 g 上述预处理后的干燥藻粉加入1 L 超纯水,置于电热磁力搅拌器上,搅拌转速200 r/min,于95 ℃进行热水抽提2 h,离心(4 000 g,20 min),收集上清液,残渣中再加入1 L超纯水,继续提取2 h,离心,合并2 次提取的上清液, 减压蒸发浓缩至300~400 mL。 用体积分数75%乙醇沉淀粗多糖,4 ℃静置过夜后, 离心(8 000 g,20 min),收集沉淀。收集的沉淀用少量超纯水复溶,置于3 500 u 分子质量截留的透析袋中,超纯水透析48 h。收集透析袋中溶液并冷冻干燥以获得红毛藻粗多糖。
多糖纯化:采用Sevage 法[14]除去粗多糖中的蛋白质, 去除蛋白质后多糖采用上述体积分数75%乙醇沉淀法回收,经透析、冷冻干燥后备用。将去除蛋白质的多糖配制成多糖溶液(5 mg/mL),上Dowex 50W×8 阳离子交换柱层析(26 mm I.D.× 200 mm),用超纯水进行洗脱,并采用苯酚-硫酸法[19]在490 nm 下的吸光值(OD490)来检测洗脱液中多糖含量,收集含有多糖的洗脱液,调节pH至7.0,经48 h 超纯水透析、冷冻干燥后备用。 将经阳离子交换柱层析后的多糖用0.1 mol/L NaCl制成5 mg/mL 多糖溶液,经0.22 m 的滤膜过滤后,上Sephadex G75 凝胶过滤柱层析(16 mm I.D.×1 000 mm),用0.1 mol/L NaCl 溶液进行洗脱,控制流速为0.2 mL/min, 利用色谱样品自动收集器连续收集40 管,每管5 mL,并采用苯酚-硫酸法在490 nm 下的吸光值(OD490)来检测每管多糖含量,以洗脱体积为横坐标,OD490为纵坐标作图, 绘制洗脱曲线。 收集处于洗脱峰处管中的洗脱液,经48 h 超纯水透析、 冷冻干燥后, 获得红毛藻多糖(B. fusco-purpure polysaccharide,BFP)。
1.3.2 红毛藻多糖的分级分离 将BFP 溶于超纯水制成5 mg/mL 的多糖溶液, 经0.22 μm 的滤膜过滤后, 取3 mL 上样于DEAE-cellulose 52 离子交换色谱柱(26 mm I.D. × 200 mm),分别选取不同浓度(0,0.1,0.3,0.5 和1.0 mol/L)的NaCl 溶液对BFP 进行梯度洗脱。 按每管10 mL 进行收集, 采用苯酚-硫酸法检测每管中多糖的含量,于490 nm 处测定吸光值(OD490)。 以OD490对洗脱体积作图,绘制曲线。 经多次重复后,收集相同出峰位置的多糖组分,超纯水透析48 h 后,冷冻干燥,获得红毛藻多糖组分。
1.3.3 多糖的化学组成分析 采用苯酚-硫酸法,以葡萄糖为标准品,测定总糖含量;采用BCA法[20],以BSA 为标准品,测定蛋白质含量;采用氯化钡明胶比浊法[21],以K2SO4为标准样品,测定硫酸根含量;采用咔唑-硫酸法[22],以葡萄糖醛酸为标准品,测定糖醛酸含量;采用Folin-酚试剂法[23],以没食子酸作为标准品,定量检测多酚的含量。
1.3.4 多糖平均分子质量的测定 使用凝胶色谱法[24]测定BFP 及各多糖组分的平均分子质量。 将100 μL 的多糖样品溶液(5 mg/mL),用0.22 μm 滤膜过滤除杂后,上样于制备型液相色谱仪(AKTApurify), 检测柱为Superdex 75 10/300 GL (10 mm I.D. × 400 mm)。 在室温条件下用0.1 mol/L的NaCl 溶液进行洗脱, 洗脱流速为0.5 mL/min。利用苯酚-硫酸法检测收集的洗脱液中多糖的含量, 根据洗脱体积和各管吸光度值绘制出洗脱曲线。 以分子质量为5,12,25 和50 ku 的葡聚糖作为标准品, 多糖样品用上述同样方法并结合分子质量标准曲线计算多糖的平均分子质量。
1.3.5 红毛藻多糖的单糖组成分析 多糖的水解:取4 mg 的多糖,加入2 mL 2 mol/L 的三氟乙酸,密封,100 ℃水解3 h,60 ℃烘干除去三氟乙酸溶液, 残余物中加入4 mL 正丁醇, 涡旋振荡2 min,60 ℃烘干后再加入正丁醇,混匀烘干,如此反复2~3 次,以彻底除净三氟乙酸,残余物用1 mL的蒸馏水溶解,4 ℃保存备用。
单糖组成分析:采用柱前PMP 衍生法[25-26]衍生单糖标准品和多糖的水解产物。 配制一定浓度的Man,Xyl,Glc,Gal,Ara 和Fuc 的单糖标准溶液和混合标准溶液。 各标准溶液分别取50 μL 置于具塞试管中, 各加50 μL 0.6 mol/L 的NaOH 溶液,漩涡混匀;再加100 μL 0.5 mol/L 的PMP 甲醇溶液, 漩涡混匀后置于70 ℃的烘箱中避光反应100 min,取出避光放置,冷却至室温,加50 μL 0.3 mol/L 的HCl 溶液, 用超纯水补充至2 mL,再加2 mL 的三氯甲烷,漩涡混匀,静置,弃去三氯甲烷相后重新加2 mL 三氯甲烷,如此萃取3 次。 将水相用0.22 μm 微孔膜过滤后, 用HPLC 进行分析。 多糖水解样品以上述同样的方法进行处理并分析。
1.3.6 红毛藻多糖的红外分析 将多糖样品烘干至恒重后,与KBr 粉末充分混合、研磨均匀,压片后使用is50 FT-IR 红外光谱仪在4 000~400 cm-1范围内扫描,记录多糖样品的谱图。
1.3.7 细胞培养 小鼠巨噬细胞系RAW264.7 采用含10% FBS、100 U/mL 青霉素及100 μg/mL 链霉素的高糖DMEM 培养基, 于37 ℃、5% CO2的CO2细胞培养箱中培养。 在试验过程中对培养细胞进行分组,如下:
阴性对照组(Control):不含LPS 和多糖;阳性对照组:以2 ng/mL 的LPS 处理;样品组(Sample):不同质量浓度(0~100 μg/mL)的BFP,各组分(F1、F2、F3)溶液;空白组(Blank):DMEM 生长培养基。
1.3.8 细胞活力分析 通过MTT 法[27]来测定多糖样品对RAW264.7 细胞活力的影响。 将处于对数生长时期的RAW264.7 细胞以3×104细胞/孔的浓度接种于96 孔细胞培养板, 于37 ℃、5% CO2的CO2培养箱中孵育24 h 后, 用不同质量浓度的各多糖样品溶液(0~100 μg/mL)孵育24 h,除去上清后,每孔加入终质量分数为5%的MTT 溶液,继续孵育30 min,移去上清后,加入100 μL DMSO,振荡20 min, 于细胞成像多功能检测系统测量570 nm 处吸光值(OD570)。采用以下公式计算计算细胞活力。

1.3.9 多糖诱导RAW264.7 细胞活化释放免疫因子NO、TNF-α 和ROS 的测定
1.3.9.1 NO 测定 通过Griess 法测定RAW264.7细胞释放NO[28]。 参照1.3.8 节方法将细胞接种于细胞培养板中。 经过夜培养后, 分别向贴壁的RAW264.7 细胞中加入100 μL 不同质量浓度 (0~100 μg/mL)的多糖样品溶液,设置空白对照和阳性对照组, 并以0 μg/mL 质量浓度的多糖处理组为阴性对照, 多糖样品溶液每个浓度和各对照组均做3~5 个平行,于37 ℃、5% CO2的条件下培养24 h 后,每孔取出50 μL 培养上清液置于新的96孔细胞培养板中,然后向上清液中加入100 μL 的Griess 试剂 (含3 mmol/L 磺胺酸,30 mg/L N-1-(萘基)乙二胺二盐酸盐, 质量分数25%的冰醋酸),室温避光孵育20 min 后,检测540 nm 下的吸光值(OD540)。 同时,用不同浓度的NaNO2标准溶液绘制标准曲线,计算培养上清液中NO 浓度。
1.3.9.2 TNF-α 测定 采用ELISA 测定RAW264.7细胞分泌的TNF-α[3]。 细胞接种方法参照1.3.8 节中方法,用不同质量浓度(0~100 μg/mL)的多糖样品溶液在37 ℃、5% CO2的条件下处理培养板中贴壁的RAW264.7 细胞24 h 后,每孔取出4 μL 培养上清液用含有4% BSA 的PBS 溶液稀释50倍,然后,根据Mouse TNF-α Colorimetric ELISA kit 说明手册所示的操作步骤对稀释后培养上清中TNF-α 进行定量测定。 同时,利用不同浓度的TNF-α 标准溶液绘制标准曲线, 计算培养上清液中TNF-α 的含量。
1.3.9.3 ROS 测定 多糖诱导RAW264.7 细胞产生ROS 采用NBT 还原法检测[29-30]。 将RAW264.7细胞接种于24 孔细胞培养板(5×106细胞/孔)中。经贴壁培养后, 用含Ca2+和Mg2+的Hank’s Balanced Salt Solution (HBSS)轻轻冲洗贴壁细胞2次,分别向每孔加入450μL 的不同质量浓度(0~100 μg/mL)的多糖样品溶液在37 ℃、5% CO2的条件下诱导RAW264.7 细胞。10 min 后,每孔加入NBT 溶液(质量分数为0.25%)。 经1 h 继续培养,用HBSS 轻轻洗去每孔过量NBT 溶液, 加入600 μL 的DMSO 充分溶解细胞中的甲瓒,再加入700 μL 的2 mol/L KOH 溶液混匀显色, 检测630 nm波长下的吸光值(OD630)。
1.3.10 多糖诱导RAW264.7 细胞释放NO 及分泌TNF-α 信号通路分析[31]将RAW264.7 细胞接种于96 孔细胞培养板中, 细胞接种参照1.3.8 节中方法。 分别用50μL 的含U0126(ERK)、SB203580(P38)、SP600125(JNK)和PDTC(NF-κB)不同细胞信号通路抑制剂的DMEM 生长培养基预处理贴壁的RAW264.7 细胞1 h, 抑制剂终浓度为20 μmol/L,然后加入50 μL 的多糖样品溶液(质量浓度为20 μg/mL),设置只用多糖样品处理的阳性对照组、 不加多糖样品阴性对照组和只用各抑制剂处理的空白对照组,每组设置3~5 个平行试验。将加样后的细胞置于37 ℃、5.0% CO2的条件下培养24 h,取培养上清分别按照1.3.9 节中Giress 法和ELISA 法测定培养上清中RAW264.7 细胞释放出NO 和分泌出TNF-α 的含量。
2 结果与分析
2.1 多糖的分离纯化
红毛藻粗多糖采用Sevage 法脱除蛋白质后,经过阳离子交换柱层析初步纯化后, 上样Sephadex G75 凝胶柱层析,用浓度为0.1 mol/L 的NaCl 溶液进行洗脱,结果如图1a 所示,红毛藻粗多糖的洗脱曲线得到单一对称峰,命名为BFP;将多糖BFP 上样于DEAE-cellulose 52 层析柱,用不同浓度的NaCl 溶液进行梯度洗脱, 结果如图1b 所示。 当NaCl 溶液浓度为0.1,0.3,0.5 mol/L时,各有一个洗脱峰出现,收集各洗脱峰溶液,分别命名为F1、F2 和F3。
2.2 红毛藻多糖的基本组成结果
由表1 可知, 与标准单糖出峰的保留时间相比较, 多糖BFP 及多糖组分F1、F2 和F3 均为杂多糖。 Jiang 等[15]报道表明BFP 的单糖组成主要为Gal、Man、Glc 和糖醛酸, 并含有少量Fuc、Xyl 和Ara,其物质的量比为11.23∶1.02∶1.00∶2.36∶0.34∶0.35∶0.16 (Glc 的物质的量为1.00)。 本研究表明F1 主要由Gal、Man、Glc、糖醛酸、Ara 和Fuc 组成, 其物质的 量比为1.43 ∶0.62 ∶1.00 ∶0.31 ∶0.51 ∶0.50;F2 主要由Gal、Man、Glc、糖醛酸和Ara 组成,其物质的量比为1.14∶1.38∶1.00∶0.37∶1.12;F3的主要单糖组成为Man、Glc 和Ara, 并含有少量的糖醛酸和Gal,其物质的量比为0.53∶1.99∶1.00∶2.92∶1.06。BFP、F1、F2 和F3 中硫酸根含量分别为10.34%,2.73%,3.09%和2.20%, 含有少量蛋白质(分别占0.31%,0.14%,0.15%和2.19%), 且几乎不含多酚。平均分子质量分析结果表明,多糖BFP分子质量为43.16 ku,而组分F1、F2 和F3 分子质量分别为2.07,32.07 和28.32 ku。
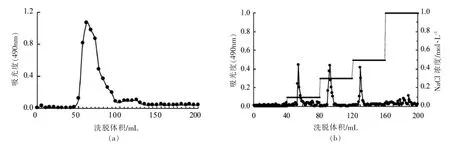
图1 红毛藻多糖Sephadex G75 凝胶过滤层析洗脱曲线图(a)和DEAE-cellulose 52阴离子交换柱层析洗脱曲线图(b)Fig.1 Elution profile of polysaccharide isolated from B. fusco-purpureaon on a Sephadex G75 gel permeation chromatography (a)and gradient elution profile of BFP on a DEAE-cellulose 52 anion exchange chromatography(b)

表1 BFP、F1、F2 和F3 的单糖、硫酸基团组成和分子质量Table 1 Monosaccharide compositions, sulfate group compositions and molecular mass of BFP, F1, F2 and F3
2.3 BFP、F1、F2 和F3 的红外光谱学特征
由图2 可得,在3 400 cm-1处的宽强峰是分子内O-H 的伸缩振动的吸收峰,由于分子内羟基间形成氢键而使吸收峰变宽[32];在3 000~2 800 cm-1区较弱的吸收峰和1 400~1 200 cm-1区较宽的吸收峰是C-H 伸缩振动吸收和变角振动吸收,这两个区域的吸收峰是糖类的特征吸收峰[33];1 230 cm-1处是硫酸基中S=O 的伸缩振动吸收[34-35],BFP、F1、F2 在此吸收峰较强, 说明F1、F2 含较多的硫酸根,F3 硫酸根含量较低, 这与上述化学分析的结果一致;1 200~1 000 cm-1间的强吸收峰是由两种C-O 伸缩振动所引起的, 一种属于C-O-H,另一种是糖环C-O-C[36];没有930 cm-1处的吸收峰, 提示BFP、F1、F2 和F3 不含或很少含有3,6-内醚-L-半乳糖[37]。 892 cm-1处的弱带则表明存在α-糖苷键[38]。 在820 cm-1处的吸收峰可能是由D-半乳糖的C-6 位的硫酸根基团引起的[34]。 F1、F2、F3 在1 740 cm-1处吸收峰较弱表明含少量糖醛酸,BFP 有较强峰表明糖醛酸含量较高[38]。 在1 633 cm-1和1 644 cm-1处的独特吸光度强烈表明BFP、F1、F2 和F3 中的羧基[39]。
2.4 红毛藻多糖对RAW264.7 细胞活力的影响
由图3 可知, 在本文所设定的多糖质量浓度(0~100 μg/mL)和作用时间(24 h)范围内,BFP、F1、F2 和F3 对细胞活力没有显著的影响。

图2 BFP、F1、F2 和F3 的红外光谱图Fig.2 FT-IR spectra characteristics of BFP, F1,F2 and F3
2.5 红毛藻多糖诱导RAW264.7 细胞活化释放免疫因子NO、TNF-α 和ROS 的结果
多糖样品诱导细胞释放的NO 溶于细胞培养上清液形成NO2-, 以细胞上清液中NO2-浓度表示样品诱导细胞释放NO 的活性,其结果如图4a 所示: 多糖BFP、F1、F2、F3 在所测定质量浓度 (0~100 μg/mL)范围内显著诱导RAW264.7 细胞活化释放NO,与阴性对照组相比差异极显著(P<0.01),且BFP、F1、F2、F3 诱导RAW264.7 细胞释放NO 能力在多糖质量浓度为0~12.5 μg/mL 范围内呈现浓度依赖性, 随着多糖质量浓度的升高而增加; 当多糖质量浓度为0~6.25 μg/mL 时,BFP、F1、F2、F3 诱导细胞释放NO 的量开始呈现出F2>F1>F3>BFP 的差异;当多糖质量浓度为12.5~100 μg/mL 时,BFP、F1、F2、F3 诱导细胞释放NO量趋于平稳,不呈现多糖质量浓度依赖性。
图4b 表明,多糖BFP、F1、F2、F3 在所测定质量浓度(0~100 μg/mL)范围内显著诱导RAW264.7细胞活化分泌TNF-α, 其活性呈现多糖质量浓度依赖性;多糖组分F1 和F2 诱导细胞分泌TNF-α的量与阴性对照组相比差异极显著 (P<0.01);多糖BFP 和组分F3 在质量浓度为25~100 μg/mL时,其诱导细胞分泌TNF-α 的量与阴性对照组相比,存在极显著差异性(P<0.01),而BFP 和F3 的质量浓度为12.5 μg/mL 时, 其诱导RAW264.7 细胞分泌TNF-α 活性与阴性对照组相比差异显著(P<0.05),当多糖质量浓度为0~6.25 μg/mL 时,无显著差异。
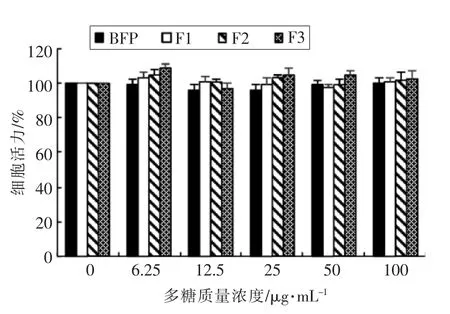
图3 BFP、F1、F2 和F3 对RAW264.7 细胞活性的影响Fig.3 Effects of BFP, F1, F2 and F3 at different concentrations on the viabilities of RAW264.7 cells
红毛藻多糖诱导RAW264.7 细胞活化产生ROS 的结果是通过溶解其胞内的甲瓒, 并以在630 nm 处的吸光值OD630来表示, 其结果如图4c所示。 多糖质量浓度为0~100 μg/mL 的范围内,BFP、F1、F2 和F3对细胞产生ROS没有显著影响, 表明BFP、F1、F2 和F3 在所测定质量浓度范围内没有诱导RAW264.7 细胞产生ROS 的活性。
2.6 不同信号通道抑制剂对红毛藻多糖诱导RAW264.7 细胞活化释放NO 和分泌TNF-α的影响
MAPK 信号通路和NF-κB 信号通路在巨噬细胞活化释放NO 和分泌TNF-α过程中起重要作用[40-41]。 为阐明MAPK 和NF-κB 信号传导通路是否参与红毛藻多糖诱导RAW264.7 细胞活化释放NO 和分泌TNF-α,本文利用ERK MAPK (U0126)、JNKMAPK(SP600125)、p38 MAPK(SB203580)的3 种经典MAPK 信号通路特异性抑制剂和NF-κB信号通路特异性抑制剂PDTC 分别预处理细胞,阻断相应信号通路, 来分析参与红毛藻多糖诱导RAW264.7 细胞活化释放NO 和分泌TNF-α 的相关细胞信号通路。 抑制剂对BFP、F1、F2 和F3 诱导细胞活化释放NO 和分泌TNF-α 的结果如表2和表3 所示。 抑制剂SP600125 和PDTC 均显著抑制BFP、F1、F2 和F3 诱导细胞活化释放NO,而抑制剂U0126 只显著抑制 BFP 诱导细胞活化释放NO (表1)。 抑制剂SP600125 和U0126 均显著抑制BFP、F1、F2 和F3 诱导细胞活化分泌TNF-α。抑制剂SB203580 只显著抑制BFP 和F1 诱导细胞活化分泌TNF-α,而PDTC 对F1 诱导细胞活化分泌TNF-α 无明显的抑制作用(表2)。 以上结果表明,BFP 主要通过诱导RAW264.7 细胞中NFκB、JNK MAPK 和ERK MAPK 信号通路活化释放NO,而诱导NF-κB、ERK MAPK 和p38 MAPK 信号通路活化分泌TNF-α;F1 主要通过诱导细胞中的NF-κB、和JNK MAPK 信号通路活化使细胞释放NO,通过诱导JNK、ERK 和p38 MAPK 信号通路活化分泌TNF-α;F2 和F3 作用机制相似,主要通过激活细胞的NF-κB 和JNK MAPK 信号通路使细胞释放NO, 并通过诱导细胞中NF-κB、JNK MAPK 和ERK MAPK 信号通路活化分泌TNF-α。

图4 不同质量浓度(0~100 μg/mL)的BFP、F1、F2 和F3 诱导RAW264.7 细胞活化产生NO (a)、TNF-α (b)和ROS (c)的水平Fig.4 NO (a), TNF-α (b)and ROS (c)levels in RAW264.7 cells induced by various concentration (0~100 μg/mL)of BFP, F1, F2 and F3

表2 抑制剂对BFP、F1、F2 和F3 诱导RAW264.7 细胞产生NO 的影响aTable 2 Effects of inhibitors on the BFP, F1, F2 and F3 induced NO production from RAW264.7 cellsa

表3 抑制剂对BFP、F1、F2 和F3 诱导RAW264.7 细胞产生TNF-α 的影响aTable 3 Effects of inhibitors on the BFP, F1, F2 and F3 induced TNF-α production from RAW264.7 cellsa
3 结论
从红毛藻中提取多糖BFP 经阳离子交换柱层析、 再经Sephadex G75 凝胶过滤柱层析和DEAE-cellulose 52 阴离子交换柱分离纯化得到3个多糖组分:F1、F2 和F3。多糖组成分析结果表明BFP、F1、F2 和F3 均为杂多糖且单糖组成存在较大差异(表1)。 分子质量分析结果表明,4 个片段分子质量相差较大, 其中BFP 分子质量为43.16 ku,而F1、F2 和F3 片段分子质量分别为2.07,32.07和28.32 ku。 活性研究结果表明BFP、F1、F2 和F3均能够显著诱导RAW264.7 细胞活化释放NO 和分泌TNF-α,并且组分F1 和F2 的活性显著高于多糖BFP 和F3, 说明F1 和F2 是BFP 中具有免疫诱导活性的主要活性组分。 通过进一步分析多糖诱导细胞活化的胞内信号转导通路, 推测红毛藻多糖BFP 共同通过诱导NF-κB 和ERK MAPK信号通路使RAW264.7 细胞活化释放NO 和分泌TNF-α,BFP 通过分别激活细胞中JNK 和p38 MAPK 释放NO 和分泌TNF-α;F1 主要通过JNK MAPK 信号通路活化RAW264.7 细胞释放NO 和分泌TNF-α,F1 通过分别诱导细胞中NF-κB 和ERK、p38 MAPK 活化释放NO 和分泌TNF-α;F2和F3 主要通过NF-κB 和JNK MAPK 信号通路诱导细胞活化释放NO, 并通过NF-κB、JNK MAPK 和ERK MAPK 信号通路诱导细胞活化分泌TNF-α。
