基于ITS2序列的市售木通药材及其混伪品的分子鉴定
2022-04-01穆威杉谢红波史萌萌胡志刚魏妙洁刘金欣石林春
穆威杉,谢红波,赵 晴,史萌萌,胡志刚,魏妙洁,刘金欣, ,石林春
• 药材与资源 •
基于ITS2序列的市售木通药材及其混伪品的分子鉴定
穆威杉1,谢红波1,赵 晴1,史萌萌1,胡志刚2,魏妙洁3,刘金欣1, 3*,石林春3*
1. 承德医学院 河北省中药研究与开发重点实验室,河北 承德 067000 2. 湖北中医药大学药学院,湖北 武汉 430065 3. 中国医学科学院北京协和医学院 药用植物研究所,北京 100193
建立基于核糖体内部转录间隔区2(internal transcribed spacer 2,ITS2)序列的木通药材DNA条形码鉴定方法,对市售木通药材进行物种分析。收集河北、安徽、贵州等地的样品总计45份,其中木通药材及其混伪品的原植物样品18份,市售木通药材样品27份。通过提取DNA、聚合酶链式反应(polymerase chain reaction,PCR)扩增、双向测序获得ITS2序列,基于邻接(neighbor joining,NJ)系统发育树和单核苷酸多态性(single nucleotide polymorphisms,SNP)位点进行物种鉴定分析。基于木通药材及其混伪品原植物ITS2序列构建的NJ树分析结果表明,木通药材正品及其混伪品在NJ树上聚为独立的分支,木通药材正品及其混伪品在NJ树上可明确区分;基于NJ树对27份市售木通药材的物种分析表明,市售样品中仅有4份为正品木通,2份为小木通,21份为粗齿铁线莲,正品率为14.8%。基于ITS2序列的DNA条形码技术可以准确区分中药材木通及其混伪品,市售木通药材物种较混乱。
木通;市售药材;ITS2;DNA条形码;鉴定
木通为临床常用药材。据《中国药典》2020年版记载[1],中药材木通为木通科植物木通(Thunb.) Decne.、三叶木通(Thunb.) Koidz.或白木通(Thunb.) Koidz. var.(Diels) Rehd.的干燥藤茎。近代以来木通药材的使用情况十分混乱,易将木通与川木通、关木通混淆使用[2]。1954年任仁安[3]调查发现木通类商品以马兜铃科关木通为主,但由于关木通含有马兜铃酸会引发肾损伤[4-5],2003年关木通已被国家食品药品监督管理局禁用[6]。在关木通被禁用之后,川木通成为木通类药材的主流商品[7-8]。川木通为毛茛科铁线莲属植物小木通Franch.或绣球藤Buch. -Ham.的干燥藤茎[1]。木通药材长期依赖于野生资源,市场供应不足[9],而川木通资源丰富且具有较高利润,市场上存在川木通代替木通的现象[7]。木通类药材虽名称相近,但木通、川木通、关木通的原植物来源于不同的科属,其化学成分、药理作用及临床应用均存在差异[10-11]。若临床中将木通与川木通、关木通混淆使用,不仅药效难以保证,临床用药安全也将存在隐患。
《中国药典》2020年版收载的木通药材鉴别方法主要为性状鉴定法、显微鉴定法及薄层色谱法[1]。性状鉴定与显微鉴定依赖于鉴定人员的专业知识和鉴定经验,同时中药材的性状或显微特征可能因其基原与产地不同而存在一定差异[12],加上木通类药材均以藤茎入药,性状相似,利用性状及显微特征对木通药材进行鉴别存在一定困难。利用薄层色谱法对木通药材进行鉴定时,木通药材的甲醇和乙酸乙酯提取物为多种化学成分的混合物[13],对木通苯乙醇苷B的检测易受其他化学性质相似成分的影响,同时孙萍等[14]研究发现木通与川木通同样含有较多相似的化学成分。DNA条形码技术利用基因组中一段公认的、相对较短的DNA序列进行物种鉴定[15],不受时间、气候、植物发育阶段等的影响,具有准确、快速、易于操作等优势,是对传统中药鉴定方法的有效补充[16]。目前DNA条形码技术已广泛用于动物、植物、真菌等生物类群的物种鉴定[17-19]。当前,“中药材DNA条形码分子鉴定指导原则”、“DNA测序技术指导原则”已收载于《中国药典》2020年版[20],基于测序技术的DNA分子鉴定方法将成为中药鉴定学的重要发展方向。
本研究以木通药材为研究对象,通过收集木通及其混伪品的原植物样品,利用基于ITS2序列的DNA条形码技术构建中药材木通及其混伪品的鉴定方法;并应用该技术对市售木通药材进行物种分析,为保障木通药材的临床用药安全提供技术支持。
1 仪器、试剂与材料
1.1 仪器与试剂
SQP型电子天平(德国赛多利斯科学仪器有限公司);MM400型球磨仪(德国Retsch公司);手动移液枪(德国eppendorf公司);VORTEX-5型涡旋混合器(海门市其林贝尔仪器制造有限公司);1-14型离心机(德国Sigma公司);Nanodrop One型超微量分光光度计(美国Thermo Fisher Scientific公司);T100型聚合酶链反应(PCR)仪(美国Bio-Rad公司);DYY-6C型电泳仪(北京六一生物科技有限公司);Gel DocTMXR+型凝胶成像仪(美国Bio-Rad公司);天根植物DNA提取试剂盒[天根生化科技(北京)有限公司];2×Taq PCR Master Mix试剂(北京艾德莱生物科技有限公司);AL2000 DNA Maker(北京艾德莱生物科技有限公司);琼脂糖(BIOWEST公司);引物 [生工生物工程(上海)股份有限公司]。
1.2 材料
本研究共收集45份实验样品,包括18份原植物样品和27份市售药材样品。原植物样品采集自湖北、吉林、重庆等地,并经由湖北中医药大学药学院胡志刚教授和中国医学科学院药用植物研究所石林春副研究员鉴定;市售药材样品收集自河北、安徽、广西等地的药材市场、药房或药店。详细信息见表1、2。
2 方法
2.1 DNA提取、PCR扩增和序列测定
原植物样品的称样量为10 mg,药材样品的称样量为30 mg,使用球磨仪进行研磨,使用天根植物DNA提取试剂盒进行DNA提取,利用超微量分光光度计测定DNA的浓度和吸光度比值(260/280)。PCR扩增的引物、反应程序依据中药材DNA条形码分子鉴定指导原则[15]并略作调整,使用25 μL的反应体系进行PCR扩增,以1%的琼脂糖凝胶电泳对PCR产物进行检测。将PCR产物纯化后,使用AB1 3730XL测序仪进行双向测序。
表1 木通及其混伪品原植物样品采集信息及其ITS2序列的GenBank登录号
Table 1 Information of original plant samples of Akebiae Caulis and its adulterants, and their ITS2 GenBank accession numbers
样品编号物种名拉丁名来源登录号 BZYP001木通Akebia quinata 江西九江MT534353 BZYP002木通A. quinata 江西九江MT534352 BZYP003木通A. quinata 江西九江MT534351 BZYP004三叶木通A.trifoliata江西九江MT534350 BZYP005三叶木通A.trifoliata江西九江MT534349 BZYP006白木通A.trifoliata var. australis湖北武汉MT534348 BZYP007白木通A.trifoliata var. australis湖北武汉MT534347 BZYP008白木通A.trifoliata var. australis湖北武汉MT534346 BZYP009小木通Clematis armandii重庆城口MT534358 BZYP010小木通C. armandii重庆城口MT534359 BZYP011绣球藤C. montana湖北十堰MT534360 BZYP012绣球藤C. montana湖北十堰MT534361 BZYP013关木通Aristolochia manshuriensis吉林通化MT534342 BZYP014关木通A. manshuriensis吉林通化MT534341 BZYP015关木通A. manshuriensis吉林通化MT534340 BZYP016粗齿铁线莲Clematis argentilucida江西九江MT534355 BZYP017粗齿铁线莲C. argentilucida江西九江MT534356 BZYP018粗齿铁线莲C. argentilucida江西九江MT534357
表2 市售木通药材样品信息及其ITS2序列的GenBank登录号
Table 2 Information of commercially available Akebiae Caulis medicinal materials and their ITS2 GenBank accession numbers
样品编号样品来源登录号 MTYC001贵州省毕节市某药店MT534379 MTYC002贵州省毕节市某药店MT534380 MTYC003贵州省毕节市某药店MT534381 MTYC004贵州省毕节市某药店MT534382 MTYC005贵州省毕节市某药店MT534343 MTYC006北京某药房MT534383 MTYC007北京某药房MT534384 MTYC008河北承德某药店MT534362 MTYC009河北安国药材市场MT534344 MTYC010河北安国药材市场MT534370 MTYC011河北安国药材市场MT534371 MTYC012河北安国药材市场MT534363 MTYC013四川成都药材市场MT534365 MTYC014四川成都某药店MT534366 MTYC015四川成都某药店MT534367 MTYC016四川成都某药店MT534368 MTYC017四川成都某药店MT534369 MTYC018安徽亳州某药店MT534374 MTYC019安徽亳州药材市场MT534375 MTYC020安徽亳州药材市场MT534376 MTYC021安徽亳州药材市场MT534345 MTYC022山东菏泽药材市场MT534372 MTYC023山东菏泽药材市场MT534373 MTYC024重庆某药店MT534364 MTYC025江苏宿迁某药店MT534377 MTYC026陕西宝鸡某药店MT534378 MTYC027广西玉林药材市场MT534354
2.2 数据分析
利用CodonCode Aligner v.8.0.2软件去除测序峰图两端的低质量区,并完成校对和拼接,基于隐马尔可夫模型(hidden markov model,HMM)注释获得ITS2条形码序列区间[21];利用MEGA X软件[22]完成多序列比对及NJ系统发育树的构建,并设置Bootstrap为2000检验各分支的支持率;采用建树法和SNP分析完成物种鉴定。
3 结果与分析
3.1 DNA提取、PCR扩增及测序
根据“2.1”项中的DNA提取方法完成45份样品的DNA提取。DNA检测结果显示,45份样品DNA质量浓度的平均值为178.9 ng/μL,260/280在1.8~2.05,表明所有样品均成功提取质量较高的DNA,DNA提取成功率为100%。将提取的DNA模板加入25 μL的PCR体系中,按照设置好的扩增程序进行PCR扩增,所得到的PCR产物在电泳胶图上的条带单一且明亮,长度在500 bp左右。18份原植物样品及27份市售木通药材样品的PCR产物经过双向测序,所有样品的ITS2序列均获得较高质量双向测序峰图,部分样品的ITS2序列在个别碱基位点存在不同程度的测序套峰,如在第87位存在AC套峰、103位和170位存在AG套峰、201位存在TC套峰(图1)。经CodonCode Aligner软件校对拼接,切除5.8 S rRNA和28 S rRNA区域后得到45条ITS2条形码序列,质量分析表明符合《中国药典》2020年版的“DNA测序技术指导原则”,可满足后续分析需要。
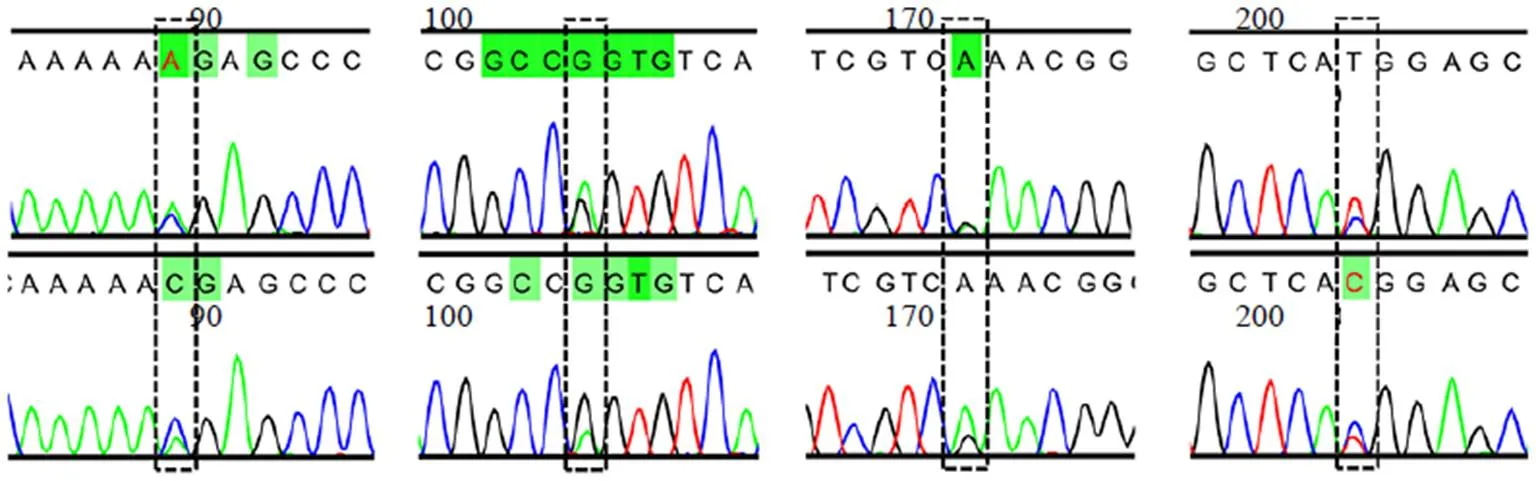
图1 部分样品的局部测序峰图
3.2 木通及其混伪品原植物的DNA条形码分析
18份原植物样品均可成功获得ITS2序列。木通、三叶木通、白木通的ITS2序列共8条,比对后长度均为216 bp,平均GC含量为67.28%,共有2种序列类型A1和A2,A1为木通,A2为三叶木通或白木通,其中第190位可以作为木通与三叶木通、白木通的特异性SNP鉴定位点,木通在该位点的碱基为G,而三叶木通或白木通在该位点均为T,木通可以与三叶木通、白木通相互区分。白木通作为三叶木通的亚种,无法与三叶木通清晰区分。小木通、绣球藤的ITS2序列各2条,比对后序列长度均为222 bp,GC含量为66.50%~68.30%,平均GC含量为67.40%;获得粗齿铁线莲的序列3条,比对后序列长度为222 bp,GC含量为68.90%;关木通的ITS2序列共3条,比对后长度为274 bp,GC含量为71.2%。木通及其混伪品原植物ITS2序列的变异位点见图2。

图2 木通及其混伪品种内种间ITS2序列比对
经系统发育树分析,木通药材的基原植物木通、三叶木通、白木通及其混伪品在邻接系统发育树上分别聚为独立的分支,同为毛茛科的小木通、绣球藤、粗齿铁线莲序列聚为一大支,各物种间可明显区分,关木通单独聚为一支,木通药材正品及其混伪品在NJ系统发育树上可明确区分(图3),表明基于ITS2序列构建的NJ系统发育树可有效鉴别木通药材基原植物及川木通、粗齿铁线莲、关木通等易混品。

图3 基于ITS2序列构建的木通药材及其混伪品的NJ系统发育树
3.3 基于DNA条形码技术的市售药材物种鉴定
本研究从药材市场、药店和药房共收集27份市售木通药材样品,均可成功获得ITS2序列,将市售药材与木通及其混伪品原植物获得的ITS2序列共同构建NJ系统发育树(图4),以对市售木通药材进行物种分析,结果表明:在27份市售木通药材样品中,21份与粗齿铁线莲的原植物样品聚为一支,占比77.8%,2份与小木通的原植物样品聚为一支,占比7.4%,4份与木通药材的基原植物聚为一支,正品率为14.8%;木通药材混伪品存在于市场流通的各个环节,在药材市场、药店和药房均发现木通药材的混伪品存在。
4 讨论
4.1 木通药材品种混乱,DNA条形码技术可用于市场上木通药材的物种分析
本草文献对木通的记载不明确。《本草纲目》[23]中记载“有细细孔,两头皆通,故名通草,即今所谓木通也”。谢宗万认为木通科木通属、野木瓜属、八月瓜属,毛茛科铁线莲属、马兜铃科马兜铃属等多种科属植物的藤茎均符合上述特征[24]。清代《植物名实图考》[25]中“小木通”项下提到“藤本能利水者,多以木通名之”,而木通与川木通均具有“利尿通淋”的功效。由于木通类药材性状功效相似,不同地区的用药习惯差异,市场上的木通药材存在一物多名、同名异物等现象。1996年出版的《全国中草药汇编》记载,在江苏及四川等地存在将正品木通当作“海风藤”使用的情况[26]。木通产于安徽大别山、湖南武陵山、河南伏牛山及桐柏山脉、湖南、湖北、江浙等地[9],多为自产自销,野生资源蕴藏量有限,栽培木通的主要目的是获取其果实,俗称“八月炸”“八月瓜”“中华肾果”等,味道甘甜清润,营养价值高[27-28],种植户砍藤获取木通药材的动力不足。此外,《中国药典》中收录的“预知子”为木通的干燥近成熟果实,市场价格一般为木通药材的1~3倍,木通果实入药也在一定程度上使得木通藤茎获取受限。木通药材北方药源不足,而关木通在东北地区产量大,价格较低,逐渐推广销售至全国[2],在2003年关木通被禁用之后,市场上存在较广泛川木通代替木通的现象。另外,根据国锦琳等对川木通商品的调查发现,市场上存在大量粗齿铁线莲作为川木通商品流通的情况[29]。川木通的混伪品也出现在木通药材中。
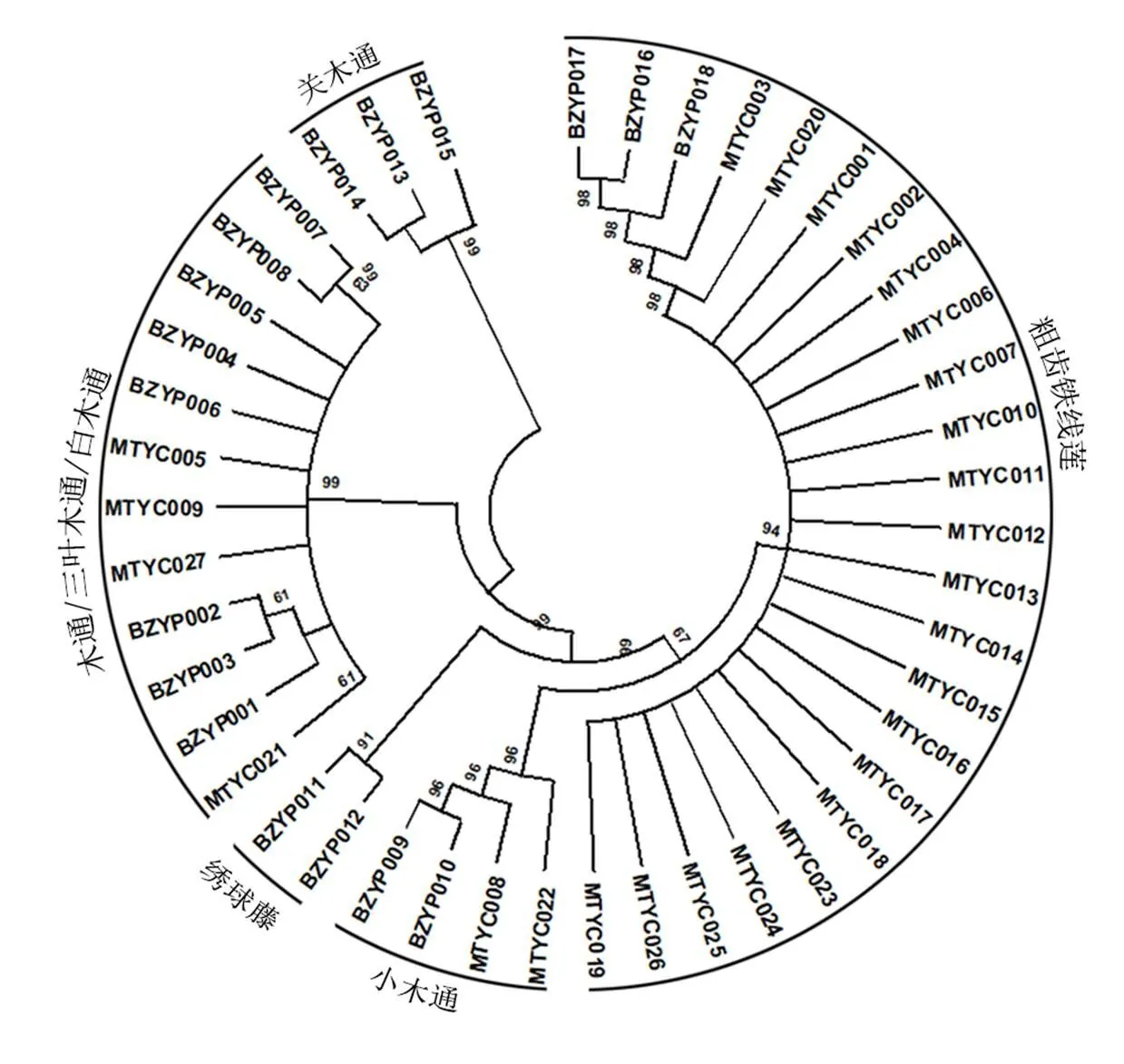
图4 基于ITS2序列构建的市售木通药材NJ系统发育树
本研究基于ITS2序列对收集的27份市售木通药材鉴定表明,仅有4份为正品木通,混伪品包括川木通与粗齿铁线莲,与其他学者相关的市场调查结果一致[7,29],表明基于ITS2序列的DNA条形码技术可以区分中药材木通、川木通、关木通和粗齿铁线莲,可用于市场上木通药材的物种分析。但由于ITS2序列通常作为物种水平的鉴定条形码,在本研究中无法实现亚种或变种水平的鉴定,需要筛选新的辅助条形码或者采用叶绿体全基因组[30]来实现木通的种内物种鉴定。
4.2 DNA条形码技术与高通量测序技术相结合可用于中成药中木通成分的物种分析
木通是小儿金丹片、龙胆泻肝丸、排石颗粒等28种中成药的处方成分。但历版《中国药典》对“木通类”药材的收载情况存在变化。《中国药典》1963年版[31]同时收录了木通、川木通及关木通3种木通类药材,随后在《中国药典》1977年版[32]、1985版[33]、1990年版[34]、1995年版[35]、2000年版[36]中只收录了关木通和川木通,由于木通药源短缺,未被收录其中[37],木通逐渐淡出市场[2]。2002年,木通再次被《中国药典》2000年版增补版收载。1977版和《中国药典》1985年版一部的药材及饮片部分虽未收载木通,但成方制剂和单方制剂部分收载的导赤丸、龙胆泻肝丸的处方成分一直规定为木通。在《中国药典》1990年版所收载的赤导丸、龙胆泻肝丸的处方中,直接以关木通取代木通。1993年,比利时出现因使用含中草药的减肥药而导致肾衰竭的事件[38],1996年,研究者从受害者的肾组织中分离出马兜铃酸-DNA加合物[39]。随着研究的深入,人们逐渐明确了导致此类肾病的罪魁祸首为马兜铃酸,由于关木通含有马兜铃酸成分,在2003年国家药品监督管理局通知取消关木通药用标准(国药监注[2003]121号)后,《中国药典》2005年版[40]及此后各版药典只收录川木通和木通。导赤丸、龙胆泻肝丸等成方制剂的处方成分也将关木通修改为木通。可见由于木通药材的混乱,导致含木通的成方制剂也存在处方成分混乱的情况。但药典中含木通中成药的处方成分仅存在木通与关木通更替的情况,并未将川木通与两者混淆。
本研究所收集的样品中发现,各地药材市场和药店销售的木通药材中,将川木通及其混伪品当作木通来使用的情况较严重,木通的流通商品以粗齿铁线莲和小木通为主,而正品木通却较少。Xin等[41]通过对3份市售龙胆泻肝丸样品研究发现,一份样品同时检测到正品三叶木通和混伪品小木通,其余两份仅检测出小木通,说明中成药中存在将川木通代替木通使用的现象。本研究以木通及其混伪品原植物参考样品为基础,表明基于ITS2序列的DNA条形码技术可准确鉴定木通及其混伪品。但由于中成药成分复杂,针对单一物种鉴定的DNA条形码技术无法满足多组分中成药的鉴定。随着测序技术的发展,可将高通量测序与DNA条形码技术相结合,即DNA metabarcoding技术[42-43]和shotgun metagenomics技术[41],用于含木通中成药的成分鉴定,从而保证中成药的投料准确与临床疗效,为木通药材及其中成药监管提供技术支持。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 236.
[2] 黄和平, 黄璐琦, 王键, 等. 木通基源考证、药用沿革与资源 [J]. 中成药, 2013, 35(11): 2488-2490.
[3] 任仁安. 商品木通的生藥學鑑定 [J]. 药学学报, 1954(1): 23-30.
[4] Lord G M, Tagore R, Cook T,. Nephropathy caused by Chinese herbs in the UK [J]., 1999, 354(9177): 481-482.
[5] Gillerot G, Jadoul M, Arlt V M,. Aristolochic acid nephropathy in a Chinese patient: Time to abandon the term “Chinese herbs nephropathy” ? [J]., 2001, 38(5): E26.
[6] 国家药品监督管理局. 关于取消关木通药用标准的通知[EB/OL]. [2003-4-1]. http://www. chinalawedu. com/falvfagui/fg22598/28332. shtml.
[7] 黄得栋, 晋玲, 林丽, 等. 木通及川木通流通使用情况调查分析 [J]. 中国中医药信息杂志, 2017, 24(3): 1-4.
[8] 万德光, 国锦琳. 川木通的本草考证及道地性考证 [J]. 时珍国医国药, 2007, 18(11): 2696.
[9] 李丽, 陈绪中, 姚小洪, 等. 三种木通属植物的地理分布与资源调查 [J]. 武汉植物学研究, 2010, 28(4): 497-506.
[10] 郑立红, 李淑莉. 三种木通的鉴别研究 [J]. 中国中医基础医学杂志, 2014, 20(10): 1410-1411.
[11] 张怀阳. 木通、关木通、川木通的应用鉴别 [J]. 中医临床研究, 2019, 11(4): 13-15.
[12] 宁宏. 中药饮片质量监管现状问题的分析 [J]. 继续医学教育, 2017, 31(7): 159-160.
[13] 郭林新. 三叶木通化学成分及生物活性研究 [D]. 西安: 陕西科技大学, 2017.
[14] 孙萍, 罗国安. LC-MS鉴定木通、川木通与关木通 [J]. 中药材, 2004, 27(12): 898-901.
[15] 陈士林, 姚辉, 韩建萍, 等. 中药材DNA条形码分子鉴定指导原则 [J]. 中国中药杂志, 2013, 38(2): 141-148.
[16] 陈士林. 中药DNA条形码分子鉴定 [M]. 北京: 人民卫生出版社, 2012: 6-7.
[17] Xing B P, Lin H S, Zhang Z L,. DNA barcoding for identification of fish species in the Taiwan Strait [J]., 2018, 13(6): e0198109.
[18] Chen S L, Yao H, Han J P,. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species [J]., 2010, 5(1): e8613.
[19] Schoch C L, Seifert K A, Huhndorf S,. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi [J]., 2012, 109(16): 6241-6246.
[20] 中国药典[S]. 四部. 2020: 236.
[21] Keller A, Schleicher T, Schultz J,. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation [J]., 2009, 430(1/2): 50-57.
[22] Kumar S, Stecher G, Li M,. MEGA X: Molecular evolutionary genetics analysis across computing platforms [J]., 2018, 35(6): 1547-1549.
[23] 明·李时珍. 本草纲目: 校点本 [M]. 2版. 北京: 人民卫生出版社, 2004: 1316-1319.
[24] 谢宗万. 通草与木通品种的本草考证 [J]. 中药通报, 1986, 11(5): 13-15.
[25] 清·吴其浚. 植物名实图考长编[M]. 新1版. 北京: 中华书局, 1963:461-462.
[26] 《全国中草药汇编》编写组. 全国中草药汇编(上册) [M]. 第2版. 北京: 人民卫生出版社, 1996: 663-664.
[27] 李祥, 王芸, 郭晓成, 等. 西安市鄠邑区三叶木通果实的化学成分 [J]. 贵州农业科学, 2019, 47(10): 101-104.
[28] 杨树忠. 八月瓜的营养价值与栽培技术 [J]. 基层农技推广, 2015, 3(8): 24.
[29] 国锦琳, 万德光, 唐远, 等. 川木通的资源分布与商品初步调查 [J]. 成都中医药大学学报, 2007, 30(1): 44-46.
[30] Shi L C, Chen H M, Jiang M,. CPGAVAS2, an integrated plastome sequence annotator and analyzer [J]., 2019, 47(W1): W65-W73.
[31] 中国药典[S]. 一部. 1963: 26.
[32] 中国药典[S]. 一部. 1977: 49.
[33] 中国药典[S]. 一部. 1985: 23.
[34] 中国药典[S]. 一部. 1990: 169.
[35] 中国药典[S]. 一部. 1995: 89.
[36] 中国药典[S]. 一部. 2000: 129.
[37] 张玉珠. 木通与川木通关木通的鉴别与应用 [J]. 实用中医内科杂志, 2009, 23(9): 87-88.
[38] Vanherweghem J L, Depierreux M, Tielemans C,. Rapidly progressive interstitial renal fibrosis in young women: Association with slimming regimen including Chinese herbs [J]., 1993, 341(8842): 387-391.
[39] Schmeiser H H, Bieler C A, Wiessler M,. Detection of DNA adducts formed by aristolochic acid in renal tissue from patients with Chinese herbs nephropathy [J]., 1996, 56(9): 2025-2028.
[40] 中国药典[S]. 一部. 2005: 126.
[41] Xin T Y, Su C, Lin Y L,. Precise species detection of traditional Chinese patent medicine by shotgun metagenomic sequencing [J]., 2018, 47: 40-47.
[42] Zhang G X, Liu J X, Gao M,. Tracing the edible and medicinal plantand its products in the marketplace yields sub species level distinction using DNA barcoding and DNA metabarcoding [J]., 2020, 11: 336.
[43] 石林春, 刘金欣, 魏妙洁, 等. 基于DNA metabarcoding技术的如意金黄散处方成分鉴定研究 [J]. 中国科学: 生命科学, 2018, 48(4): 490-497.
Molecular identification of commercially availableand its adulterants based on ITS2 sequence
MU Wei-shan1, XIE Hong-bo1, ZHAO Qing1, SHI Meng-meng1, HU Zhi-gang2, WEI Miao-jie3, LIU Jin-xin1, 3, SHI Lin-chun3
1. Hebei Key Laboratory of Research and Development of Chinese Medicine, Chengde Medical University, Chengde 067000, China 2. College of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430065, China 3. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
A DNA barcoding identification method based on internal transcribed spacer 2 (ITS2) sequences was established to analyze the species of commercially available Mutong ().A total of 45 samples from Hebei, Anhui, Guizhou provinces and other places were collected, including 18 samples of original plants samples and 27 samples of commercially available medicinal materials. Their ITS2 sequences have been obtained after DNA extraction, polymerase chain reaction (PCR) amplification and bi-directional sequencing. Species identification analysis were based on neighbor-joining (NJ) phylogenetic tree and single nucleotide polymorphisms (SNPs).The results of NJ phylogenetic tree constructed by the original plants ofand its adulterants showed that the authenticand its main adulterants gathered into independent branches. The authenticand its adulterants could be clearly distinguished by the NJ phylogenetic tree. Based on the NJ tree, the analysis of the species of 27 commercial samples showed that only four samples were, two samples were, and 21 samples were. The authenticity rate of commercially available medicinal materials was 14.8%.The DNA barcoding based on the ITS2 sequence can accurately distinguishand its adulterants. The varieties of commercially availableare more chaotic.
; commercial medicinal materials; ITS2; DNA barcoding; identification
R282.12
A
0253 - 2670(2022)07 - 2108 - 07
10.7501/j.issn.0253-2670.2022.07.021
2021-09-06
国家自然科学基金项目(81703659);河北省教育厅青年拔尖人才项目(BJ2016002);河北省高校重点学科建设项目(冀教高[2013] 4号);承德医学院重大项目科研专项(KY2020003)
穆威杉(1997—),女,硕士研究生,从事中药资源与鉴定相关研究。Tel: (0314)2290474 E-mail: muweishan1997@126.com
刘金欣,副教授,从事中药资源与鉴定相关研究。Tel: (0314)2290474 E-mail: liujx_23@163.com
石林春,副研究员,从事中药资源与鉴定相关研究。Tel: (010)57833194 E-mail: linchun_shi@163.com
[责任编辑 时圣明]
