利用体外发酵模型研究叶绿素对儿童肠道菌群的影响
2020-07-08李媛媛欧雅文
李媛媛 欧雅文 崔 羽 张 燕
(中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心 北京100083)
随着生活水平的提高,居民高脂肪、高蛋白饮食的摄入使肥胖、 高血脂等代谢疾病的发病率在全世界普遍上升[1]。 为了降低肥胖发生率,缓解这一健康问题,2016年美国农业部和中国营养学会分别修订了各自的膳食指南, 指南中均明确提出增加蔬菜的摄入量[2-3]。 叶绿素作为绿色蔬菜中含量最为丰富的色素,其决定了果蔬的品质特征,国内外研究发现其还具有降低胆固醇, 调节肠道功能,抗突变等生理功能[3]。近年来,随着深色蔬菜中花色苷、多酚等非营养物质研究的深入,摄入蔬菜后叶绿素的生物活性和营养价值引起研究人员的重视, 目前人们对叶绿素的生物活性作用的了解还十分有限[4]。
人体肠道中含有大量的与宿主共存的微生物,这些菌群共同构成了人体独特的肠道环境,个体的肠道菌群种类和丰度都不同[5]。 近年来,肠道菌群及其代谢产物对宿主的健康作用受到研究者们极大的关注。 大量研究表明胎儿出生时肠道没有细菌定植,出生7~10 d 开始需氧菌或兼性厌氧菌的先期定植和繁殖, 从此经历了肠道菌群从无到有,从简单到复杂的过程,出生至2 岁婴儿期是肠道菌群形成并达到平衡的最重要时期, 此期的菌群决定了机体日后免疫应答和代谢等[6]。前期研究发现, 叶绿素对乳酸链球菌的生长特性及代谢水平均有显著影响, 而乳酸菌作为人体肠道中的有益菌,在人体肠道中能发挥营养功能作用[9]。 婴儿刚出生后, 最初肠道菌群中以乳酸菌属为优势菌,随着婴儿的成长,肠道菌群中乳酸菌属数量反而下降[4],这一结果值得深入研究。
基于此,本试验以叶绿素为对象,研究其对不同年龄儿童(2 岁和5 岁)肠道菌群的影响,探究叶绿素是否会影响儿童肠道菌群中乳酸菌属的丰度等, 帮助人们了解叶绿素的早期摄入与健康的关系, 从营养角度为绿色蔬菜的摄入提供合理的理论依据。
1 材料与方法
1.1 材料和试剂
新鲜菠菜(Spinacia oleracea L.),中国农业大学家属区农贸市场;2 岁健康儿童1 名(重复取粪便样本5 次);5 岁健康儿童1 名 (重复取粪便样本5 次);色谱级甲醇、三氯甲烷、乙腈、正己烷,美国Thermo fisher 公司; 浓硫酸、95%无水乙醇、厌氧肉汤培养基、L-半胱氨酸盐酸盐、刃天青等均为分析纯试剂,试验中所用的水均为超纯水。
1.2 试验设备与仪器
CR21GⅢ型高速冷冻离心机,日本日立公司;DHP-9082 恒温培养箱,上海一恒科技有限公司;JYDZ-31B 九阳打浆机, 九阳股份有限公司;Acquit UPLC 液相色谱仪 (UPLC), 美国Agilent 公司;T6 新世纪旋转蒸发仪, 北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 叶绿素制备 参照Rivera-Chávez 等[7]的方法提取新鲜菠菜中的叶绿素。 将洗净晾干的菠菜叶去梗,放搅拌机中,并倒入适量乙醇(料液比1∶3),搅拌成浆。4 ℃,8 000 r/min 离心6 min,所得上清液在36 ℃水浴条件下旋转真空蒸发浓缩,获得叶绿素浓浆,随后测定叶绿素浓度。用移液枪吸取1 mL 叶绿素浓缩液, 梯度稀释100 倍后分别在645,663 nm 处测吸光度值OD, 以体积分数80%的丙酮为对照。 叶绿素水平计算公式如下:
Ca=12.71A663-2.59A645
Cb=22.88A645-4.67A663
C=Ca+Cb=8.04A663+20.29A645
本试验中, 得到叶绿素溶液平均质量浓度为7 mg/mL。
1.3.2 体外粪便发酵实验 参照Parkar 等[8]的方法,对采集到的受试者的粪便样本发酵24 h,体外模拟肠道菌群的变化。试验前,将所有缓冲液置于N2环境下24 h。向pH 6.8 的厌氧肉汤培养基中添加0.05%过滤消毒的L-半胱氨酸盐酸盐和0.00005%的刃天青的发酵培养液分装于厌氧瓶中,充氮密封,灭菌。 而后向厌氧培养管中用注射器分别加入叶绿素样品10 mL 以及10%粪便悬液10 mL,混合振荡,厌氧环境37 ℃摇床(70 r/min)总计培养24 h, 取发酵液时间点设定为0,4,8,12,16,20,24 h。
1.3.3 肠道菌群丰度及多样性测定 分别取不同处理的粪便样本, 采用MoBio 公司PowerSoil-htp 96 Well Soil DNA Isolation Kit 试剂盒对样本的基因组DNA 进行提取, 具体步骤按说明书操作,所提取的DNA 于-20 ℃保存备用。 使用Promega公司的GoTaqRHot Start Colorless Master Mix 进行PCR 扩增, 引物为16S V4 区特异引物515 F(5′-GTGCCAGCMGCCGCGGTAA-3′)-806R(5′-GGACTACHVGGGTWTCTAAT-3′), 产物使用质量分数为2%的琼脂糖凝胶进行电泳检测,Qiagen公司的QIAquickRPCR Purification Kit 试剂盒纯化回收产物, 并使用Pico Green 荧光定量以及Agilent 2200 TapeStation 电泳工作平台检测,合格后使用Illumina 公司的Miseq 设备测序进行上机测序及菌群数据相关分析。
1.3.4 短链脂肪酸及有机酸HPLC 法测定 采用高效液相色谱法(High Performance Liquid Chromatography, HPLC)测定有机酸、短链脂肪酸等乳酸菌代谢产物的变化趋势[9]。 具体试验方法如下:分别配制乙酸、丙酸、丁酸、正戊酸、异戊酸、乳酸等标准品的系列浓度梯度, 用0.22 μm 的水相滤膜进行过滤,滤液用高效液相色谱法测定,定量分析后绘制标准曲线, 用于后续有机酸和短链脂肪酸含量的计算。 HPLC 条件为:用超纯水作为流动相A, 在13 mm 水系滤膜下过滤后的0.005 mol/L H2SO4作为流动相B, 等梯度洗脱, 流速0.5 mL/min,柱温65 ℃,进样量10 μL,检测波长210 nm。
1.3.5 数据统计与分析 每个试验重复至少3次,数据统计分析采用Statistix 8.1(分析软件,St Paul, MN)软件包中Linear Models 程序进行,差异显著性(P<0.05)分析使用Tukey HSD 程序,采用Origin 8.1(Microcal Software,Inc.,Northampton USA)制图软件作图。
2 结果与讨论
2.1 叶绿素对肠道菌群多样性的影响
菌群多样性分析采用香农指数,指数值越大,代表群落多样性程度越高。Clarke 等[10]研究表明菌群多样性的减少与健康问题相关, 将各组间及各个样本的多样性指数进行比较,如图1 所示。 图1(A-24 h)中,分析2 岁儿童肠道菌群多样性的变化发现,添加叶绿素使菌群多样性显著降低,发酵24 h 多样性指数由2.6~3.2 降至2.4~2.7, 平均多样性降低14%。 同样在图1(B-24 h)中显示,5 岁儿童粪便发酵24 h 后,添加叶绿素也使菌群多样性由2.5~2.8 降至1.8~2.4,平均多样性降低19%。可见, 叶绿素显著降低肠道菌群多样性。 Sommer等[11]研究发现菌群多样性会影响宿主的健康发展,多样性越高可能会产生更多的积极作用。但本试验中对前20 个优势菌属进行分析,发现降低的菌属主要包括拟杆菌属(Bacteroides)、 双岐菌属(Bifidobacterium)、 未分类的肠杆菌(Unclassified Bacillales)、 未分类的瘤胃科菌属(Unclassified Ruminococcaceae)、霍乱弧菌(Dialister),除拟杆菌属(Bacteroides)、双岐菌属(Bifidobacterium)外,其它有所下降的菌属均对人体有不利的影响, 因此本试验结果中, 叶绿素降低了儿童肠道菌群多样性是否对儿童健康有影响,仍需要进一步研究。
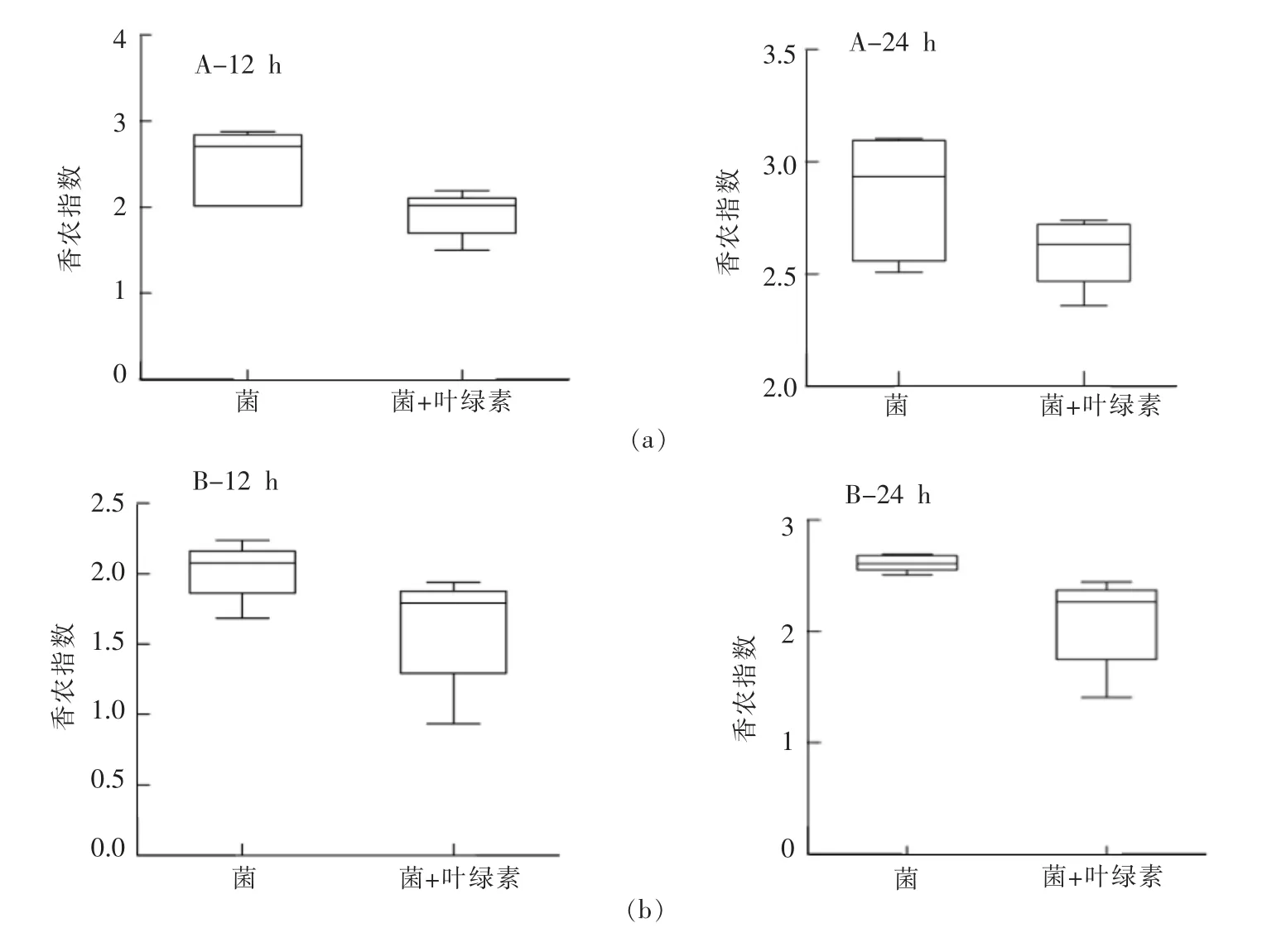
图1 香农指数(Shannon index)变化Fig.1 Changes of Shannon index
2.2 叶绿素对肠道菌群相对丰度的影响
2.2.1 群落组成分析 肠道菌群门和属的平均值如图2 所示, 通过对测序样品的序列进行比对分析,人体肠道菌群序列主要分属于4 个菌门,包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形杆菌门 (Proteobacteria)和放线菌门(Actinobacteria)。 剩余的序列分别包括黏胶球形菌门(Lentisphaerae)、梭杆菌门(Fusobacteria)、螺旋菌门(Spirochaetae)、软壁菌门(Tenericutes)和疣微杆菌门(Verrucomicrobia), 另外还包括未分类的细菌。
在属(genus)的水平上,可以看出,人体肠道中含量较多的菌属包括变形菌门中的埃希氏-志贺菌属(Escherichia_Shigella)、 普雷沃菌属(Prevotella)、小类杆菌(Dialister)、肠球菌属(Enterococcus)、 肠杆菌属(unclassified_Enterobacteriaceae),拟杆菌门中的拟杆菌属(Bacteroides),放线菌门中的双歧杆菌属(Bifidobacterium)、柯林斯菌(Collinsella)。 下面对有差异的菌属进行分析。
2.2.2 属水平的差异分析 双歧杆菌属相对丰度变化如图3a 所示,2 岁儿童样本中,添加叶绿素显著降低了双歧杆菌属的丰度(P<0.05),发酵12 h时,由4.7%下降至2.8%,约下降39%。 与2 岁儿童样本不同,5 岁儿童样本中双歧杆菌属丰度无显著性差异 (P>0.05), 发酵12 h 时微量上升。Huang 等[13]研究发现双歧杆菌属具有较高的营养功能,如快速降解乳糖、产生乳酸和短链脂肪酸、辅助消化吸收、 通过菌膜屏障及产生双歧杆菌素抑制多种致病菌等, 在母乳喂养的0~1 岁儿童肠道内丰度较高。 在本试验中推测两岁儿童样本中双歧杆菌属丰度的降低可能与样本年龄及肠道菌群稳定性相关, 因为2 岁儿童的肠道菌群结构此时为饮食方式影响阶段, 叶绿素的摄入可能对2岁儿童菌属的影响较大[6]。 此外,Krautkramer 等[12]研究发现双歧杆菌属作为人体肠道内的益生菌,在人体肠道定植较难,且受环境、饮食等因素影响较大,因此,叶绿素的摄入可能造成2 岁儿童双歧杆菌属丰度的降低, 而5 岁儿童此时的肠道菌群已经趋于稳定, 因此叶绿素摄入对5 岁儿童肠道菌群中的双歧杆菌属丰度影响较小。 值得注意的是双歧杆菌属丰度的降低是否对2 岁儿童的健康产生影响,目前尚不可知,进一步的研究仍需进行。
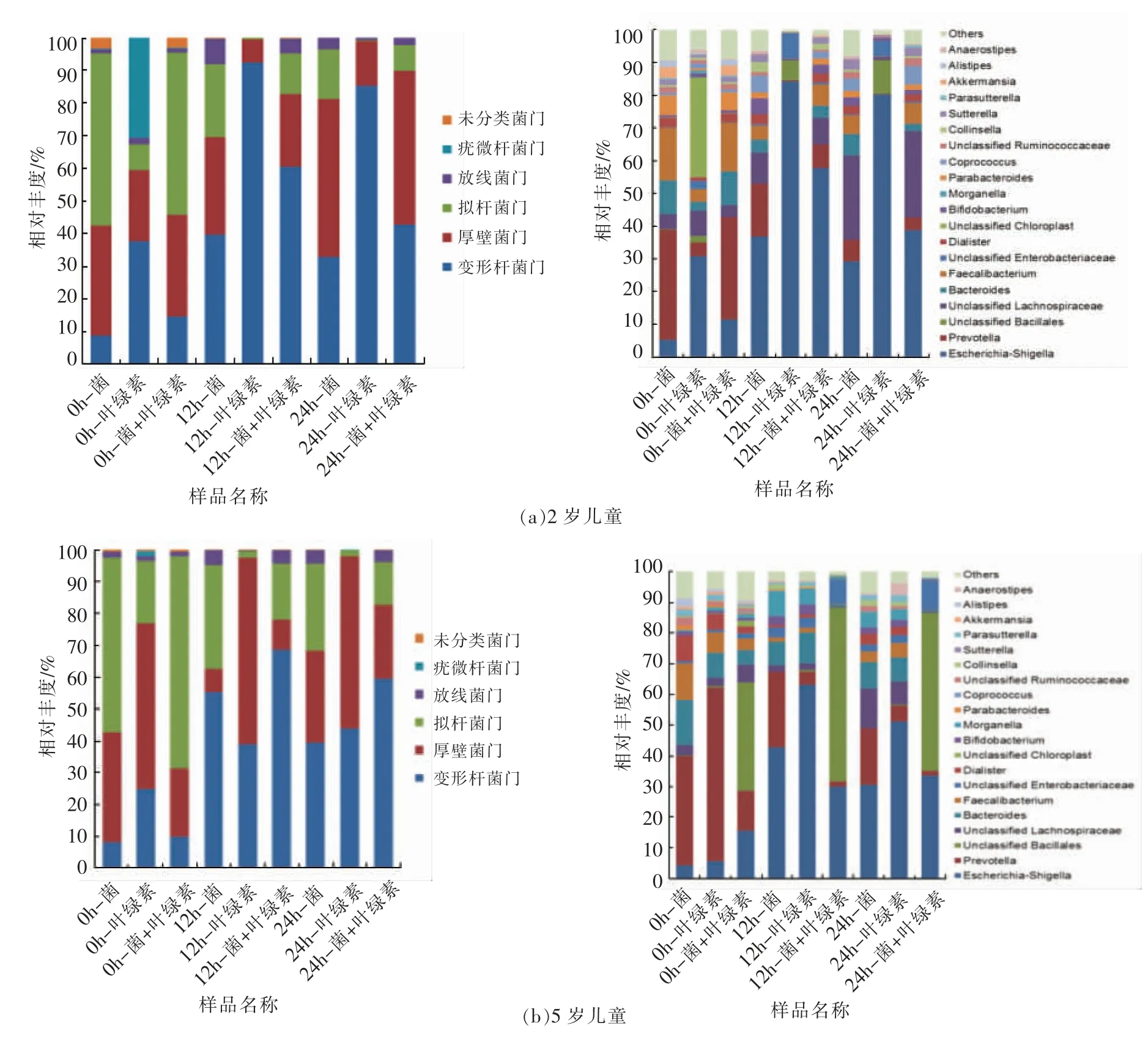
图2 肠道菌群门和属的平均值Fig.2 The average value of phylum and genus of gut microbiota
柯林斯菌是放线菌门中的主导菌, 其相对丰度变化如图3b 所示,叶绿素使儿童肠道菌群中柯林斯菌属的相对丰度显著下降(P<0.05), 其中2岁儿童12 h 样本中柯林斯菌属相对丰度由3.1%下降至1.9%, 下降率约36%;5 岁儿童12 h 样本中柯林斯菌属相对丰度由1.7%下降至0.4%,下降率约68%。 Rosenbaum 等[14]研究发现柯林斯菌属的丰度与促炎细胞因子IL-17A 水平呈正相关,柯林斯菌属的相对丰度越高,促炎因子IL-17A 分泌水平越高。 IL-17A 能通过诱导Th17 细胞产生分泌型抗体IgA, 进而对免疫系统起调节作用。 Liu等[15]研究发现在动脉粥样硬化病人粪便菌群中柯林斯菌属数量会上升, 且与高密度脂蛋白水平呈负相关,而类风湿性关节炎病人、溃疡性结肠炎病人肠道中柯林斯菌属丰度也发生改变, 因此结合本试验结果推测叶绿素可能通过降低柯林斯菌属的相对丰度实现对人体的健康作用。
叶绿素对乳酸菌属丰度的影响如图3c 所示。发酵12 h 时儿童样本肠道菌群中乳酸菌属丰度均有所上升, 其中2 岁儿童粪便中乳酸菌属的丰度增加更显著(P<0.05),这与实验室前期研究叶绿素对乳酸链球菌生长特性及代谢产物的影响结果一致,和对照组相比,叶绿素显著增加乳酸链球菌代谢产物水平, 证明了叶绿素具有一定的生物活性作用。 Terayama 等[16]研究发现乳酸菌属在宿主肠道中属于有益菌,对宿主有解毒、降血脂抗癌等多种健康作用。 此外,张海均等[17]研究发现大鼠在饮用亚硝酸盐含量较高的泡菜水时, 同时摄入石榴皮中的多酚提取物, 发现多酚提取物能通过提高大鼠肠道菌群中乳酸菌数量, 促进亚硝酸盐的降解达到解毒目的。因此,本试验结果显示叶绿素可能与多酚类非营养物质一样, 能促进乳酸菌属丰度的上升,促进对宿主的解毒作用。

图3 儿童肠道中双歧杆菌属、柯林斯菌属、乳酸菌属相对丰度 (12 h)Fig.3 The relative abundance of Bifidobacterium, Collinsella, Lactobaillus in children’s gut (12 hours)
2.3 叶绿素对肠道菌群代谢物的影响
图4~图6 为发酵24 h 时叶绿素对儿童肠道菌群代谢物水平的影响,主要探讨乳酸、乙酸、丙酸的变化趋势。 如图4 所示,添加叶绿素促进了5岁儿童肠道菌群代谢物乳酸水平显著上升(P<0.05),由发酵24 h 的42 μg/mL 升至101 μg/mL,2岁儿童样本中乳酸水平同5 岁儿童样本呈现相同的变化趋势。 Fung 等[18]综述了肠道中的乳酸能给肠道环境提供稳定的酸性环境, 抑制丙酮酸转化为乳酸, 促进丙酮酸参与三羧酸循环, 进行糖酵解,促进宿主的身体代谢。因此结合上述乳酸菌属变化趋势可推测本研究中叶绿素可能通过促进肠道中乳酸菌数量的生长, 促进不同年龄儿童肠道菌群代谢物乳酸水平上升。
发酵24 h 叶绿素对肠道菌群产乙酸水平的影响如图5 所示。 由图5 可知添加叶绿素促进5岁儿童肠道菌群代谢物乙酸水平显著上升, 发酵24 h 由0.23 μg/mL 升至0.3 μg/mL(P<0.05),同样的, 添加叶绿素也显著促进2 岁儿童样本中乙酸水平的上升(P<0.05)。
发酵24 h 叶绿素对肠道菌群产丙酸水平的影响如图6 所示。添加叶绿素后发酵24 h 时,5 岁儿童肠道菌群代谢物丙酸水平由0.34 μg/mL 上升至0.39 μg/mL(P<0.05),而2 岁儿童样本中丙酸水平微量下降,可能由于2 岁儿童年龄较小,且个体的肠道菌群差异较大, 因此代谢物种类和水平均有差异。儿童肠道菌群代谢物乙酸、丙酸水平的上升可能是由于叶绿素促进产乙酸、 丙酸相关的菌群的生长,或促进菌群对乙酸、丙酸的分泌,但仍需进一步试验证明叶绿素与菌群的关系。 Fung等[18]研究发现短链脂肪酸微量的增加也会对人体产生积极的健康作用, 如丁酸盐在mmoL 浓度下就能发挥抑制肿瘤细胞增值、分化,并诱导细胞凋亡的作用。 Voltolini 等[19]研究发现乙酸、丙酸均能促进宿主的健康发展, 包括保护宿主肠道上皮细胞完整性,提供能量以及抗癌作用。 因此,本试验结果发现叶绿素能促进乙酸、 丙酸水平的微量上升, 是进一步理解叶绿素生物活性实现的可能途径。

图4 乳酸水平的变化Fig.4 Change of lactic acid
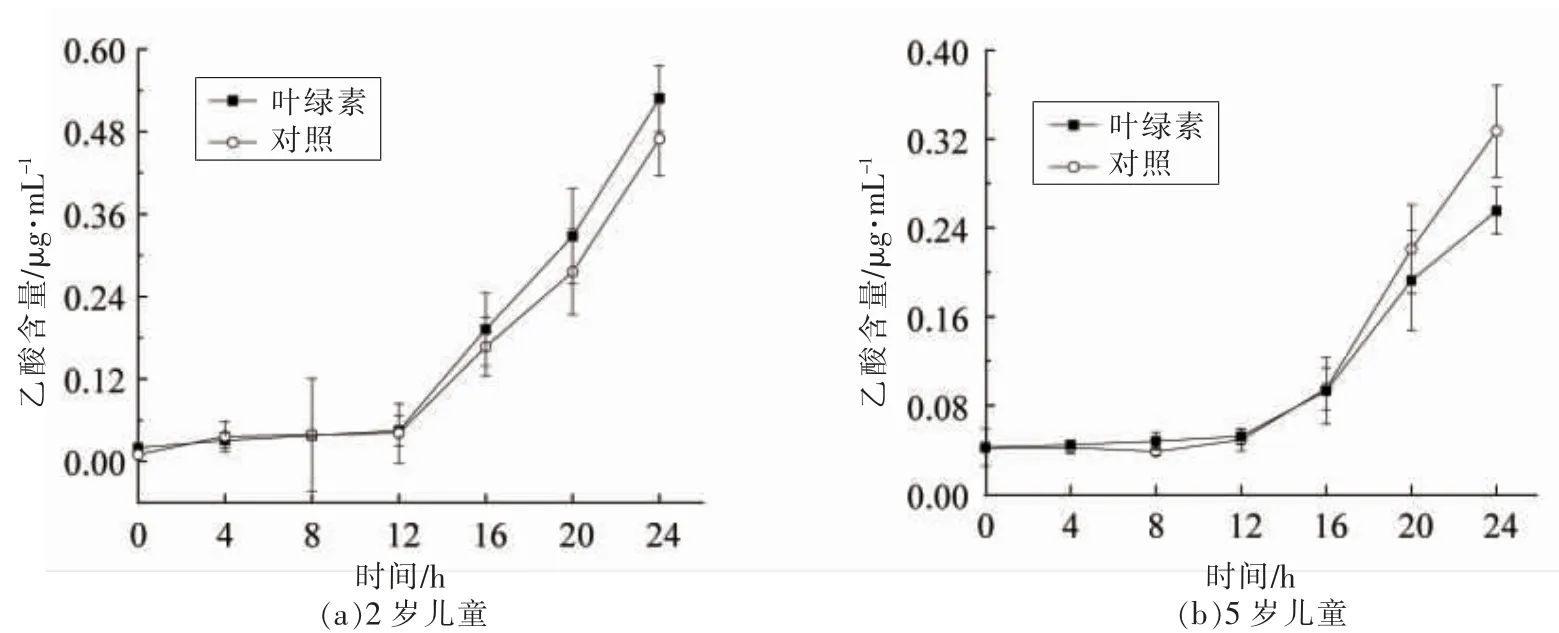
图5 乙酸水平的变化Fig.5 Change of acetic acid
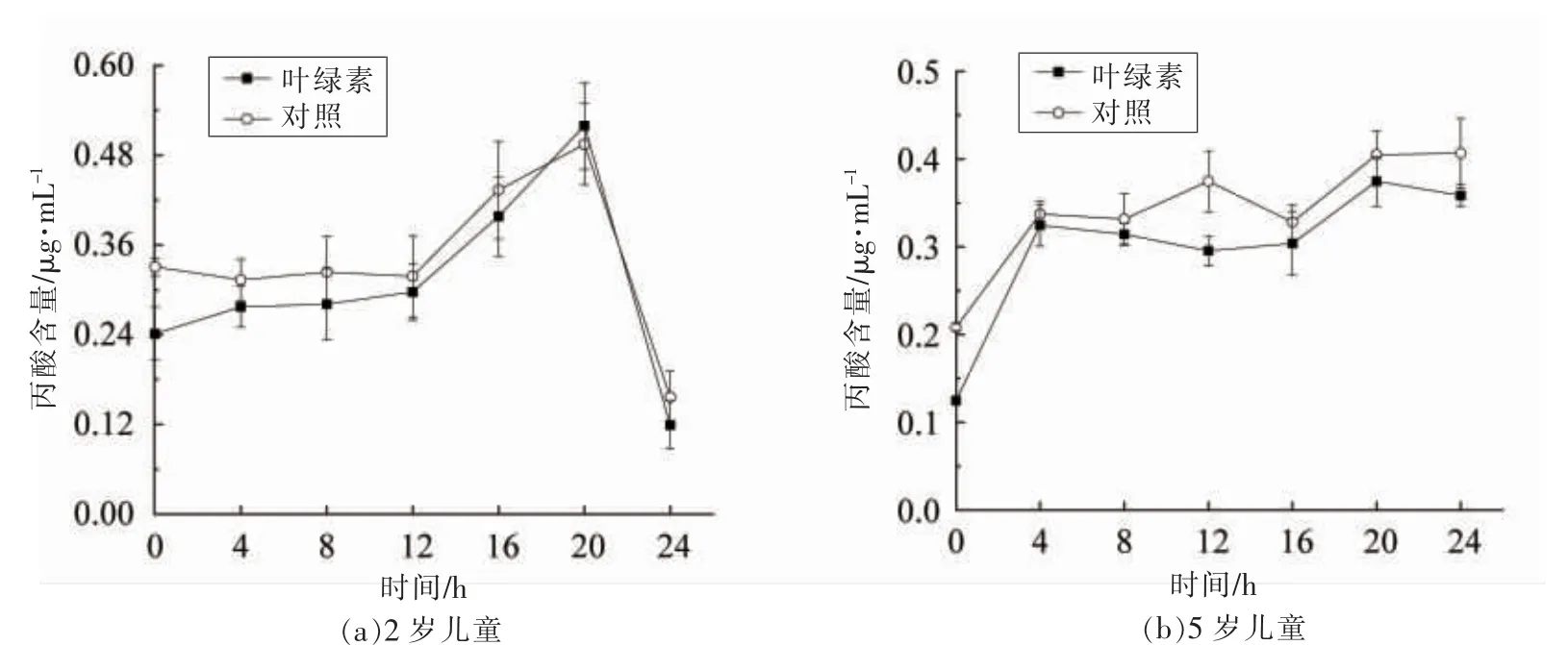
图6 丙酸水平的变化Fig.6 Change of propionic acid
3 结论
本研究通过体外分别对不同年龄段儿童粪便进行体外发酵试验, 对肠道菌群进行16S rDNA测序,对菌群丰度和多样性进行分析,同时测定菌群代谢物水平变化, 探究叶绿素对肠道菌群的影响,结论如下:叶绿素的添加降低了儿童肠道菌群多样性, 由于儿童样本在年龄、 个体方面存在差异,叶绿素对其作用效果也存在差异。儿童粪便中微生物以放线菌门、变形菌门、厚壁菌门和拟杆菌门为主。属水平上添加叶绿素促进柯林斯菌、双岐菌属相对丰度的下降,乳酸菌属相对丰度上升;且比较5 岁儿童样本,在2 岁儿童样本中,食源性物质的摄入对双岐菌属、 乳酸菌属这类人体肠道不易定植的菌属影响较大,此外,摄入叶绿素有助于增加不同年龄儿童肠道菌群代谢物乳酸、 乙酸的水平。
