体外模拟胃、肠消化萝卜苗的表观抗氧化性及其综合评价
2020-07-08李茹郝睿朱毅
李 茹 郝 睿 朱 毅
(中国农业大学食品科学与营养工程学院 北京100083)
植物性饮食有助于降低癌症、心血管疾病、糖尿病和其它与衰老有关的疾病的风险[1]。这些功能主要是由于它们的生物活性成分,如多酚、维生素C 和其它内源性代谢物的抗氧化作用[2]。 此外,一些抗氧化酶,如超氧化物歧化酶(SOD),有助于增强抗氧化剂的潜在益处。 果蔬成熟后,经历采摘-包装-运输-贮藏-加工-食用等环节,除了“从农场到餐桌”的各阶段外,影响果蔬的功能品质还包括胃、肠消化吸收环节。在此过程中果蔬多以不可分割的整体或混合匀浆存在, 而非以单一活性成分的纯化物质形式存在,其中的营养物质状态、活性等变化是一个整体的动态互作过程。
用有机溶剂提取的抗氧化活性物质可能存在一些正常消化过程中不能释放的物质, 这类提取物质不一定适宜细胞吸收,不能发挥保健作用,常常被高估了食物的保健作用。 有机溶剂提取过程不同于消化过程,在消化过程中,通过酶解和化学环境作用,物质从结合状态释放,在这个过程中有可能会发生物质的转化和降解。总之,有机溶剂水溶液提取法所得抗氧化物质成分和含量与消化所得不尽相同, 因此有必要在评价食物的保健作用时考虑消化过程[3-8]。
不同的天然抗氧化剂在相同的外部条件下可能会有不同程度的改变, 例如短时间的蒸制会因热降解而减少十字花科蔬菜中大部分酚类和维生素,部分芥子油苷得到改善[9]。 身体在摄取生理活性物质时,必须在食物中附带其它物质,如淀粉、蛋白质、脂肪和其它生理活性物质。这些物质在消化吸收过程中相互作用。 据报道,几种多酚,特别是类黄酮抑制α-淀粉酶和α-葡糖苷酶(用于消化淀粉的酶)[10]以及共同施用类黄酮与富含碳水化合物的食物, 通过其对肠内微生物恶化的保护作用来增强类黄酮吸收, 通过发酵释放结合的类黄酮[11]。 作者认为一定的处理对蔬菜生理活性物质的影响应同时考虑该物质中所有的生理活性物质。
萝卜芽苗菜是具有抗氧化作用的 “活体蔬菜”。 作者不采取传统的有机试剂提取、纯化手段来得到单一活性物质, 而是模拟实际情况下萝卜苗以整体形式摄入, 以磷酸盐缓冲溶液提取总活性物质。以体外模拟胃、肠消化和吸收的手段探究人体胃、肠道对萝卜苗抗氧化性的影响。根据萝卜苗的柔嫩多汁的特性及其主要营养物质的保留率等因素来设置贮藏和蒸制的条件, 以不同角度的体外抗氧化试验及综合评价方法来表征萝卜苗的总抗氧化能力, 反映萝卜苗抗氧化功能品质的变化。
1 材料与方法
1.1 萝卜苗培育及处理
挑选颗粒饱满、无霉变的盛丰萝卜种子(北京京研盛丰种苗研究所), 将萝卜种子清洗干净,蒸馏水浸泡5 h,浸种后再掏洗种子2~3 遍。 浸泡后的种子均匀播撒在30 cm× 20 cm 育苗盘内,育苗盘内铺有4 层纱布, 均匀铺满种子 (每盘约200粒),25 ℃避光催芽3 d,早晚喷洒适量去离子水。3天后恢复光照(光照强度100 mmol/m2/s,光照时间16 h/8 h(昼/夜),温度25 ℃,相对湿度70%~80%,7 d 得到成品萝卜苗[12]。
贮藏处理: 新鲜采摘的萝卜苗分装入自封袋内,分别置于(25±1)℃或(4±1)℃的恒温箱中,放置0,6,12 和24 h,处理完毕后在液氮保护下磨粉备用。
蒸制处理: 盛有足量去离子水的蒸锅置于电磁炉上, 水沸后分别将新鲜采摘的萝卜苗置于锡箔纸覆盖的篦子上,隔水蒸制0,5,15,30,60,120,300 s,处理完毕后在液氮保护下磨粉备用。
1.2 体外模拟消化吸收
1)模拟唾液 2.38 g Na2HPO4,0.19 g KH2PO4和8 g NaCl 溶解至1 L 去离子水中, 调节pH 至6.75, 加 入α-淀 粉 酶12.5 mg (E.C. 3.2.1.1,A3176-500KU,16 U/mg 固体,Sigma)获得200 U/mL 酶活。
2)模拟胃液 添加胃蛋白酶A(EC3.4.23.1,P7012-250 MG,3641 U/mg 蛋白,87%蛋白含量,Sigma)(来自猪胃黏膜)至0.03 mol/L NaCl,获得300 U/mL 的酶活,调节pH 至1.2。
3)模拟肠液 0.05 g 胰液素(等于4 倍USP,P1750-25G,Sigma)和0.3 g 胆汁提取物(B8631-100 g,Sigma)溶解至35 mL 的0.1 mol/L NaHCO3。
4)终液 120 mmol/L NaCl 和5 mmol/L KCl。
5)PBS 样品 样品粉末取2 g 置于50 mL 离心管中,加20 mL PBS(pH=7.4),室温振荡1 h,3 000 g 室温离心15 min,取上清,最终质量浓度为0.1 g/mL(mf)。
6)GD 样品(消化)5 g 样品粉末在5 mL 模拟唾液中均质后,在37 ℃下振荡10 min;然后,样品用HCl (5 mmol/L)调节pH 至1.2, 悬浮在15 mL 模拟胃液中,在37 ℃下振荡120 min;然后,样品用0.1 mol/L NaHCO3调节至pH=6, 悬浮在15 mL 模拟肠液中, 用1 mol/L NaOH 调节pH=7,再加入5 mL 终液,体外消化120 min。 最终含量为0.1 g/mL(mf)[13]。
7)IA 样品(吸收)将模拟消化混合物置于透析袋中(D6066-25EA,Sigma-Aldrich),透析袋置于含有50 mL PBS 的锥形瓶中, 锥形瓶置于旋转振荡器上振荡 (2×2 h,37 ℃),PBS 和最终经过透析膜的物质作为原始材料经过消化后由肠道吸收的物质。 结果以原始材料每g 鲜重计,即0.1 g/mL(mf)[14]。
1.3 抗氧化功能测定
1.3.1 亚铁还原能力(Ferric reducing antioxidant power,FRAP)试验 参照南京建成总抗氧化能力(T-AOC)检测试剂盒(FRAP 法),结果以U/mL 表示。
1.3.2 DPPH 自由基清除(DPPH radical scavenging assay,DPPH)试验 0.5 mL DPPH 的乙醇溶液(0.1 mmol/L)中加入0.5 mL 样品溶液,漩涡振荡混匀,室温放置30 min,在518 nm 处测定吸光度。
复色紫薇优化施肥模式研究…………………………………………………………………………… 王 昊,刘 博,蔡卫佳(110)
清除率=[A0-(A1-A2)]/A0×100%
式中:A0——DPPH 溶液加入无水乙醇的吸光度;A1——DPPH 溶液加入样品溶液的吸光度;A2——样品溶液加入无水乙醇的吸光度; 公式中引入A2是为了消除样品溶液中本身颜色对试验测定的干扰[15]。
1.3.3 还原能力(Reducing power,RP)试验 0.1 mL 样品溶液与0.25 mL 磷酸缓冲液(pH 6.6)和0.25 mL 1%的铁氰化钾混合,50 ℃反应20 min后,加入0.25 mL 10%三氯乙酸,有沉淀生成,1 000 r/min 离心10 min, 取0.25 mL 上清液与0.25 mL 去离子水和0.05 mL 0.1%氯化铁溶液混合,静置10 min,紫外分光光度计700 nm 测定吸光度值,吸光值越高还原能力越强[16],以各样品对应的提取试剂为空白。 以还原能力率表示结果:
还原能力率=(1-A空白/A样品)×100%
1.3.4 抗超氧阴离子能力(Anti-superoxide anion power,ASA)试验 参照南京建成抑制与产生超氧阴离子自由基测定试剂盒,结果以U/mL 表示。
1.3.5 超氧化物歧化酶活性 (Superoxide dismutase,SOD)试验 参照南京建成总超氧化物歧化酶(T-SOD)测试盒,结果以U/mL 表示。
1.4 抗氧化能力综合评价-TOPSIS 法
1.5 数据处理
采用SPSS 20.0 软件进行数据分析, 结果均表示为平均值±标准偏差,应用Origin 9.0 进行图形绘制,每组试验重复3 次。不同小写字母表示差异显著(P<0.05)。
2 结果与分析
短时贮藏和蒸制后的萝卜苗经过模拟消化吸收前、 后的亚铁还原能力测定结果如图1 所示。FRAP 法原理为Fe3+-三吡啶三吖嗪可被样品中还原物质还原为二价铁形式,呈现出明显的蓝色[19],它反映的不是样品针对某一种自由基的清除活性,而是样品的总还原能力。萝卜苗的PBS 提取物的FRAP 能力在24 h 贮藏内基本上都显著下降;GD 提取物的FRAP 活性在0~6 h 之间的贮藏急剧上升(4.12 倍和4.86 倍),但在6~24 h 之间基本保持稳定;IA 提取物的FRAP 活性在(25±1)℃贮藏12~24 h 之间显著上升,0~12 h 之间无显著变化, 而在(4±1)℃贮藏0~6 h 之间显著下降。 而PBS 提取物的FRAP 能力在蒸制30 s 时上升了8.76%,在蒸制60 s 时又下降了60.05%,在蒸制5 min 后达到FRAP 能力的最高点 (37.52 U/mL);GD 提取物的FRAP 能力在蒸制0~60 s 之间显著上升并达到最高点(32.04 U/mL),在60~300 s 之间缓慢下降;IA 提取物的FRAP 能力在蒸制5 s时降低至最小, 在30 s 时达到最高, 在30~300 s之间一直处于显著下降趋势。
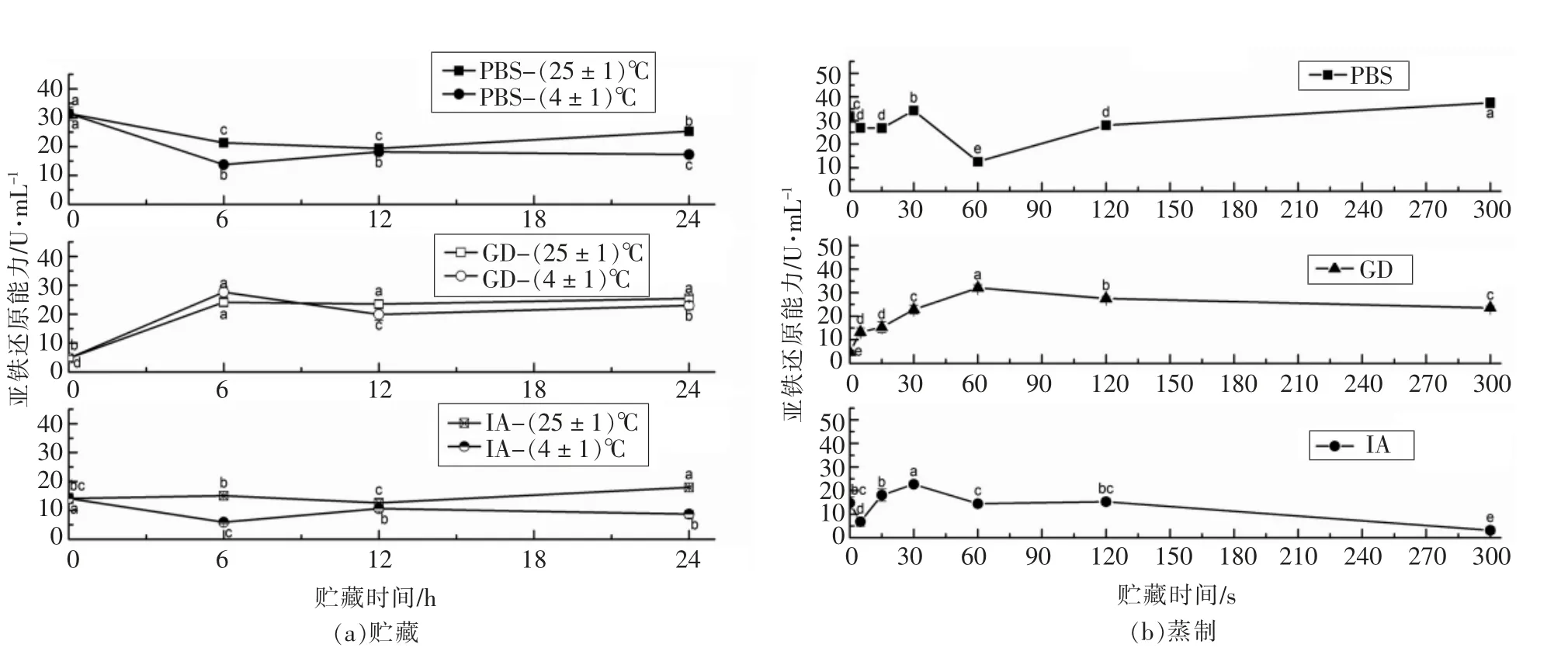
图1 萝卜苗中的FRAP 在贮藏/蒸制+模拟消化吸收后的变化Fig.1 Changes of FRAP in radish sprouts after storage/steaming + simulated digestion and absorption
短时贮藏和蒸制后的萝卜苗经过模拟消化吸收前后的DPPH 自由基清除能力测定结果如图2所示。 DPPH 自由基清除法是根据DPPH 自由基有单电子,其醇溶液呈紫色的特性。当有自由基清除剂存在时, 由于与其单电子配对而使其吸收逐渐消失,导致溶液颜色变浅,其变化程度与自由基清除程度呈线性关系[20]。 故该法可以用来表征某种物质对自由基的清除能力。通常用清除率表示,清除率越大, 表明该物质对自由基的清除能力越强。 萝卜苗的PBS 提取物的DPPH 自由基清除能力在常温和低温贮藏之间无显著区别, 且在贮藏期间随时间变化也不显著;GD 提取物的DPPH 自由基清除能力在24 h 的常温贮藏期间显著高于在低温贮藏下的DPPH 自由基清除能力, 常温贮藏6~12 h 达到最高(46.89%~47.19%),而低温贮藏在0~24 h 之间基本无明显变化;萝卜苗的PBS提取物DPPH 自由基清除能力在蒸制2~5 min 时显著高于对照, 而GD 提取物的DPPH 自由基清除能力在蒸制期间基本都显著高于对照, 且二者都在蒸制5 min 时达到最大,IA 提取物的DPPH自由基清除能力在蒸制期间处于先上升再下降的趋势,在蒸制120 s 时为拐点。从结果中可以看出,体外模拟消化后的DPPH 自由基清除能力在贮藏和蒸制期间的各个时间点上基本都显著小于消化前对应时间点的DPPH 自由基清除能力, 而蒸制的IA 提取物在30~300 s 之间都大于PBS 和GD提取物的对应点的能力。
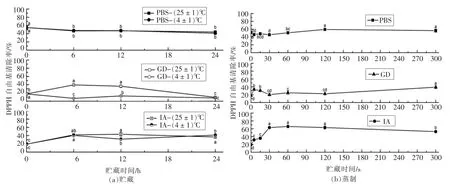
图2 萝卜苗中的DPPH 在贮藏/蒸制+模拟消化吸收后的变化Fig.2 Changes of DPPH in radish sprouts after storage/steaming + simulated digestion and absorption
短时贮藏和蒸制后的萝卜苗经过模拟消化吸收前后的还原能力测定结果如图3 所示。 还原能力法也称铁氰化钾还原法,其原理为:K3Fe(CN)6+样品→K4Fe(CN)6+样品氧化物,K4Fe(CN)6+Fe3+→Fe4[Fe(CN)6]3。抗氧化剂(还原剂)是通过自身的还原作用,给出电子而清除自由基的,还原能力越强,抗氧化性越强。因此可通过测定还原力来说明抗氧化活性的强弱[16]。 萝卜苗的PBS、GD 和IA 提取物的还原能力在常温和低温贮藏之间基本无显著区别,只是GD 提取物的还原能力在低温贮藏6 h 时显著高于常温的还原能力,同时,各个提取物的还原能力在0~24 h 的贮藏期间也基本无显著变化,而且,各个提取物的还原能力在对应的时间和温度上呈现以下趋势,PBS (84%~90%)>IA(74%~79%)>GD (57%~72%);PBS 提取物的还原能力在蒸制0~5 min 之间变化不大,在5 min 时达到最低, 而GD 提取物的还原能力则是在0~15s的蒸制间急剧下降至最低(46.95%),IA 提取物的还原能力在5 min 之间变化也不大, 但是和贮藏期间的还原能力变化类似的是, 各个提取物的还原能力在对应的时间和温度上呈现以下趋势,PBS(81%~90%)>IA(71%~79%)>GD(46%~72%)。
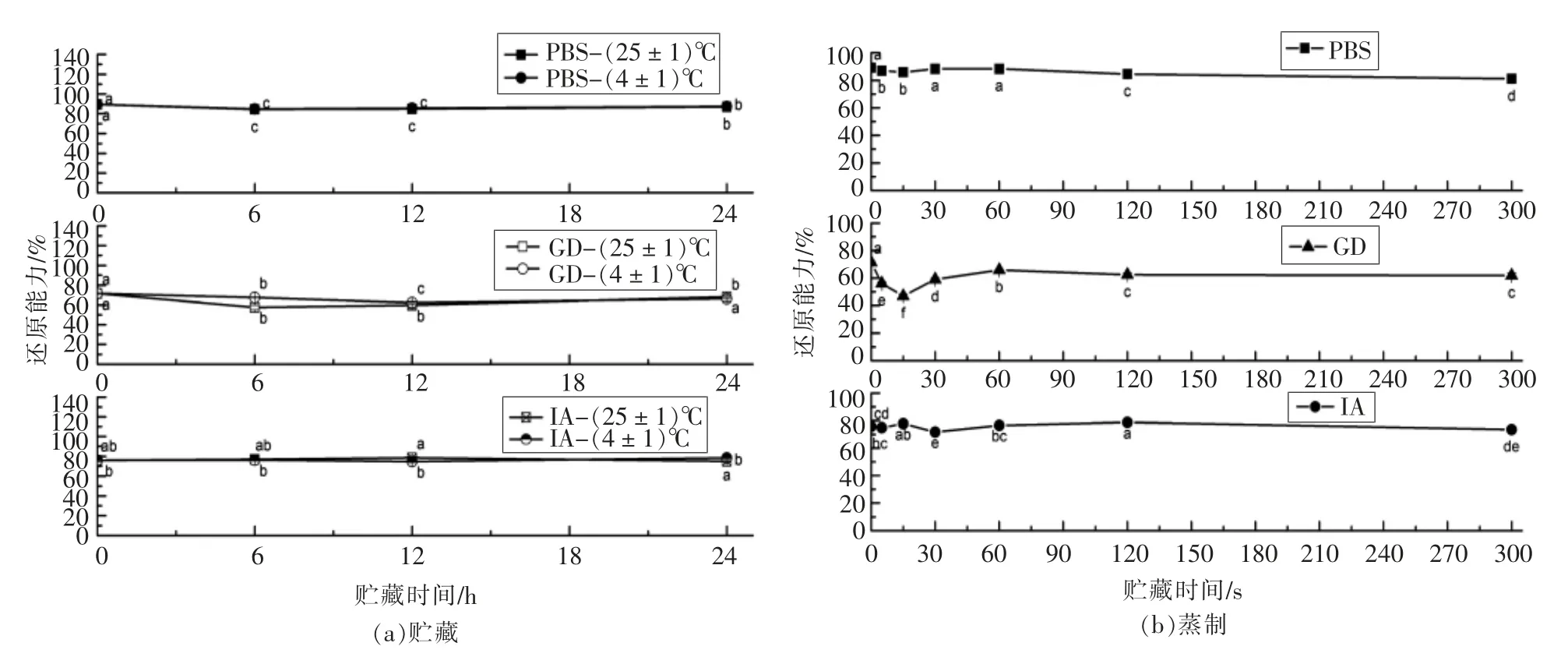
图3 萝卜苗中的RP 在贮藏/蒸制+模拟消化吸收后的变化Fig.3 Changes of RP in radish sprouts after storage/steaming + simulated digestion and absorption
短时贮藏和蒸制后的萝卜苗经过模拟消化吸收前后的抗超氧阴离子能力测定结果如图4 所示。 ASA 能力是模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统,产生超氧阴离子自由基O·2,加入电子传递物质及显色剂,使反应体系呈紫红色。抗超氧阴离子的物质可以抑制该反应使O·2 减少,故比色时颜色变浅。 依据形成物的颜色深浅计算出抑制超氧阴离子自由基O·2 的能力强弱。 从结果中我们可以得出, 萝卜苗在贮藏和蒸制的PBS、GD 和IA 提取物的抗超氧阴离子能力虽然都比较弱(≤0.10 U/mL),但是贮藏条件和蒸制时间对各个阶段的提取物的抗超氧阴离子能力影响显著。PBS 提取物在低温和常温贮藏0~6 h 之间基本保持一致,在6~24 h 之间的低温贮藏导致其依然显著上升并达到最高点, 而常温则与之相反;GD 阶段在0~12 h 的常温和低温贮藏期间变化不大,但低温贮藏的12~24 h 之间的抗超氧阴离子能力则显著上升;IA 提取物在常温和低温贮藏期间的变化趋势保持一致。 蒸制阶段的3 种提取物的抗超氧阴离子能力变化趋势也很类似,三者均在0~15 s 之间有个小高峰,然后下降至蒸制120 s 时又达到最高峰。
短时贮藏和蒸制后的萝卜苗经过模拟消化吸收前后的超氧化物歧化酶活性测定结果如图5 所示。 超氧化物歧化酶(SOD)参与在酶学防御体系(SOD 歧化O2-为H2O2)而对机体的氧化与抗氧化平衡起着至关重要的作用[21]。 它能清除超氧阴离子自由基,保护细胞免受损伤,本试验采用黄嘌呤氧化酶法(羟胺法)测定SOD 活力,黄嘌呤氧化酶催化黄嘌呤产生超氧阴离子自由基, 后者氧化羟胺成亚硝酸盐, 亚硝酸盐在对氨基苯磺酸与甲萘胺作用下呈现紫红色, 用可见光分光光度计测其吸光度。 当被测样品中含SOD 时,则对超氧阴离子自由基(O2-)有专一性抑制作用,使形成的亚硝酸盐减少, 比色时测定管的吸光度值低于对照管的吸光度值, 通过公式计算可求出被测样品中的SOD 活力[22-23]。 PBS 提取物的SOD 活力在贮藏0~6 h 之间急剧下降,6~24 h 之间缓慢回升, 低温与常温贮藏只在12 h 时有明显差异; 而GD 提取物在常温贮藏和低温贮藏期间处于下降趋势, 但在12~24 h 之间的低温贮藏回升至与对照无显著差异,12 h 时的常温贮藏有些微回升;IA 阶段,低温与常温贮藏在0~24 h 期间的SOD 活性均处于下降趋势。PBS、GD 和IA 提取物的SOD 活性在蒸制期间总体处于下降趋势, 但是PBS 提取物在蒸制5 s 时达到一个低峰,在120 s 时达到最低峰,虽然在蒸制5 min 时有些微回升, 但总体上SOD 活性处于下降趋势;GD 提取物的SOD 活性在蒸制5 min 时达到最低点;IA 提取物则是在蒸制5 s 时达到最低峰。
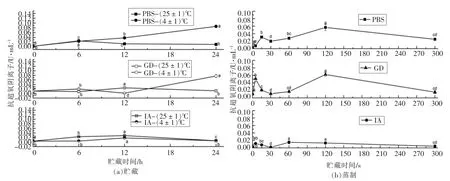
图4 萝卜苗中的ASA 在贮藏/蒸制+模拟消化吸收后的变化Fig.4 Changes of ASA in radish sprouts after storage/steaming + simulated digestion and absorption
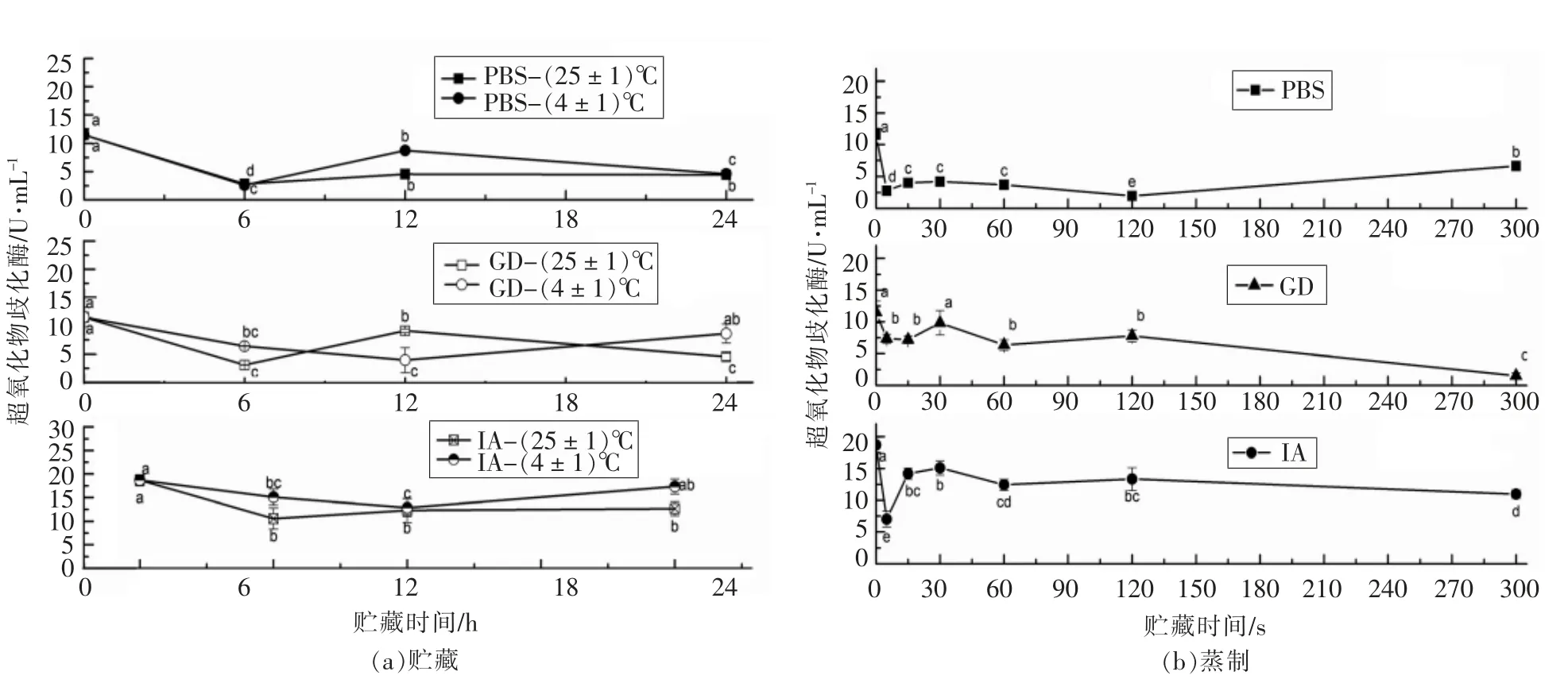
图5 萝卜苗中的SOD 在贮藏/蒸制+模拟消化吸收后的变化Fig.5 Changes of SOD in radish sprouts after storage/steaming + simulated digestion and absorption
TOPSIS 法综合评价萝卜苗的体外抗氧化能力结果如图6 所示。 TOPSIS 评价法的基本原理:在基于归一化后的原始矩阵中, 找出有限方案中的最优方案和最劣方案(分别用最优向量和最劣向量表示),然后分别计算出评价对象与最优方案和最劣方案间的距离, 获得该评价对象与最优方案的相对接近程度,以此作为评价优劣的依据[24]。本研究以萝卜苗为材料,以贮藏+模拟胃肠消化和蒸制+模拟胃肠消化为叠加处理手段,检测5 种抗氧化指标,以TOPSIS 法模糊评价方法进行所有数据的综合评价。 在本研究中, 权重设置为单位矩阵, 也就是说各个指标在整个评价过程中的重要性相等。 TOPSIS 法排序结果中纵坐标代表的是各个处理的Rj值,CK 到S6 的7 种贮藏方式中,在PBS 阶段,CK-S2 之间Rj值一直降低,S3-S6 的Rj值一直上升,也就是在24 h 的贮藏中,低温贮藏时间越长则萝卜苗的PBS 提取物的综合抗氧化能力越强;GD 阶段,CK-S2 之间Rj值一直上升,S3-S5 的Rj值则又降低,S6 的Rj值达到最大;IA 阶段,CK-S2 之间的Rj值一直上升并达到最大值。而在最优蒸制时间方面,PBS、GD 和IA 阶段的蒸制120 s 的Rj值基本上都是处于各个处理最大点,但是和贮藏处理的Rj值变化类似的是,蒸制3个阶段的Rj值随蒸制时间的变化趋势也各不相同。
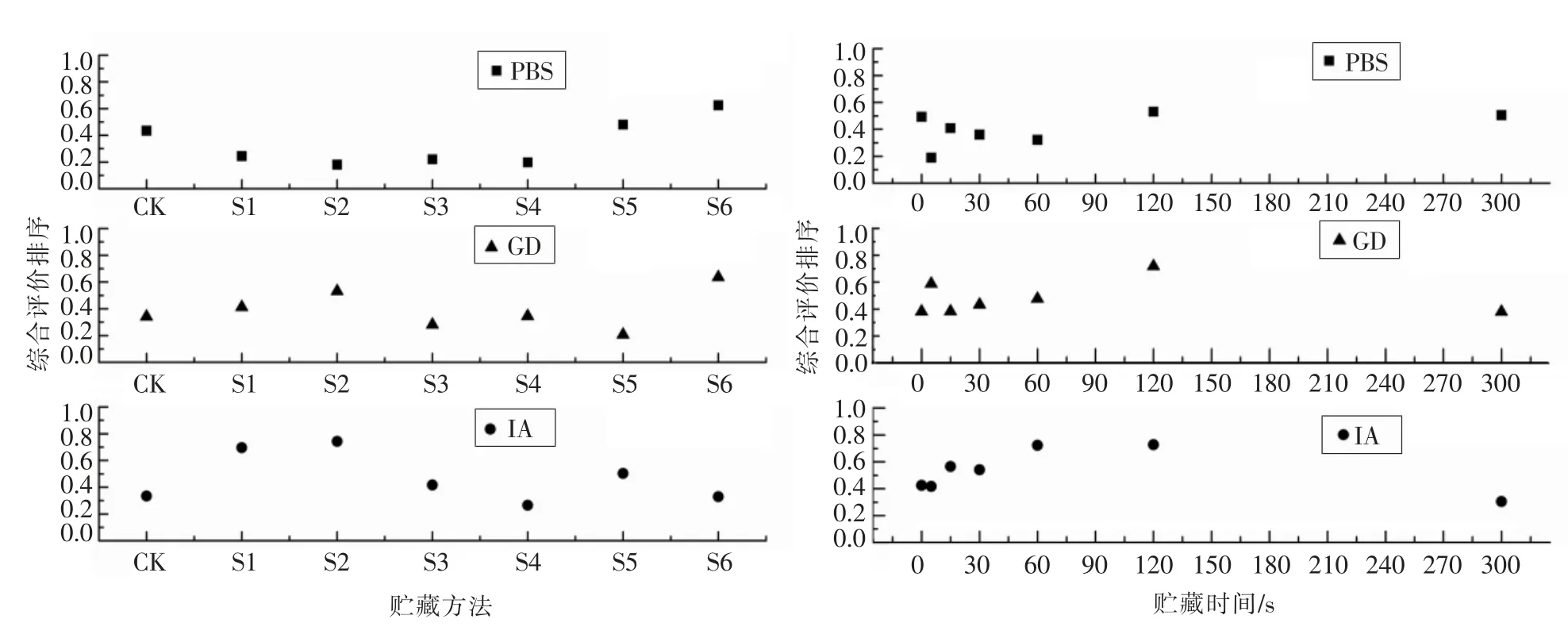
图6 萝卜苗的抗氧化性的综合评价-TOPSIS 排序Fig.6 Comprehensive evaluation of antioxidant activity of radish sprouts - TOPSIS Rank
3 讨论
十字花科类蔬菜含有丰富的抗氧化活性物质[25-27],如酚酸、类黄酮、硫代葡萄糖苷的代谢产物-异硫氰酸盐和维生素等,而十字花科芽苗菜的营养价值远远高于其成熟蔬菜[27],萝卜苗就是一种典型的十分受市场欢迎的十字花科芽苗菜。
胃、肠消化过程中的pH、胃蛋白酶等因素导致食品中的抗氧化活性物质以原始形式的降解,其它物质的转化,结合形式的解离等原因而释放,还有从非活性形式转化为活性形式[13,28],最终导致抗氧化活性有可能上升、下降甚至不变[14]。 在本研究中,首先,各个抗氧化能力分析在同样处理同一阶段(即PBS、GD 和IA 阶段)基本各不相同,每个分析的最优处理时间各不相同, 这主要归因于各个分析的原理不同;其次,同一贮藏或蒸制处理下的同一抗氧化分析在PBS、GD 和IA 3 个阶段也各不相同, 我们推测可能是由于模拟胃肠消化和吸收使抗氧化物质降解、转化等导致的,如多酚、磷酸盐缓冲溶液作为酚类的提取试剂相对于有机溶剂(如乙醇或甲醇)来讲,对于酚类的提取效率本身就不高[29];而且,消化过程中的pH、胃蛋白酶等使得结合形式的多酚以有利形式释放出来;更重要的是,模拟肠吸收阻挡了多数大分子酚类,一般来说,只有苷元可以在小肠中被吸收。大多数多酚以酯、 糖苷或不能以天然形式吸收的聚合物的形式存在于食品中, 经过消化后释放出小分子苷元[30]。 在类似的试验中,Gil-Izquierdo 等[31]证明了在模拟消化不同的橙汁后总黄酮含量降低, 发现能够渗透通过透析膜的化合物和保留在渗余物中的化合物的水平低于未消化的汁液中的水平。 而TOPSIS 法综合评价结果显示,经过贮藏和蒸制的萝卜苗的综合抗氧化能力强于新鲜萝卜苗, 尤其是模拟吸收样品的结果。 除了酶和pH 的因素外,热处理可以促进自由形式的抗氧化剂从共轭形式释放[32]。
在胃肠道中, 抗氧化物质和其它功能因子首先必须从固体食糜中释放出来, 并进一步转化为其它可吸收和有生物活性的物质。在消化过程中,降解转化和不完全释放是可能发生的, 而这会影响食物表现出来的抗氧化能力。 传统的有机溶剂水溶液萃取不能反映来自食物的抗氧化活性物质在胃肠道中的利用率(从食糜中的释放量),降解及转化和吸收等情况[33-35]。 最重要的是,通过比较PBS,GD 和IA 提取物的生物活性,可以直接评估化合物的生物有效性的效果, 并且通过食物代谢命运对其复合混合物的抗氧化作用的调节可以在萝卜芽提取物中发现[13]。
4 结论
探讨了贮藏和蒸制后的萝卜苗在从新鲜到消化、吸收过程中的多角度抗氧化能力,并初步探讨萝卜苗的整体功能活性的评价方法。 综合评价结果显示经过常温贮藏12 h 以及蒸制1~2 min 的萝卜苗在模拟吸收中显现最优的综合抗氧化能力。贮藏蒸制和模拟胃肠道消化吸收不仅会导致活性物质的组成和结构的变化, 而且影响体外抗氧化活性和某些活性物质的降解效率;同时,贮藏蒸制也提高了抗氧化能力的生物有效性。 由于植物材料中细胞壁的破坏, 蒸制可影响植物化学物质的可萃取性和生物可接近性, 但植物化学物质的数量和性质在数量和质量上可能与通过化学萃取程序获得的数值不同。 对果蔬产品的生物活性进行合理而全面的衡量需要更深入的研究。
