不同干燥方法对珠兰花挥发油成分及其生物活性的影响
2020-07-08赵昌恒吴永祥万志兵武梦雪王雅莉曹田中
赵昌恒,吴永祥,万志兵*,武梦雪,王雅莉,曹田中,苏 兴
1黄山学院生命与环境科学学院,黄山 245041;2黄山雾云间生态农业开发有限公司,黄山 245200
珠兰Chloranthusspicatus(Tunb.)Makino属金粟兰科常绿蔓性亚灌木植物[1]。珠兰花具有优雅香气,珠兰花是窨制珠兰花茶的重要原材料,珠兰花与茉莉花、白兰花和玳玳花一起被称为“中国四大著名茶花”[2]。珠兰鲜花和茶叶窖制的珠兰花茶是我国传统的花茶之一,黄山市歙县珠兰花茶历史悠久,是黄山茶叶的重要组成部分。在故宫博物院收藏的清代《内务府奏销档》中,歙县珠兰花茶被乾隆皇帝列为贡茶。因而关于珠兰花的研究也一直在持续进行中,但是前人研究一直关注于珠兰花的栽培繁育等方面。关于珠兰花的研究也有一些集中香气成分研究中[3],珠兰花的干燥后的成分分析,以及成分的抗氧化、抑菌性能、对酪氨酸酶抑制作用等方面的研究都未见报道。
植物材料的干燥是植物样品加工利用的最初步骤,是进一步进行样品保存和其功能成分提取的预处理阶段,不同干燥方法的选择能显著影响样品功能性成分的保存。样品在干燥过程过程中可能会发生不同程度的热敏性成分的降解和挥发散失,也可能导致全新化合物的形成[4],植物材料不同干燥会导致植物材料抗氧化、抗菌、对酪氨酸酶抑制作用以及感官特征呈明显差异。Ozdemir等[5]研究表明不同干燥方式影响牛至OriganumvulgareL.挥发油成分的抗氧化活性;Zhang等[6]研究发现不同干燥方式柠檬Citruslimon(L.)Burm.f.皮挥发油的抗菌活性有较大差异。Farag等[7]揭示了大蒜AlliumsativumL.挥发油在冷冻干燥干燥条件下生物活性优于阴干。Liu等[8]研究表明不同干燥方法对杭白芷中的挥发油成分有一定的影响。因此,在植物资源加工利用过程中干燥方式的选择至关重要,探索合适的干燥方式方法具有极为重要的应用价值和生产实践意义。
本研究以珠兰花鲜花为材料,采用自然干燥和鼓风加热干燥,采用水蒸气蒸馏法提取干燥后珠兰花的挥发油,使用GC-MS对挥发油成分进行化学成分的定性和定量分析,探究干燥后的珠兰花挥发油的还原能力、对DPPH和ABTS自由基的清楚能力及抑菌效果、对酪氨酸酶抑制作用,为珠兰花的综合利用于进一步开发提供理论依据。
1 材料与方法
1.1 材料与仪器
珠兰花鲜花2019年5月采自于黄山雾云间生态农业开发有限公司生产基地。新鲜珠兰花除去枝梗后分别采用阴干和热风干燥2种方法干燥至恒重,热风干燥,具体方法是:38 ℃,2 h;40 ℃,12 h;50 ℃,3 h,干燥后粉碎过20~40目筛子,干燥的珠兰花粉末保存于干燥器中存放。大肠杆菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus、枯草芽孢杆菌Bacillussubtilis、绿脓杆菌Pseudomonasaeruginosa等购于无锡赛维科技有限公司。DPPH、ABTS、酪氨酸酶(tyrosinase,50 000 units)、左旋多巴等购于Sigma公司。白胨、牛肉膏、琼脂:生物试剂,北京陆桥技术有限责任公司。SQ510C型高压灭菌器(重庆雅马拓科技有限公司);AR124CN型电子天平,奥豪斯仪器(常州)有限公司;SpectraMax-190型全波长酶标仪(美国Molecular Devices公司)。
1.2 方法
1.2.1 挥发油的提取
称取经过干燥后的珠兰花粉末100.0 g 置于烧杯中,加重蒸馏水350 mL,用挥发油提取器按水蒸气蒸馏法提取6 h,收集无水乙醚层,挥发无水乙醚溶剂,加入无水硫酸钠进行干燥,得到具有浓郁香味淡黄色透明油状物。取适量挥发油用正己烷稀释,用于GC-MS检测,其余的挥发油密封保存于4 ℃条件下,用于抗氧化、抑菌活性以及酪氨酸酶抑制作用的实验。
1.2.2 挥发油成分分析
色谱条件:选用HP-5 MS 弹性石英毛细光柱(0.25 μm,30 m×0.25 mm);载气为高纯氦气,载气流速为1.0 mL/min;分流比为40∶1,进样量为1.0 μL;进样口温度为60 ℃,保持3 min,以5 ℃/min升至280 ℃,保持10 min。
质谱条件:离子源温度230 ℃,电离方式为EI,电子能量为70 eV,四级杆温度为150 ℃;质量扫描范围为35~450 u;溶剂延迟时间3 min;采用NIST08标准普库进行检索。
1.2.3 挥发油的抗氧化活性测定
1.2.3.1 清除DPPH自由基活性的测定
参考文献Cherrat等[9]的方法略作改进:取1 mL不同浓度梯度珠兰花挥发油(0.0、0.9、1.8、3.6 mg/mL),加入3 mL DPPH-乙醇溶液,黑暗且室温条件下震荡30 min,测定波长为517 nm处样品的吸光度,并计算自由基清除率I:I=(AO-AS)/AO×100%,计算公式中:AO为空白样品吸光度;AS为珠兰花挥发油和抗坏血酸样品溶液吸光度。
1.2.3.2 清除ABTS自由基活性的测定
参照Hu等[10]的方法并略作修改,分别配置浓度为7 mmol/L的ABTS水溶液和浓度为2.45 mmol/L的过硫酸钾水溶液,两者按照等比例混合,混合液置于黑暗条件下反应16 h。以无水乙醇稀释调整至在波长734 nm处吸光度为0.70±0.000 5,制备得到ABTS+溶液。取0.3 mL不同浓度梯度挥发油-乙醇样液,加入2.7 mL ABTS+溶液,30 ℃水浴加热6 min,于波长734 nm处测定吸光度,并计算自由基清除率I。
1.2.4 挥发油的抑菌活性测定
参考Abdelli等[11]的方法并进行改进。将活化后的大肠杆菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus、枯草芽孢杆菌Bacillussubtilis和绿脓杆菌Pseudomonasaeruginosa,以平板菌落计数法调整至106~107CFU/mL。MH(Mueller Hinton)平板中加入调整后的4种菌悬浮液100 μL,用涂布棒均匀涂布,并干燥。在中央加入10 μL挥发油,以丙酮为空白对照,以5%吐温80溶液为阴性对照,以对羟基甲酸丙酯(propylparaben,PP)为阳性对照,37 ℃培养箱中倒置培养24 h,设置3次重复,测量记录抑菌圈(diameters of inhibition zones,DIZ)直径的大小,以mm为单位,取其平均值。
1.2.5 挥发油酪氨酸酶抑制作用的测定
根据Tang等[12]的测定方法稍加改进,具体如下:向96孔板中依次加入50 μL磷酸缓冲液(pH=6.8)、80 μL 10 mM的左旋多巴与50 μL不同浓度(0.9、1.8、3.6 mg/mL)的 HAD-VO和SD-VO,混匀后反应5 min,加入20 μL 125 unit/mL的酪氨酸酶溶液,37 ℃恒温反应15 min,于475 nm波长处测定吸光度值。以Arbutin为阳性对照,并按照下列公式计算酪氨酸酶抑制率:

式中,I:表示酪氨酸酶抑制率;AS:表示样品组吸光度值;ASB:表示样品对照组吸光值;AC:表示空白组吸光值;ACB:表示空白对照组吸光值。
1.3 数据处理
利用Excel对数据进行输入和初步处理,使用SPSS18.0软件对实验结果进行统计分析。
2 结果与分析
2.1 不同干燥方法对珠兰花挥发油成分及含量的影响
不同干燥方法珠兰花挥发油化学成分GC-MS分析的总离子流图见图1。由图1可知,两种方法干燥后珠兰花挥发油总离子流图基本相似。用NIST08质谱图库对各组分峰进行检索,两种干燥处理所得的挥发油共鉴定出62种化合物,鼓风加热干燥法(HAD-VO)鉴定出58种,被鉴定化合物相对含量占挥发油总量的94.12%,阴干法(SD-VO)鉴定出56种,被鉴定化合物相对含量占挥发油总量的92.43%,两种方法共有物质52种。珠兰花挥发油化合物种类较多,以烯、酮、醇为主。鼓风加热干燥法中烯类物质占47.95%,阴干法中稀类物质占38.84%。酮类物质分别为11.82%和15.5%,醇类物质分别为24.29%和31.22%。珠兰花挥发油中含量较高成分有1-(1,4-二甲基-3-环己烯-1-基)乙酮(HAD-VO:11.33%,SD-VO:15.55%),别香橙烯(HAD-VO:6.12%,SD-VO:11.25%),匙桉醇(HAD-VO:5.75%,SD-VO:5.94%),3-甲氧基苯甲醇(HAD-VO:5.08%,SD-VO:11.04%)。
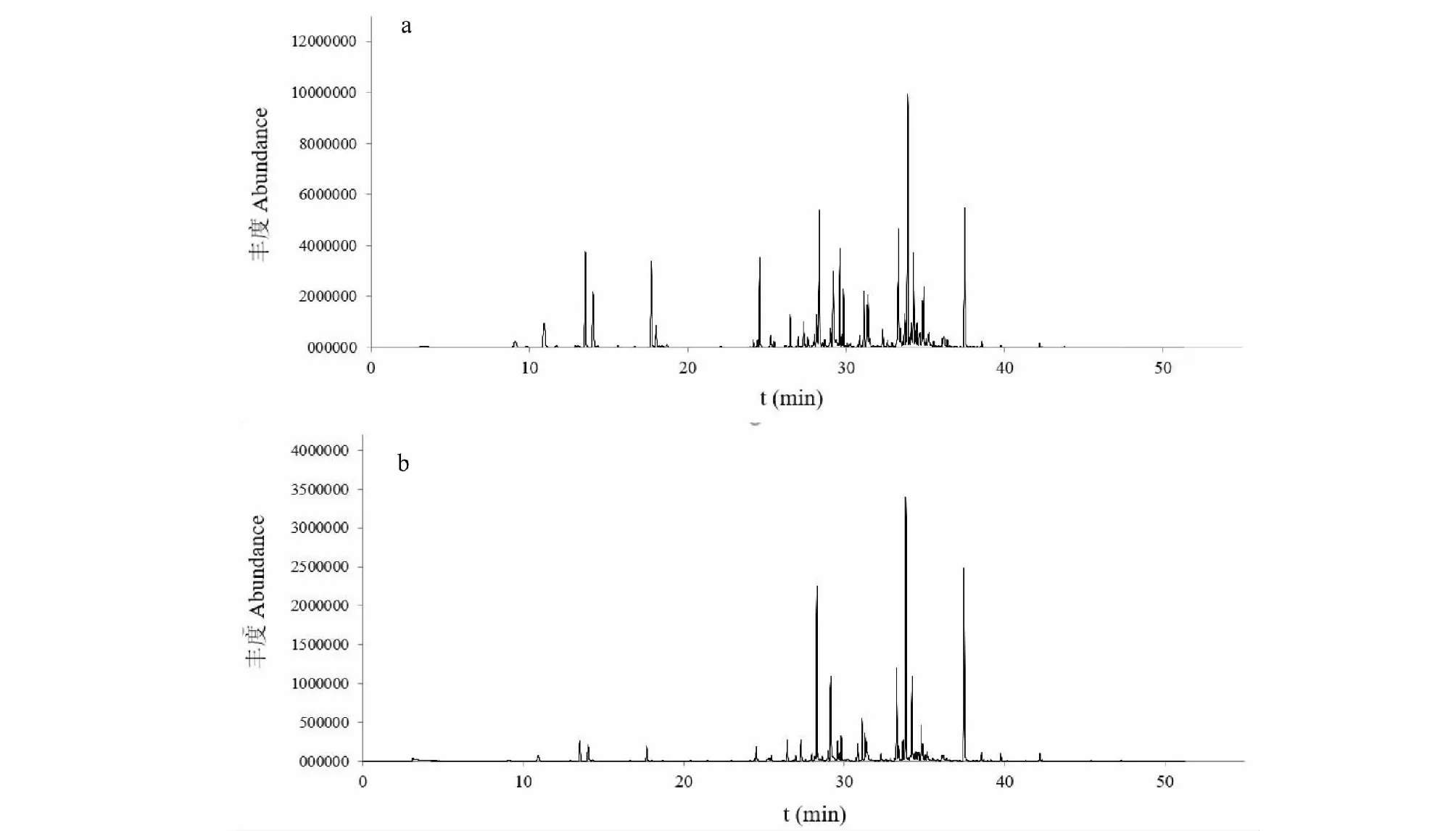
图1 珠兰花热风干燥(a)、阴干(b)挥发油GC-MS总离子流图

表1 不同干燥处理珠兰花挥发油的化学成分及其相对含量
续表1(Continued Tab.1)
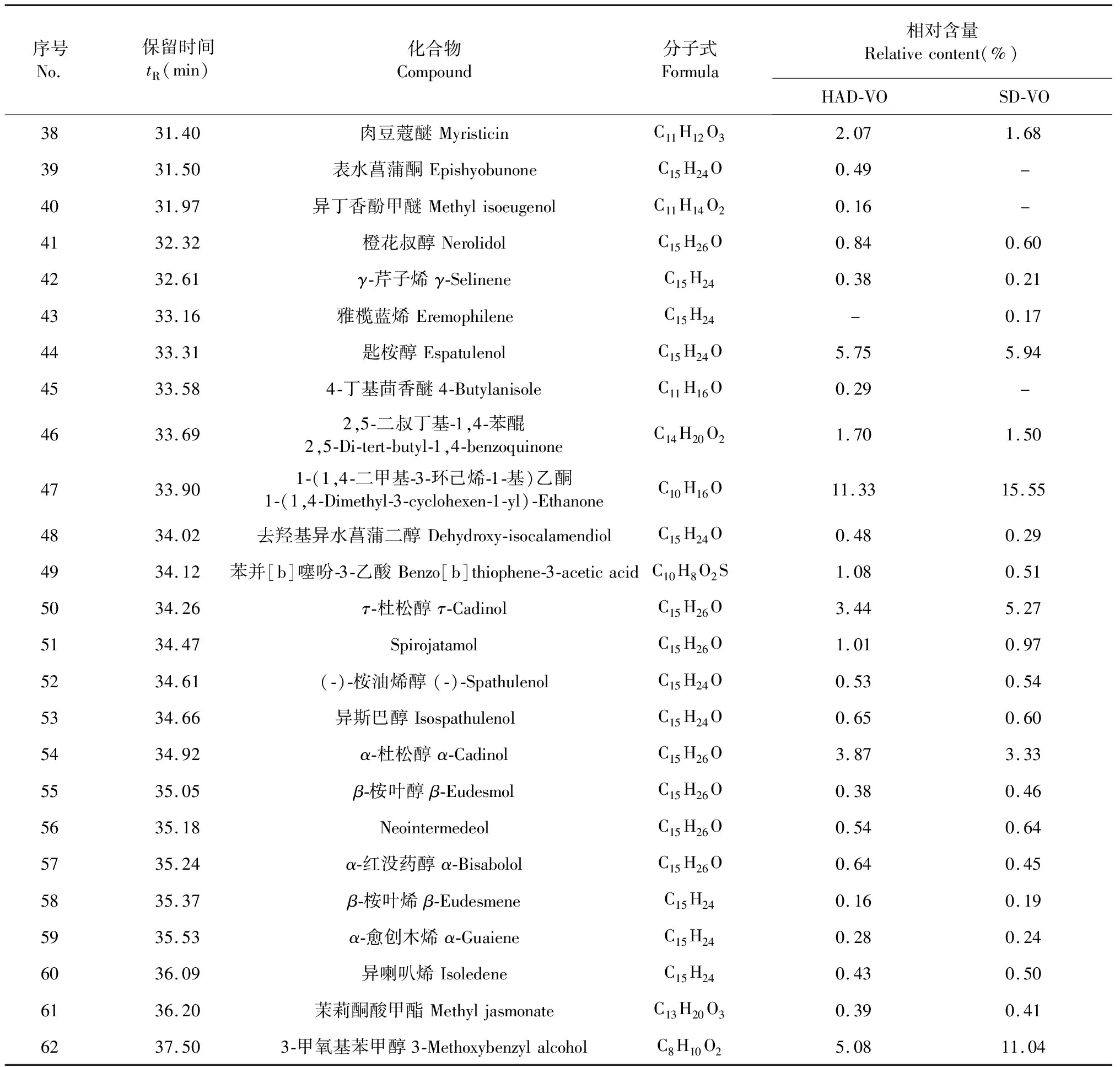
序号No.保留时间tR(min)化合物Compound分子式Formula相对含量Relativecontent(%)HAD-VOSD-VO3831.40肉豆蔻醚MyristicinC11H12O32.071.683931.50表水菖蒲酮EpishyobunoneC15H24O0.49-4031.97异丁香酚甲醚MethylisoeugenolC11H14O20.16-4132.32橙花叔醇NerolidolC15H26O0.840.604232.61γ-芹子烯γ-SelineneC15H240.380.214333.16雅榄蓝烯Eremophilene C15H24-0.174433.31匙桉醇EspatulenolC15H24O5.755.944533.584-丁基茴香醚4-ButylanisoleC11H16O0.29-4633.692,5-二叔丁基-1,4-苯醌2,5-Di-tert-butyl-1,4-benzoquinoneC14H20O21.701.504733.901-(1,4-二甲基-3-环己烯-1-基)乙酮1-(1,4-Dimethyl-3-cyclohexen-1-yl)-EthanoneC10H16O11.3315.554834.02去羟基异水菖蒲二醇Dehydroxy-isocalamendiolC15H24O0.480.294934.12苯并[b]噻吩-3-乙酸Benzo[b]thiophene-3-aceticacidC10H8O2S1.080.515034.26τ-杜松醇τ-CadinolC15H26O3.445.275134.47SpirojatamolC15H26O1.010.975234.61(-)-桉油烯醇(-)-SpathulenolC15H24O0.530.545334.66异斯巴醇Isospathulenol C15H24O0.650.605434.92α-杜松醇α-CadinolC15H26O3.873.335535.05β-桉叶醇β-EudesmolC15H26O0.380.465635.18NeointermedeolC15H26O0.540.645735.24α-红没药醇α-BisabololC15H26O0.640.455835.37β-桉叶烯β-EudesmeneC15H240.160.195935.53α-愈创木烯α-GuaieneC15H240.280.246036.09异喇叭烯IsoledeneC15H240.430.506136.20茉莉酮酸甲酯MethyljasmonateC13H20O30.390.416237.503-甲氧基苯甲醇3-MethoxybenzylalcoholC8H10O25.0811.04
2.2 挥发油的抗氧化活性测定
珠兰花挥发油和阳性对照清除ABTS自由基能力如表2所示。珠兰花挥发油有一定的ABTS自由基清除能力,在0.9~3.6mg/mL内,热风干燥珠兰花挥发油对ABTS自由基清除率分别为10.08%、23.20%、50.91%,而阴干珠兰花挥发油对ABTS自由基清除率分别为6.13%、11.98%、21.90%。不同种干燥方式的珠兰花挥发油对ABTS自由基清除率随着挥发油质量浓度的增加,清除能力随之增强。在珠兰花挥发油相同浓度下,热风干燥的珠兰花挥发油对ABTS自由基清除率显著高于阴干的珠兰花。最高浓度的热风干燥的珠兰花挥发油对ABTS自由基清除率也显著低于阳性对照。
由表2可知,珠兰花挥发油对DPPH自由基清除能力表现出明显的剂量效应,随着珠兰花挥发油浓度的增加,DPPH自由基清除能力也随之增强,前差异达到显著水平(P<0.05)。在挥发油相同浓度下,热风干燥的珠兰花挥发油对DPPH自由基清除率显著高于阴干的珠兰花。在珠兰花挥发油浓度为3.6mg/mL时,热风干燥的珠兰花挥发油对DPPH自由基清除率为61.36%,显著高于阴干的珠兰花挥发油对DPPH自由基清除率32.57%,但是显著低于阳性对照对DPPH自由基清除率81.42%。
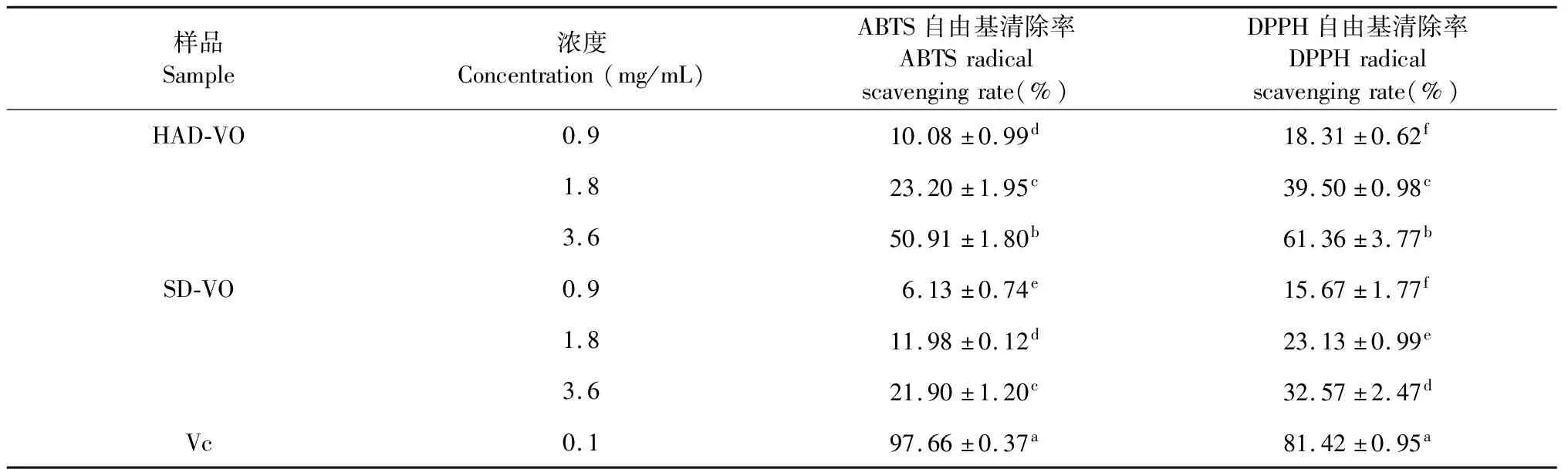
表2 不同干燥处理对珠兰花挥发油抗氧化活性的影响
注:同列不同字母表示在统计学上具有显著差异(P<0.05)。
Note:Different letters in the same column show statistically significant differences(P<0.05).
通过以上分析表明,珠兰花挥发油具有一定的抗氧化活性,但活性相对较弱。可能需要提高挥发油浓度才能达到阳性对照对ABTS自由基和DPPH自由基的清除率。
2.3 挥发油的抗菌活性测定
由图2可知,珠兰花挥发油对四种供试菌均有一定的抑制作用,但其抑菌活性要弱于对羟基苯甲酸丙酯。珠兰花挥发油对金黄色葡萄球菌具有显著的抑制效果,鼓风干燥的珠兰花挥发油最大的抑菌圈直径为13.50±0.61 mm,阴干的珠兰花挥发油最大的抑菌圈直径为12.83±1.18 mm,都低于阳性对照PP(1 mg/mL)浓度为1.0 mg/mL时,最大抑菌圈直径14.53±1.00 mm,但是差异没有达到显著水平。
珠兰花挥发油对大肠杆菌、枯草芽孢杆菌和绿脓杆菌具有一定的抑菌作用,鼓风干燥的珠兰花挥发油最大的抑菌圈直径分别为10.97±0.47、11.23±0.12、12.10±0.82 mm,阴干的珠兰花挥发油最大的抑菌圈直径分别为9.83±0.35、9.53±0.25、12.27±1.33 mm,但都显著低于阳性对照。鼓风干燥的珠兰花挥发油对大肠杆菌和绿脓杆菌的抑制显著强于阴干的珠兰花挥发油对两者的抑制。也表明这两种干燥方法对于珠兰花成分的保存存在一定的差异。
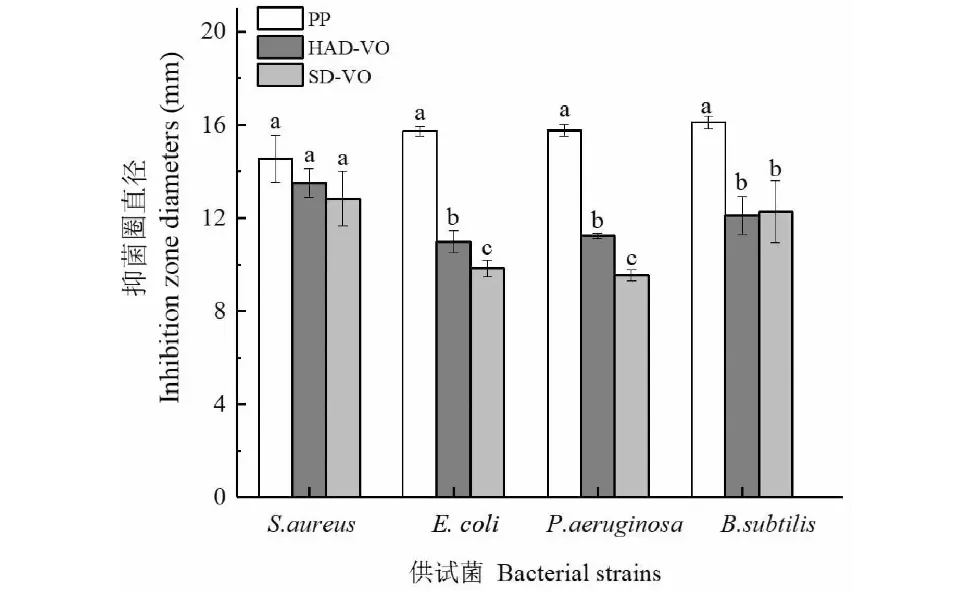
图2 不同干燥处理对珠兰花挥发油抑菌作用的影响
2.4 挥发油酪氨酸酶抑制作用的测定
不同干燥处理对珠兰花挥发油酪氨酸酶抑制作用见图3。从图3可以看出,鼓风干燥或者阴干处理中,同一种干燥方式中随着浓度的增加抑制酪氨酸酶的活性增强,表现为呈浓度依赖的方式抑制酪氨酸酶活性。在挥发油浓度为3.6 mg/mL时,鼓风干燥的珠兰花挥发油对酪氨酸酶抑制作用达到68.47%,略高于对照组的64.61%,但是没有达到显著水平,显著高于阴干的珠兰花挥发油对酪氨酸酶抑制作用(51.63%)。
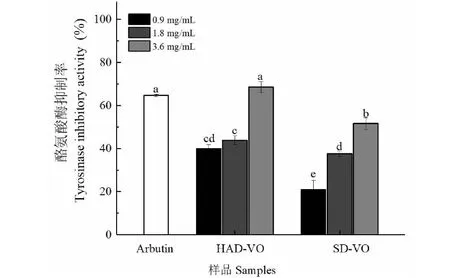
图3 不同干燥处理对珠兰花挥发油酪氨酸酶抑制作用的影响
3 讨论与结论
野生植物资源是人类拥有的无比巨大的财富,开发利用野生植物资源有利于保护生态系统中各个物种的平衡,也是实施天然林资源保护的需要,并符合经济开发中的物尽其用、综合开发、产生最大经济效益的原则,因此,合理开发利用我国丰富的野生植物资源对其经济发展起着巨大作用。野生植物资源含有的各种对人类生产、生活有用的化合物,对植物资源的成分的研究,有助于进一步开发利用植物资源。
许多植物中蕴藏着迄今人们仍未得知的许多有用成分。本研究中采用水蒸气蒸馏法提取珠兰花的挥发油,通过GC-MS对挥发油化学成分进行分离鉴定出62种化合物,鼓风加热干燥法鉴定出58种,被鉴定化合物相对含量占挥发油总量的94.12%,阴干法鉴定出56种,被鉴定化合物相对含量占挥发油总量的92.43%,两种方法共有物质52种,表明这两种干燥方法导致成分及含量存在一定的差异,这与Liu等[8]研究不同干燥方法对杭白芷中挥发油类化学成分的影响结果类似,以及Cheng等[13]研究不同干燥方法对红花玉兰挥发油成分的结果都相似,也说明干燥方式的研究对于开发利用植物资源具有重要意义。
珠兰花挥发油化合物种类较多,以烯、酮、醇为主。Wang[3](2003)采用同时-蒸馏萃取法制备珠兰花香精油,利用气相色谱和气质联用分析从珠兰中鉴定出78种香气化合物,其中醇类15种,酯类4种、碳氢化合物44种,酮类6种,醛类2种,含氮化合物2种,其它5种。可见珠兰花中化学成分种类非常丰富。珠兰花挥发油中含有多种具有应用价值的化学成分,如1-(1,4-二甲基-3-环己烯-1-基)乙酮是珠兰花挥发油成分中含量最高的物质,鼓风加热干燥方式中含量为11.33%,阴干方式中含量为15.5%,而该物质也是毛细辛和铜钱细辛挥发油中含量最高的物质,含量分别为14.16%和14.24%[14]。这种物质的功能尚未明确,但是细辛具有归心、肺、肾经,具有祛风散寒、通窍止痛、温肺化饮的功效,临床上常用于治疗风寒头疼、痰饮咳喘、关节疼痛、鼻塞、牙痛等[15],细辛也是治疗新型冠状病毒肺炎通用方剂中的成分之一[16]。该物质在珠兰花中含量也是最高的,表明珠兰花有继续开发利用的可能性。本研究的结果为进一步开发利用珠兰花资源提供科学依据,促进对珠兰花的综合开发利用。
珠兰花挥发油具有显著的DPPH和ABTS自由基清除能力,鼓风加热干燥珠兰花挥发油较阴干珠兰花挥发油具有更强的DPPH和ABTS自由基清除能力,抗氧化能力与挥发油质量浓度呈正相关,浓度越高珠兰花挥发油抗氧化能力越强。珠兰花挥发油抗氧化活性与其化学组成及含量有关系,烯烃、酮是重要的抗氧化活性成分[17,18]。珠兰花挥发油成分种类多,各种成分之间也存在一定的协同作用,也在一定程度上加强抗氧化活性[19]。从抑菌结果可知,珠兰花挥发油对金黄色葡萄球菌具有显著的抑制效果,对大肠杆菌、枯草芽孢杆菌和绿脓杆菌具有一定的抑菌作用。鼓风加热烘干珠兰花挥发油抑制强度依次为:金黄色葡萄球菌>枯草芽孢菌>绿脓杆菌>大肠杆菌。阴干珠兰花挥发油抑制强度依次为:金黄色葡萄球菌>枯草芽孢菌>大肠杆菌>绿脓杆菌。
珠兰花挥发油对酪氨酸酶活性均具有一定的抑制能力,在一定范围内随着质量浓度增大,抑制率逐渐升高。在相同浓度挥发油的条件下,鼓风加热干燥珠兰花挥发油显著强于阴干珠兰花挥发油。酪氨酸酶是黑色素合成过程中的关键酶[20],它可催化L-酪氨酸生成多巴,多巴逐步氧化生成多巴醌,进而形成色素颗粒,是引发黄褐斑、雀斑、老年斑及黑色素瘤等疾病的主要原因。酪氨酸酶抑制剂是现代美白化妆品和皮肤用药的主要组成成分。植物资源中含有的天然活性成分毒副作用小、安全性高,比化学合成的抑制剂具有更大优势,因此近年来逐渐成为酪氨酸酶抑制剂研究者的关注热点。也表明珠兰花可进一步开发成美白化妆品,甚至可以填加在皮肤用药中。
综上,鼓风干燥是珠兰花最佳的干燥方法,珠兰花挥发油成分中有抗氧化、抑菌、酪氨酸酶抑制作用,珠兰花挥发油可进一步开发利用成美白化妆品或皮肤用药中,本研究对珠兰花挥发油提取工艺和产品的开发应用提供了重要的理论依据。
