不同干燥方式对连翘花主要成分的影响
2021-06-15杨梦婷1*,王相1,2,3,王倩王鑫国毕晓东牛丽颖
杨梦婷1*,王 相1,2,3,王倩 王鑫国 毕晓东 牛丽颖


中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2021)08-0921-06
DOI 10.6039/j.issn.1001-0408.2021.08.05
摘 要 目的:建立测定阴干、真空冷冻干燥、烘箱干燥(30、50、70 ℃)、晒干等干燥方式下连翘花中4种成分含量的方法并进行比较,以评价不同干燥方式对连翘花主要成分含量的影响,筛选其最佳干燥方式。方法:采用超高效液相色谱法。色谱柱为Waters ACQUITY UPLC BEH C18,流动相为乙腈-0.1%磷酸水溶液(梯度洗脱),流速为0.3 mL/min,检测波长为230 nm,柱温为35 ℃,进样量为1 μL。采用优劣解距离法(TOPSIS)综合分析法计算不同干燥方式与理想方法的欧氏贴近度(Ci),以确定最佳干燥方法。结果:连翘酯苷A、芦丁、连翘酯苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷检测进样量的线性范围分别为0.007 5~0.037 7、0.027 4~0.137 2、0.001 9~0.009 5、0.005 6~0.028 8 ?g(r均大于0.999);精密度、稳定性(32 h)、重复性试验的RSD均小于2%;加样回收率分别为97.27%~102.53%、100.53%~104.11%、98.45%~104.02%、98.66%~104.82%,RSD均小于3%(n=3)。含量分别为1.645 8~4.987 9、11.730 2~20.978 0、0.875 5~2.005 0、2.366 0~5.535 7 mg/g。连翘酯苷A以30 ℃烘箱干燥后含量最高,芦丁、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷均以真空冷冻干燥后含量最高,连翘苷以50 ℃烘箱干燥后含量最高。TOPSIS分析结果显示,阴干、真空冷冻干燥、烘箱干燥(30、50、70 ℃)、晒干的Ci分别为0.079 9、0.553 5、0.495 4、0.503 8、0.157 9、0.217 2;Ci排序为真空冷冻干燥>50 ℃烘箱干燥>30 ℃烘箱干燥>晒干>70 ℃烘箱干燥>阴干。结论:所建含量测定方法简便、重复性好,可用于同时测定连翘花中4种成分的含量。连翘花样品以真空冷冻干燥方式最佳,其次为50 ℃烘箱干燥、30 ℃烘箱干燥,再次为晒干和烘箱干燥70 ℃,最后为阴干。
关键词 连翘花;主要成分;阴干;烘箱干燥;真空冷冻干燥;晒干
Effects of Different Drying Methods on the Main Components of Forsythia suspensa Flowers
YANG Mengting1,WANG Xiang1,2,3,WANG Qian1,WANG Xinguo1,2,3,BI Xiaodong1,2,3,NIU Liying1,2,3(1. College of Pharmacy, Hebei University of TCM, Shijiazhuang 050091, China; 2. Hebei TCM Formula Granule Technology Innovation Center, Shijiazhuang 050091, China; 3. Hebei TCM Quality Evaluation and Standardization Engineering Research Center, Shijiazhuang 050091, China)
ABSTRACT OBJECTIVE: To establish the method for the content determination of 4 components in Forsythia suspensa flowers by drying in shade, vacuum freeze-drying, oven (30, 50, 70 ℃) and sun, so as to evaluate the effects of different drying methods on the main components of F. suspensa flowers and screen the optimal drying method. METHODS: UPLC method was adopted. The determination was performed on Waters ACQUITY UPLC BEH C18 column with mobile phase consisted of acetonitrile-0.1% phosphoric acid aqueous solution (gradient elution) at the flow rate of 0.3 mL/min. The detection wavelength was set at 230 nm, and column was 35 ℃. The sample size was 1 μL. Euclidean closeness (Ci) of different drying methods was calculated by TOPSIS comprehensive analysis method, and the optimal drying method was defined. RESULTS: The linear range of forsythiaside A, rutin, forsythin, (+)-pinoresinol-4-O-β-D-glucopyranoside were 0.007 5-0.037 7, 0.027 4-0.137 2, 0.001 9-0.009 5, 0.005 6-0.028 8 ?g(all r>0.999). RSDs of precision, stability (32 h) and reproducibility tests were all lower than 2%. The recoveries were 97.27%-102.53%, 100.53%-104.11%, 98.45%-104.02%, 98.66%-104.82%, respectively; and all RSDs<3%(n=3). The contents were 1.645 8-4.987 9, 11.730 2-20.978 0, 0.875 5-2.005 0, 2.366 0-5.535 7 mg/g. The content of forsythiaside A was the highest after drying at 30 ℃, rutin and (+)-pinoresinol-4- O-β-D-glucopyranoside were the highest after vacuum freeze-drying, forsythiaside was the highest after drying at 50 ℃. Results of TOPSIS analysis showed that Ci of F. suspensa flowers by drying in shade, vacuum freeze-drying, oven (30, 50, 70 ℃) and sun were 0.079 9, 0.553 5, 0.495 4, 0.503 8, 0.157 9, 0.217 2, respectively; the order of Ci was vacuum freeze-drying> 50 ℃ oven drying> 30 ℃ oven drying>sun drying>70 ℃ oven drying> shade drying. CONCLUSIONS: Established method is simple, reproducible and can be used for the content determination of 4 components in F. suspensa flowers. The samples are preferably dried by vacuum freeze-drying, followed by 50 ℃ oven drying, 30 ℃ oven drying, and then dried in the sun and oven at 70 ℃ and finally in the shade.
KEYWORDS Forsythia suspensa flowers; Main component; Drying in the shade; Oven drying; Vacuum freeze-drying; Drying in the sun
连翘为木犀科植物连翘Forsythia suspensa(Thunb.)Vahl的干燥果实,始载于《神农本草经》[1],主产于我国山西、河南、陕西、湖北等省,具有清热解毒、消肿散结、疏散风热之功效,主要含有苯乙醇类、木质素类、黄酮类、三萜酸类、挥发油类等成分[2]。《本草纲目》中记载,连翘“处处有之。今用茎连花实”“有大、小二种,大翘生下湿地或山冈上……南人用花叶”[3],可见最早连翘是以地上部位入药。目前,关于连翘的研究大多集中于果实的质量标准、化学成分、药理作用等方面[4-6];而关于连翘花的研究相对较少,对其主要功效的了解也较为有限。有研究指出,连翘花所含化学成分与连翘果实大致相似,主要含有芦丁、金丝桃苷、连翘酯苷 A、连翘苷、齐墩果酸、熊果酸、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷等成分,且(+)-松脂素-4-O-β-D-葡萄吡喃糖苷在连翘花中的含量明显高于连翘果实,具有抗菌、抗氧化、抗衰老等药理作用[7-10]。连翘约于每年3~4月份先长叶,后再开花,由于花期长、花量大,在其生长期需行疏花以增加座果率,因此导致大量的连翘花被舍弃,造成资源浪费。
有研究发现,不同干燥方式可直接影响中药饮片的质量[11-15]。2020年版《中国药典》(一部)中收载的花类药材有23种,干燥方式大多数为阴干、晒干和-40 ℃低温干燥[16]。中药材化学成分的复杂性决定了不能仅以单一成分含量评价其质量,而如何以多指标成分客观评价中药材的质量已成为亟待解决的问题。优劣解距离法(TOPSIS)是一种多目标决策的方法,可以通过计算选出最接近理想化方案的分析方法,能有效避免人为主观因素对中药材质量评价的影响[17-19]。超高效液相色谱法(UPLC)具有高效、简便、专属性强等优点[20]。芦丁、连翘酯苷A、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷在连翘花中含量相对较高,具有降血压、抗菌、抗炎、抗病毒等作用,是区分连翘花、果实、叶的主要成分[2,7]。基于此,本研究以连翘花为研究对象,采用UPLC法测定不同干燥方式 [阴干、真空冷冻干燥、烘箱干燥(30、50、70 ℃)、晒干]下连翘花中芦丁、连翘酯苷A、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷的含量,采用TOPSIS法对连翘花中上述4种成分的含量进行综合评价,以确定最佳干燥方法,旨在为连翘花的利用及开发提供参考。
1 材料
1. 1 主要仪器
实验所用主要仪器有ACQUITY 型UPLC H-Class 色谱系统(包括四元溶剂管理器、自动进样器、二极管阵列检测器、高温柱温箱、Empower 3 色谱工作站,美国Waters有限公司)、TB-215D型百万分之一和BSA224S- CW 型万分之一电子分析天平[赛多利斯科学仪器(北京)有限公司]、JY10001 型百分之一电子天平(上海民桥精密科学仪器有限公司)、KQ-250 型超声波清洗器(昆山市超声仪器有限公司,功率250 W,频率40 kHz)、FD-1C-50 型真空冷冻干燥机(北京博医康实验仪器有限公司)、DHG-9123A 型电热恒温鼓风干燥箱(上海一恒科技有限公司)、XS-02型多功能高速粉碎机(上海兆申科技有限公司)。
1.2 主要药品与试剂
连翘酯苷A对照品(批号111810-201304,纯度98%)、芦丁对照品(批号100080-201610,纯度98%)、连翘苷对照品(批号110821-201212,纯度98%)均购自中国食品药品检定研究院;(+)-松脂素-4-O-β-D-葡萄吡喃糖苷对照品(批号17041701,纯度98%)购自成都普菲德生物技术有限公司;乙腈、乙酸均为色谱纯,甲醇为分析纯,水为超纯水。
30批连翘花样品(编号S1~S30)均为自采,经河北省中医药管理局孙宝惠主任药师鉴定均为木犀科植物连翘F. suspensa(Thunb.)Vahl 的干燥花。30批连翘花样品信息来源见表1。
2 方法与结果
2.1 样品干燥方式
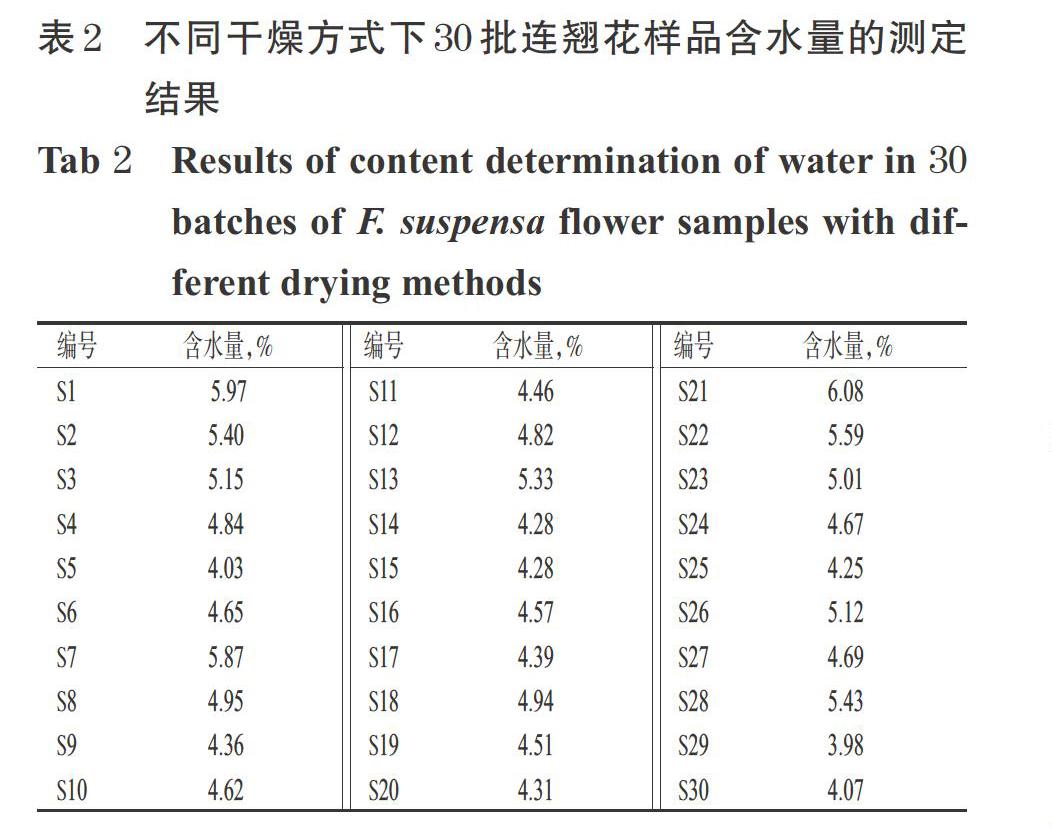
药材加工时,干燥方法是药材品质形成的关键因素之一,适宜的干燥方法有利于藥材的贮藏和有效成分保留,如热风干燥、冷冻干燥等,具有参数可控、干燥时间短、药材质量稳定等特点,而花类药材产地初加工时多采用晾晒的干燥方式[21-22]。故本研究取30批连翘花样品分别按不同干燥方式[阴干、真空冷冻干燥、烘箱干燥(30、50、70 ℃)、晒干]进行处理。阴干(编号S1~S5):将连翘花平铺于托盘内,每朵花之间应有间隙,置于通风干燥的室内,于20~25 ℃下避光晾干5天。真空冷冻干燥(编号S6~S10):将连翘花平铺于托盘内,每朵花之间应有间隙,置于-80 ℃冰箱预冷1 h后,置于真空冷冻干燥机中(真空度为600 Pa、冷冻温度为-56 ℃ )干燥12 h。烘箱干燥(编号S11~S30):将连翘花平铺于托盘内,每朵花之间应有间隙,分别置于30 ℃(编号S11~S15)干燥10 h、50 ℃(编号S16~S20)干燥5 h、70 ℃(编号S21~S25)恒温鼓风干燥机中干燥2 h。晒干(编号S26~S30):将连翘花平铺于托盘内,每朵花之间应有间隙,置于35~40 ℃阳光下晾晒10 h。按2020年版《中国药典》(四部)通则“0832水分测定法”第二法(烘干法)检测不同干燥方式下连翘花的含水量,含水量=(烘干前样品质量-烘干后样品质量)/烘干前样品质量×100%[23],结果见表2。
2.2 色谱条件
以Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)为色谱柱,以乙腈(A)-0.1%磷酸水溶液(B)为流动相进行梯度洗脱(0~3 min,5%A;3~6 min,5%A→15%A;6~9 min,15%A→20%A;9~18 min,20%A→30%A),流速为0.3 mL/min,检测波长为230 nm,柱温为35 ℃,进样量为1 μL。
2.3 溶液的制备
2.3.1 混合对照品溶液 精密称取连翘酯苷A、芦丁、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷对照品适量,分别置于25 mL量瓶中,加70%甲醇溶解并定容,制成上述成分质量浓度分别为1.886 2、1.372 1、0.956 8、0.144 2 mg/mL的单一对照品贮备液;精密吸取上述各单一对照品贮备液适量,置于10 mL量瓶中,加70%甲醇稀释并定容,制成上述成分质量浓度分别为0.018 9、0.068 6、0.004 8、0.014 4 mg/mL的混合对照品溶液,经0.22 ?m微孔滤膜滤过,取续滤液,即得。
2.3.2 供试品溶液 取经干燥的连翘花样品粉末(过三号筛,下同)约0.1 g,精密称定,加70%甲醇25 mL,称定质量,超声处理30 min,放冷,再次称定质量,用70%甲醇补足减失的质量,摇匀,经0.22 ?m微孔滤膜滤过,取续滤液,即得。
2.3.3 空白对照溶液 以70%甲醇为空白对照溶液。
2.4 系统适用性试验
取“2.3”项下混合对照品溶液、供试品溶液、空白对照溶液各适量,按“2.2”项下色谱条件进样测定,记录色谱图。结果,连翘酯苷A、芦丁、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷与其他相邻色谱峰的分离度均大于1.5,理论板数均不低于8 000,空白对照溶液对测定无干扰,详见图1。
2.5 线性关系考察
精密吸取“2.3.1”项下混合对照品溶液0.4、0.8、1.0、1.4、1.8、2.0 ?L,按“2.2”项下色谱条件进样测定,记录色谱图。以各待测成分进样量(X,?g)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表3。
2.6 精密度试验
精密吸取“2.3.1”项下混合对照品溶液,按“2.2”项下色谱条件连续进样测定6次,记录峰面积。结果,连翘酯苷A、芦丁、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷峰面积的RSD分别为0.32%、0.33%、0.15%、0.28%(n=6),表明仪器精密度良好。
2.7 重复性试验
精密称取经干燥的连翘花样品粉末(编号S1)约0.1 g,共6份,按“2.3.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果,连翘酯苷A、芦丁、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷含量的RSD分别为0.92%、1.05%、1.26%、1.10%(n=6),表明方法重复性良好。
2.8 稳定性试验
取“2.3.2”项下供试品溶液(编号S1),分别于室温下放置0、2、4、8、16、24、32 h时,按“2.2”项下色谱条件进样测定,记录峰面积。结果,连翘酯苷A、芦丁、连翘苷、(+)-松脂素-4-O-β-D-葡萄吡喃糖苷峰面积的RSD分别为1.21%、1.06%、1.19%、1.30%(n=7),表明供试品溶液在室温下放置32 h内稳定性良好。
2.9 加样回收率试验
精密称取已知含量的连翘花样品粉末(编号S1)约0.05 g,共9份,分别按质量比1 ∶ 0.5、1 ∶ 1、1 ∶ 1.5加入一定量的混合对照品溶液(按“2.3.1”项下方法制备,4种待测成分的质量浓度分别为0.27、3.22、0.09、0.18 mg/mL),按“2.3.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表4。
2.10 样品含量测定
精密称取30批经干燥的连翘花样品粉末约0.1 g,再按“2.3.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。每样品平行操作两次,取平均值,结果见表5。
以待测成分的含量(mg/g)为对象,采用Origin 8.0软件绘制连翘酯苷A等4種待测成分含量的柱状图;采用SPSS 25.0软件对连翘花中的4种待测成分进行单因素方差分析,P<0.05为差异有统计学意义,结果见图2。
由图2可知,不同干燥方式对连翘花中4种待测成分含量的影响显著,其中连翘酯苷A经30 ℃烘箱干燥后含量最高,其次为50 ℃烘箱干燥和真空冷冻干燥,晒干和70 ℃烘箱干燥较低,阴干最低(P<0.05)。芦丁在真空冷冻干燥后含量最高且显著高于其他干燥方式,以30 ℃烘箱干燥最低(P<0.05)。连翘苷以50 ℃烘箱干燥最高,30 ℃烘箱干燥次之,70 ℃烘箱干燥、晒干、真空冷冻干燥无明显差别,阴干最低。(+)-松脂素-4-O-β-D-葡萄吡喃糖苷以真空冷冻干燥最高且显著高于其他干燥方式(P<0.05),其他干燥方式无明显差异(P>0.05)。
2.11 TOPSIS分析
2.11.1 4种待测成分含量正、负理想值的确定
采用SPSS 22.0 软件对不同干燥方式连翘花中4种待测成分含量进行分析;采用DPS 7.05数据处理系统对样品含量测定结果进行TOPSIS分析,以确定4种待测成分含量均值的正理想值[Z+,Z+=(Z+
i1,Z+
i2…Z+
im)]和负理想值[Z-,Z-=(D-
i1,D-
i2…D-
im)][16],其中i表示样本值(i=1,2,……m),j表示指标值(j=1,2,……m)。结果,Z+=(0.563 0、0.485 4、0.498 0、0.460 3),Z-=(0.239 7、0.291 9、0.260 4、0.242 5)。
2.11.2 欧式贴近度 根据正理想值和负理想值,按如下公式计算不同干燥方式与两者之间最优方案的距离(D+)、与最劣方案的距离(D-)及最优解的欧氏贴近度(Ci)[16]:
D+
i=[∑][j=1][m][(Zij-Z +
j)2] [√]
D-
i=[∑][j=1][m][(Zij-Z -
j)2] [√]
[Ci=][D-
i
D+
i+D-
i]
若0
3 讨论
本课题组前期分别对甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液、乙腈-0.5%磷酸水溶液为流动相进行了考察。结果,各待测成分在乙腈中的分离度均优于甲醇,且基线平稳,0.1%磷酸水溶液对应峰形优于0.5%磷酸水溶液,故选择乙腈-0.1%磷酸水溶液为流动相。又对200~400 nm全波长进行了扫描,结果,在230 nm波长处峰面积大且峰形好,故选择230 nm为检测波长。
干燥作为保证中药材品质的重要措施,是中药材加工中必不可少的一个环节[11-15]。干燥可直接影响中药材的质量,会影响到其中一些热敏性、易氧化及光敏性成分的含量,因此干燥方式的选择对于中药材的质量控制至关重要[12-13]。常规的干燥方式如阴干成本虽低,但耗时较长,且花类药材在阴干条件下易发霉变质;晒干则容易受气候条件的影响,且干燥过程不受人为因素控制;70 ℃烘箱干燥所需时间虽然最短,但不利于热敏性及挥发类物质的保存[12];30、50 ℃烘箱干燥对成分的影响虽较70 ℃烘箱干燥小,但干燥时间相对较长;而真空冷冻干燥可最大限度地保存中药材的主要有效成分,也能较好地保存药材的外观、颜色、气味等,虽成本较高,但可弥补上述其他干燥方式的不足[24]。
本研究采用不同干燥方式[阴干、真空冷冻干燥、烘箱干燥(30、50、70 ℃)、晒干]对连翘花样品进行干燥。结果,30批连翘花样品的含水量为4.03%~6.08%。表明该结果在2020年版《中国药典》(一部)花类药材规定的水分范围内[16]。含量测定结果显示,不同干燥方式对连翘花中4种待测成分含量的影响显著,其中连翘酯苷A 在30 ℃烘箱干燥后含量最高,阴干含量最低;芦丁在真空冷冻干燥后含量最高,30 ℃烘箱干燥后含量最低;连翘苷以50 ℃烘箱干燥最高,阴干含量最低;(+)-松脂素-4-O-β-D-葡萄吡喃糖苷以真空冷冻干燥最高,其他干燥方式无明显差异。TOPSIS分析结果显示,不同干燥方式与理想方案的接近程度排序为真空冷冻干燥>50 ℃烘箱干燥>30 ℃烘箱干燥>晒干>70 ℃烘箱干燥>阴干。真空冷冻干燥所得连翘花样品较其他干燥方式所得样品各成分含量均相对较高,且水分含量与其他干燥方式相差不大。
综上所述,所建含量测定方法简便、重复性好,可用于同时测定连翘花中4種成分的含量。不同批次连翘花样品经不同干燥方式干燥后,各成分含量略有不同;连翘花样品以真空冷冻干燥方式最佳,其次为50 ℃烘箱干燥、30 ℃烘箱干燥,再次为晒干和70 ℃烘箱干燥,最后为阴干。
参考文献
[ 1 ] 神农本草经[M].徐树楠,牛兵占,编著.石家庄:河北科学技术出版社,1994:20.
[ 2 ] 李丹凤,李石飞,张立伟.连翘不同部位活性成分含量分析[J].山西医科大学学报,2015,46(11):1097-1100.
[ 3 ] 李时珍.本草纲目:第3册[M].北京:商务印书馆,1967:69-70.
[ 4 ] 宋贞贞,王丽,朱立忠,等.连翘饮片质量分析与评价[J].中国民族民间医药,2020,29(23):18-20.
[ 5 ] 叶良红,郭延垒,阳勇,等.基于UPLC-Q-TOF-MS法快速分析鉴定连翘化学成分[J].中药与临床,2020,11(3):14-18、35.
[ 6 ] 张宁.连翘主要有效成分的提取与药理作用[J].世界最新医学信息文摘,2019,19(91):180、189.
[ 7 ] 原江锋,胡金婉,王大红,等.不同产地连翘叶花中主要活性成分的含量分析[J].天然产物研究与开发,2020,32(3):389-397.
[ 8 ] 白美美,李丹凤,李石飞,等.连翘花中抑制酪氨酸酶活性成分研究[J].天然产物研究与开发,2017,29(10):1688- 1694.
[ 9 ] 樊雪艳,李丹凤,李石飞,等.连翘花美白活性有效部位的筛选及其成分分析[J].化学研究与应用,2018,30(6):887-892.
[10] 葛莉,姚园园,康天兰,等.不同收获期贯叶连翘花中抗氧化能力、主要活性物质变化及挥发性组分分离鉴定[J]. 草业学报,2017,26(9):66-74.
[11] 麻景梅,王迎春,李琛,等.不同干燥条件连翘叶茶有效成分含量比较[J].中国中医药信息杂志,2017,24(8):76- 79.
[12] 徐翔英,衷林清,刘乾松,等.不同干燥方式对草珊瑚中5个有效成分的影响[J].中药材,2018,41(6):1343-1347.
[13] 张润,陈千良,胡河荷.干燥方法对秦艽药材中有效成分含量的影响[J].时珍国医国药,2019,30(6):1348-1351.
[14] 李鹏辉,吴啟南,严辉,等.基于多元功效成分的干姜干燥方式研究[J].中草药,2018,49(18):4293-4301.
[15] 徐磊,熊吟,崔秀明,等.真空冷冻干燥工艺中天麻干燥特性和活性成分的变化规律研究及其质量评价[J].中药材,2018,41(7):1678-1683.
[16] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:Ⅻ.
[17] 李运,张霁,徐福荣,等.多指标决策分析TOPSIS对三七的质量评价研究[J].中草药,2017,48(22):4764-4771.
[18] 马天翔,顾志荣,许爱霞,等.基于OPLS结合熵权TOPSIS法对不同产地锁阳的鉴别与综合质量评价[J].中草药,2020,51(12):3284-3291.
[19] 严玉晶,崔婷,丁青,等.熵权TOPSIS法结合多指标成分综合评价金钱草药材的质量[J].中国药房,2020,31(23):2870-2876.
[20] 董自亮,李红亮,原欢欢,等. UPLC测定经典名方金水六君煎中11种成分[J].中草药,2021,52(3):711-717.
[21] 吳潍.产地初加工方法对中药材质量的影响[J].中医药管理杂志,2020,28(1):90-94.
[22] 彭亮,杨冰月,程虎印,等.不同干燥方法对远志筒及根中主要化学成分的影响[J].中草药,2018,49(21):5010- 5017.
[23] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:114.
[24] 范天慈,窦志英,李捷,等.不同干燥方式对中药成分影响的研究进展[J/OL].中国现代中药,2021[2021-03-10].https://doi.org/10.13313/j.issn.1673-4890.20200824004.
(收稿日期:2020-11-13 修回日期:2021-02-01)
(编辑:陈 宏)
