展毛野牡丹酚类化学成分的研究
2020-07-04何瑞杰王亚凤李典鹏黄永林
何瑞杰 王亚凤 李典鹏 黄永林
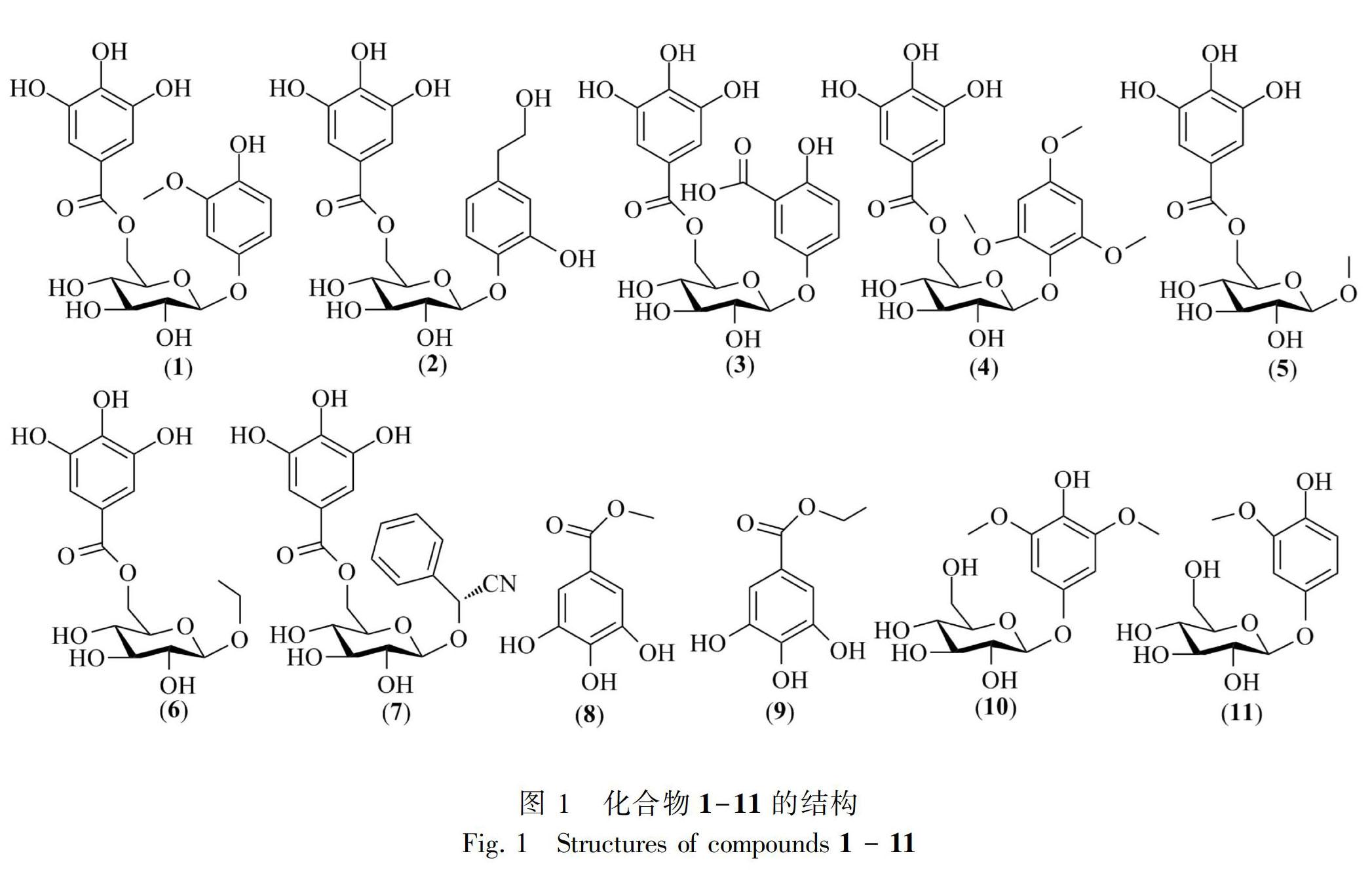
摘 要: 为了明确展毛野牡丹的化学成分,该研究采用Diaion HP20SS、MCI gel、Sephadex LH-20柱层析和反相高效液相色谱等方法,对展毛野牡丹根和茎的醇提物分别进行了分离纯化。结果表明:从展毛野牡丹中分离得到11个化合物,它们的结构经波谱数据分析和鉴定。它们分别是4-羟基-3-甲氧基苯酚1-O-β-D-(6′-O-没食子酰)-吡喃葡萄糖苷(1)、3,4-二羟基苯乙醇4-O-β-D-(6′-O-没食子酰基)-吡喃葡萄糖苷(2)、龙胆酸5-O-β-D-(6′-O-没食子酰基)-吡喃葡萄糖苷(3)、2,4,6-三甲氧基苯酚1-O-β-D-(6′-O-没食子酰)-吡喃葡萄糖苷 (4)、甲基6-O-没食子酰基-β-D-吡喃葡萄糖苷(5)、乙基6-O-没食子酰基-β-D-吡喃葡萄糖苷(6)、6′-O-没食子酰基黑樱苷(7)、没食子酸甲酯(8)、没食子酸乙酯(9)、2,6-二甲氧基对苯二酚4-O-β-D-吡喃葡萄糖苷(10)、 2-甲氧基对苯二酚4-O-β-D-吡喃葡萄糖苷(11)。所有化合物均为首次从展毛野牡丹中分离得到,化合物2-7、10和11为首次从该属植物中分离得到。
关键词: 展毛野牡丹, 野牡丹属, 化学成分, 酚类, 结构鉴定
中图分类号: Q946
文献标识码: A
文章编号: 1000-3142(2020)05-0641-07
Phenolic constituents from Melastoma normale
HE Ruijie, WANG Yafeng, LI Dianpeng, HUANG Yonglin*
( Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China )
Abstract: To clarify the chemical constituents of Melastoma normale, the ethanol extracts of roots of and stems M. normale were respectively isolated and purified by various chromatographic methods such as Diaion HP20SS, MCI gel, Sephadex LH-20, and reversed-phase HPLC. Eleven compounds were obtained, and their structures were identified by spectral data analyses. They are 4-hydroxy-3-methoxyphenyl 1-O-β-D-(6′-O-galloyol)-glucopyranoside (1), 3,4-dihydroxyphenethyol alcohol 4-O-β-D-(6′-O-galloyol)-glucopyranoside (2), gentisic acid 5-O-β-D-(6′-O-galloyl)-glucopyranoside (3), 2,4,6-trimethoxyphenol 1-O-β-D-(6′-O-galloyl)-glucopyranoside (4), methyl 6-O-galloyl-β-D-glucopyranoside (5), ethyl 6-O-galloyl-β-D-glucopyranoside (6), 6′-O-galloylprunasin (7),methyl gallate (8), ethyl gallate (9), 2,6-dimethoxy-hydroquinone-4-O-β-D-glucopyranoside (10), and 2-methoxy-hydroquinone-4-O-β-D-glucopyranoside (11). All these compounds were obtained firstly from this plant, and compounds 2-7, 10, and 11 were obtained from the genus Melastoma for the first time.
Key words: Melastoma normale, Melastoma L., chemical composition, phenolic constituents, structure identification
野牡丹科 (Melastomaceae)野牡丹属 (Melastoma L.) 植物在全世界约有100种,广泛分布于亚洲南部至大洋洲北部以及太平洋诸岛,在我国有9种1变种,分布于长江流域以南各省(区),本属植物多供药用(中国科学院中国植物志编辑委员会, 1984)。目前的研究表明该属植物含有黄酮类、鞣酸类、甾体类和萜类等多种化学成分,其中黄酮和可水解鞣酸类成分为本属植物的特征性成分,也是其发挥药效的活性成分(姚亮亮和刘新亚, 2010)。展毛野牡丹(Melastoma normale)为该属植物之一,主要分布于尼泊尔、印度、缅甸、马来西亚及菲律宾等国家,在我国主产于西藏、四川、广西、福建至台湾以南各省(区)(中国科学院中国植物志编辑委员会, 1984)。它的根和茎在广西壮族和瑶族民间常用于治疗痢疾、带下病、外伤出血等病证(广西壮族自治区食品药品监督管理局, 2014;黄瑞松, 2015)。现代的研究发现展毛野牡丹中含有没食子酸和鞣花酸为代表的鞣酸类成分(Takashi et al., 1994;田丽娟,2001;邹节明等,2011),这些成分通常显示出良好的抗菌、抗炎消肿等作用(Hagiwara et al., 2010;Rattanata et al., 2016)。为了更全面地了解展毛野牡丹化学成分,为该药用植物进一步开发利用提供理论基础,本研究对展毛野牡丹的根和茎的化学成分进行研究,从中分离得到11个酚类化合物(图1),这些化合物均为首次从该植物中分离到,其中化合物2-7、10和11为首次从野牡丹屬植物中分离得到。
1 材料与方法
1.1 材料和仪器
材料于2017年7月采自广西桂林市雁山镇,由黄俞淞副研究员鉴定为展毛野牡丹(Melastoma normale),标本(编号:20170716)保存于广西植物功能物质研究与利用重点实验室。
半制备液相色谱仪(北京赛谱锐思)、Agilent Zorbax SB-C18 色谱柱(5 μm, 9.4 mm × 250 mm,美国,Agilent)、BRUKER HCT电喷雾质谱(美国,布鲁克道尔顿公司)和MAT 95XP高分辨质谱 (美国,Thermo)、Brucker Avance Ш HD-500 MHz超导核磁共振波谱仪(瑞士,Brucker公司)、ADP440+ 旋光计(λ 589 nm, 1.0 cm)、Sephadex LH-20(瑞典,GE Healthcare Bio-Science AB)、MCI gel CHP 20P(日本,Mitsubishi Chemical公司)、Diaion HP20SS(日本,Mitsubishi Chemical公司),分离所用的试剂均为分析纯。
1.2 提取与分离
将自然风干、粉碎的展毛野牡丹根9 kg用75%乙醇室温提取3次,每次7 d,合并滤液,滤液减压浓缩得560 g浸膏。将浸膏分散于热水中,依次用石油醚和乙酸乙酯萃取得到三部分。取水部分(205 g)过Sephadex LH-20 (10 cm × 40 cm)层析柱,用甲醇-水(0%→100%, 10%为一梯度,每一梯度2 L)为洗脱剂进行洗脱,合并得到11组份Fr.1→Fr.11。Fr.1(40.0 g) 上HP20SS层析柱,用洗脱剂甲醇-水(0%→100%, 10%为一梯度,每一梯度1 L)进行洗脱,合并得到9组份Fr.1.1→Fr.1.9。Fr.1.1 (0.47 g)经半制备HPLC C18 (10 mm × 250 mm, 10% → 20% MeOH-H2O为流动相)色谱分离得到化合物9 (3.1 mg)。Fr.1.3 (1.5 g)经半制备HPLC C18 (10% → 20%甲醇-水為流动相) 色谱分离得到化合物7 (4.5 mg)和8 (5.3 mg)。Fr.3 (10 g)经MCI (以10%, 20%, 30%甲
醇-水为流动相,每一梯度600 mL)层析柱及Sephadex LH-20层析柱(以0% → 50%甲醇-水为流动相,10%为一梯度,每一梯度500 mL)分离得到化合物5 (2.8 mg)和6 (8.0 mg)。Fr.5 (15 g) 上MCI柱层析(以0% → 50%甲醇-水为流动相, 10%为一梯度,每一梯度1 L)及Sephadex LH-20柱层析(以0% → 50%甲醇-水为流动相,10%为一梯度,每一梯度500 mL)分离得到化合物1 (5.3 mg)、2 (3.4 mg)。
将自然风干、粉碎的展毛野牡丹茎5 kg用同样的方法萃取得到石油醚萃取部分、乙酸乙酯萃取部分及水部分。取水部分(120 g)过Sephadex LH-20 (10 cm× 40 cm)层析柱,用洗脱剂甲醇-水(0%→100%, 10%为一梯度,每一梯度2 L)进行洗脱,合并得到10组份Fr.1→Fr.10。Fr.4 (10.0 g) 上MCI层析柱(以10% → 50%甲醇-水, 10%为一梯度,每一梯度2 L)及Sephadex LH-20层析柱(以0% → 50%甲醇-水为流动相, 10%为一梯度,每一梯度600 mL)分离得到化合物3 (5.1 mg)、4 (3.2 mg)、10 (6.2 mg)、11 (4.5 mg)。
2 结构鉴定
化合物1 白色粉末。(+)HR-ESI-MS m/z: 477.10081 [M+Na]+(计算相对分子质量 477.10090),结合碳谱数据,其对应的分子式为C20H22O12Na+,在1H NMR (CD3OD,500 MHz) 中δ 7.01 (2H, s, H-2″, 6″)为一对对称芳烃的质子信号;δ6.60 (1H, d, J = 2.0 Hz, H-2), 6.53 (1H, d, J=8.7 Hz, H-5)和6.49 (1H, dd, J = 8.7, 2.0 Hz, H-6) 为一组ABX藕合芳烃质子信号;另外氢谱中还存在一组糖信号,其中δ 4.63 (1H, d, J=7.4 Hz, H-1′)为糖端头质子的信号, 4.49 (1H, dd, J=11.9, 1.9 Hz, H-6′a), 4.33 (1H, dd, J=11.9, 6.7 Hz, H-6′b), 3.62 (1H, m, H-5′), 3.30-3.41 (3H, m, H-2′-4′)为糖上其他质子信号;3.60 (3H, s, -OCH3)为甲氧基信号。在13C NMR (CD3OD, 125 MHz)中δ 166.9 (C-7″), 145.2 (C-3″, 5″), 138. 6 (C-4″), 120.1 (C-1″)和108.9 (C-2″, 6″)为典型的没食子酰基基团碳信号; 151.4 (C-1), 147.9 (C-3), 141.8 (C-4), 114.8 (C-5), 108.8 (C-6) 和102.6 (C-2) 为芳环上碳的信号;102.6 (C-1′), 76.5 (C-3′), 74.3 (C-5′), 73.7 (C-2′), 70.5 (C-4′), 63.7 (C-6′)为葡萄糖片段碳的信号;55.0 (-OCH3)为甲氧基信号;在异核远程相关 (HMBC)谱中甲氧基质子 (δH3.60)与C-3相关,糖端头质子(H-1′)与C-1相关,糖上H2-6′和 C-7″相关,说明甲氧基、糖端头碳氧键、没食子酰基分别连接在C-3、C-1和C-6′ 位上。以上波谱数据与文献(万春鹏和周寿然,2013)报道的数据基本一致,故化合物 1鉴定为4-羟基-3-甲氧基苯酚1-O-β-D-(6′-O-没食子酰)-吡喃葡萄糖苷。
化合物2 黄色粉末。(+)HR-ESI-MS m/z: 491.11650 [M+Na]+ (计算相对分子质量 491.11655),结合碳谱数据,其对应的分子式为C21H24O12Na+,1H NMR (CD3OD, 500 MHz) δ: 7.06 (2H, s, H-2″, 6″), 6.92 (1H, d, J = 1.8 Hz, H-2), 6.72 (1H, d, J = 8.6 Hz, H-5), 6.69 (1H, dd, J = 8.6, 1.8 Hz, H-6), 2.48 (2H, m, H-7), 4.72 (1H, d, J = 7.5 Hz, H-1′), 4.57 (1H, dd, J = 12.0, 1.6 Hz, H-6′a), 4.42 (1H, dd, J = 12.0, 5.6 Hz, H-6′b), 3.29-3.69 (6H, overlapped, H-2′ -5′, 8); 13C NMR (CD3OD, 125 MHz) δ: 168.4 (C-7″), 146.7 (C-3), 146.6 (C-3″, 5″), 146.4 (C-4), 140.2 (C-4″), 132.4 (C-1), 125.5 (C-6), 121.6 (C-1″), 119.5 (C-5), 116.9 (C-2), 110.1 (C-2″, 6″), 104.4 (C-1′), 77.5 (C-3′), 76.0 (C-5′), 75.0 (C-2′), 71.8 (C-4′), 65.0 (C-6′), 64.3 (C-8), 39.4 (C-7)。以上數据与文献(Takashi et al., 1993)报道的数据基本一致,故化合物2鉴定为3,4-二羟基苯乙醇4-O-β-D-(6′-O-没食子酰基)-吡喃葡萄糖苷。
化合物3 白色粉末。(+)HR-ESI-MS m/z: 469.09817 [M+H]+ (计算相对分子质量469.09822),其对应的分子式为C20H21O13+, 1H NMR (Acetone-d6, 500 MHz) δ: 7.54 (1H, d, J = 3.1 Hz, H-6), 7.26 (1H, dd, J = 9.0, 3.1 Hz, H-3), 7.11 (2H, s, H-2″, 6″), 6.77 (1H, d, J=9.0 Hz, H-4), 4.83 (1H, d, J=7.8 Hz, H-1′), 4.59 (1H, dd, J=11.9, 1.8 Hz, H-6′a), 4.46 (1H, dd, J=11.9, 6.2 Hz, H-6′b), 3.75 ( 1H, m, H-2′), 3.50-3.60 (3H, m, H-3′-5′);13C NMR (Acetone-d6, 125 MHz) δ: 172.8 (-COOH), 168.2 (C-7″), 157.4 (C-2), 150.9 (C-5), 146.3 (C-3″, 5″), 139.7 (C-4″), 126.5 (C-4), 121.2 (C-1″), 119.3 (C-6), 118.8 (C-3), 113.6 (C-1), 110.3 (C-2″, 6″), 103.3 (C-1′), 77.5 (C-3′), 75.3 (C-5′), 74.7 (C-2′), 71.5 (C-4′), 64.6 (C-6′)。以上数据与文献(Ishimaru et al., 1987) 报道的数据基本一致,故化合物 3鉴定为龙胆酸5-O-β-D-(6′-O-没食子酰基)-吡喃葡萄糖苷。
化合物4 白色粉末。(+)HR-ESI-MS m/z: 521.12703 [M+Na]+ (计算相对分子质量521.12711),其对应的分子式为C22H26O13Na+,1H NMR (CD3OD, 500 MHz) δ: 7.06 (2H, s, H-2″, 6″), 6.38 (2H, s, H-3, 5), 4.85 (1H, d, J=7.6 Hz,H-1′), 4.63 (1H, dd, J=11.9, 1.7 Hz, H-6′a), 4.43 (1H, dd, J=11.9, 6.6 Hz, H-6′b), 3.65 (6H, s, -OMe×2), 3.66 (3H, s, -OMe), 3.40-4.0 (4H, m, H-2′ -5′);13C NMR (CD3OD, 125 MHz) δ: 168.2 (C-7″), 155.8 (C-4), 154.6 (C-2, 6), 146.5 (C-3″, 5″), 139.8 (C-4″), 134.5 (C-1), 121.3 (C-1″), 110.1 (C-2″, 6″), 103.1 (C-1′), 96.2 (C-3, 5), 77.6 (C-3′), 75.6 (C-5′), 74.8 (C-2′), 71.7 (C-4′), 65.1 (C-6′), 61.2 (-OMe), 56.5 (-OMe×2)。以上数据与文献(Genichiro et al., 1982)报道的数据基本一致,故化合物 4鉴定为2,4,6-三甲氧基苯酚1-O-β-D-(6′-O-没食子酰)-吡喃葡萄糖苷。
化合物5 白色粉末。(+)HR-ESI-MS m/z: 369.07970 [M+Na]+ (计算相对分子质量369.07977),其对应的分子式为C14H18O10Na+, 1H NMR (CD3OD, 500 MHz) δ: 7.14 (2H, s, H-2′, 6′), 4.55 (1H, dd, J=11.9, 1.7 Hz, H-6a), 4.42 (1H, dd, J=11.9, 5.3 Hz, H-6b), 4.23 (1H, d, J=7.8 Hz, H-1), 3.58 (4H, m, H-2 -5), 3.48 (3H, s, -OCH3);13C NMR (CD3OD, 125 MHz) δ: 167. 5 (C-7′), 146.1 (C-3′, 5′), 139.5 (C-4′), 121.1 (C-1′), 110.0 (C-2′, 6′), 104.9 (C-1), 77.5 (C-3), 75.0 (C-5), 74.7 (C-2), 71.3 (C-4), 64.5 (C-6), 57.3 (-OCH3)。在HMBC谱中糖端头质子(H-1) 与甲氧基碳(δ 57.3)相关,糖上H2-6与C-7′相关,提示糖端头碳氧键及C-6位上碳氧键分别与甲基和没食子酰基相连。以上波谱数据与文献(Tanaka et al., 1984)报道的数据基本一致,故化合物5鉴定为甲基6-O-没食子酰基-吡喃葡萄糖苷。
化合物6 白色粉末。(-)HR-ESI-MS m/z: 359.09775 [M-H]- (计算相对分子质量359.09782),其对应的分子式为C15H19O10-,1H NMR (Acetone-d6, 500 MHz) δ: 7.14 (2H, s, H-2′, 6′), 4.55 (1H, dd, J=11.9, 1.8 Hz, H-6a), 4.32 (1H, dd, J=11.9, 5.6 Hz, H-6b), 4.27 (1H, d, J=7.5 Hz, H-1), 3.45-3.59 (4H, m, H-2 -5), 3.48 (1H, m, H-1″a), 3.24 (1H, m, H-1″b), 1.12 (3H, t, J=7.5 Hz, H-2″);13C NMR (CD3OD, 125 MHz) δ: 167.4 (C-7′), 146.0 (C-3′, 5′), 139.0 (C-4′), 121.2 (C-1′), 110.1 (C-2′, 6′), 104.0 (C-1), 77.3 (C-3), 74.9 (C-5), 74.5 (C-2), 71.2 (C-4), 64.4 (C-6), 65.4 (C-1″), 15.5 (C-2″)。在HMBC譜中糖端头质子(H-1) 与C-1″相关,糖上H2-6与羰基碳(C-7′)相关,提示糖端头碳氧键及C-6位上碳氧键分别与乙基及没食子酰基相连。以上波谱数据与文献(Kang et al., 2008) 报道的数据基本一致,故化合物6鉴定为乙基6-O-没食子酰基-吡喃葡萄糖苷。
化合物7 白色粉末。 [α]25D-17 (c 1.5, MeOH)。(+) HR-ESI-MS m/z: 448.12426 [M+H]+ (计算相对分子质量448.12437),其对应的分子式为C21H22NO10+,1 H NMR (Acetone-d6,500 MHz) δ: 7.56 (2H, dd, J=6.9, 2.9 Hz, H-4, 8), 7.41-7.46 (3H, m, H-5 -7), 7.21 (2H, s, H-2″, 6″), 5.84 (1H, s, H-2), 4.62 (1H, dd, J=11.9, 2.0 Hz, H-6′), 4.44 (1H, d, J=7.5 Hz, H-1′), 4.36 (1H, dd, J =11.9, 6.1 Hz, H-6′), 3.39-360 (4H, m, H-2′ -5′),13 C NMR (Acetone-d6, 125 MHz) δ: 166.9 (C-7″), 146.1 (C-3″, 5″), 138.9 (C-4″), 134.3 (C-3), 130.6 (C-6), 129.9 (C-5, 7), 128.6 (C-4, 8), 121.6 (C-1″), 118.9 (C-1), 110.0 (C-2″, 6″), 101.8 (C-1′), 77.6 (C-3′), 75.4 (C-5′), 74.4 (C-2′), 71.0 (C-4′), 68.1 (C-2), 64.2 (C-6′)。以上波谱数据与文献(Isaza et al., 2001) 报道的数据基本一致,故化合物7鉴定为6′-O-没食子酰基黑樱苷。
化合物8 无色针晶(甲醇),mp 203~204 ℃。(+)HR-ESI-MS m/z: 207.02685 [M+Na]+ (计算相对分子质量207.02694),对应的分子式为C8H8O5Na+,在1H NMR (CD3OD, 500 MHz) δ: 7.06 (2H, s, H-2, 6),3.80 (3H, s, -OCH3); 在13C NMR (CD3OD, 125 MHz) δ: 170.2 (C-7), 146.3 (C-3, 5), 138.9 (C-4),119.4 (C-1), 109.6 (C-2, 6), 51.9 (-OCH3)。在HMBC谱中甲氧基质子 (δH 3.80) 与C-7相关,提示甲氧基与羰基相连。以上波谱数据与文献(杨素珍等,2014) 报道的数据基本一致,故化合物8鉴定为没食子酸甲酯。
化合物9 无色针晶(甲醇),mp 136~137 ℃。(+)HR-ESI-MS m/z: 221.04251 [M+Na]+ (计算相对分子质量221.04259),对应的分子式为C9H10O5Na+,其比化合物8多了CH2片段。化合物9的氢碳谱数据与化合物8的相似,只是化合物9乙基信号代替化合物8甲基信号。1H NMR (CD3OD, 500 MHz) δ: 7.18 (2H, s, H-2, 6), 4.46 (2H, q, J = 7.5 Hz, H-8), 1.52 (3H, t, J = 7.5 Hz, H-9); 13C NMR (CD3OD, 125 MHz) δ: 169.2 (C-7), 146.8 (C-3, 5), 139.9 (C-4), 122.2 (C-1), 110.6 (C-2, 6), 61.9 (-OCH2), 15.2 (-CH3)。以上波谱数据与文献(黄文强等, 2006) 报道的数据基本一致,故化合物9鉴定为没食子酸乙酯。
化合物10 白色粉末。(+)HR-ESI-MS m/z: 355.10042 [M+Na]+ (计算相对分子质量355.10050),其对应的分子式为C14H20O9Na+,1H NMR (DMSO-d6, 500 MHz) δ: 6.10 (2H, s, H-3, 5), 4.63 (1H, J=7.7 Hz, H-1′), 3.70 (6H, s, -OCH3×2), 3.57 (1H, dd, J = 11.6, 1.8 Hz, H-6′a), 3.41 (1H, dd, J = 11.6, 5.1 Hz, H-6′b), 3.00-3.20 (4H, m, H-2′ -5′);13C NMR (DMSO-d6, 125 MHz) δ: 150.4 (C-4), 130.1 (C-1), 148.2 (C-2, 6), 102.2 (C-1′), 96.0 (C-3, 5), 73.5 (C-2′), 76.7 (C-3′), 70.1 (C-4′), 77.0 (C-5′), 61.0 (C-6′), 56.4 (-OCH3×2)。以上波谱数据与文献(林生等, 2010) 报道的数据基本一致,故化合物10鉴定为2,6-二甲氧基对苯二酚4-O-β-D-吡喃葡萄糖苷。
化合物11 白色粉末。(+)HR-ESI-MS m/z: 325.08986 [M+Na]+ (计算相对分子质量325.08994),其对应的分子式为C13H18O8Na+,1H NMR (D2O, 500 MHz) δ: 6.88 (1H, d, J = 8.7 Hz, H-6), 6.85 (1H, d, J = 2.6 Hz, H-3), 6.67 (1H, dd, J=8.7, 2.6 Hz, H-5), 4.99 (1H, d, J = 7.7 Hz, H-1′), 3.94 (1H, dd, J = 12.4, 2.0 Hz, H-6′a), 3.86 (3H, s, -OCH3), 3.74 (1H, dd, J=12.4, 6.0 Hz, H-6′b), 3.63-3.46 (4H, m, H-2′ -5′);13C NMR (D2O, 125 Hz) δ: 150.9 (C-4), 148.1 (C-2), 140.7 (C-1), 115.8 (C-6), 109.0 (C-5), 103.2 (C-3), 101.5 (C-1′), 76.2 (C-3′), 75.7 (C-5′), 73.1 (C-2′), 69.6 (C-4′), 60.7 (C-6′), 56.2 (-OCH3)。以上波谱数据与文献(甘茂罗等, 2010) 报道的数据基本一致,故化合物11鉴定为2-甲氧基对苯二酚4-O-β-D-吡喃葡萄糖苷。
3 讨论与结论
展毛野牡丹干燥的根即中药“羊开口”,是三金片系列产品的重要原料,展毛野牡丹的茎作为采挖羊开口的一个副产品, 可以形成大宗商品药材, 具有非常大的开发前景(蒋受军等,2010)。本研究从展毛野牡丹的根中分离鉴定得到7个没食子酸衍生物(即化合物1、2、5-9),大量研究表明,没食子酸衍生物具有显著的抗氧化、抑菌、抗病毒、抗炎等的作用(赵国强,1990),这些作用与羊开口的药用功效相符合。从展毛野牡丹的茎中也得到2个没食子酸衍生物(即化合物3和4),这为羊开口药用部位的扩大使用提供重要的科学依据。另外从展毛野牡丹的茎中还分离得到2个酚苷(即化合物10和11),随着更多的化学成分从该部位被发现以及这些成分药理研究的深入,作为采挖羊开口的一个副产品的茎有作为新药源的可能。
参考文献:
Editorial Committee of the Flora of China of Chinese Academy of Sciences, 1984. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 53(1): 154-155. [中国科学院中国植物志编辑委员会, 1984. 中国植物志 [M]. 北京:科学出版社, 53(1):154-155.]
Food and Drug Administration of Guangxi Zhuang Autonomous Region, 2014. Quality standard of Yao medicinal materials of Guangxi Zhuang Autonomous Region [M]. Nanning: Guangxi Science and Technology Press: 102. [廣西壮族自治区食品药品监督管理局, 2014. 广西壮族自治区瑶药材质量标准 [M]. 南宁:广西科技出版社:102.]
GAN ML, ZHU CG, ZHANG YL, et al., 2010. Constituents from a water-soluble portion of ethanolic extract of Iodes cirrhosa [J]. Chin J Chin Mat Med, 35(4): 456-467. [甘茂罗, 朱承根, 张艳玲, 等, 2010. 微花藤乙醇提取物水溶性部位的化学成分 [J]. 中国中药杂志, 35(4): 456-467.]
GENICHIRO N, HIROAKI N, ITSUO N, 1982. Tannins and related compounds IV. Seven new phenol glucoside gallates from Quercus stenophylla Makino. (1) [J]. Chem Pharm Bull, 30(6): 2061-2067.
HAGIWARA Y, KASUKABE T, KANEKO Y, et al., 2010. Ellagic acid, a natural polyphenolic compound, induces apoptosis and potentiates retinoic acid-induced diffe-rentiation of human leukemia HL-60 cells [J]. Int J Hematol, 92(1): 136-143.
HUANG RS, 2015. Selection and edition of Zhuang Medicine [M]. Nanning: Guangxi Science and Technology Press: 115-116. [黄瑞松, 2015. 壮药选编 [M]. 南宁: 广西科技出版社: 115-116.]
HUANG WQ, SHI MF, SONG XP, et al., 2006. Chemical constituents isolated from Fructus quisqualis [J]. J NW A & F Univ (Nat Sci Ed), 34(4): 79-82. [黄文强, 施敏峰, 宋晓平, 等, 2006. 使君子化学成分研究 [J]. 西北农林科技大学学报(自然科学版), 34(4): 79-82.]
ISAZA JH, ITO H, YOSHIDA T, 2001. Aflavonol glycoside-lignan ester and accompanying acylated glucosides from Monochaetum multiflorum [J]. Phytochemistry, 58(2): 321-327.
ISHIMARU K, NONAKA GI, NISHIOKA I, 1987. Phenolic glucoside gallates from Quercus mongolica and Q. acutissima [J]. Phytochemistry, 26(4): 1147-1152.
JIANG SJ, ZHONG XQ, L GR, et al., 2010. Textual research on the name and practice of ‘Yangkaikou” [J]. Chin Trad Herb Drugs, 41(9): 1555-1557. [蒋受军, 钟小清, 吕高荣, 等, 2010. 羊开口药材的名实考证 [J]. 中草药, 41(9): 1555-1557.]
KANG QJ, YANG XW, WU SH, et al., 2008. Chemical constituents from the stem bark of Trewia nudiflora L. and their antioxidant activities [J]. Plant Med, 74(4): 445-448.
LIN S, LIU MT, WANG SJ, et al., 2010. Phenolic and phenylethanoidal glycosides from branch of Fraxinus sieboldiana [J]. Chin J Chin Mat Med, 35(8): 992-996. [林生, 刘明韬, 王素娟, 等, 2010. 小蜡树的酚苷及苯乙醇苷类成分 [J]. 中国中药杂志, 35(8): 992-996.]
RATTANATA N, KLAYNONGSRUANG S, DADUANG S, et al., 2016. Inhibitory effects of gallic acid isolated from Caesalpinia mimosoides Lamk on cholangiocarcinoma cell lines and foodborne pathogenic bacteria [J]. Asian Pac J Canc Prev, 17(3): 1341-1345.
TAKASHI Y, FENG WS, TAKUO O, 1993. Twopolyhhenol glyeosides and tannins from Rosa cymosa [J]. Phytoehemistiy, 32(4): 1033-1036.
TAKASHI Y, HIROE A, TAKAKO F, et al., 1994. Monomeric and dimeric hydrolysable tannins from two melastomataceous species [J]. Phytochemistry, 37(3): 863-866.
TANAKA T, NONAKA G, NISHIOKA I, 1984. Tannins and related compounds. XVI. Isolation and characterization of six methylglucoside gallates and a gallic acid glucoside gallate from Sanguisorba officinalis L. [J]. Chem Pharm Bull, 32(1): 117-121.
TIAN LJ, 2001. Studies on the chemical constituents of Annona muricata and Melastoma normale [D]. Nanjing: China Pharmaceutical University: 36. [田丽娟, 2001. 圆滑番荔枝化学成分的研究展毛野牡丹化学成分的研究 [D]. 南京: 中国药科大学: 36.]
WANG CP, ZOU SR, 2013. Chemical constituents of Acer rubrum L. and their antioxidant activities [J]. Chem Ind For Prod, 33(5): 93-96. [万春鹏, 周寿然, 2013. 红槭树树枝化学成分及抗氧化活性研究 [J]. 林产化学与工业, 33(5): 93-96.]
YANG SZ, JIANG JQ, 2014. Chemical constituents from rhizomes of Paeonia sinjiangensis [J]. Chin Trad Herb Drugs, 45(6): 760-764. [杨素珍, 蒋建勤, 2014. 新疆芍药的化学成分研究 [J]. 中草药, 45(6): 760-764.]
YAO LL, LIU XY, 2010. Advances on investigation of chemical constituents, pharmacological activities and clinical applications of Melastoma [J]. J Jiangxi Univ Trad Chin Med, 22(6): 52-55. [姚亮亮, 刘新亚, 2010. 野牡丹属植物的化学成分、药理活性及临床应用研究概况 [J]. 江西中医药大学学报, 22(6): 52-55.]
ZHAO GQ, 1990. A review of gallic acid derivatives and their physiological activities [J]. Tianjin Pharm, (1): 19-23. [赵国强, 1990. 没食子酸衍生物及其生理活性综述 [J]. 天津药学, (1): 19-23.]
ZOU JM, ZHONG XQ, L GR, et al., 2011. Selection and compilation of Chinese herbal medicine resources with Guangxi characteristics [M]. Beijing: Science Press: 273-274. [鄒节明, 钟小清, 吕高荣, 等, 2011. 广西特色中草药资源选编 [M]. 北京: 科学出版社: 273-274.]
(责任编辑 周翠鸣)
