延胡索总生物碱对慢性低灌注脑损伤大鼠神经保护的作用研究
2020-07-02田冰来杰黄树明
田冰,来杰,黄树明*
(1.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040;2.黑龙江省药品检验研究中心,黑龙江 哈尔滨 150088)
慢性低灌注脑损伤(chronic cerebral hypoperfusion, CCH)又称慢性脑缺血,是由于长期脑血流量灌注不足所致。大量研究表明[1],慢性低灌注脑损伤可导致临床认知障碍和血管性痴呆的发展。对大鼠采用双侧颈总动脉永久性结扎(bilateral common carotid artery occlusion, BCCAO)可有效模拟脑慢性低灌注损伤[2]。
中药延胡索,又名元胡、延胡等,为罂粟科(Papaveraceae)紫堇属植物延胡索(CorydalisyanhusuoW. T. Wang ex Z. Y. Su et C. Y. Wu)的干燥块茎,具有活血,止痛,行气之功。延胡索的主要活性成分为生物碱类,包括叔胺型和季胺型生物碱,和大量非生物碱类成分。目前,从块茎中分离鉴定的生物碱已有60余种,如延胡索甲素(d-Corydaline)、延胡索乙素(tetrahydropalmatine, THP)、左旋延胡索乙素(levo-tetrahydropalmatine,l-THP)、脱氢紫堇碱(dehydrocorydaline,DHC)、四氢小檗碱(tetrahydroberberine, THB)和四氢黄连碱(tetrahydrocoptisine)等[3]。现代基础研究表明:延胡索具有扩张冠脉血管、提高冠脉血流量的作用[4],可预防大鼠急性全脑缺血再灌注损伤[5],抑制脑缺血再灌注组织中Ca2+聚集,明显减轻大鼠神经功能障碍并减轻由于缺血再灌注脑组织的病理损害[6]。延胡索总生物碱(TAC)是从延胡索块茎中提取纯化的总生物碱有效部位,纯度达80%以上。现代研究表明,中药的多组分特性对脑血管作用具有多靶点性和叠加性的特点[7],对中药有效部位的提取也有利于实际应用。本研究以永久性结扎双侧颈总动脉法制备大鼠模型,探讨TAC对慢性低灌注脑缺血的保护作用,为新药研发和临床应用奠定理论基础。
1 材料
1.1 实验动物
清洁级Wistar大鼠60只,雄性,体质量(220±20)g购自黑龙江中医药大学药物安全评价中心,合格证编号:SCXK(黑)2013-0004。饲养条件:温度(22±2)℃,湿度45%~60%,动物分笼饲养,12 h/d循环光照。
1.2 药品及试剂
TAC(黑龙江中医药大学实验实训中心提供,纯度达85%);尼莫地平(三精明水药业有限公司,批号:1805002);10%水合氯醛(哈尔滨医科大学附属第一医院,批号:20181219);伊红染液(北京索莱宝科技有限公司,批号:20181112);苏木素染液(北京索莱宝科技有限公司,批号:20181025);兔抗大鼠VEGF抗体(博士德生物工程有限公司,批号:13CM409B);DAB显色试剂盒(北京中杉金桥生物技术有限公司,批号:K196721D);聚合HRP标记抗兔Ig G试剂盒(北京博奥森生物技术有限公司,批号:A108168211);石蜡(LEICA,批号:39601095);手术器械(3-0手术线、手术剪、止血钳等);中性树胶、多聚甲醛、二甲苯、无水乙醇(国药集团化学试剂有限公司)。
1.3 仪器
JR-30鼠恒温实验台(成都泰盟软件有限公司);走横木装置(自制);Morris水迷宫装置及视频分析系统(成都泰盟科技有限公司);光学显微镜(LEICA,型号:DM2500);微量分析天平(瑞士Mettler Toledo公司,型号:XS205DU);自动组织脱水机、包埋机、漂片仪、烘片机(LEICA)。
2 方法
2.1 实验分组及BCCAO模型制备
取Wistar大鼠60只,随机分为4组:假手术组(Sham组)、模型组(Model组)、TAC组和阳性对照组(Nimodipine组)。大鼠于手术前禁食12 h,禁水3 h。使用10%水合氯醛按300 mg/kg腹腔注射进行麻醉,将大鼠仰卧位固定,于颈部正中切口,钝性分离肌肉组织和筋膜,轻柔分离颈动脉鞘和迷走神经,暴露双侧颈总动脉,采用3-0#手术线永久性结扎双侧颈总动脉,缝合皮肤。Sham组仅分离双侧颈总动脉,不进行永久性结扎。
2.2 给药方案
于造模4周后给药,TAC组灌胃给予TAC 7.0 mg/kg,1次/d;Sham组和Model组灌胃给予等体积的纯化水,Nimodipine组灌胃给予尼莫地平10.8 mg/kg,灌胃体积10 mL/kg,连续给药4周。
2.3 精细运动能力检测
走平衡木实验(balance beam test,BBT)是评价大鼠精细运动能力的实验方法[8]。给药4周后进行,将大鼠放置于刺激源一侧,打开噪声和灯光,大鼠延横木跑向暗箱后立即关闭噪声,实验在暗室中进行,持续7 d。记录指标包括:整体运动时间、起始区时间(潜伏期)及滑足次数。
2.4 认知功能检测
水迷宫实验(morris water maze,MWM)实验是评价大鼠海马区依赖性空间记忆和学习能力的经典行为学方法[9-10]。给药4周后进行,首先进行定位巡航实验。将水池分为4个部分,第一象限设为目标象限并放置逃生平台,每只大鼠依次从二、三、四象限入水寻找逃生平台,探索时间为120 s。若找到平台,让大鼠继续站台10 s,若未找到则引导上台,站台20 s,实验持续5 d,记录大鼠的逃避潜伏期。在空间探索实验中,于第6天移除逃生平台,将大鼠从第三象限面入水,设定平台中点向外2倍半径区域为记忆有效区域,探索时间为120 s,记录大鼠穿越平台有效区域的次数[11]。
2.5 组织学检测
各组实验动物在行为学实验后,立即处死大鼠,用生理盐水进行心脏灌流,待肝脏发白后,用4%多聚甲醛继续灌流。取脑组织于4%多聚甲醛固定48h,随后进行洗涤、脱水、透明、浸蜡、包埋、切片等步骤制备脑病理切片。用苏木素和伊红染液进行常规HE染色[12],中性树胶封固,于20×10倍光学显微镜下观察海马CA1区的组织形态学改变。
2.6 免疫组织化学检测
血管内皮生长因子(vascular endothelial growth factor,VEGF)是衡量脑组织缺血缺氧后血管重新生成的重要因素[13]。首先将包埋好的脑组织切片(厚度5um),于65℃烘箱脱蜡12 h,PBS冲洗3次,3% H2O2孵育15 min,微波热修复抗原15 min,PBS冲洗3次,随后加入一抗,37℃孵育1.5 h,加入二抗,滴加DAB显色,放入蒸馏水终止显色。复染、HCl分化后,中性树胶封固。光学显微镜拍照,应用Image-Pro Plus(IPP)图象分析系统,计算各组大鼠脑内皮质区阳性细胞的累积光密度值(Integrated optic density, IOD)。
2.7 统计学分析

3 结果
3.1 CCH对精细运动能力的影响及TAC的改善作用
各组大鼠在BBT中,整体运动时间、潜伏期及滑足次数结果的统计分析见表1。整体运动时间结果表明:与Sham组比较,Model组整体运动时间明显增加(P<0.01);与Model组比较,TAC组整体运动时间明显减少(P<0.01)。大鼠潜伏期结果显示:与Sham组比较,Model组的潜伏期显著增长(P<0.01);与Model组相比,TAC组潜伏期缩短,且存在显著性差异(P<0.05)。大鼠滑足次数结果显示:与Sham组比较,Model组滑足次数明显增加,表明CCH对大鼠精细运动产生阻碍;与Model组比较,TAC组滑足次数明显减少(P<0.01)。
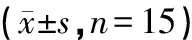
表1 TAC在BBT中的测试结果
注:与Sham组相比,△P<0.01;与Model组相比,□P<0.05,■P<0.01
3.2 CCH对大鼠认知功能的影响及TAC的改善作用
各组大鼠在MWM实验中的结果见表2。在定位巡航实验中,Model组大鼠逃避潜伏期(41.83±7.28)s与Sham组大鼠逃避潜伏期(18.06±3.90)s相比较具有显著性差异(P<0.01),提示CCH大鼠的学习能力下降;与Model组相比较,TAC组大鼠逃避潜伏期(35.96±6.84)s明显缩短(P<0.05),提示TAC可减少CCH大鼠的逃避潜伏期,改善大鼠学习记忆能力。在空间探索实验中,Model组大鼠穿越平台有效次数(3.10 ±1.02)次与Sham组大鼠穿越平台的有效次数(5.12±1.80)次相比具有统计学意义(P<0.05);与Model组比较,TAC组大鼠穿越平台有效次数(5.60 ±1.98)次明显增加(P<0.01),提示TAC可改善慢性低灌注引起的学习记忆障碍。
3.3 CCH对大鼠海马CA1区神经元的影响及TAC的改善作用
各组大鼠于20×10倍光学显微镜下观察HE染色后海马CA1区的组织形态学改变,实验结果显示,Sham组大鼠脑海马CA1区细胞结构清晰完整,染色均匀,神经细胞数目较多且排列较整齐。与Sham组比较,Model组大鼠CA1区细胞排列稀疏,神经元数目较少,并伴有核固缩和空泡现象。与Model组比较,TAC组神经细胞形态趋于正常,细胞间排列紧密,神经细胞数目增多,提示CCH可造成脑海马CA1区神经细胞组织形态的改变和损伤,经TAC治疗后有明显改善。见图1。
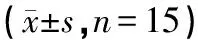
表2 TAC在MWM实验中的测试结果
注:与Sham组相比,△P<0.05,▲P<0.01;与Model组相比,□P<0.05,■P<0.01
3.4 CCH对大鼠脑海马CA1区VEGF表达的影响及TAC的改善作用
利用光学显微镜于20×10倍可以观察到VEGF阳性细胞经DAB显色后主要表达于细胞膜和细胞浆内。通过对各组大鼠阳性细胞VEGF的IOD值测定,结果显示与Sham组相比,Model组VEGF的阳性细胞数显著增加(P<0.01),提示在缺血状态下脑内VEGF表达增加;与Model组比较,TAC组大鼠阳性细胞数显著增加(P<0.01),提示TAC可上调CCH大鼠VEGF的表达,促进血管新生。见表3、图2。
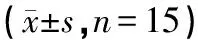
表3 各组大鼠脑海马CA1区VEGF的表达情况
注:与Sham组相比,△P<0.01;与Model组相比,□P<0.01
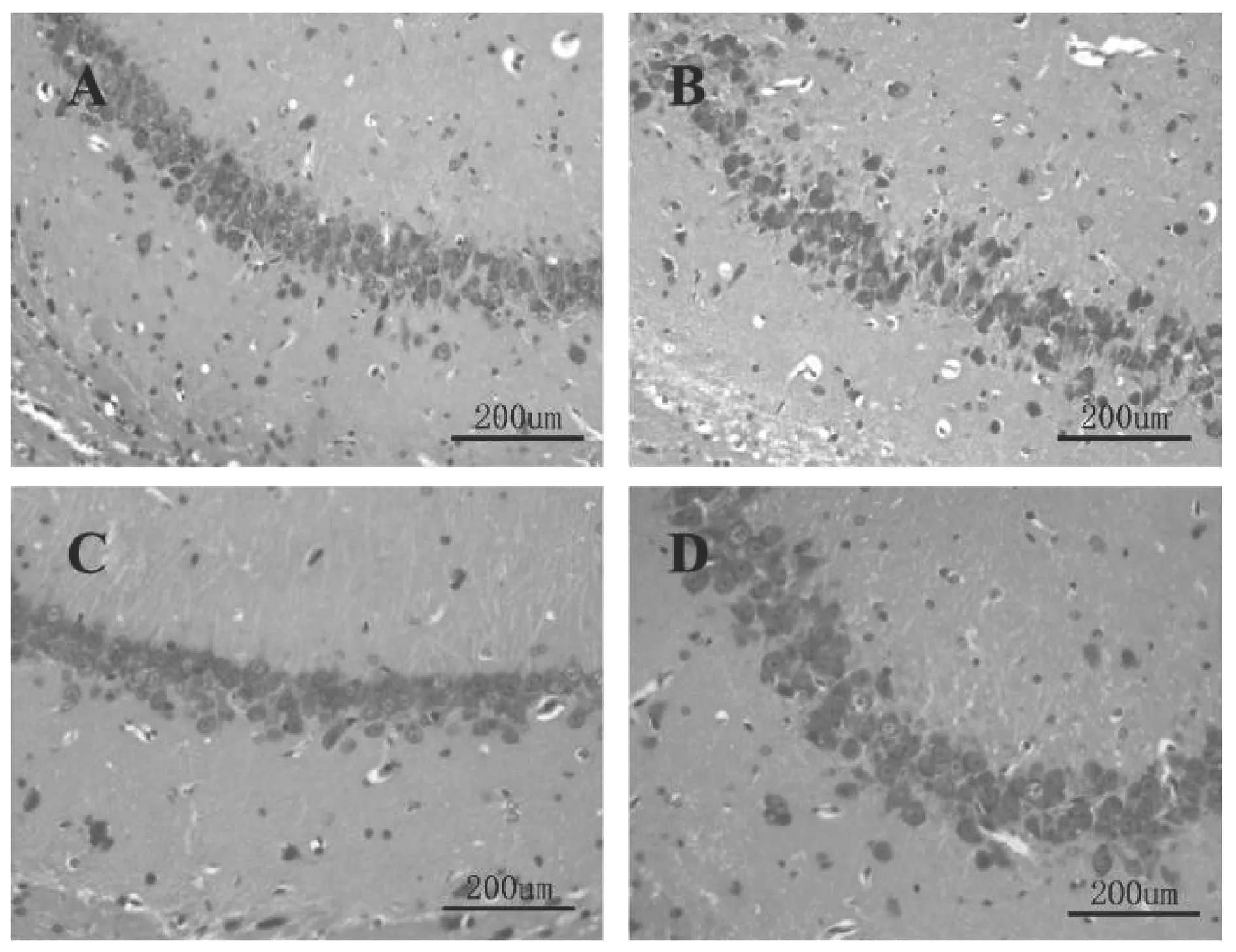
注:A-Sham组;B-Model组;C-TAC组(7.0 mg/kg);D-Nimodipine组(10.8 mg/kg)图1 TAC对CCH大鼠脑海马CA1区组织形态的影响(HE,×200,标尺:20 um)

注:A-Sham组;B-Model组;C-TAC组(7.0 mg/kg);D-Nimodipine组(10.8 mg/kg)图2 TAC对CCH大鼠脑海马CA1区VEGF表达的影响(×200,标尺:20 um)
4 讨论
随着人口老龄化的剧增,神经退行性疾病如血管性痴呆、阿尔兹海默病的发病率与日俱增,而脑血管功能障碍无疑是一个促成因素[14]。CCH可诱发脑缺血缺氧,是导致神经功能障碍及认知衰退的重因素,因此,开发研制治疗CCH的药物具有重大意义。目前常用的复刻慢性全脑缺血模型包括:BCCAO法和改良的Pulsinell四动脉结扎法等[15],BCCAO法是引起认知动能障碍和血管性痴呆最为常用的造模方法,并且与临床上由于血流量减少所致的慢性脑缺血行为十分相似,因此本研究采用BCCAO对TAC治疗CCH的作用进行探讨。
延胡索为活血、化瘀类中药,其主要活性成分为生物碱类,许多单独成分如紫堇碱、L-四氢巴马汀均有对心脑血管作用的报道[16]。中药治疗是多靶点和各单一成分相叠加的综合作用,近年来对TAC类有效部位作为指标的研究相对较少,且进展缓慢,这为延胡索今后的药物开发和临床应用提供了机遇。因此本研究选用TAC为研究对象,探讨其对CCH损伤的治疗作用,本实验结果也证实了上述观点。
本研究采用BWT评价CCH大鼠精细运动能力,通过改进原有评分标准,记录整体运动时间、潜伏期、大鼠滑足次数,客观的判断CCH大鼠精细运动能力的变化。实验结果显示,Model组各项指标明显高于Sham组,说明Model组大鼠精细运动能力发生障碍,而TAC组大鼠各项指标明显小于Model组,表明给予TAC后,CCH大鼠精细运动障碍得到改善。MWM实验结果提示,在定位巡航实验中,给予TAC 4周后大鼠逃避潜伏期曲线变化明显,而Model组曲线变化幅度较小。在空间探索实验中,Sham组和TAC组穿越平台有效区域次数明显增加,表现出对原有平台空间记忆的能力。研究采用HE染色观察海马CA1区细胞形态的改变,经TAC治疗后神经细胞间排列紧密,神经细胞数目增加,形态趋于正常,提示TAC可改善由CCH引起的脑神经元细胞缺失和形态改变。VEGF又称血管通透因子,是一种高度特异性促血管内皮细胞的生长因子,在体内可诱导血管新生[17]。本研究发现经TAC治疗后可显著上调VEGF阳性细胞的表达,由此推断TAC可能通过诱导血管新生,改善脑缺血后的血流灌注发挥神经保护作用。本研究仅针对VEGF的表达进行了研究,但具体的作用机制还有待深入探讨。
