天然产物来源的金属β-内酰胺酶抑制剂
2020-06-19刘琛楠刘忆霜肖春玲
刘琛楠,刘忆霜,肖春玲
·综述·
天然产物来源的金属β-内酰胺酶抑制剂
刘琛楠,刘忆霜,肖春玲
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家新药(微生物)筛选实验室
近年来,随着包括耐万古霉素肠球菌、耐甲氧西林金黄色葡萄球菌、耐碳青霉烯肺炎克雷伯菌、耐碳青霉烯鲍曼不动杆菌、耐碳青霉烯铜绿假单胞菌、耐碳青霉烯类肠杆菌科细菌在内的多重耐药菌的出现和传播[1-12],临床使用的抗生素逐渐对其失效,使得细菌耐药形势越发严峻。并且治疗这些耐药菌感染的抗生素研发进展缓慢,1970 年至今,仅有5 种新类型的抗生素上市,包括 2000 年上市的噁唑烷酮类药物利奈唑胺(linezolid)[13-14]、2003 年上市的环脂肽类药物达托霉素(daptomycin)[15-16]、2007 年上市的截断侧耳类药物瑞他帕林(retapamulin)[17]、2012 年上市的二芳基喹啉类药物贝达喹啉(bedaquiline)[18]和 2014 年上市的迪拉马尼(delamanid)[19-20]。对已有抗生素的改造是药物研发的另一种常用策略。例如,2018 年上市的 plazomicin[21]是西索米星(sisomicin)[22]的衍生物,在2016 年 12 月其临床 III 期结果达到了 FDA 设定的,对复杂性尿路感染患者临床试验中非劣效于美罗培南的试验目标,并且达到了欧洲药监局 EMA 对复杂性尿路感染和急性肾盂肾炎临床III期试验设定的优效试验终点。与西索米星相比,这类药物安全性更好,且可避免多种氨基糖苷类抗生素钝化酶对其进行修饰,但仍无法有效克服耐药菌已有的耐药性,plazomicin 对于部分耐药菌株的最低抑菌浓度(MIC)> 128 μg/ml。
在新型抗耐药菌药物匮乏,且结构改造药物不能有效克服细菌已有耐药性的情况下,对能使已有抗生素恢复活性的抗生素增效剂的研究是抗耐药菌药物研发的另一有效途径,其中最为成功的是 β-内酰胺酶抑制剂。已上市的 β-内酰胺酶抑制剂有 3 种——克拉维酸、舒巴坦与他唑巴坦。该类增效剂与 β-内酰胺类抗生素的联合用药可以显著降低它们对大部分耐药革兰氏阳性菌和部分耐药革兰氏阴性菌的 MIC[23]。
β-内酰胺类抗生素是临床上广泛使用的一类抗生素[24],以化学结构含有 β-内酰胺核为标志,包括被称为“最后一道防线”的碳青霉烯类抗生素[25],具有毒性低、适应证广的特点。然而,该类抗生素的长期使用使得其耐药情况越发严峻,其中 β-内酰胺酶的产生是细菌对其耐药的主要机制之一。β-内酰胺酶可分为以丝氨酸残基为活性位点的丝氨酸 β-内酰胺酶和活性中心存在一个或两个锌离子的金属 β-内酰胺酶(MBLs)两种[26]。按照分子结构分类,可将 β-内酰胺酶分为 A、B、C、D 4 类,其中 A 类、C 类、D 类为丝氨酸 β-内酰胺酶,B 类为金属 β-内酰胺酶,可以细分为 B1、B2、B3 3 个子类,B1 类金属 β-内酰胺酶活性部位含有两个锌离子,包括新德里金属 β-内酰胺酶(NDM)、维罗纳金属 β-内酰胺酶(VIM)、碳青霉烯酶(IMP)、首尔亚胺培南水解酶(SIM)、圣保罗金属 β-内酰胺酶(SPM)等;B2 类 MBLs 是活性位点含有一个锌离子的碳青霉烯酶,如 CphA;B3 类 MBLs 如 L1 等[27]。
引起细菌耐药的 β-内酰胺酶早期以 A 类 β-内酰胺酶为主,故克拉维酸、舒巴坦与他唑巴坦均为丝氨酸 β-内酰胺酶抑制剂[28-31],有效保证了 β-内酰胺类抗生素的药物活性。但 2008 年出现的新德里金属β-内酰胺酶-1(NDM-1)[32]具有对亚胺培南、美罗培南等碳青霉烯类抗生素的抗性,可水解除氨曲南外的 β-内酰胺类抗生素,且克拉维酸等丝氨酸 β-内酰胺酶抑制剂对其无抑制效果,其出现和广泛传播导致了严重的抗生素耐药,因而急需对 MBLs 抑制剂进行研究。
早期研究的金属 β-内酰胺酶抑制剂以金属螯合剂为主,但其对于体内含锌酶如血管紧张素转化酶等有较低选择性,影响其成药前景,因而还需研发具有不同作用机制的金属 β-内酰胺酶抑制剂。天然产物不仅是药物的重要来源,更是获取药物先导结构的重要途径[33],丝氨酸 β-内酰胺酶抑制剂克拉维酸是从链霉菌的发酵液中分离,舒巴坦与他唑巴坦是基于青霉素的母核 6-氨基青霉烷酸(6-APA)合成的[28-30],且天然产物结构新颖,能从中获得具有新机制的金属 β-内酰胺酶抑制剂,目前天然产物来源的金属 β-内酰胺酶抑制剂已取得了一些进展,按其作用机制综述如下。
1 与锌离子结合的抑制剂
由曲霉菌发酵产生的天然产物曲霉明 A (aspergillomarasmine A,AMA)[34]是L-天冬氨酸的衍生物,含有 4 个羧酸基团和 3 个含氮基团,可通过螯合锌离子快速有效抑制 NDM-1 和 VIM-2。AMA 与乙二胺四乙酸(EDTA,一种常见的金属离子螯合剂)结构相似,但毒性更低,约为其 1/5,其结构如图 1 所示,NDM-1 的蛋白结构与 AMA-锌离子复合物结构如图 2所示。AMA 对 NDM-1 的 IC50为(4.0 ± 1.0)μmol/L,对 VIM-2 的 IC50为(9.6 ± 2.4)μmol/L,并且 AMA 可恢复美罗培南对产 NDM-1 或 VIM-2 的大肠杆菌、鲍曼不动杆菌和铜绿假单胞菌的活性。
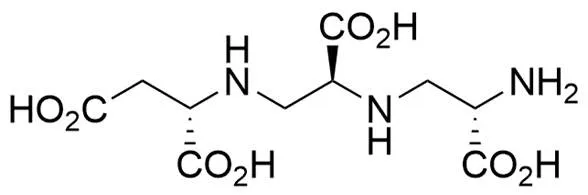
图 1 曲霉明 A
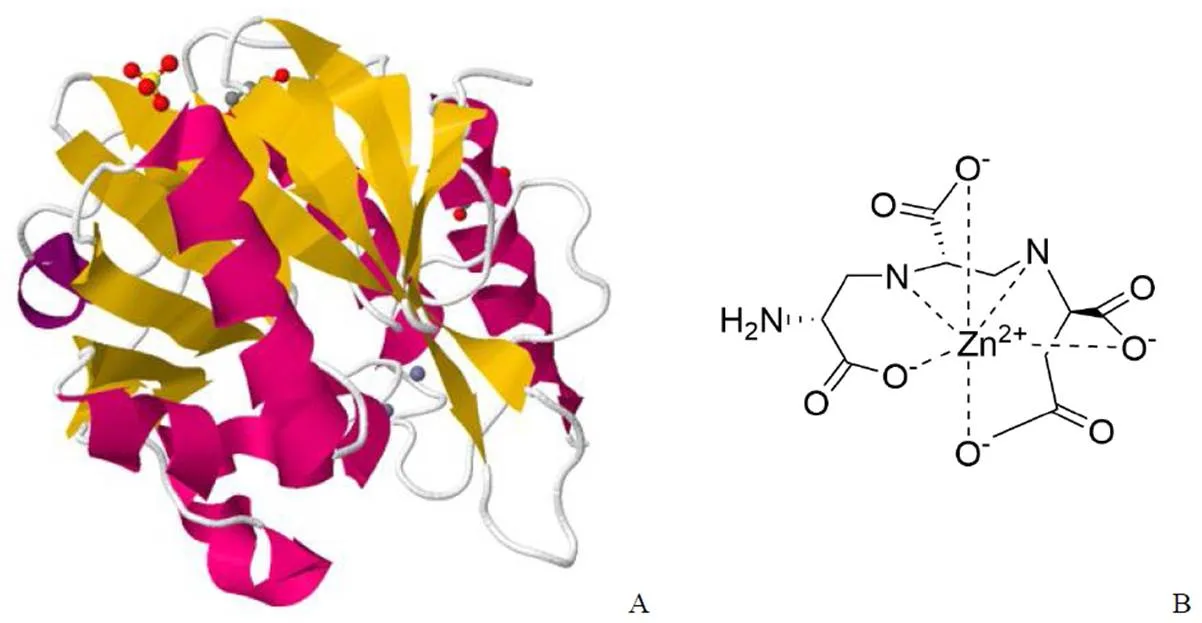
图 2 NDM-1 蛋白与美罗培南的晶体结构(A)与曲霉明 A-锌离子复合物结构式(B)
在感染表达 NDM-1 的肺炎克雷伯菌的小鼠中,10 mg/kg 美罗培南与 30 mg/kg 的AMA 联合使用,亦有效地恢复了美罗培南的活性[35]。
在酶与 AMA 的混合液中,将 AMA 通过过滤去除,并添加过量硫酸锌可恢复酶的活性,说明其与酶活性中心的锌离子相互作用;但进一步的结构研究显示,AMA 与酶的相互作用不仅是简单地与锌离子螯合,推测可能还有其他作用机制。Albu等[36]发现,AMA 在其自身几乎所有手性中心变化的情况下,对 NDM-1 仍保持了显著的体外活性,使得对 AMA 进行结构改造更加便捷。目前已有更多学者对 AMA 的全合成路线进行研究[37-39]。
2 与酶保守活性位点残基相互作用的抑制剂
Liu 等[40]通过酶抑制剂筛选发现,从木兰树皮分离得到的天然产物木兰醇(图 3)可抑制 NDM-1 酶的活性,其 IC50值为 6.47 μg/ml。木兰醇在 32 μg/ml 的浓度下,与美罗培南联合使用,可使重组工程菌3(NDM-1)、5(NDM-5)和7(NDM-9)的MIC 降低 4 倍。木兰醇的动物毒性研究表明,与金属离子螯合剂相比,木兰醇在小鼠和大鼠体内并无临床毒性征兆,且在 1 g/kg 的给药剂量下,以比格犬为实验动物,并无死亡。
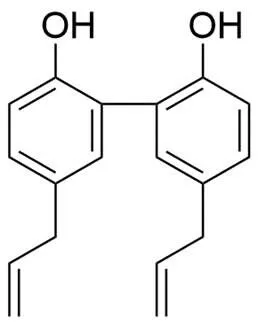
图 3 木兰醇
木兰醇-NDM-1 复合物分子对接结果提示,二者的相互作用可能包括范德华力、静电作用、溶剂化作用等(图 4),且木兰醇本身并不影响 NDM-1 的稳定性。其分子对接和点突变实验结果表明,木兰醇通过直接结合在具有 110 ~ 200 个残基的 NDM-1 催化口袋上,与 Ser217 形成氢键从而阻塞了 NDM-1 与美罗培南的结合,使 NDM-1 无法水解美罗培南。其中,Val73、Lys211、Leu218、Gly219 和 His250 有极强的结合能(ΔEtotal≤–2.0 kcal/mol),因此这可能是木兰醇与 NDM-1 结合的关键位点。除这 5 个残基外,His189、Cys208、Asp212 和 Ser217 的结合能也较强(ΔEtotal≤–1.0 kcal/mol)。
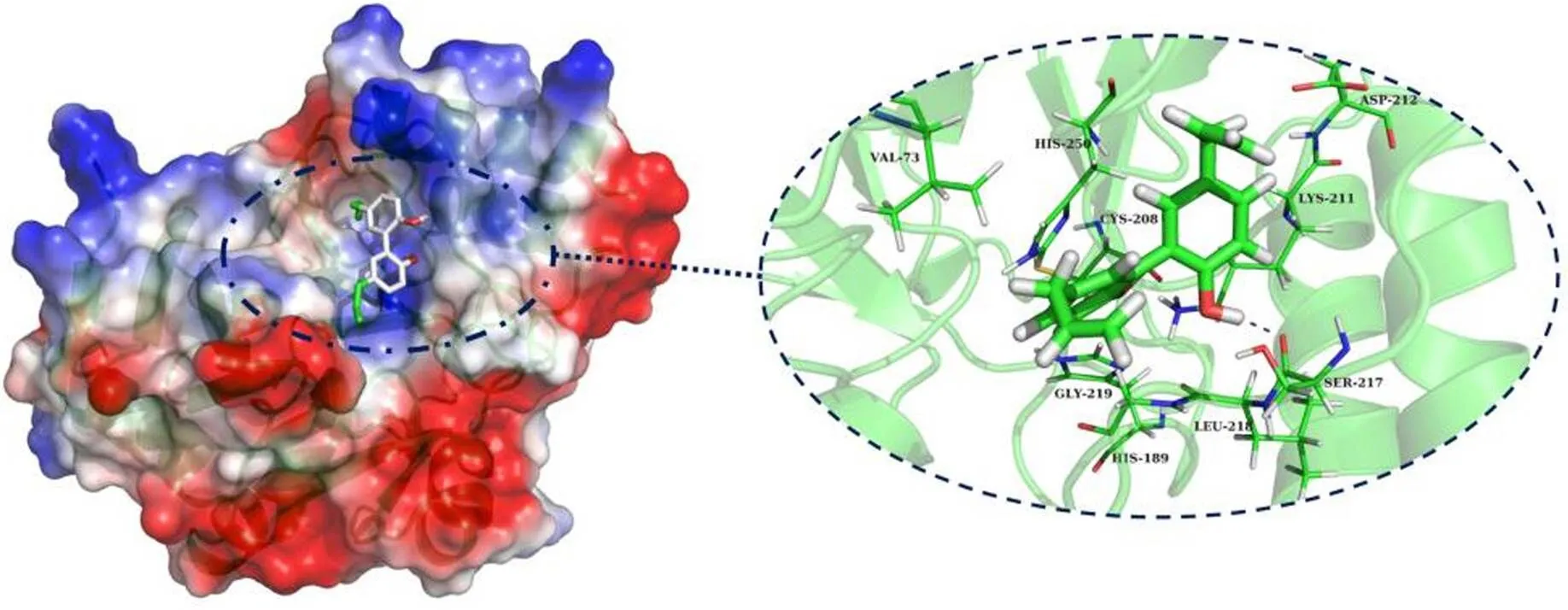
图 4 木兰醇-NDM-1 复合物的结构
3 既抑制锌离子结合又与酶保守活性位点残基相互作用的抑制剂
3.1 三环类天然产物
Payne 等[41]在 2002 年发现了一系列从毛壳菌中得到的三环天然产物对金属 β-内酰胺酶II 有抑制活性。其中化合物 SB238569 对 IMP-1 的i 值为 17 μmol/L,对II的i 值为 79 μmol/L,对脆弱拟杆菌酶(CfiA)的i 值为3.4 μmol/L,在其以8 μg/ml 浓度与美罗培南联用时,对含有 CfiA 的临床分离菌株表现出良好的抗菌协同作用。
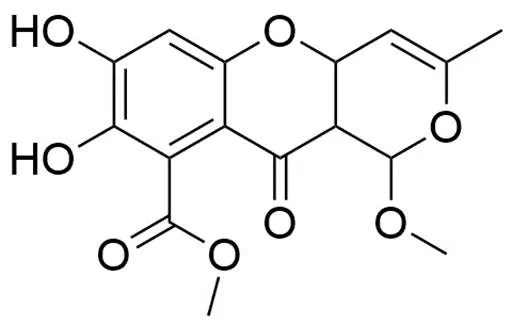
图 5 SB236050
化合物 SB236050(图 5)与 CfiA 复合物的晶体结构(图 6)显示其羧酸基团与锌离子相互结合,并与 Lys184、Asn193、His162 有相互作用,当其处于闭合构象时,与 Trp49 的柔性吲哚环有相互作用,这可能是其具有 β-内酰胺酶抑制活性的原因。
3.2 黄芩苷
黄芩苷(baicalin)是黄芩中含量最高的黄酮类化合物之一,作为食用药用植物中的生物活性成分,其对 NDM-1 的 IC50值为(3.89 ± 1.1)μmol/L[42]。体外实验结果显示,黄芩苷本身具有抗菌活性,其对产 NDM-1 的重组工程菌BL21(DE3)/pET28a-NDM-1 的 MIC ≥ 512 μg/ml;当其与氨苄西林联用时,可使氨苄西林的 MIC 由128 μg/ml降至 8 μg/ml;与头孢呋辛联用可使其 MIC 由 64 μg/ml 降低至 4 μg/ml。黄芩苷(图 7)与 NDM-1 的分子对接结果(图 8)表明黄芩苷中的羧基可能与锌离子相互作用,且与氨基酸残基 Glu52、Glu123、Met67、Trp93 和 Phe70 形成氢键。
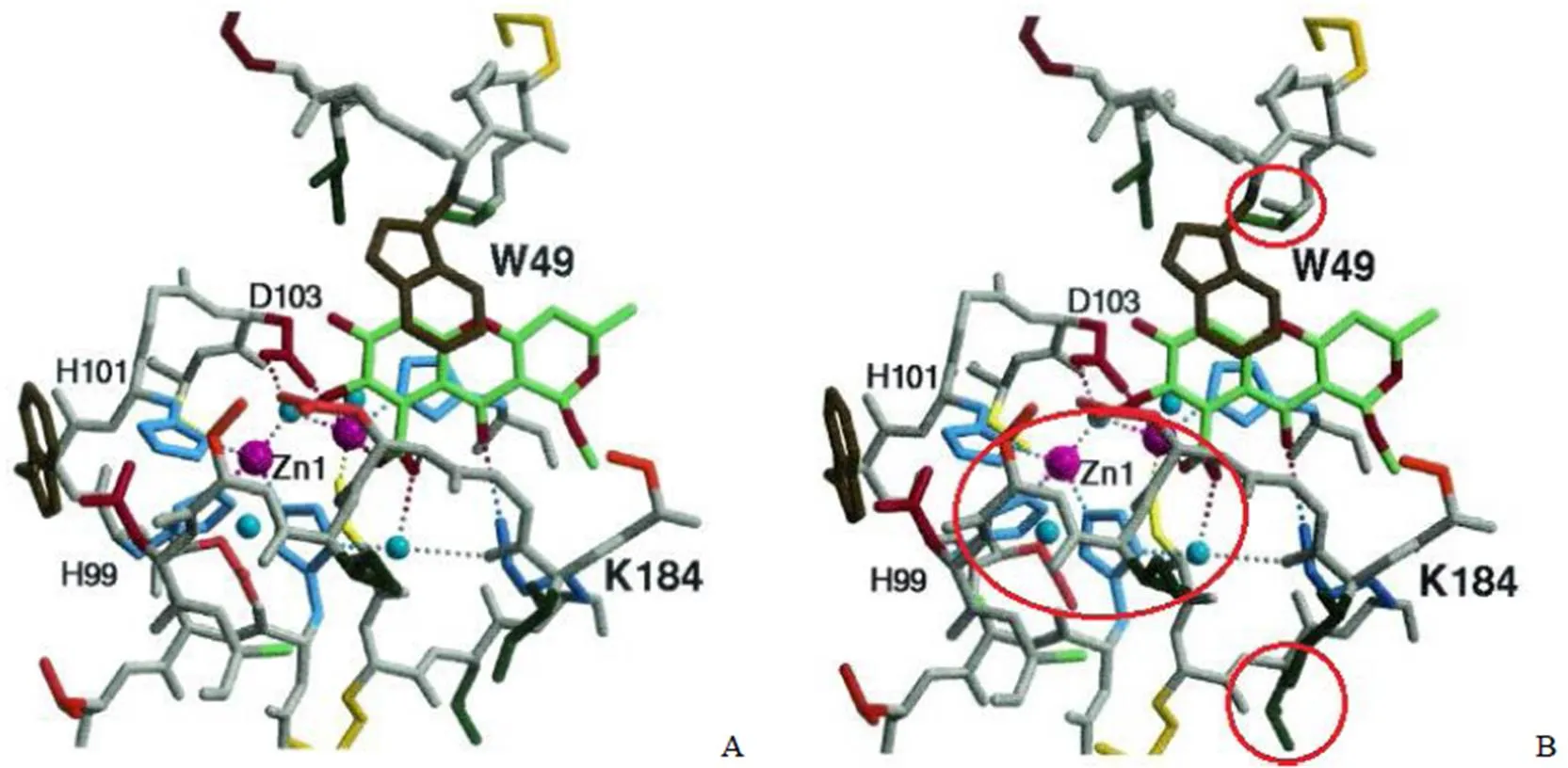
图 6 三环类天然产物 SB236050 与 CfiA 酶活性位点结合的立体视图(A:复合物的一般构象;B:复合物的闭合构象)
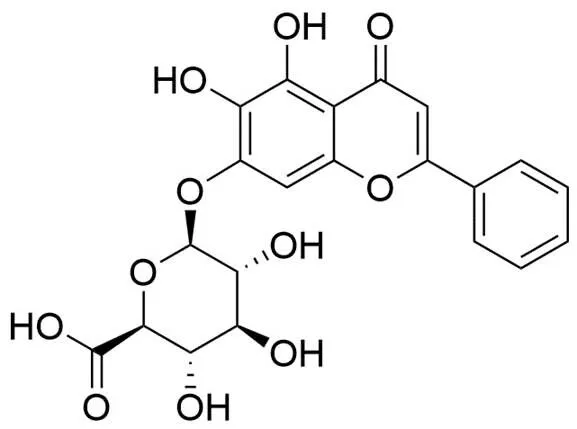
图 7 黄芩苷
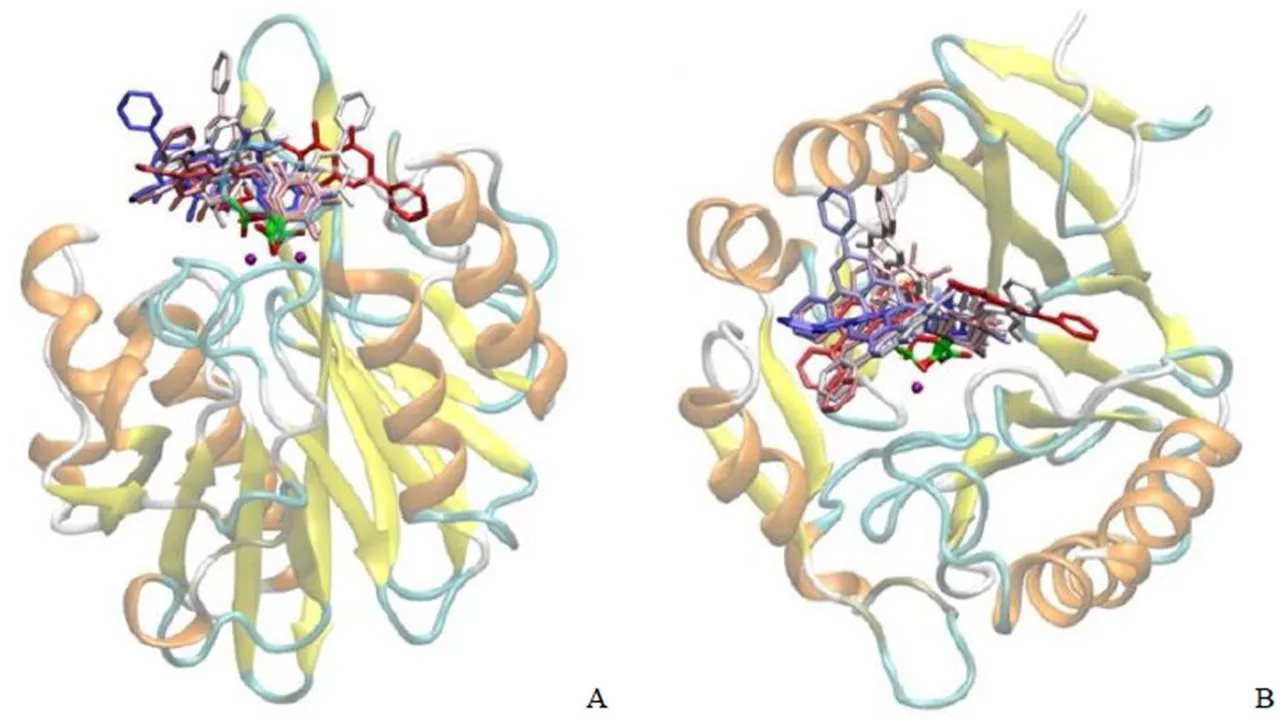
图 8 黄芩苷-NDM-1分子对接结构(A:正视图;B:俯视图)
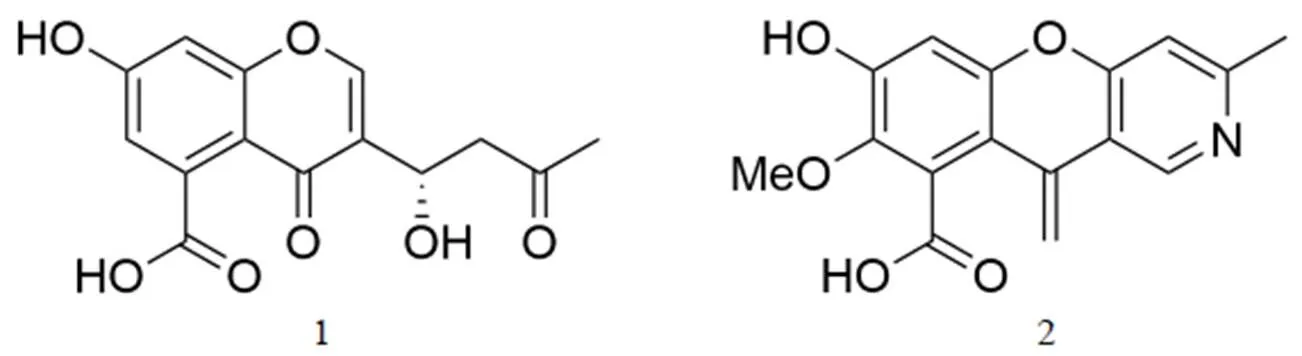
图 9 聚酮类化合物
4 作用机制研究尚未明确
4.1 聚酮类化合物
Gan 等[43]从中国新疆土壤分离的菌株sp.I09F 484 的发酵产物中得到的 2 个新的聚酮类化合物 1 和 2(图9),对 NDM-1 有一定的抑制活性,IC50值分别为 94.9 μmol/L 和 87.9 μmol/L。聚酮类化合物 1 和 2 与三环天然产物具有相同的色酮-5-羧酸骨架。
4.2 Bulgecin A
Bulgecin A(BlgA)[44]是一种硫酸化的 N-乙酰-D-葡萄糖胺(图 10),通过 β-糖基与 4-羟基-5-羟基甲基丙氨酸环相连,可抑制从中得到的金属 β-内酰胺酶 BceII,但当该酶只有一个锌离子时,BlgA 对其无抑制作用。通过锌离子回补实验可知,BlgA 的作用机制可能与酶中的锌离子有关,分子对接结果表明其可能通过糖基上的硫酸基团与锌离子相互作用。Skalweit 和 Li[45]从菌株发酵产物中分离得到BlgA,分离得到的 BlgA 对 L1 有较弱的抑制活性,在体外实验中,对产 VIM-2 的耐药菌也有一定的抑制活性。
4.3 茶黄素-3,3'-没食子酸酯
茶黄素-3,3'-没食子酸酯(TFDG)(图 11)被发现是一种本身没有抗菌活性的天然产物,但可以抑制金属 β-内酰胺酶的活性,其对 NDM-1 的 IC50值为 8.75 μg/ml;当其以 32 μg/ml 与 β-内酰胺类抗生素联用时,可使抗生素的 MIC 降低 4 ~ 8 倍;在体外实验中,TFDG 与 β-内酰胺抗生素的组合在小鼠金黄色葡萄球菌肺炎模型中显示出有效的保护作用[46]。分子动力学模拟结果表明,TFDG 与氨基酸残基 Gln242 和 Ser369 结合,可能与其发挥作用相关。
4.4 其他
Shi等[47]以 NDM-1 的蛋白晶体结构数据对天然产物化合物库来源的 2000 余个化合物进行虚拟筛选,筛选出包括甜菊苷、橘皮苷、香叶木苷、巴龙霉素、芸香甘 5 种化合物具有抑制活性,其 IC50值分别为(214.1 ± 13.37)、(3.348 ± 1.35)、(20.740 ± 1.92)、(20.764 ± 2.21)和(15.53 ± 1.32)μmol/L。
5 结语
近年来,耐药菌感染的临床严峻性以及相关治疗药物的短缺已成为威胁人民健康的重要因素。β-内酰胺类抗生素在抗感染领域发挥着重要的作用,是应用最广泛的抗生素,但广泛应用使其耐药问题愈发严重。随着多种耐药机制的出现,已有的 β-内酰胺类抗生素在临床使用中逐渐失去其原有作用,而 β-内酰胺酶的出现与广泛传播是其耐药的最主要原因。在具有新化学实体的抗生素研发困难,且结构改造药物不能有效克服细菌已有耐药性的情况下,针对 β-内酰胺酶尤其是金属 β-内酰胺酶研制新型的 β-内酰胺酶抑制剂成为抗耐药药物研发的有效途径。
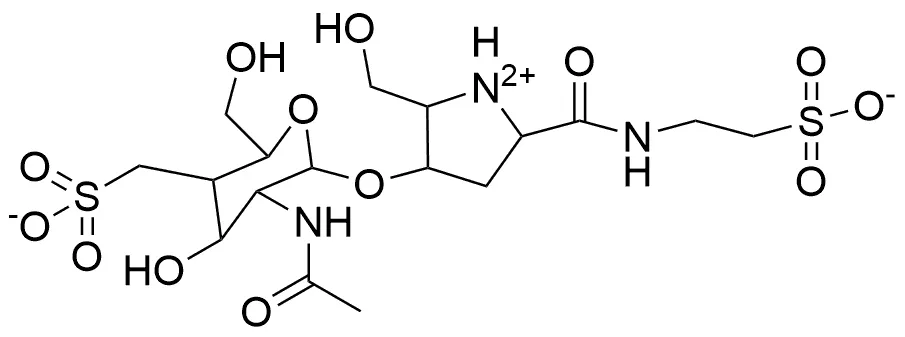
图 10 Bulgecin A
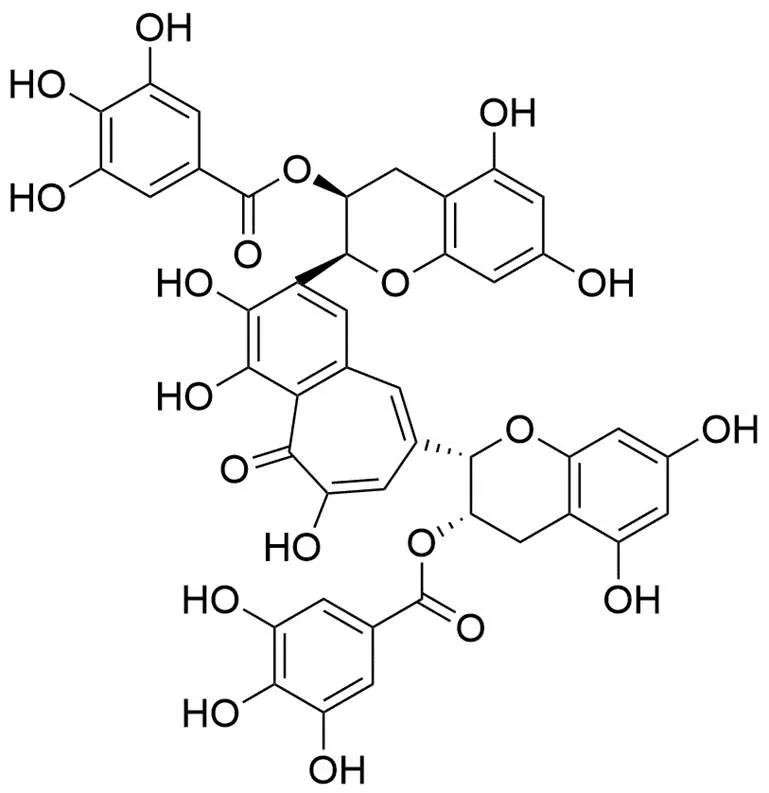
图 11 茶黄素-3,3'-没食子酸酯
早期研发的金属 β-内酰胺酶抑制剂以金属离子螯合剂为主,如1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、2-S-(4-氨基苯)-1,4,7 三氮杂环壬烷-1,4,7-三乙酸(NOTA)[48]等,作用机制为与金属 β-内酰胺酶中的锌离子进行螯合,该类抑制剂对体内其他金属酶的低选择性和毒性是该类金属 β-内酰胺酶抑制剂开发的难点。除此之外,如二苯基四醇、半胱氨酸肽、甲酰氨基甲酸、琥珀酸衍生物等[49-58]非天然产物来源的分子被发现具有对金属 β-内酰胺酶的抑制活性,但这些化合物的药物代谢、毒性、作用机制等对这些分子的成药性存在较大影响。
目前更多的金属 β-内酰胺酶抑制剂是分子结构中具有与芳香族基团结合的螯合基团[59](如硫醇基团[60]、羧酸基团[61]等)的化合物。另一可能的研究方向是获得能模拟高能四面体中间产物的化合物。尽管丝氨酸 β-内酰胺酶与金属 β-内酰胺的结构之间差异明显,但环硼酸酯类化合物[62]通过模拟 β-内酰胺类药物在被酶水解过程中所产生的四面体中间产物从而发挥其对两类 β-内酰胺酶的抑制活性。该类化合物的发现提示我们通过筛选获得具有模拟高能四面体中间产物的化合物可能获得丝氨酸 β-内酰胺酶与金属 β-内酰胺酶的双重抑制剂或金属 β-内酰胺酶的新型抑制剂。天然产物来源分子结构新颖丰富,易从中获得具有更多不同结构的分子或具有新机制的金属 β-内酰胺酶抑制剂,故本文综述了部分天然产物来源的金属 β-内酰胺酶抑制剂,以期对新型的 MBLs 抑制剂的研发有所帮助。此外,应用虚拟筛选[63],基于片段的药物发现[64]等技术对天然产物库进行高通量筛选和基于天然产物的结构改造,也可对金属 β-内酰胺酶抑制剂的研发提供帮助。
[1] Li CH, Wu AH. Interim standard definition of MDR, XDR and PDR multidrug-resistant bacteria -- International expert advice. Chin J Infect Control, 2014, 13(1):62-64. (in Chinese)
李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议. 中国感染控制杂志, 2014, 13(1):62-64.
[2] McDermott H, Skally M, O'Rourke J, et al. Vancomycin-resistant enterococci (VRE) in the intensive care unit in a nonoutbreak setting: identification of potential reservoirs and epidemiological associations between patient and environmental VRE. Infect Control Hosp Epidemio, 2018, 39(1):40-45.
[3] Reyes K, Bardossy AC, Zervos M. Vancomycin-resistant enterococci: epidemiology, infection prevention, and control. Infect Dis Clin North Am, 2016, 30(4):953-965.
[4] Qureshi ZA, Hittle LE, O'Hara JA, et al. Colistin-resistant Acinetobacter baumannii: beyond carbapenem resistance. Clin Infect Dis, 2015, 60(9):1295-1303.
[5] Aires-de-Sousa M. Methicillin-resistant Staphylococcus aureus among animals: current overview. Clin Microbiol Infect, 2017, 23(6):373-380.
[6] Buehrle DJ, Shields RK, Clarke LG, et al. Carbapenem-resistant pseudomonas aeruginosa bacteremia: risk factors for mortality and microbiologic treatment failure. Antimicrob Agents Chemothe, 2016, 61(1):e01243-16.
[7] Zhanel GG, Lawson CD, Zelenitsky S, et al. Comparison of the next-generation aminoglycoside plazomicin to gentamicin, tobramycin and amikacin. Expert Rev Anti Infect Ther, 2012, 10(4):459-473.
[8] Rojas LJ, Salim M, Cober E, et al. Colistin resistance in carbapenem-resistant klebsiella pneumoniae: laboratory detection and impact on mortality. Clin Infect Dis, 2017, 64(6):711-718.
[9] Lutgring JD, Limbago BM. The problem of carbapenemase- producing-carbapenem-resistant-enterobacteriaceae detection. J Clin Microbiol, 2016, 54(3):529-534.
[10] Labarca JA, Salles MJ, Seas C, et al. Carbapenem resistance in Pseudomonas aeruginosa and Acinetobacter baumannii in the nosocomial setting in Latin America. Crit Rev Microbiol, 2016, 42(2): 276-292.
[11] Khurshid M, Rasool MH, Ashfaq UA, et al. Emergence of ISAba1 harboring carbapenem-resistant Acinetobacter baumannii isolates in Pakistan. Future Microbiol, 2017, 12:1261-1269.
[12] Deurenberg RH, Stobberingh EE. The molecular evolution of hospital- and community-associated methicillin-resistant Staphylococcus aureus. Curr Mol Med, 2009, 9(2):100-115.
[13] Zahedi Bialvaei A, Rahbar M, Yousefi M, et al. Linezolid: a promising option in the treatment of Gram-positives. J Antimicrob Chemother, 2017, 72(2):354-364.
[14] Kishor K, Dhasmana N, Kamble SS, et al. Linezolid Induced Adverse Drug Reactions - an Update. Curr Drug Metab, 2015, 16(7):553-559.
[15] Frankenfeld C, Mittal S, Melendez Y, et al. Daptomycin: a comparison of two intravenous formulations. Drug Des Devel Ther, 2018, 12:1953-1958.
[16] Chuang YC, Wang JT, Lin HY, et al. Daptomycin versus linezolid for treatment of vancomycin-resistant enterococcal bacteremia: systematic review and meta-analysis. BMC Infect Dis, 2014, 14:687.
[17] Dhingra D, Parakh A, Ramachandran S. Retapamulin: a newer topical antibiotic. J Postgrad Med, 2013, 59(2):127-130.
[18] Pym AS, Diacon AH, Tang SJ, et al. Bedaquiline in the treatment of multidrug- and extensively drug-resistant tuberculosis. Eur Respir J, 2016, 47(2):564-574.
[19] Gler MT, Skripconoka V, Sanchez-Garavito E, et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med, 2012, 366(23):2151-2160.
[20] Blair HA, Scott LJ. Delamanid: a review of its use in patients with multidrug-resistant tuberculosis. Drugs, 2015, 75(1):91-100.
[21] Karaiskos I, Souli M, Giamarellou H. Plazomicin: an investigational therapy for the treatment of urinary tract infections. Expert Opin Investig Drugs, 2015, 24(11):1501-1511.
[22] Haidar G, Alkroud A, Cheng S, et al. Association between the presence of aminoglycoside-modifying enzymes and in vitro activity of gentamicin, tobramycin, amikacin, and plazomicin against klebsiella pneumoniae carbapenemase- and extended-spectrum-β-lactamase- producing enterobacter species. Antimicrob Agents Chemother, 2016, 60(9):5208-5214.
[23] Lyu Y, Li JT, Shan AL. Evaluation of the antibacterial activity of the combination of β-lactamase inhibitor and β-lactam antimicrobial agents. Chin J Clin Pharmacol, 1998, 14(1):54-58. (in Chinese)
吕媛, 李家泰, 单爱莲. β-内酰胺酶抑制剂与β-内酰胺类抗生素联合应用的抗菌作用评价. 中国临床药理学杂志, 1998, 14(1):54-58.
[24] Zheng W. Advances in research on β-lactamase and its inhibitors. World Notes Antibiot, 2001, 22(2):49-56. (in Chinese)
郑卫. β-内酰胺酶及其抑制剂研究进展. 国外医药(抗生素分册), 2001, 22(2):49-56.
[25] Shi S, Wu C, Lu P, et al. Pharmacologic characteristics and clinical application evaluation of four carbapenems antibiotics. Women's Health Res, 2019, (2):110, 115. (in Chinese)
师帅, 吴春, 陆萍, 等. 4种碳青霉烯类抗生素的药理学特点及临床应用评价. 中外女性健康研究, 2019, (2):110, 115.
[26] Williams JD. Beta-lactamases and beta-lactamase inhibitors. Int J Antimicrob Agents, 1999, 12 Suppl 1:S3-S7, discussion S26-S27.
[27] Naas T, Oueslati S, Bonnin RA, et al. Beta-lactamase database (BLDB) - structure and function. J Enzyme Inhib Med Chem, 2017, 32(1): 917-919.
[28] Reading C, Cole M. Clavulanic acid: a beta-lactamase-inhiting beta-lactam from Streptomyces clavuligerus. Antimicrob Agents Chemother, 1977, 11(5):852-857.
[29] Adnan S, Paterson DL, Lipman J, et al. Ampicillin/sulbactam: its potential use in treating infections in critically ill patients. Int J Antimicrob Agents, 2013, 42(5):384-389.
[30] Scott LJ. Ceftolozane/tazobactam: a review in complicated intra-abdominal and urinary tract infections. Drugs, 2016, 76(2):231- 242.
[31] Hedberg M, Nord CE. Beta-lactam resistance in anaerobic bacteria: a review. J Chemother, 1996, 8(1):3-16.
[32] Shen B, Zhu C, Gao X, et al. Oligopeptides as full-length New Delhi metallo-β-lactamase-1 (NDM-1) inhibitors. PLoS One, 2017, 12(5): e0177293.
[33] Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010. J Nat Prod, 2012, 75(3):311-335.
[34] King AM, Reid-Yu SA, Wang W, et al. Aspergillomarasmine a overcomes metallo-beta-lactamase antibiotic resistance. Nature, 2014, 510(7506):503-506.
[35] von Nussbaum F, Schiffer G. Aspergillomarasmine A, an inhibitor of bacterial metallo-β-lactamases conferring blaNDM and blaVIM resistance. Angew Chem Int Ed Engl, 2014, 53(44):11696-11698.
[36] Albu SA, Koteva K, King AM, et al. Total synthesis of aspergillomarasmine A and related compounds: a sulfamidate approach enables exploration of structure-activity relationships. Angew Chem Int Ed Engl, 2016, 55(42):13259-13262.
[37] Liao D, Yang S, Wang J, et al. Total synthesis and structural reassignment of aspergillomarasmine A. Angew Chem Int Ed Engl, 2016, 55(13):4291-4295.
[38] Zhang J, Wang S, Bai Y, et al. Total syntheses of natural metallophores staphylopine and aspergillomarasmine A. J Org Chem, 2017, 82(24): 13643-13648.
[39] Koteva K, King AM, Capretta A, et al. Total synthesis and activity of the metallo-β-lactamase inhibitor aspergillomarasmine A. Angew Chem Int Ed Engl, 2016, 55(6):2210-2212.
[40] Liu S, Zhou Y, Niu X, et al. Magnolol restores the activity of meropenem against NDM-1-producing Escherichia coli by inhibiting the activity of metallo-beta-lactamase. Cell Death Discov, 2018, 4:28.
[41] Payne DJ, Hueso-Rodríguez JA, Boyd H, et al. Identification of a series of tricyclic natural products as potent broad-spectrum inhibitors of metallo-beta-lactamases. Antimicrob Agents Chemother, 2002, 46(6):1880-1886.
[42] Shi C, Bao J, Sun Y, et al. Discovery of Baicalin as NDM-1 inhibitor: Virtual screening, biological evaluation and molecular simulation. Bioorg Chem, 2019, 88:102953.
[43] Gan M, Liu Y, Bai Y, et al. Polyketides with New Delhi metallo-β-lactamase 1 inhibitory activity from Penicillium sp. J Nat Prod, 2013, 76(9):1535-1540.
[44] Simm AM, Loveridge EJ, Crosby J, et al. Bulgecin A: a novel inhibitor of binuclear metallo-beta-lactamases. Biochem J, 2005, 387(Pt 3):585-590.
[45] Skalweit MJ, Li M. Bulgecin A as a β-lactam enhancer for carbapenem-resistant Pseudomonas aeruginosa and carbapenem- resistant Acinetobacter baumannii clinical isolates containing various resistance mechanisms. Drug Des Devel Ther, 2016, 10:3013-3020.
[46] Teng Z, Guo Y, Liu X, et al. Theaflavin-3,3'-digallate increases the antibacterial activity of β-lactam antibiotics by inhibiting metallo- β-lactamase activity. J Cell Mol Med, 2019, 23(10):6955-6964.
[47] Shi C, Chen J, Xiao B, et al. Discovery of NDM-1 inhibitors from natural products. J Glob Antimicrob Resist, 2019, 18:80-87.
[48] Somboro AM, Tiwari D, Bester LA, et al. NOTA: a potent metallo-β-lactamase inhibitor. J Antimicrob Chemother, 2015, 70(5): 1594-1596.
[49] Ke W, Rodkey EA, Sampson JM, et al. The importance of the trans-enamine intermediate as a β-lactamase inhibition strategy probed in inhibitor-resistant SHV β-lactamase variants. ChemMedChem, 2012, 7(6):1002-1008.
[50] Rotondo CM, Marrone L, Goodfellow VJ, et al. Arginine-containing peptides as potent inhibitors of VIM-2 metallo-beta-lactamase. Biochim Biophys Acta, 2015, 1850(11):2228-2238.
[51] Bounaga S, Galleni M, Laws AP, et al. Cysteinyl peptide inhibitors of Bacillus cereus zinc beta-lactamase. Bioorg Med Chem, 2001, 9(2): 503-510.
[52] Faridoon, Hussein WM, Vella P, et al. 3-mercapto-1,2,4-triazoles and N-acylated thiosemicarbazides as metallo-β-lactamase inhibitors. Bioorg Med Chem Lett, 2012, 22(1):380-386.
[53] Toney JH, Hammond GG, Fitzgerald PM, et al. Succinic acids as potent inhibitors of plasmid-borne IMP-1 metallo-beta-lactamase.
J Biol Chem, 2001, 276(34):31913-31918.
[54] Somboro AM, Amoako DG, Osei Sekyere J, et al. 1,4,7- triazacyclononane restores the activity of β-lactam antibiotics against metallo-β-lactamase-producing enterobacteriaceae: exploration of potential metallo-β-lactamase inhibitors. Appl Environ Microbiol, 2019, 85(3):e02077-18.
[55] Rotondo CM, Wright GD. Inhibitors of metallo-β-lactamases. Curr Opin Microbiol, 2017, 39:96-105.
[56] Meng Z, Tang ML, Yu L, et al. Novel mercapto propionamide derivatives with potent new delhi metallo-β-lactamase-1 inhibitory activity and low toxicity. ACS Infect Dis, 2019, 5(6):903-916.
[57] Shen B, Zhu C, Gao X, et al. Oligopeptides as full-length New Delhi metallo-β-lactamase-1 (NDM-1) inhibitors. PLoS One, 2017, 12(5): e0177293.
[58] Sanschagrin F, Levesque RC. A specific peptide inhibitor of the class B metallo-beta-lactamase L-1 from Stenotrophomonas maltophilia identified using phage display. J Antimicrob Chemother, 2005, 55(2): 252-255.
[59] Bebrone C, Lassaux P, Vercheval L, et al. Current challenges in antimicrobial chemotherapy: focus on ß-lactamase inhibition. Drugs, 2010, 70(6):651-679.
[60] Klingler FM, Wichelhaus TA, Frank D, et al. Approved drugs containing thiols as inhibitors of metallo-β-lactamases: strategy to combat multidrug-resistant bacteria. J Med Chem, 2015, 58(8):3626- 3630.
[61] García-Saez I, Hopkins J, Papamicael C, et al. The 1.5-A structure of Chryseobacterium meningosepticum zinc beta-lactamase in complex with the inhibitor, D-captopril. J Biol Chem, 2003, 278(26):23868- 23873.
[62] Cahill ST, Cain R, Wang DY, et al. Cyclic boronates inhibit all classes of β-lactamases. Antimicrob Agents Chemother, 2017, 61(4):e02260- 16.
[63] Rehman MT, AlAjmi MF, Hussain A, et al. High-throughput virtual screening, molecular dynamics simulation, and enzyme kinetics identified ZINC84525623 as a potential inhibitor of NDM-1. Int J Mol Sci, 2019, 20(4):E819.
[64] Chen AY, Thomas PW, Stewart AC, et al. Dipicolinic acid derivatives as inhibitors of new delhi metallo-β-lactamase-1. J Med Chem, 2017, 60(17):7267-7283.
国家自然科学基金面上项目(81872913);863 计划生物和医药技术领域青年科学家专题(2015AA020911)
刘忆霜,Email:yishuang@gmail.com
2019-10-17
10.3969/j.issn.1673-713X.2020.03.014
