新型荧光探针组合用于循环肿瘤细胞中鉴定的研究
2020-06-19于华杰李浩李胜
于华杰,李浩,李胜
·论著·
新型荧光探针组合用于循环肿瘤细胞中鉴定的研究
于华杰,李浩,李胜
250220 济南,济南大学山东省医学科学院医学与生命科学学院/山东省肿瘤医院肝胆外科(于华杰);250062 济南,山东省药物研究院(李浩、李胜)
验证新型荧光探针组合鉴定循环肿瘤细胞(CTCs)的可行性,建立一种新的鉴定 CTCs 的方法。
选取 Eca-109 和 HeLa 两种肿瘤细胞系,将肿瘤细胞系制作成单细胞悬液代替 CTCs,对其进行分离、荧光探针组合染色和瑞氏吉姆萨染色,分别观察染色的肿瘤细胞的形态,对比测量到的肿瘤细胞形态学特征,包括细胞长径、细胞核长径、细胞表面积和核质比,计算新型荧光探针组合与瑞氏吉姆萨分别染色肿瘤细胞系的符合率。在此基础上,课题组选取5例次肿瘤患者,按照上述实验方法进行临床验证,观察新型荧光探针组合染色 CTCs 的情况。
分析瑞氏吉姆萨染色和荧光探针组合染色 Eca-109 和 HeLa 的细胞形态学结果,发现细胞长径、细胞核长径、细胞表面积和核质比均无差异;对两种肿瘤细胞系的细胞形态学结果的均数分析发现也无差异。因此,课题组认为瑞氏吉姆萨染色和荧光探针组合染色的同一肿瘤细胞系在形态学上是一致的。在 5 例次临床验证实验中,新型荧光探针组合染色检出 2 例次。
建立的新型荧光探针组合可用于 CTCs 的检测。
荧光探针; 循环肿瘤细胞; 鉴定; ISET; 瑞氏吉姆萨染色
随着发病率和死亡率的增加,癌症已经成为我国最主要死亡原因之一[1]。其中超过 90%的癌症患者死于肿瘤转移[2]。1889 年英国病理学家 Paget[3]指出循环肿瘤细胞(circulating tumor cells,CTCs)作为“种子”在肿瘤发生、转移过程中起了重要的作用。循环肿瘤细胞是指自发或因诊疗操作自肿瘤原发灶或者转移病灶脱落进入外周血循环系统的肿瘤细胞[4]。CTCs 的检测是一个复杂的过程,涉及细胞分离、富集和鉴定,检测 CTCs 的关键在于如何提高 CTCs 的截留率和如何对截留的细胞进行识别鉴定[5-6]。鉴定 CTCs 的方法按照其应用的原理不同,可归纳为 4 类,即:形态学鉴定方法、免疫学鉴定方法、遗传学鉴定方法和细胞生物化学鉴定方法[7-12],目前尚无明确的鉴定 CTCs的“金标准”。CTCs 是癌细胞的一种特殊存在方式[13],课题组认为解决 CTCs 鉴定的方法可以借鉴传统病理学对癌细胞的鉴定。目前活检是传统病理学临床疾病诊断的金标准[14]。活检区分癌细胞和非癌细胞的方法可以归纳为三个方面:病理形态学改变、生物学行为改变和相关技术检测结果[15]。结合传统病理学诊断技术、ISET 技术和免疫学方法,本课题组提出了物理方法捕获-形态方法识别-免疫方法鉴定的检测思路[16]。依据上述思路,前期课题组建立并验证了“ISET-ICC技术”[17]。“ISET-ICC技术”先通过物理方法捕获 CTCs,再以形态学方法识别 CTCs,最后利用 ICC 法排除血液来源细胞的方法鉴定 CTCs[16-18]。这种“阴性排除”的方法,对形态学疑似 CTCs 的非血液来源细胞无法识别,课题组需要探索一种新的“直接”鉴定 CTCs 的方法。
荧光探针是一种与靶标结合后可以产生荧光光谱变化的探针,并且这种变化能用来检测细胞内的靶标。在应用探针时首先是在一个复杂的细胞内环境中确定一个明确靶标,这种靶标可以是分子、离子、细胞器或其他实体,荧光探针与之结合使目标可以被检测并且可用光度法和显微镜直接定量[19]。新型荧光探针组合是利用多种荧光探针复合染色的方法,可分别标记细胞膜、细胞核、核仁、线粒体、细胞器等。课题组希望利用新型荧光探针(DiI、Hoechst 33342 和PY 组合)染色 CTCs 的细胞结构,达到“直接”鉴定 CTCs 的目的。
课题组选取食管癌 Eca-109 和宫颈癌 HeLa 这两种肿瘤细胞系进行新型荧光探针(DiI、Hoechst 33342 和 PY 组合)用于 CTCs 鉴定的实验,初步确定了新型荧光探针组合(DiI、Hoechst 33342 和PY 组合)鉴定 CTCs 的 SOP。课题组选取符合入组标准的 5 例恶性肿瘤患者,验证了新型荧光探针组合染色患者外周血的 CTCs 的可行性和鉴定标准并优化了 SOP。
1 材料与方法
1.1 材料
1.1.1 细胞系 HeLa 细胞系山东大学功能晶体材料实验室赠与(中国科学院细胞库编号:TCHu 187);Eca-109 细胞系是山东省肿瘤医院中心实验室赠与(中国科学院细胞库编号:TCHu 69),用37 ℃的胰蛋白酶分解为稳定的单细胞悬液。
1.1.2 研究对象 选取 2017 年 6 月– 2017 年 8 月期间在山东省肿瘤防治研究院接受治疗且符合入组标准的 5 例恶性肿瘤患者,其中食管癌4 例,肝癌 1 例。入组标准:①患者有明确的临床或病理诊断;②年龄≥ 18 岁;③患者及家属同意并签署知情同意书。排除标准:①伴有第二原发的恶性肿瘤;②患有皮肤病病史;③患有严重的血管病变,如脉管炎等。本试验已通过山东省肿瘤防治研究院伦理委员会的审核批准,符合条件的受试者入组前均签署书面知情同意书。
1.2 方法
1.2.1 新型荧光探针组合染色 按照 1:1.5:1.5 的比例配制 Hoechst 33342、PY 和 DiI 工作液。用Hoechst 33342、PY 和 DiI 的工作液对细胞进行染色,在盖玻片的一角加入 100 μl 的染料工作液,轻轻晃动使染料均匀覆盖所有细胞,然后在室温下放置 30 min。放置到荧光显微镜下选择三个通道,第一个通道采集Hoechst 33342 的光,选用 405 nm 作为激发光,收集 420 ~ 470 nm 的荧光;第二个通道采集 PY 的光,选用 405 nm 作为激发光,收集 500 ~ 560 nm 的荧光;第三个通道采集 DiI的光,选用 543 nm 作为激发光,收集 560 ~ 600 nm 的荧光。本次研究在荧光染色实验中 CTCs 的判定标准如下:①细胞核大小变异大(比率 > 0.5);②细胞核大于 24 μm;③细胞核形状不规则;④核仁较多(> 3 个)或大核仁;⑤高核质比。只要同时符合以上至少 4 个特征,就可从形态学上认为是循环肿瘤细胞。
1.2.2 瑞氏吉姆萨染色 新型荧光探针组合染色后的玻片,使用移液器加入适量 Diff-A 染液,染色 1 min,然后加入 100 μl PBS 将 Diff-A 染液稀释,弃掉稀释的染液。加入 300 μl Diff-B 染液,染色 2 min,弃掉 Diff-B 染液。冲洗后,放入50 ℃干燥箱中。甘油封片,显微镜下判读并拍照。循环肿瘤细胞判定标准:①细胞核大小变异大(比率 > 0.5);②细胞核大于 24 μm;③细胞核形状不规则;④染色质染色存在三维层次;⑤高核质比。只要同时符合以上至少 4 个特征,就可从形态学上认为是循环肿瘤细胞。
1.2.3 CD45 免疫化学染色 将瑞氏吉姆萨染色的玻片放入 DI 水中,润洗 5 min,将载玻片依次放入梯度无水酒精脱色,滴加 100 μl 0.1% Triton X-100,室温孵育 15 min,滴加 100 μl 0.3% H2O2,室温孵育 10 min,滴加 100 μl CD45 一抗,室温孵育 1 h,滴加 100 μl 山羊抗兔/小鼠 IgG/HRP,室温孵育 15 min 滴加 100 μl DAB 显色液,室温孵育并随时在显微镜下观察显色情况,显色完成后,弃掉 DAB 显色液,苏木素染色 5 min。盐酸酒精分化 8 s,DI 水返蓝 5 min,梯度酒精脱水,晾干,中性树脂封固,显微镜下观察。CD45 染色后阳性细胞判读标准:细胞核染色为蓝色(苏木素),细胞膜染色为棕黄色(DAB),阴性细胞判读标准:细胞核染色为蓝色(苏木素),核周围无棕黄色。
1.3 统计学处理
使用 SPSS v2.0 软件进行统计分析。用配对检验比较两种染色方法的细胞长径、核长径、细胞表面积和核质比。对三组配对数据进行卡方检验。< 0.05 有统计学意义。
2 结果
2.1 新型荧光探针组合 SOP 验证实验结果
选取 2 种肿瘤细胞系(Eca-109 和 HeLa)进行新型荧光探针组合染色实验的研究。课题组将细胞系制成稳定的单细胞悬液;利用 ISET 法对单细胞悬液进行分离;分离后的细胞进行荧光探针组合染色,观察并对细胞染色情况进行拍照(图 1)。荧光探针组合染色清晰呈现了肿瘤细胞的形态学特征,细胞膜、细胞核和细胞质分界清晰,可进行测量,更加精确地从形态学特征上判定细胞是否为 CTCs;对已荧光探针组合染色的细胞进行瑞氏吉姆萨染色,观察并对细胞染色情况进行拍照(图 2)。
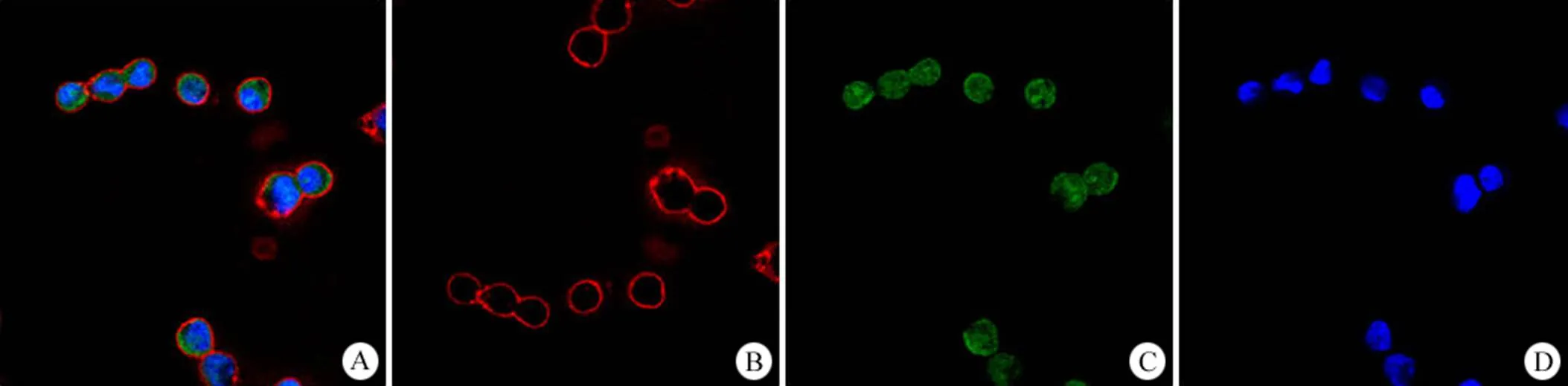
图 1 Eca-109 进行新型荧光探针组合染色(× 40)(A:组合图;B:细胞膜;C:细胞质;D:细胞核)
Figure 1 Eca-109 combined fluorescent probe staining (× 40) (A: Combination diagram; B: Cell membrane; C: Cytoplasm;D: Nucleus)
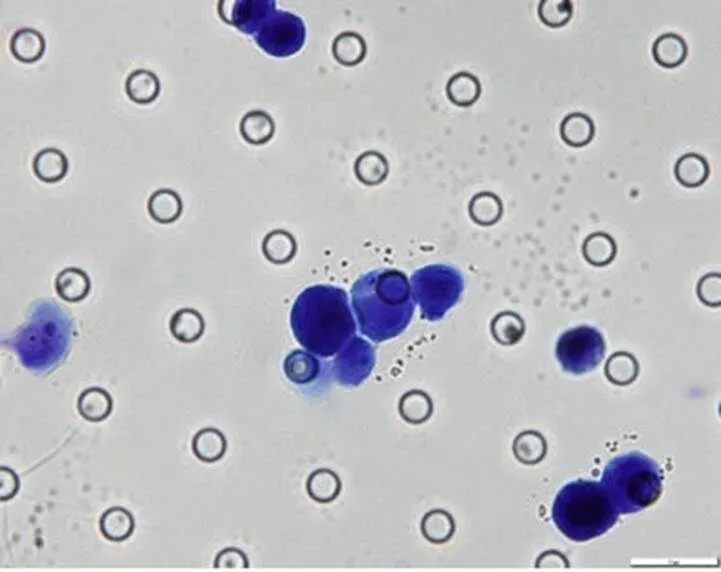
图 2 Eca-109 瑞氏吉姆萨染色(× 100)
Figure 2 Wright's Giemsa staining of Eca-109 (× 100)
2.2 两种染色方法肿瘤细胞形态学特征的比较
课题组采用 Image J 测量软件,对比了荧光探针组合染色和瑞氏吉姆萨染色检测的 Eca-109 细胞系(表 1)和 HeLa 细胞系(表 2)的细胞长径、核长径、细胞表面积和核质比的平均值,均无统计学差异。对瑞氏吉姆萨染色和荧光探针组合染色2 种肿瘤细胞系的细胞形态学结果的均数进行分析,发现细胞长径、细胞核长径、细胞表面积和核质比均无差异(表 3)。因此课题组认为瑞氏吉姆萨染色和荧光探针组合染色的同一肿瘤细胞系在形态学上是一致的。
2.3 新型荧光探针组合 SOP 的临床验证实验结果
课题组分别对 5 例肿瘤患者的外周血进行了分离,利用荧光探针组合染色、瑞氏吉姆萨染色和 CD45 免疫化学染色检测其中 CTCs,其中荧光探针组合染色检出 2 例(YG04 和 YG05),瑞氏吉姆萨染色检出 0 例,CD45 免疫化学染色检出0 例(图 3,表 4)。通过 5 例验证实验,课题组认为新型荧光探针组合染色可用于鉴定肿瘤患者外周血 CTCs。
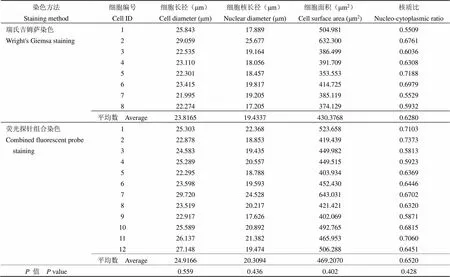
表 2 宫颈癌细胞系 HeLa 的细胞形态学测量结果的比较
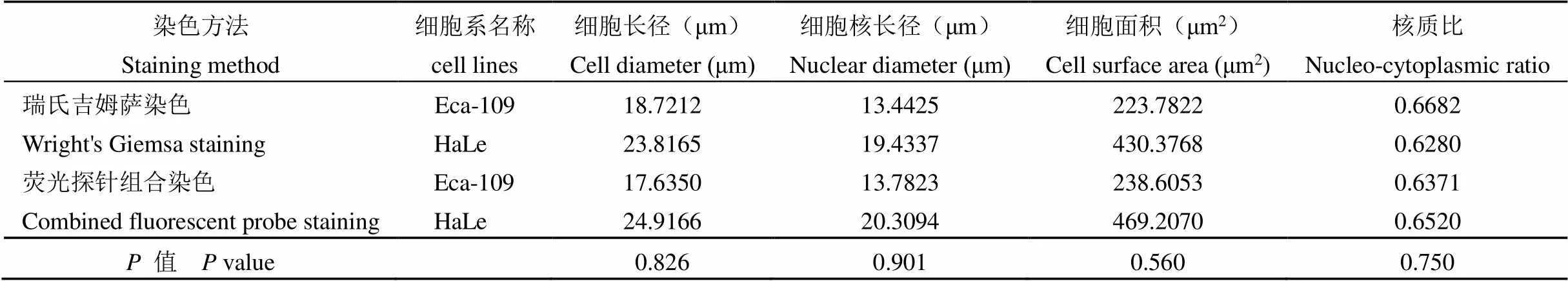
表 3 2 种细胞系细胞形态学测量结果均数的比较
Figure 3 Combined fluorescent probe staining of CTCs (YG04 Li×cheng) (A: Combination diagram; B: Cell membrane; C: Cytoplasm; D: Nucleus) (× 40)
3 讨论
课题组对两种细胞系进行实验,发现荧光探针组合染色能够染色肿瘤细胞,在显微镜下能够清晰分辨各细胞结构,边界清晰。对已荧光染色的细胞进行瑞氏吉姆萨染色,在显微镜下发现各细胞结构的边界较为模糊。瑞氏吉姆萨染色是目前细胞学中重要的染色方法之一[14],是通过酸性染料和碱性染料对细胞内结构的亲和力来着色细胞。新型荧光探针组合是通过不同探针分别染色细胞膜、细胞质和细胞核,所以能更清晰观察精确地测量各细胞结构,可明确判定 CTCs。
对两种方法染色的肿瘤细胞形态学特征(包括细胞长径、细胞核长径、细胞表面积和核质比)进行了测量和比较,无统计学差异;又对两种细胞系细胞形态学测量结果均数进行比较,无统计学差异。这表明两种染色方法对细胞形态无影响,在细胞形态学结果上是符合的。课题组在肿瘤细胞系实验的基础上选取了 5 例次恶性肿瘤患者进行了临床验证实验。新型荧光探针组合检出 2 例次,4 个 CTCs;瑞氏吉姆萨染色未检出。荧光探针组合染色的 CTCs 细胞膜、细胞质和细胞核均清晰可辩,符合制订的鉴定标准。通过肿瘤细胞系实验发现,两种染色之间互无影响,分析瑞氏吉姆萨染色未检出的原因可能有2 个,其一,瑞氏吉姆萨染色未能着色或着色较差无法判定;其二,荧光探针组合染色无冲洗玻片步骤,瑞氏吉姆萨染色需冲洗玻片,可能造成了细胞脱落和移位。通过观察新型荧光探针组合染色 CTCs 的情况,验证了染色 CTCs 可行性。下一步课题组将通过 27 例恶性肿瘤患者的临床试验研究进一步确定新型荧光探针组合用于 CTCs 鉴定的操作手册和鉴定标准。
[1] Wicha MS, Hayes DF. Circulating tumor cells: not all detected cells are bad and not all bad cells are detected. Clin Oncol, 2018, 29(12): 1508-1511.
[2] Hong B, Zu Y. Detecting circulating tumor cells: current challenges and new trends. Theranostics, 2017, 3(6):377-394.
[3] Paget S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Rev, 1989, 8(2):98-101.
[4] Seiden MV, Kantoff PW, Krithivas K, et al. Detection of circulating tumor cells in men with localized prostate cancer. J Clin Oncol, 1994, 12(12):2634-2639.
[5] Engell HC. Cancer cells in the circulating blood; a clinical study on the occurrence of cancer cells in the peripheral blood and in venous blood draining the tumour area at operation. Acta Chir Scand Suppl, 1955, 201:1-70.
[6] Jatana KR, Lang JC, Chalmers JJ. Identification of circulating tumor cells: a prognostic marker in squamous cell carcinoma of the head and neck? Future Oncol, 2011, 7(4):481-484.
[7] Ankeny JS, Court CM, Hou S, et al. Circulating tumour cells as a biomarker for diagnosis and staging in pancreatic cancer. Br J Cancer, 2016, 114(12):1367-1375.
[8] Lorente D, Olmos D, Mateo J, et al. Circulating tumour cell increase as a biomarker of disease progression in metastatic castration-resistant prostate cancer patients with low baseline CTC counts. Ann Oncol, 2018, 29(7):1554-1560.
[9] Carles J, Castellano D, Méndez-Vidal MJ, et al. Circulating tumor cells as a biomarker of survival and response to radium-223 therapy: experience in a cohort of patients with metastatic castration-resistant prostate cancer. Clin Genitourin Cancer, 2018, 16(6):e1133-e1139.
[10] Zhang H, Gao P, Xiao X, et al. A liquid biopsy-based method for the detection and quantification of circulating tumor cells in surgical osteosarcoma patients. Int J Oncol, 2017, 50(4):1075-1086.
[11] Deng G, Herrler M, Burgess D, et al. Enrichment with anti-cytokeratin alone or combined with anti-EpCAM antibodies significantly increases the sensitivity for circulating tumor cell detection in metastatic breast cancer patients. Breast Cancer Res, 2008, 10(4):R69.
[12] Satelli A, Mitra A, Cutrera JJ, et al. Universal marker and detection tool for human sarcoma circulating tumor cells. Cancer Res, 2014, 74(6):1645-1650.
[13] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5):646-674.
[14] Zheng J. Increase in accuracy and meaningful content of pathological diagnosis. Chin J Pathol, 2006, 35(1):2-3. (in Chinese)
郑杰. 努力增加病理诊断的准确性和内涵. 中华病理学杂志, 2006, 35(1):2-3.
[15] Chinese Medical Association. Clinical technical specification -- vol. pathology. Beijing: People's Military Medical Publishing House, 2004. (in Chinese)
中华医学会. 临床技术操作规范 -- 病理学分册.北京: 人民军医出版社, 2004.
[16] Li H. Research of detection and clinical significance of circulating tumor (CTC) in peripheral circulation of patients with esophageal squamous cell carcinoma. Jinan: Jinan University, 2015. (in Chinese)
李浩. 食管鳞癌患者外周血循环肿瘤细胞检测及临床意义的研究. 济南: 济南大学, 2015.
[17] Wang ZD. The establishment of ISET-ICC technical system to detect circulating tumor cells and the validation of its clinical application. Jinan: Jinan University, 2015. (in Chinese)
王振丹. ISET联合细胞免疫荧光检测循环肿瘤细胞技术体系的建立及其临床研究研究. 济南: 济南大学, 2015.
[18] Li P. Optimization improved ISET (CTC-Biopsy) detection system and Verify the effect of the detection of circulating tumor cells in cancer patients. Jinan: Jinan University, 2015. (in Chinese)
李庞. 改良ISET(CTC-Biopsy)技术体系的优化及其检测肿瘤患者循环肿瘤细胞效果的验证. 济南: 济南大学, 2015.
[19] Liu Y, Zhanga WJ, Sun YM, et al. et al. Two-photon fluorescence imaging of RNA in nucleoli and cytoplasm in living cells based on low molecular weight probes. Dyes Pigments, 2014, 103:191-201.
A novel combined fluorescent probe staining method for CTCs identification
YU Hua-jie, LI Hao, LI Sheng
School of Medicine and Life Sciences, Jinan University, Jinan 250220, China (YU Hua-jie); Shandong Institute of Materia Medica, Jinan 250062, China (LI Hao, LI Sheng)
To verify the feasibility of a novel combination of fluorescent probes to identify circulating tumor cells (CTCs), and to establish a new method for identifying CTCs.
Two types of tumor cell lines (Eca-109 and HeLa) were selected by the research group. The tumor cell lines were made into single-cell suspensions instead of CTCs. The new fluorescent probe combination SOP was developed and compared. Morphological characteristics of tumor cells, including cell diameter, nucleus diameter, cell surface area, and nuclear-to-cytoplasmic ratio, were measured by fluorescent probe and Wright's Gemsa staining. The coincidence rate of the new fluorescent probe combination with Wright'sGimsa staining tumor cell lines was calculated with preliminary determination of the new fluorescent probe combination to identify the SOPs of CTCs.On this basis, 5 tumor patients were selected according to the above experimental methods and CTCs were observed by the combination of new fluorescent probes staining.
The morphological results of two tumor cell lines (Eca-109 and HeLa) stained by Wright's Giemsa staining and fluorescent probes were analyzed. It was found that the cell diameter, nucleus diameter, cell surface area, and nuclear-to-cytoplasm ratio were all no difference. Therefore, after morphological analysis, there was no difference in the cell morphological results of the two tumor cell lines (Eca-109 and HeLa) stained by Wright's Giemsa staining and fluorescent probe combination. The mean of cell morphology results of the two tumor cell lines stained by Wright's Giemsa staining and fluorescent probes was analyzed, and no difference was found in cell diameter, nucleus diameter, cell area, and cytoplasmic ratio. Therefore, after morphological analysis, the same tumor cell line stained by Wright's Giemsa staining and fluorescent probe combination was morphologically consistent.In 5 clinical verification experiments, 2 cases were detected by combined staining of new fluorescent probes. Therefore, the SOP for identification of CTCs by combined staining of new fluorescent probes was feasible.
The new fluorescent probe combination can be used for the detection of CTCs, and the research team has established a new method for identifying CTCs.
Fluorescence probe; Circulating tumor cell; Identification; ISET; Wright's Giemsa staining
LI Sheng, Email: drlisheng@sohu.com
山东省重大科技创新项目(2017CXGC1204)
李胜,Email:drlisheng@sohu.com
10.3969/j.issn.1673-713X.2020.03.010
2020-02-24
