2019新型冠状病毒核酸检测试剂盒的研发与应用
2020-06-19孟影陈春峰张小燕沈维祥郜恒骏
孟影,陈春峰,张小燕,沈维祥,郜恒骏
·新型冠状病毒专栏·
2019新型冠状病毒核酸检测试剂盒的研发与应用
孟影,陈春峰,张小燕,沈维祥,郜恒骏
201203 上海,生物芯片上海国家工程研究中心
评价自主研发的针对 2019 新型冠状病毒的多重核酸检测试剂的性能指标及临床验证。
通过测试本试剂盒的准确性、灵敏度、特异性、精密度等指标,评估研发试剂盒的性能指标;同时,在临床单位收集 60 例临床样本,统计本试剂盒对临床样本中 2019 新型冠状病毒的检出结果,并与诊疗指南推荐的确诊/排除方法的结果进行比较,评估试剂在临床检验中的适用性。
新研制的试剂盒各性能指标均符合要求:阳性符合率和阴性符合率均为 100%,对各阳性参考品和阴性参考品能够准确检出;灵敏度测试经过确认和验证过程确定本试剂盒的最低检测限浓度为 350 copies/ml;特异性测试显示对具有潜在交叉可能的病原体和具有潜在干扰作用的药物进行测试,检出结果均正常,未受到交叉病原体和干扰物质的影响,特异性良好;精密度测试结果符合要求,批内精密度和批间精密度均 < 5%;对 60 例临床样本进行检测,与参比方法相比,灵敏度为 95%(19/20),特异性为 100%(41/40),经分析和参比方法检出结果差异不显著(> 0.05)。
建立的 2019 新型冠状病毒核酸检测试剂盒达到国内临床诊断试剂所要求的主要性能指标,可以满足临床样本的检测,是一种快速、准确的检测方法,可应用于临床。
2019 新型冠状病毒; 荧光PCR; 多重检测; 性能评估
2019 年年底,武汉发生不明原因肺炎[1-2],存在人传人的现象,且在潜伏期同样具有传染性。2020 年 1 月 8 日,初步确认了新型冠状病毒为此次疫情的病原,随后病原体序列信息公布,世界卫生组织(WHO)收到中国疾控部门的基因谱数据,并将检出的病毒命名为 2019-nCoV(2019 新型冠状病毒)。2019-nCoV 属于 β 属的新型冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径 50 ~ 200 nm。S 蛋白是病毒的主要蛋白之一,其编码基因用于病毒分型。N 蛋白包裹病毒基因组,可作为诊断抗原。2020 年 2 月 11 日,国际病毒分类委员会声明,将新型冠状病毒命名为“SARS-nCoV-2”[3]。
2020 年 1 月 10 日,上海公共卫生临床中心联同武汉中心医院、华中科技大学、武汉市疾病预防控制中心、中国疾病预防控制中心、中国医学科学院、悉尼大学等多家研究机构在 Virological.org、基因库网站 GISAID 联合公布了武汉不明肺炎感染病原体的基因序列[4]。GISAID 网站介绍称新型冠状病毒与蝙蝠中发现的某些冠状病毒相似,但有别于此前发现的SARS/MERS 冠状病毒[5]。
国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案》(以下简称“诊疗方案”)中建议新冠病毒检测时可同时收集上呼吸道(包括鼻咽和口咽)和下呼吸道(包括痰、气管内吸出物或支气管肺泡灌洗液)的标本,通过 RT-PCR 进行新冠病毒检测。在下呼吸道样本易于获得的情况下(例如机械通气的患者),临床医生可以选择仅收集下呼吸道样本。
本研究参照 WHO 发布《2019 新型冠状病毒 RT-PCR 检测指南》中推荐的检测的靶标基因和 CDC 公布的靶标基因设计引物探针,单管检测2 个靶标基因(新冠病毒基因、基因)和 1 个内标基因(人基因组 β-球蛋白基因),有效保证实验结果的准确性,极大降低检测的漏检率和假阳性。同时本研究操作简便,检测迅速,检出率高,操作过程无需开盖,极大降低污染的可能。
1 材料与方法
1.1 实验材料
1.1.1 临床样本 本研究所使用的 2019 新型冠状病毒痰液样本和咽拭子样本由台州恩泽医疗中心(集团)恩泽医院提供;人类冠状病毒(HKU1、OC43、NL63、229E)、流感病毒、呼吸道合胞病毒、副流感病毒均由中国科学院上海巴斯德研究所提供;肺炎支原体、百日咳杆菌、流感嗜血杆菌、金黄色葡萄球菌、肺炎链球菌、肺炎克雷伯菌、烟曲霉、白色念珠菌均由上海芯超医学检验所提供。

表 1 测试核酸检测系统交叉反应的病原微生物
1.1.2 假病毒颗粒 本研究性能评估所使用的假病毒颗粒由第三方机构采用本司提供的 SARS-CoV-2 阳性样本核酸提取产物进行制备。
1.1.3 仪器 ABI7500 实时荧光定量 PCR 仪购自美国 Thermo Fisher 公司。
1.1.4 试剂 2019 新型冠状病毒核酸检测试剂盒(RT-PCR 荧光探针法)为本公司自主研发,选择 2019 新型冠状病毒基因组相对保守的基因和基因作为扩增靶区域,设计特异性引物和探针,进行一步法 RT-PCR 扩增,通过荧光信号的变化,定性检测人鼻咽拭子、口咽拭子、痰液、肺泡灌洗液样本中是否含有新冠病毒。
临床样本提取采用本司获证的 RNA 提取试剂盒。PCR 反应体系包含 5 × Neoscript RT Premix Buffer、25 × Neoscript RTase mix、0.2 μmol/L 引物和 0.1 μmol/L 检测探针。将配制的 PCR 反应体系进行分装,每个反应孔 10 μl,另加入 15 μl 的核酸模板,即可进行扩增检测。
1.2 方法
1.2.1 荧光测定方法 将配制的 PCR 扩增反应液放置于荧光 PCR 仪上进行检测,检测程序:50 ℃ 20 min;95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40 个循环,60 ℃收集荧光信号。根据荧光曲线Ct 值分析样本的检测结果。
1.2.2 灵敏度评价 选用第三方合成的 2019 新型冠状病毒假病毒颗粒,根据定值浓度稀释成系列浓度梯度,进行多次重复检测,将具有 95% 阳性检出率的最低浓度水平作为确定的最低检测限。在最低检测限浓度水平选择 3 例临床样本制备的假病毒颗粒进行验证,每个样本重复检测 20 次,阳性检出率应大于 95%。
1.2.3 特异性测试
1.2.3.1 交叉反应测试 通过对可能产生交叉反应的其他冠状病毒、流感病毒、呼吸道疾病相关病原体等进行测试,相关病原微生物明细和浓度见表 1,评估本产品的分析特异性。
1.2.3.2 干扰测试 通过对可能产生干扰结果的内源性物质(如取样过程中不可避免的出血)和外源性残留物质(如各种治疗药物)进行测试(表 2),评估本产品的分析特异性。

表 2 干扰物质及其添加浓度
将上述干扰物质加入到弱阳性样本和阴性样本中,评估干扰物质是否对弱阳性样本和阴性样本的检出产生干扰作用。
1.2.4 精密度评价 将假病毒颗粒和临床样本核酸提取物分别稀释为中阳性水平样本、弱阳性水平样本、阴性样本,每个样本重复 2 次,每天上下午各进行一轮试验,重复 20 d,评估试剂的批间和批内精密度。
1.2.5 准确性评价 对不同来源临床样本核酸提取物制备的阳性参考品和含有不同潜在交叉病原体的阴性参考品分别进行测试,评估试剂对阴阳性参考品检出的符合率。
1.2.6 临床样本验证 在台州恩泽医疗中心恩泽医院收集 60 例临床样本,以临床确诊方法作为对照方法,评估本试剂盒对临床样本检测结果的准确性。
2 结果
2.1 灵敏度评价
将新型冠状病毒制备的假病毒颗粒做系列梯度稀释,分别稀释至 3 × 105、3 × 104、3 × 103、3 × 102copies/ml,使用本试剂对上述浓度样本进行多次重复检测,结果表明当样本浓度大于 3 ×103copies/ml 时,本试剂对各阳性样本可达到 100% 的检出率,样本浓度为 3 × 102copies/ml 时试剂对各阳性样本的检出率达到 90%,略低于 95% 的阳性检出限,因此进一步细化测试样本的浓度范围,以具有 95% 阳性检出率的浓度为本试剂盒的最低检出限。
使用本试剂进一步测试假病毒颗粒制备的系列浓度梯度样本,浓度分别为 3 × 103、1 × 103、6 × 102、4 × 102、2 × 102copies/ml,每一浓度梯度样本重复检测 20 次,统计各浓度样本检出的阳性个数,结果见表 3。
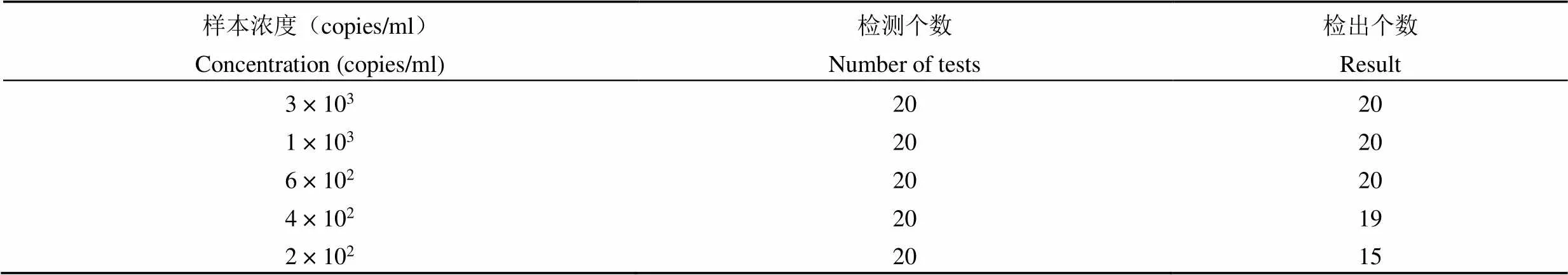
表 3 各浓度样本检出情况列表
将上述数据进行统计,利用 Minitab 数据分析软件得出具有 95% 阳性检出率的浓度为350 copies/ml。同时将此浓度下的样本再重复测试 20 次,结果全部检出阳性,表明经过确认和验证过程,本试剂的最低检测限为 350 copies/ml。
2.2 特异性评价
2.2.1 交叉反应 使用本试剂对表 1 中的7 个病毒、2 个假病毒颗粒、8 个细菌、1 个人基因组进行检测,检出结果均为 2019 新型冠状病毒阴性,无非特异性产生。
2.2.2 干扰反应 使用本试剂盒对表 2 中的7 种干扰物质进行测试,结果表明 2019 新型冠状病毒弱阳性样本检出均为阳性,2019 新型冠状病毒阴性样本检出均为阴性,结果正常,特异性良好。
2.3 精密度评价
使用 3 批次试剂,分别对临床模拟样本和临床样本从中阳性浓度水平、弱阳性浓度水平、阴性水平分别进行 20 天重复测试,经过计算,2019 新型冠状病毒基因和基因在阴性水平检出结果均为阴性,中阳性浓度水平和弱阳性浓度水平在批内、批间的精密度均小于 5%,说明本试剂盒具有良好的批内和批间精密度。
2.4 准确性评价
对企业制备的 5 个阳性参考品和 9 个阴性参考品分别进行测试,阳性参考品全部检出 2019 新冠病毒阳性,阴性参考品检出 2019 新冠病毒阴性,符合率 100%,说明本试剂准确性良好。
2.5 临床样本评价
按照统计学方法处理临床验证数据,将本次考核试剂与参比方法(临床确认/排除方法)统计入表 4,进行配对四格表统计分析。经统计,60 份样本中,本试剂盒检测结果与确诊结果相比,灵敏度达到 95.00%(75.13%,99.87%),特异性达到 100%(92.78%,100%),总符合率 98.33%(91.06%,99.96%),结果具有一致性。卡方检验结果显示> 0.05,考核试剂与确诊方法检出结果差异不显著,具有较好的临床适用性。
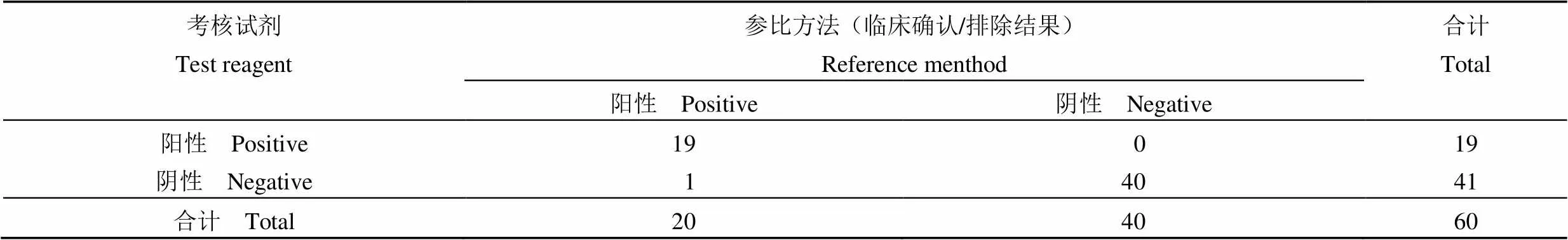
表 4 临床样本检测结果列表
检测结果中 1 例样本存在检出差异,考核试剂检出阴性,确诊方法判断为阳性,导致结果差异的原因可能是由于①取样位置和取样方法的差异,导致所取样本中新型冠状病毒滴度较低;②感染进程的差异,在感染的后期,病毒向下呼吸道转移,上呼吸道采集的样本病毒滴度较低,导致结果出现假阴性;③样本采集后未能立即检测,保存的条件不符合要求,导致样本内的病毒 RNA 降解,影响检出结果。
3 讨论
目前,2019 新型冠状病毒的传染性较高,截至 2020 年 4 月 7 日凌晨全球新冠肺炎确诊病例,达到 1 312 628 例,累计死亡病例 72636 例,多个国家呈现爆发式增长以及二次暴发的可能。目前对于新冠病毒的确诊方法较为复杂,需要进行多方面的临床表现及检测结果的结合。首先综合流行病学史和临床表现判断是否为疑似病例,若为疑似病例同时具备下述病原学或血清学证据之一者,即可确诊为新型冠状病毒感染[6-7]:①实时荧光 RT-PCR 检测新型冠状病毒核酸阳性;②病毒基因测序,与已知的新型冠状病毒高度同源;③血清新型冠状病毒特异性 IgM 抗体和 IgG 抗体阳性;④血清新型冠状病毒特异性 IgG 抗体由阴性转为阳性或恢复期较急性期升高 4 倍及以上。在临床检测中,限于检测的紧迫性、操作的便利性以及测试的准确性,常用 PCR 检测结果作为最终的确定方法,因此核酸检测试剂的灵敏度和特异性直接影响病患的诊治结果。由于疫情的突发性,市售试剂均没有经过完整的性能验证以及临床试验验证,试剂性能存在一定的缺陷,增加结果假阴性或假阳性的可能。
本试剂在研发过程中参照 CDC、WHO 公布的引物探针序列以及靶标位点的区域进行优化,最终选择特异性检测 2019 新型冠状病毒的基因和基因的特异性序列,优化引物和探针从根本上提高试剂的特异性和灵敏度。性能评估过程中,分别针对试剂的准确性、灵敏度、特异性、精密度、临床样本验证等方面进行测试,均达到良好的检出效果。与目前临床上推荐使用的确定/排除标准的检出结果接近,可以满足临床的使用需求,具有较高的临床适用性。
[1] Li Q, Guan X, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med, 2020, 382(13):1199-1207.
[2] Bajema KL, Oster AM, McGovern OL, et al. Persons evaluated for 2019 novel coronavirus - United States, January 2020. MMWR Morb Mortal Wkly Rep, 2020, 69(6):166-170.
[3] Chinanews.cn. The novel coronavirus was named SARS-CoV-2 by the international committee on the classification of viruses. 2020-02-12. http://www.chinanews.com/gj/2020/02-12/9088314.shtml. (in Chinese)
中国新闻网. 国际病毒分类委员会将新型冠状病毒命名为SARS-CoV-2. 2020-02-12. http://www.chinanews.com/gj/2020/02-12/ 9088314.shtml.
[4] Virological.org. Preliminary phylogenetic analysis of 11 nCoV2019 genomes, 2020-01-19. (2020-01-31). http://virological.org/t/preliminary- phylogene tic-analysis-of-11-ncov2019-genomes-2020-01-19/329.
[5] Meo SA, Alhowikan AM, Al-Khlaiwi T, et al. Novel coronavirus 2019-nCoV: prevalence, biological and clinical characteristics comparison with SARS-CoV and MERS-CoV. Eur Rev Med Pharmacol Sci, 2020, 24(4):2012-2019.
[6] National Health Commission of the People's Republin of China. COVID-19 diagnosis and treatment plan (trial seventh edition). 2020-03-03. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7 dfe4cef80dc7f5912eb1989/files/ce3e6945832a438eaae415350a8ce964.pdf. (in Chinese)
中华人民共和国国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第七版). 2020-03-03. http://www.nhc.gov.cn/yzygj/s7653p/ 202003/46c9294a7dfe4cef80dc7f5912eb1989/files/ce3e6945832a438eaae415350a8ce964.pdf.
[7] World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected: interim guidance. 2020-01-28. https://apps.who.int/iris/ handle/10665/330893.
Development and clinical application of a novel nucleic acid detection reagent for SARS-nCoV-2
MENG Ying, CHEN Chun-feng, ZHANG Xiao-yan, SHEN Wei-xiang, GAO Heng-jun
National Engineering Center for Biochip, Shanghai 201203, China
To evaluate the performance and clinical validation of novel coronavirus 2019 multiple nucleic acid detection reagent.
The negative compliance rate, positive compliance rate, LOD, specificity, precision and other indicators were tested, and the performance indicators of the kit was evaluated. At the same time, 60 cases of pharyngeal swab samples were collected in hospital, and the detection results of novel coronavirus 2019 were compared with the results of the diagnosis/exclusion method recommended by the diagnostic guidelines, so as to evaluate the applicability of the reagent in clinical detection.
All the performance indicators of the newly developed kit meet the requirements: the positive compliance rate and the negative compliance rate were 100%, which indicates the positive reference and the negative reference can be accurately detected. LOD of the kit was 350 copies/ml. The specificity test showed that the pathogen and the drug were tested, and the test results were normal. The precision test results meet the requirements. The precision within batches and between batches is < 5%. Compared with the control method, the sensitivity was 95% (19/20) and the specificity was 100% (41/40). There was no significant difference in the detection results between the analysis and the control method (> 0.05).
The novel coronavirus 2019 (SARS-CoV-2) nucleic acid detection kit reaches the main performance indexes required by domestic clinical diagnostic reagents,which can be applied to clinical test.
SARS-CoV-2; Fluorescence PCR; Multiplex test; Performance evaluation
·协会之窗·
2020“声音•责任”医药卫生界人大代表政协委员座谈会召开
由中国医药行业 24 家协(学)会共同主办的 2020 “声音•责任”医药卫生界人大代表政协委员座谈会(以下简称“座谈会”)于 5 月 21 日首次采取“线上+线下”的形式召开。来自医药卫生界的近 45 位全国人大代表政协委员、省级人大代表政协委员在线出席了本次座谈会。国家发展改革委、国家卫生健康委、财政部、工信部、商务部、科技部、国家药监局、国家医保局以及中医药局等部委相关职能部门领导及专家应邀在线观摩会议。
医药卫生领域作为抗击新冠肺炎疫情主力军,科研人员刻苦钻研,加快药物、疫苗和创新疗法研究;医务人员以实际行动生动诠释了“敬佑生命、救死扶伤、甘于奉献、大爱无疆”的崇高精神,充分展现了新时代医药卫生工作者的精神风貌、职业操守、意志品质和应急能力。
在保障人民生命健康的征途上,依然任重道远。因此今年座谈会的主题确定为“构建中国优势的,保障全民健康、维护国家安全的医药卫生大格局”,希望化危为机,进一步凝聚起全面推进医疗卫生体系改革,加速医药行业转型升级,推动健康中国建设的共识和动力。
中国医药生物技术协会代表会员单位和分支机构向医药卫生届两会代表建言献策,共提交了 7 份提案,包括:
◆关于做大做强生物医药产业,全面提高国家生物安全治理能力的建议
◆关于推动生物样本库建设,增强生物资源及研发能力安全的建议
◆关于有效落实药品数据保护制度,鼓励医药产业创新转型升级的建议
◆关于加强基因编辑技术管理的建议
◆关于推动临床实验室自建项目(LDT)规范监管制度建设,促进精准医学发展的建议
◆关于进一步加快体外诊断试剂临床评价的建议
◆关于医疗机构临床实验室开展检测服务需经第三方能力认证的建议
GAO Heng-jun, Email: xiaoyan_zhang@shbiochip.com
10.3969/j.issn.1673-713X.2020.03.002
郜恒骏,Email:xiaoyan_zhang@shbiochip.com
2020-04-10
