hsa-miR-21-5p/ZNF367分子轴通过PI3K/Akt通路影响胃癌细胞的增殖和迁移
2020-06-19赵志东郇金亮汤文俊秦贤举
赵志东,郇金亮,汤文俊,秦贤举
·论著·
hsa-miR-21-5p/ZNF367分子轴通过PI3K/Akt通路影响胃癌细胞的增殖和迁移
赵志东,郇金亮,汤文俊,秦贤举
200235 上海市第八人民医院普外科
探讨ZNF367 通过 PI3K/Akt 通路抑制胃癌(GC)细胞的增殖和迁移,并初步探讨其作用分子机制。
收集 2015 年 8 月– 2018 年 10 月上海市第八人民医院普外科手术切除的 GC 组织(非坏死部分)和相邻癌旁组织(距肿瘤组织 > 3 cm)标本 46 例,同时选取正常人胃黏膜上皮细胞 GES1 及 GC 细胞系 MGC-803 和MKN-45。采用 qRT-PCR、Western blot 实验检测 ZNF367 和 hsa-miR-21-5p(miR-21-5p)在组织和细胞系中的表达情况,进行 Kaplan-Meier 生存分析得出总生存期;利用脂质体 LipofectamineTM2000 转染寡核苷酸片段 miRNA-NC、miR-21-5p mimic 和 miR-21-5p inhibitor 至 MGC-803 细胞,通过 CCK8 法和划痕实验检测细胞的增殖和迁移能力;采用双荧光素酶报告载体系统验证 ZNF367 和 miR-21-5p 的作用靶点,采用 qRT-PCR、Western blot 实验检测 miR-21-5p mimic 和 miR-21-5p inhibitor 转染 MGC-803 细胞中 ZNF367、E-cadherin、N-cadherin、Vimentin 以及 PI3K/Akt 通路中 p-PI3K 和 p-Akt 的表达情况。
ZNF367 在胃癌组织和胃癌细胞系中的表达水平分别显著低于癌旁组织和 GES-1 细胞(< 0.01),且在 MGC-803 细胞中表达水平最低,而 miR-21-5p 的表达正相反;在 MGC-803 细胞中,OE-ZNF367 和miR-21-5p inhibitor 转染组的细胞增殖和迁移能力显著低于对照组,而 siRNA-ZNF367 和 miR-21-5p mimic 转染组的细胞增殖和迁移能力显著高于对照组;生物信息学和荧光素酶活性实验结果表明 ZNF367与 miR-21-5p 具有直接靶向关系;qRT-PCR、Western blot 实验结果表明在 miR-21-5p inhibitor 转染组中,E-cadherin 的表达是显著提高的(< 0.01),而 N-cadherin、Vimentin、p-PI3K 和 p-Akt 的表达是显著下降的(< 0.01);在 miR-21-5p mimic 转染组中,结果相反(< 0.01)。
hsa-miR-21-5p/ZNF367 分子轴通过调控 PI3K/Akt 通路抑制 EMT 过程,从而影响胃癌细胞MGC-803 的增殖和迁移。
胃癌; ZNF367; miR-21-5p; PI3K/Akt; 增殖; 迁移
胃癌(gastric cancer,GC)是世界范围内第五大最常见的恶性肿瘤类型,是导致患者死亡的第三大原因,胃癌的预防和治疗是一个重要的公共卫生问题[1-2]。近几十年来,虽然全球胃癌发病率呈稳步下降趋势,但胃癌仍是一种常见的恶性肿瘤,有效治疗手段有限,5 年生存率仅为30% 左右[3-4]。因此,研究胃癌发生发展的调控机制并寻找新的治疗靶点,对于提高临床治疗效果具有重要意义。锌指蛋白 367(ZNF367)是锌指蛋白家族中的一员,在胚胎或胎儿红细胞组织中表达,而在正常成人组织中不表达。近年来的研究发现,ZNF367 可以抑制肺癌、肾上腺皮质癌、甲状腺癌等的发生和发展[5-6]。但是在胃癌研究中还没有被报道过。microRNAs(miRNAs)是一种内源性表达的单链非编码小 RNA,一般为 18 ~ 23 nt,可调控数以百计的靶 mRNA 进行翻译抑制或降解[7]。miRNAs 在调节许多肿瘤细胞过程中起着关键作用,它们可以调节多种信号通路,包括癌基因和抑癌基因的信号通路,如PI3K/Akt,从而影响肿瘤细胞的增殖、迁移、凋亡等生物学行为[8-9]。本研究旨在探究 ZNF367 对胃癌细胞增殖和迁移能力的影响,分析 miR-21-5p 与 ZNF367 的相关性,进一步探讨miR-21-5p/ZNF367 分子轴调控胃癌细胞增殖和迁移能力的分子机制。
1 材料与方法
1.1 材料
1.1.1 组织样本 采集 2015 年 8 月– 2018 年 10 月上海市第八人民医院普外科手术切除 46 例胃癌患者癌组织及配对的癌旁组织标本(距肿瘤组织 > 3 cm),所有标本取出后立即放入液氮中,并于–80 ℃长期保存。手术前未进行过任何放疗或化疗等治疗。组织样本的收集和使用征得患者同意并签署知情同意书,并获得上海市第八人民医院伦理委员会的批准。
1.1.2 细胞系及主要试剂 胃癌细胞(MKN-45、MGC-803)以及人胃黏膜上皮细胞(GES-1)细胞购自中科院昆明细胞库;RPMI1640、DMEM 培养基、胰蛋白酶和胎牛血清均购自美国 Gibco 公司;Trizol 和 LipofectamineTM2000 试剂盒购自美国 Invitrogen 公司;RNA 提取试剂盒和荧光定量 PCR 试剂盒 SYBR premix Ex TaqTM购自日本 Takara 公司;CCK8 试剂盒购自江苏晶美生物科技有限公司;双荧光素酶检测试剂盒购自美国 Promega 公司;抗 ZNF367、E-cadherin、N-cadherin、Vimentin、p-PI3K、p-Akt 和 GAPDH 抗体以及二抗均购自美国 Abcam 公司;ECL 化学发光显色液购自北京索莱宝公司。
1.2 方法
1.2.1 载体构建与细胞转染 miR-21-5p mimic、miR-21-5p inhibitor、pcDNA 空载体、pcDNA-ZNF367和 siRNA-ZNF367 质粒由上海聚公生物科技有限公司构建。
GES-1 和 MGC-803 细胞株用含 10% FBS、100 U/ml 青霉素、100 mg/ml 链霉素的RPMI1640 培养基于 37 ℃、5% CO2恒温培养箱培养。细胞转染前一天将细胞按 2 × 105个/孔接种于 6 孔板中,使用 LipofectamineTM2000 脂质体转染试剂盒分别将pcDNA-ZNF367、siRNA-ZNF367、miR-21-5p mimic、miR-135a inhibitor、pcDNA 空载体转染至 MGC-803 细胞,转染后将细胞置于 37 ℃、5% CO2培养箱内培养 48 ~ 72 h。
1.2.2 qRT-PCR 检测基因表达水平 使用 Trizol 试剂盒提取 GC 组织及细胞株中的总RNA,NanoDrop2000 分光光度计检测 RNA 浓度和纯度,琼脂糖凝胶电泳检测 RNA 的完整性。在PCR 仪上进行反转录反应,反应体系为 37 ℃,20 min;85 ℃,5 s;4 ℃,5 min。在 LightCycler®96 System Realtime PCR 仪上进行 PCR 反应。使用SuperReal PreMix(Probe)试剂盒进行 qRT-PCR 实验。反应程序:2 × SuperReal PreMix 10 μl、正向引物 0.8 μl、反向引物 0.8 μl、cDNA 模板 3 μl、ddH2O 补足到20 μl。使用作为内参基因来标准化结果,相对表达水平参照文献[10]来计算。引物由上海铂尚生物科技有限公司合成。引物序列见表 1。

表 1 引物序列
1.2.3 Western blot 检测蛋白表达水平 分别收集对数生长期的细胞 5 × 106个,使用 RAPI 裂解液提取细胞总蛋白,BCA 试剂盒检测蛋白浓度及纯度。蛋白质定量后进行 10% SDS-PAGE分离蛋白,电泳后将蛋白质转移至 PVDF 膜、5% 脱脂乳粉中封闭 2 h,一抗 4 ℃过夜孵育。次日,PBST 漂洗 3 次,每次 5 min,加入二抗,室温孵育 2 h,再 PBST 漂洗 3 次,每次 5 min,用 ECL 显影液使底物显色,并于凝胶成像系统中进行显影,然后采用 Image J 软件进行灰度值分析。每次实验进行 3 次平行重复。
1.2.4 细胞增殖能力检测 细胞增殖能力采用 CCK8 试剂盒检测。实验前 1 天将质粒(pcDNA-ZNF367、siRNA-ZNF367、miR-21-5p mimic、miR-21-5p inhibitor、pcDNA 空载体)转染处于对数生长期的 MGC-803 细胞,随后接种于 96 孔板,每孔 100 μl,置于 37 ℃培养箱中培养4 ~ 6 h 至细胞完全贴壁,每孔加入 10 μl 10% CCK8 溶液,37 ℃培养箱孵育 2 h,然后使用酶标仪检测 450 nm 处的光密度()值,每组 3 个重复孔。
1.2.5 细胞迁移能力检测 将质粒(pcDNA-ZNF367、siRNA-ZNF367、miR-21-5p mimic、miR-21-5p inhibitor、pcDNA 空载体)转染生长对数期的 MGC-803 细胞,随后接种于 6 孔板上,形成融合的单层细胞。然后用 200 μl 移液枪枪头将单层细胞划成一条直线,用 PBS 冲洗一遍,加入全营养 DMEM 培养基,分别在 0 h 和24 h 进行拍照。
1.2.6 双荧光素酶报告基因检测 构建 pLuc-ZNF367 和 pLuc-ZNF367-MUT 质粒,分别与 miR-NC 和 miR-21-5p 共转染 MGC-803 细胞。培养 48 h 后,收集细胞后使用 PBS 清洗,用 PLB 裂解细胞,取上清液 10 μl 于 96 孔板,每孔加入 10 μl Luciferase Assay Reagent II,随后使用双荧光素酶报告基因检测系统进行萤火虫和海肾荧光素酶活性检测,每个样品重复 3 次。
1.3 统计学处理
采用 SPSS 20.0 软件进行数据的统计分析,采用 Graphpad Prism 8.0 软件绘图。所有实验平行独立重复 3 次。计量资料如果数据满足正态分布及方差齐,两组间比较采用独立样本检验,多组间比较采用单因素方差分析,非正态分布或非方差齐性资料采用 U 检验。以*< 0.05 表示差异具有统计学意义。
2 结果
2.1 ZNF367 在胃癌组织和细胞系中呈低表达
qPCR 实验检测结果表明,胃癌组织中 ZNF367 的基因表达显著低于癌旁组织(< 0.01,图 1A);而 miR-21-5p 的表达显著高于癌旁组织(< 0.01,图 1B)。ZNF367 在胃癌细胞系(MGC-803 和 MKN-45)中的表达水平显著低于正常胃上皮黏膜细胞(GES-1)(< 0.01,图 1C),而 miR-21-5p 的表达显著高于胃癌细胞系(< 0.01,图 1D)。在 MGC-803 细胞中的表达水平趋势更明显,故选择该细胞株进行后续实验。通过数据库(http://kmplot.com/analysis/index.php?p=service)分析表明,ZNF367 低表达组的总存活率显著低于高表达组(= 6e-05,图 1E)。Western blot 实验结果表明,ZNF367 在 MGC-803 和 MKN-45 细胞株中的蛋白表达水平显著低于 GES-1 细胞株(< 0.05,图 1F)。实验结果表明:ZNF367 是胃癌发生发展的抑制基因,并且 ZNF367 低表达时具有不良的预后。此外,其还可能是 miR-21-5p 的潜在靶基因。

图 1 ZNF367 与miR-21-5p 在GC 组织和细胞中的表达及预后分析(A ~ B:ZNF-367 和miR-21-5p 在癌旁组织和胃癌组织中的表达分析,**P < 0.01;C ~ D:ZNF367 和miR-21-5p 在对照细胞和胃癌细胞中的表达分析,**P < 0.01;E:胃癌病人总生存率分析;F:胃癌细胞中 ZNF367 蛋白表达分析)
Figure 1 Expressions of ZNF367 and miR-21-5p in GC tissues and cell lines and survival analysis (**< 0.01 vs non-GC tissues or GES-1 group; A - B: Relative expression of ZNF367 and miR-21-5p in non-GC tissues and GC tissues by qRT-PCR; C - D: Relative expression of ZNF367 and miR-21-5p in GC cell lines by qRT-PCR; E: The correlation between ZNF367 and survival rate of GC patients; F: ZNF367 protein expression in GC cell lines)
2.2 ZNF367 可以抑制胃癌细胞的增殖和迁移
CCK8 实验结果显示:过量表达 ZNF367 的细胞的增殖能力显著低于对照组。而抑制ZNF367 表达的细胞的增殖能力显著高于对照组(**< 0.01,图 2A)。由图 2B 可以看出 miR-21-5p 对于胃癌细胞增殖的影响与 ZNF367 是相反的(**< 0.01、*< 0.05)。细胞划痕实验结果(图 2C)显示:过量表达 ZNF367 的细胞的迁移能力显著低于对照组。而抑制 ZNF367 表达的细胞的迁移能力显著高于对照组。miR-21-5p 对于胃癌细胞增殖和迁移的影响与 ZNF367 是相反的。由此可以看出:ZNF367 可以抑制胃癌细胞的增殖和迁移能力,进一步表明 ZNF367 可能是 miR-21-5p 的潜在靶基因。
2.3 ZNF367 的 3'UTR 是 miR-21-5p 的直接作用靶点
通过靶基因预测网站(http://www.targetscan. org/vert_72/)寻找 ZNF367 靶基因,结果显示 ZNF367 的 3′UTR 区域确实包含 miR-21-5p 的结合位点(图 3A)。miR-21-5p mimic、miR-21-5p inhibitor 转染 MGC-803 细胞后,qRT-PCR 结果显示在转染 miR-21-5p mimic 的细胞中,ZNF367 的基因和蛋白表达量都显著低于对照组(**< 0.01,图 3B,3C),而在转染 miR-21-5p inhibitor 的细胞中,ZNF367 的基因和蛋白表达量都显著高于对照组(**< 0.01,图 3B,3C)。双荧光素酶报告基因系统结果显示,miR-21 可以显著抑制 ZNF367-WT的活性,而不能抑制 ZNF367-MUT 的活性(**< 0.01,图 3D)。表明 ZNF367 的 3′UTR 是miR-21-5p 的直接作用靶点。此外,过量表达 miR-21-5p 还可以促进 EMT 过程,而干扰 miR-21-5p 抑制 EMT 过程(**< 0.01,图 3E、3F)。以上结果表明 miR-21-5p 可能通过 ZNF367 来影响细胞的 EMT 过程。
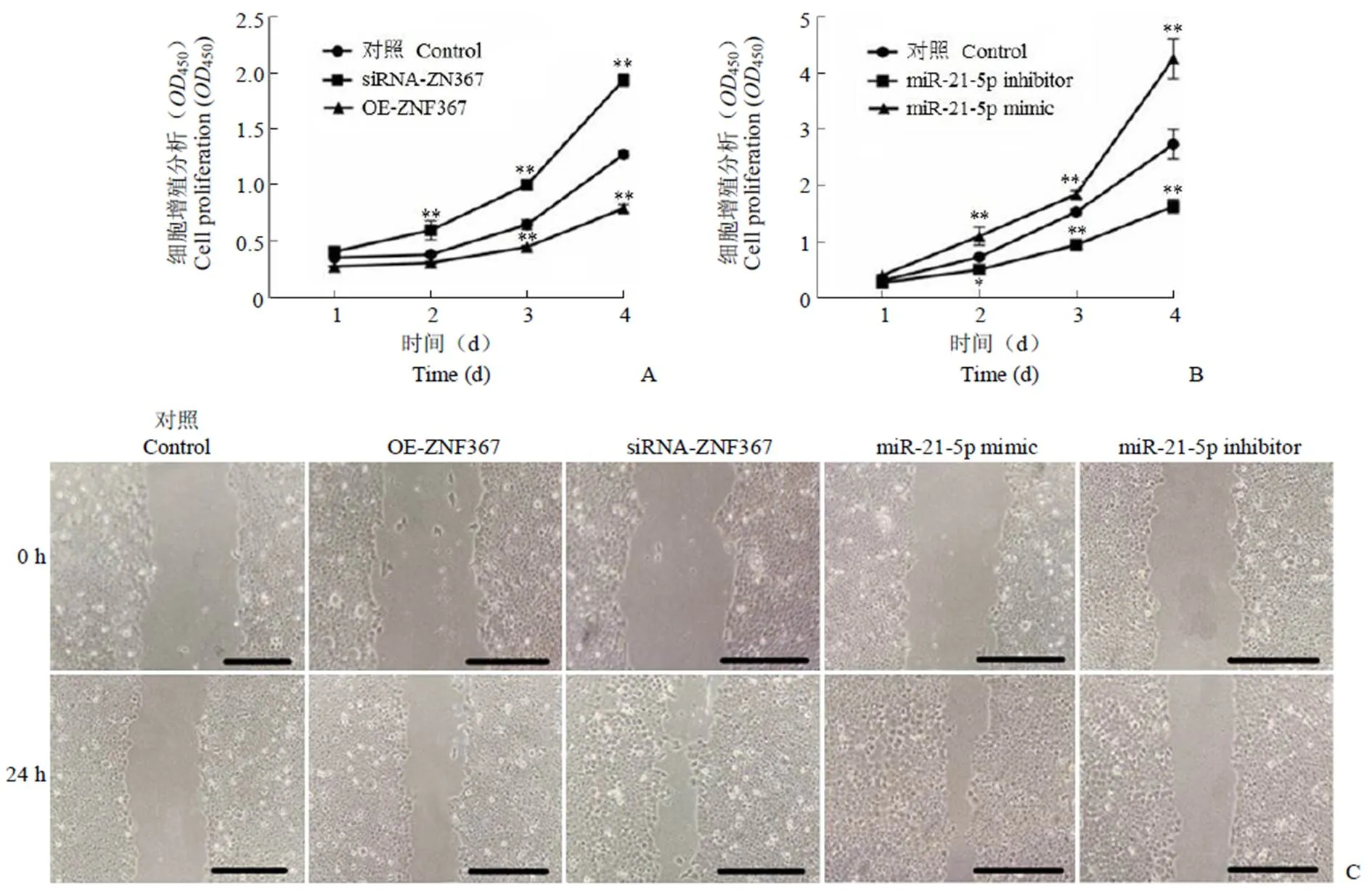
图 2 ZNF367 与miR-21-5p 对MGC-803 细胞增殖和迁移能力影响分析(A:转染siRNA-ZNF367 和OE-ZNF367 的MGC-803 细胞增殖能力分析,**P < 0.01;B:转染miR-21-5p mimic 和miR-21-5p inhibitor 的MGC-803 细胞增殖能力分析,**P < 0.01, *P < 0.05;C:转染siRNA-ZNF367、OE-ZNF367、miR-21-5p mimic 和miR-21-5p inhibitor 的MGC-803 细胞迁移能力分析,标尺:100 μm)
Figure 2 Effects of ZNF367 and miR-21-5p on proliferation and migration of MGC-803 cells (A: Cell proliferation viability of siRNA-ZNF367 and OE-ZNF367 MGC-803 cells; B: Cell proliferation viability of miR-21-5p mimic and miR-21-5p inhibitor MGC-803 cells; C: MGC-803 cell migration ability analysis in siRNA-ZNF367, OE-ZNF367, miR-21-5p mimic, and miR-21-5p inhibitor;**< 0.01,*< 0.05 vs non-GC tissues or control group. Bar: 100 μm)
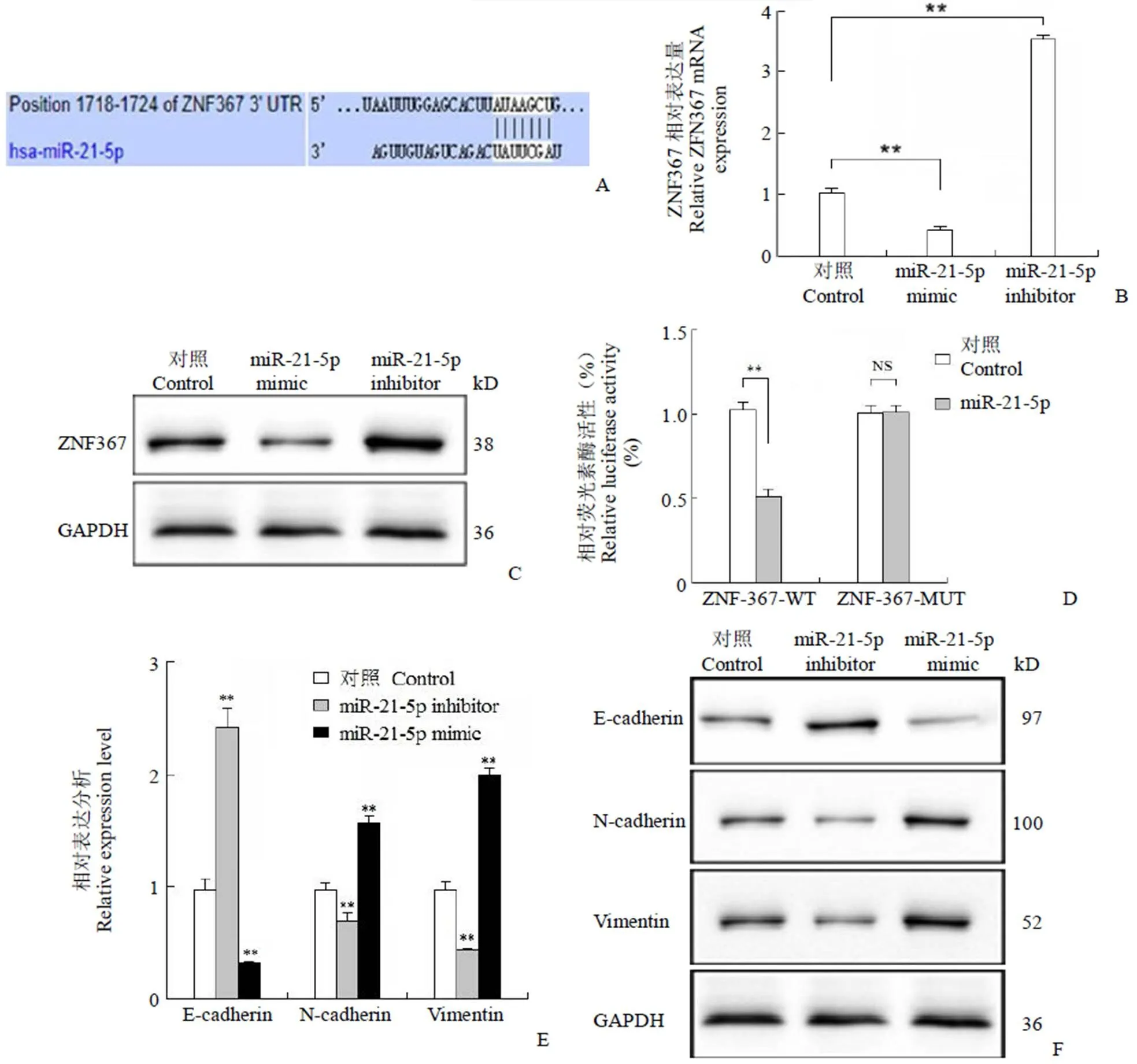
图 3 ZNF367 靶向结合miR-21-5p 并影响EMT 相关蛋白的表达(A:ZNF367 的3'UTR 区域包含miR-21-5p 结合位点;B:转染control/miR-21-5p mimic/miR-21-5p inhibitor 的MGC-803 细胞中 ZNF367 的基因表达分析,**P < 0.01;C:转染control/miR-21-5p mimic/miR-21-5p inhibitor 的MGC-803 细胞中 ZNF367 的蛋白表达分析,**P < 0.01;D:相对荧光素酶活性分析,**P< 0.01;E:EMT 信号通路基因表达分析,**P < 0.01;F:EMT 信号通路蛋白表达分析)
Figure 3 ZNF367 targeted by miR-21-5p and affected EMT-related protein expression (A: The 3'UTR of ZNF367 mRNA contains the binding sequences of miR-21-5p; B: Relative expression of ZNF367 in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor; C: ZNF367 protein expression in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor; D: Relative luciferase activity was analyzed in MGC-803 cells; E: Relative expression of EMT related genes in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor,**< 0.01; F: EMT related proteins expression in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor)
2.4 miR-21-5p/ZNF367 分子轴通过 PI3K/Akt 通路抑制胃癌细胞的增殖和迁移
Western blot和 qRT-PCR 结果显示:在 miR-21-5p inhibitor 转染细胞中,ZNF367 的表达显著提高,而 p-Akt、p-PI3K 的表达显著降低;而在 miR-21-5p mimic 转染细胞中,ZNF367 的表达显著降低,而 p-Akt、p-PI3K 的表达显著提高(**< 0.01,图 4A、4B)。结果表明:miR-21-5p/ZNF367 分子轴通过 PI3K/Akt 通路抑制胃癌细胞的增殖和迁移。
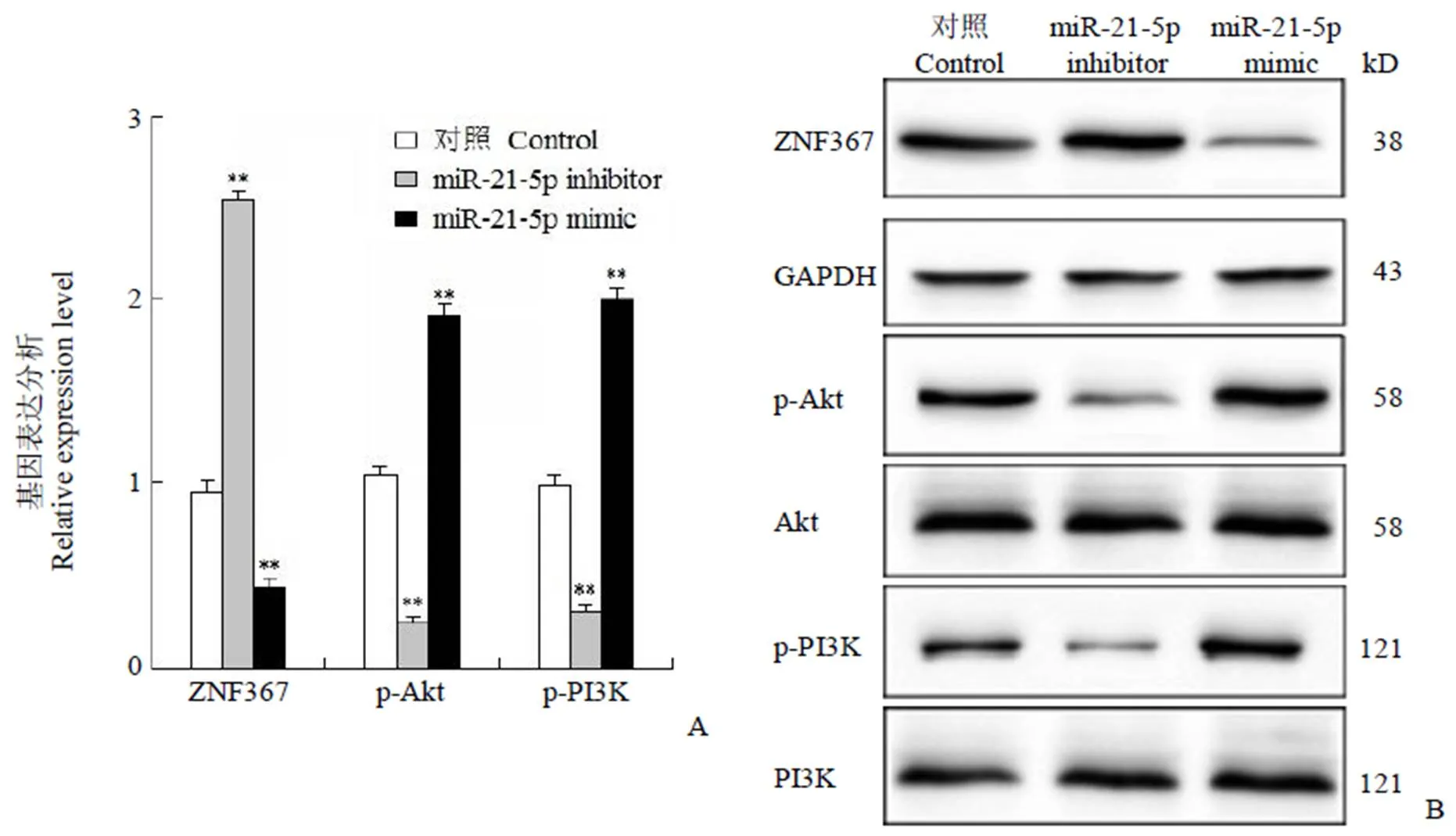
图 4 miR-21-5p/ZNF367 分子轴通过PI3K/Akt 通路影响胃癌细胞的增殖和迁移(A:转染control/miR-21-5p mimic/miR-21-5p inhibitor 的MGC-803 细胞中PI3K/Akt 通路相关基因表达分析,**P < 0.01;B:转染control/miR-21-5p mimic/miR-21-5p inhibitor 的MGC-803 细胞中PI3K/Akt 通路相关蛋白表达分析)
Figure 4 miR-21-5p/ZNF367 axis affects the proliferation and migration of gastric cancer cells via the PI3K/Akt pathway (A: The expression level of PI3K/Akt pathway related genes in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor; B: PI3K/Akt pathway related proteins expression in MGC-803 cells transfected with control/miR-21-5p mimic/miR-21-5p inhibitor;**< 0.01 vs control group)
3 讨论
锌指蛋白是自然界一大类转录因子,可以结合靶基因从而调控下游基因的转录[11]。Cys2/His2 型锌指蛋白是其中较大的一类,其中一些已被发现与癌症的发生和发展密切相关[12-13]。研究发现 ZNF382位于 19 号染色体的长臂上,在调节结肠癌和鼻咽癌细胞的增殖和凋亡等多种细胞过程中发挥着重要作用[14-15]。Western blot 和 qRT-PCR 实验表明 ZNF268 在人卵巢癌中呈现高表达,ZNF268 基因敲除和细胞迁移实验表明,ZNF268 基因可能通过促进细胞周期来增加 SKOV-3 细胞的生长[16]。ZNF367 可以影响肺癌、肾上腺皮质癌、甲状腺癌等的发生和发展[5-6]。但是关于 ZNF367 是否影响胃癌的发生和发展目前还不清楚,本研究克隆了胃癌细胞中的 ZNF367,其在胃癌组织和细胞中呈现低表达,实验结果表明其是胃癌细胞发展的抑制因子。与锌指蛋白其他成员不同,ZNF367 在胃癌的发展过程中起到抑制作用。
miRNAs 是一类进化上十分保守、长度为 20 ~ 23 nt 的核苷酸非编码单链小分子 RNA,是目前的研究重点[17]。miR-21 在癌症的发生发展过程中起着至关重要的作用[18]。研究表明 miR-21 可以通过结合 PTEN 的 3'UTR 区域来抑制胃癌和非小细胞肺癌的增殖和侵袭[19-20]。miRNA-21 还被证明可以同时结合 PTEN 和 PDCD4 蛋白进而抑制胆管癌细胞的增殖[21]。然而,miR-21-5p 能够结合锌指蛋白家族的报道还比较少。本研究的靶点预测分析、双荧光素酶实验和qRT-PCR 实验表明 ZNF367 的 3'UTR 是 miR-21-5p 的直接作用靶点。由此可见,miR-21-5p 可以参与多种途径来调控癌症的发生和发展。本研究进一步丰富了 miR-21-5p 在肿瘤进展方面的功能。
PI3K/Akt 信号通路是具有酶活性的细胞内信号转导通路。研究发现人类的多种肿瘤如胃癌、大肠癌、乳腺癌、肝癌、肾癌等均与 PI3K/Akt 信号通路密切相关,且 PI3K/Akt 信号通路中多种上下游分子的表达量改变均可影响肿瘤的发生和发展[22-23]。研究发现,ZNF407可以通过 PI3K/Akt 信号通路来影响肠胃癌的发生和进展[22]。在口腔鳞状细胞癌中,过量表达 ZNF703 可以通过 PI3K/Akt/GSK-3β 信号促进细胞增殖和转移[24]。本研究通过 qRT-PCR 和Western blot实验发现了 miR-21-5p/ZNF367 分子轴通过PI3K/Akt 通路抑制胃癌细胞的增殖和迁移。
总之,本研究探究了胃癌发展过程中的新的机制,也为胃癌的诊断和治疗提供了新的实验依据。
[1] Milroy MJ. Cancer statistics: global and national.//Hopewood P, Milroy MJ. Quality cancer care -- survivorship before, during and after treatment editors (view affiliations). Berlin: Springer, Cham, 2018:29-35.
[2] Sitarz R, Skierucha M, Mielko J, et al. Gastric cancer: epidemiology, prevention, classification, and treatment. Cancer Manag Res, 2018, 10: 239-248.
[3] Stock M, Otto F. Gene deregulation in gastric cancer. Gene, 2005, 360(1):1-19.
[4] Muñoz M, Franceschi S. Epidemiology of gastric cancer and perspectives for prevention. Salud Publica Mex, 1997, 39(4):318-330.
[5] Jain M, Zhang L, Boufraqech M, et al. ZNF367 inhibits cancer progression and is targeted by miR-195. PLoS One, 2014, 9(7): e101423.
[6] Xu BL, Qin P, Chen GY, et al. MicroRNA-520e inhibited the migration and invasion of lung cancer A549 cells by regulating Zinc finger protein 367. Chin J Exp Surg, 2017, 34(7):1163-1165. (in Chinese)
徐本玲, 秦鹏, 陈广玉, 等. 微小RNA-520e通过调控锌指蛋白367抑制肺癌A549细胞的迁移和侵袭. 中华实验外科杂志, 2017, 34(7):1163-1165.
[7] Kim VN, Han J, Siomi MC. Biogenesis of small RNAs in animals. Nat Rev Mol Cell Bio, 2009, 10(2):126-139.
[8] Tutar Y. miRNA and cancer; computational and experimental approaches. Curr Pharm Biotechnol, 2014, 15(5):429.
[9] Valeri N, Braconi C, Gasparini P, et al. MicroRNA-135b promotes cancer progression by acting as a downstream effector of oncogenic pathways in colon cancer. Cancer Cell, 2014, 25(4):469-483.
[10] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, 2001, 25(4):402-408.
[11] Siggers TW, Honig B. Structure-based prediction of C2H2 zinc-finger binding specificity: sensitivity to docking geometry. Nucleic Acids Res, 2007, 35(4):1085-1097.
[12] Singh PK, Srivastava AK, Dalela D, et al. Frequent expression of zinc-finger protein ZNF165 in human urinary bladder transitional cell carcinoma. Immunobiology, 2015, 220(1):68-73.
[13] Krig SR, Miller JK, Frietze S, et al. ZNF217, a candidate breast cancer oncogene amplified at 20q13, regulates expression of the ErbB3 receptor tyrosine kinase in breast cancer cells. Oncogene, 2010, 29(40):5500-5510.
[14] Cheng Y, Geng H, Cheng SH, et al. KRAB zinc finger protein ZNF382 is a proapoptotic tumor suppressor that represses multiple oncogenes and is commonly silenced in multiple carcinomas. Cancer Res, 2010, 70(16):6516-6526.
[15] Chong Z, Xiang T, Li S, et al. The novel 19q13 KRAB zinc-finger tumour suppressor ZNF382 is frequently methylated in oesophageal squamous cell carcinoma and antagonises Wnt/β-catenin signalling. Cell Death Dis, 2018, 9(5):573.
[16] Hu L, Wang W, Cai J, et al. Aberrant expression of ZNF268 alters the growth and migration of ovarian cancer cells. Oncol Lett, 2013, 6(1): 49-54.
[17] Ambros V. The functions of animal microRNAs. Nature, 2004, 431(7006):350-355.
[18] Kumarswamy R, Volkmann I, Thum T. Regulation and function of miRNA-21 in health and disease. RNA Biol, 2014, 8(5):706-713.
[19] Zhang JG, Wang JJ, Zhao F, et al. MicroRNA-21 (miR-21) represses tumor suppressor PTEN and promotes growth and invasion in non-small cell lung cancer (NSCLC). Clin Chim Acta, 2010, 411(11-12):846-852.
[20] Zhang BG, Li JF, Yu BQ, et al. microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN. Oncol Rep, 2012, 27(4):1019-1026.
[21] Liu CZ, Liu W, Zheng Y, et al. PTEN and PDCD4 are bona fide targets of microRNA-21 in human cholangiocarcinoma. Chin Med Sci J, 2012, 27(2):65-72.
[22] Jiang Q, Weiss JM, Back T, et al. mTOR kinase inhibitor AZD8055 enhances the immunotherapeutic activity of an agonist CD40 antibody in cancer treatment. Cancer Res, 2011, 71(12):4074-4084.
[23] Wang D, Chen J, Chen H, et al. Leptin regulates proliferation and apoptosis of colorectal carcinoma through PI3K/Akt/mTOR signalling pathway. J Biosci, 2012, 37(1):91-101.
[24] Wang H, Deng X, Zhang J, et al. Elevated expression of zinc finger protein 703 promotes cell proliferation and metastasis through PI3K/AKT/GSK-3β signalling in oral squamous cell carcinoma. Cell Physiol Biochem, 2017, 44(3):920-934.
The hsa-miR-21-5p/ZNF367 molecular axis affects the proliferation and migration of gastric cancer cells through the PI3K/Akt pathway
ZHAO Zhi-dong, HUAN Jin-liang, TANG Wen-jun, QIN Xian-ju
General Surgery, Shanghai Eighth People's Hospital, Shanghai 200235, China
To investigate effect of miR-21-5p/ZNF367 axis on the proliferation and migration of gastric cancer (GC) cells.
GC and corresponding para-cancer normal tissues were obtained from 46 gastric cancer patients undergoing surgery in General Surgery Department of Shanghai Eighth People's Hospital. Meanwhile, GES-1 and GC cell lines MGC-803 and MKN-45 were selected to perform the assays. We used qRT-PCR and Western blot (WB) to detect the expression level of ZNF367 and hsa-miR-21-5p (miR-21-5p) in the tissues and cell lines, and kaplan-meier survival analysis was performed to obtain total survival period. The LipofectamineTM2000 was used to transfect oligonucleotide fragments, including miRNA-NC, miR-21-5p mimic and miR-21-5p inhibitor, into MGC-803 cells. The proliferation and migration of the cells were detected by CCK8 and wound healing assay, respectively. Dual luciferase reporter gene assays were used to validate the relationship between ZNF367 and miR-21-5p. The expression level of ZNF367, E-cadherin, N-cadherin, Vimentin, p-PI3K and p-Akt in MGC-803 cells transfected with miR-21-5p mimic and miR-21-5p inhibitor were detected by qRT-PCR and WB experiments.
The expression level of ZNF367 in GC tissues and cell lines was significantly lower than that in para-cancer tissues and GES-1 cells (< 0.01), and the expression level was the lowest in MGC-803 cells, while the expression level of miR-21-5p was found in an opposite way (< 0.01). In MGC-803 cells, the proliferation and migration abilities of cells transfected with over-expressed ZNF367 and miR-21-5p inhibitor were significantly lower than those of the control group, while the proliferation and migration abilities of cells transfected with siRNA-ZNF367 and miR-21-5p mimic were significantly higher than those of the control group. Bioinformatics and luciferase activity assays showed that ZNF367 had a direct targeting relationship with miR-21-5p. The results of qRT-PCR and WB experiments demonstrated that the expression of E-cadherin was significantly increased in the miR-21-5p inhibitor transfection group (< 0.01), while the expression of N-cadherin, Vimentin, p-PI3K and p-Akt significantly was decreased. In the transfection group of miR-21-5p mimic, opposite results were observed (< 0.01).
ZNF367 was a negative regulator in the proliferation and migration of GC cell MGC-803. The miR-21-5p/ZNF367 molecular axis affects EMT process by regulating PI3K/Akt pathway.
Gastric cancer, ZNF367, miR-21-5p, PI3K/Akt, Proliferation; Migration
QIN Xian-ju, Email: qinxj@hotmail.com
·协会之窗·
协会医学实验室建设与管理学分会正式启动《医学实验室安全与管理学》教材编写工作
日前,《医学实验室安全与管理学》教材第一次编委会召开,启动了教材的编写序幕。编委会由协会医学实验室建设与管理学分会主任委员吴炳义教授担任主持,参会人员包括大连医科大学朱亮教授、中南大学湘雅医院申竑教授、四川大学华西医院黄强科长、安徽医科大学肖风丽教授、大连医科大学吴云红教授等十余位专家。吴炳义主委首先向大家宣布《医学实验室安全与管理学》教材获人卫社批准编写,接着由副主任委员朱亮教授就编写思路和具体要求进行详细讲解。会议还针对具体章节的编写和分工情况进行了讨论,对教材的内容、章节增补和修改提出了建议并达成共识。
2019 年年底,协会医学实验室建设与管理分会和大连医科大学向人民卫生出版社提出《医学实验室安全与管理学》教材的编写申请并进行联合申报。经人民卫生出版社严谨的调研后,于 2020 年 2 月正式批准。该教材由朱亮、吴炳义任主编,申竑、黄强、肖风丽、吴云红任副主编。教材贯彻习近平总书记“把生物安全纳入国家安全体系,系统规划国家生物安全风险防控和治理体系建设,全面提高国家生物安全治理能力”的精神,把生物安全上升到国家安全的高度。
近年来,高校实验室事故频发,与高校安全管理机制不健全,措施落实不到位及学生实验室安全与管理知识匮乏有关。但目前市场上还没有适合医学本科生、研究生和医学实验室从业人员使用的关于医学实验室安全与管理类的教材;缺少一本能帮助医学科研者建立全面、系统,且实际操作性强的通识教育教材。
此次《医学实验室安全与管理学》获批编写,对各级别医学实验室的安全使用及管理具有重要的指导意义;同时对于实验室建设与管理学分会是一个重要契机,扩大了分会在行业内的影响力。
10.3969/j.issn.1673-713X.2020.03.008
上海市徐汇区科委重大项目(SHXH201794)
秦贤举,Email:qinxj@hotmail.com
2019-12-09
