人脐带间充质干细胞对HaCaT细胞增殖与迁移的影响
2020-06-19章毅陈侃俊伍婷张晗祁成孔凡瑞陈亮胡肖希李品宙
章毅,陈侃俊,伍婷,张晗,祁成,孔凡瑞,陈亮,胡肖希,李品宙
·论著·
人脐带间充质干细胞对HaCaT细胞增殖与迁移的影响
章毅*,陈侃俊*,伍婷,张晗,祁成,孔凡瑞,陈亮,胡肖希,李品宙
200051 上海市脐带血造血干细胞库/上海市干细胞技术有限公司/中国干细胞集团有限公司
探讨人脐带间充质干细胞(hucMSCs)对人表皮角质形成细胞增殖与迁移的影响及其可能机制。
采用 II 型胶原酶消化法从新生儿脐带中分离制备 hucMSCs,用流式细胞术鉴定 P3 代 hucMSCs 表面标记抗原,用油红 O 染色、茜素红 S 染色和 Masson 染色进行间充质干细胞三向分化能力鉴定;以人表皮角质细胞系HaCaT 为研究模型,在 transwell 上室接种 P3 代 hucMSCs进行共培养,显微镜观察24、48 和 72 h 时 HaCaT 的细胞形态,CCK8 法检测细胞增殖状况,划痕法检测细胞 12 h 和 24 h 迁移率,qRT-PCR 法测定 HaCaT 细胞迁移、增殖相关生长因子 KGF-2、FGFR-2、TGF-β1,以及细胞外基质蛋白 Fibronectin、MMP-1 和 Collagen I mRNA 表达水平。
hucMSCs 呈成纤维细胞样贴壁生长,其表面间充质干细胞标志性抗原 CD105、CD90、CD73 阳性表达率分别为 98.35%、99.97% 和 99.94%,不表达 CD45、CD34、CD14 和 CD19,在诱导培养 16 d 后出现明显的成脂、成骨和成软骨细胞特性。hucMSCs 共培养 24、48 和72 h,HaCaT 细胞存活率较对照组分别显著增加了(20.42 ± 3.90)%(= 0.002)、(36.30 ± 8.08)%(= 0.001)和(27.31 ± 10.04)%(= 0.012),与形态学观察结果一致。划痕后继续培养 12 h,对照组、共培养组 HaCaT 的空白区域面积分别为(36354.19 ± 1705.32)μm2、(29497.63 ± 1286.49)μm2(= 0.045),培养 24 h,其空白区域面积分别减少为(13086.65 ± 1695.85)μm2、(2895.69 ± 224.32)μm2(= 0.014)。qRT-PCR 结果显示,共培养处理 24 h 后 hucMSCs 组 KGF-2、TGF-β1 基因表达分别上调为对照组的 1.24 倍和 1.92 倍;共培养 48 h 后 KGF-2、TGF-β1 和 FGFR-2 分别上调 2.01 倍、2.26 倍和 1.34 倍,细胞外基质蛋白 Fibronectin 转录水平显著上调为对照组的 1.59 倍,MMP-1 降低至对照组的 0.52 倍。
hucMSCs 能够显著促进 HaCaT 细胞的增殖与迁移,这可能与 hucMSCs 调节 HaCaT 增殖、迁移相关生长因子及细胞外基质蛋白的基因表达水平有关,提示 hucMSCs是有潜力的表皮创伤愈合种子细胞。
脐带间充质干细胞; 创伤愈合; HaCaT; 细胞迁移
皮肤是人体最大的器官,其中表皮层位于皮肤最外层,不仅担负着机体屏障功能、吸收功能和感觉功能,也直接反映了个体皮肤的健康及代谢状况。角质形成细胞是表皮的主要细胞类型,其形态、大小和排列从基底层到角质层随着细胞分化与更新而发生有规律的变化,具有表皮构成、创伤修复、细胞角化、细胞因子分泌和免疫监视等功能[1-2]。角质形成细胞的增殖活力下降、迁移不足、角化功能衰退会导致表皮萎缩变薄、皮肤干燥、皱纹产生和皮肤免疫功能退化,严重影响皮肤健康[3]。
间充质干细胞(mesenchymal stem cell,MSCs)是一类具有自我更新能力和多向分化潜能的多能干细胞,广泛存在于骨髓、脐带、胎盘和脂肪等组织中。MSCs 除了能够支持造血、防治移植物抗宿主病,还能修复骨和软骨、肌腱、心肌、皮肤等组织损伤,被认为是组织工程和细胞治疗的理想种子细胞。多项研究表明,MSCs 能够向皮肤创伤部位迁移、调节细胞炎症水平、诱导细胞外基质蛋白的合成与分泌,进而修复皮肤缺损和促进创面愈合[4-6],此外还能促进异体移植皮肤存活[7],改善纤维化[8]、减轻皮肤放射性损伤[9]。然而,目前关于MSCs 对人表皮的潜在调节作用还鲜有报道。HaCaT 由人皮肤永生化角质形成,拥有正常人表皮角质形成细胞的增殖、分化特性。本文以 HaCaT 细胞为模型,探究了人脐带间充质干细胞(human umbilical cord MSCs,hucMSCs)对 HaCaT 增殖和迁移的影响及其可能机制。
1 材料与方法
1.1 材料
1.1.1 试剂与耗材 采集足月产健康新生儿脐带,经产妇或家属签署知情同意书后获得,符合国家相关法律和伦理委员会规定。成脂、成软骨、成骨诱导试剂盒为美国 Gibco 公司产品;CCK8 试剂盒为碧云天公司产品;MSC Phenotyping Kit(CD105-PE、CD90-FITC、CD73-APC、CD14-/ CD19-/CD34-/CD45-PerCP)为德国 Miltenyi Biotec 公司产品;油红 O 染液、Masson 染液、茜素红 S 染液购自南京建成生物工程研究所有限公司;0.4% 台盼蓝为美国 Sigma 公司产品;FBS、DMEM、0.25% Typsin-EDTA、L-谷氨酰胺、0.4 μmol/L transwell 小室为美国 Gibco 公司产品;Trizol 溶液、cDNA合成试剂盒、PCR 试剂盒购自美国 Life technologies 公司;基因引物为美国 Invitrogen 公司产品;青霉素-链霉素溶液购自德国 PAN-biotech 公司。
1.1.2 仪器 Varioskan LUX 多功能酶标仪和 ST-16R 低温离心机购自美国 Thermo 公司;stepone plus 实时荧光定量 PCR 仪购自美国 Life 公司;1800 系列-190 气相液氮罐购自美国 MVE 公司;自动细胞计数仪购自美国 Invitrogen 公司;FACS Calibur 流式细胞仪购自美国 BD 公司。
1.2 方法
1.2.1 hucMSCs 的分离培养 无菌条件下取脐带华通胶剪碎成约 2 mm3的组织块,加入 II 型胶原酶 37 ℃恒温消化 1.5 h,收集滤液室温2000 r/min离心 10 min,收集细胞沉淀加入含 10% FBS 的 DMEM 培养基重悬,置于 37 ℃、5% CO2恒温培养箱内进行培养,待细胞融合度达到 85% ~ 90% 时,用 0.25% 胰酶消化传代,接种密度为 5 × 104/ml,每 2 天为细胞全量换液,每 3 ~ 4 天传代 1 次。
人力资源管理系统之中,应当加强绩效管理的运用,从而提升人力资源管理的质量以及效率,促进医院可以实现健康以及稳定发展。首先,进行绩效考核的过程当中,注意考核和岗位实现有效融合。对员工考核过程当中,医院方面应当对护理及医生进行不同层面考核,考核内容、考核指标差异化,也需要注意技术、难度、劳动强度、专业特点、职责岗位以及风险系数等多方面因素,切忌一刀切,实现全面、综合性考核。考核过程当中应当避免僵化,实现动态化的考核,并且奖金发放以及职称评聘要有依据,对于表现良好员工需要给予一定精神奖励以及物质奖励,促使工作积极性得到显著提高,督促员工不断提升自我。
1.2.2 hucMSCs 表面抗原检测 参考文献[10]鉴定方法,取 P3 代对数生长期 hucMSCs,用 PBS 调整细胞密度为 5 × 106/ml,取 1 ml 细胞,分别加入鼠抗人单克隆标记抗体CD90-PerCP-Cy5.5、CD105-PE、CD73-APC、CD45-/CD34-/CD14-/CD19- FITC,室温避光孵育 30 min,流式细胞仪上样检测。
1.2.3 hucMSCs 三向分化检测 参考文献[10]鉴定方法,取 P3 代对数生长期 hucMSCs 接种于六孔板中,细胞密度为 5 × 104/ml,2 ml/孔,置于37 ℃、5% CO2、饱和湿度的恒温培养箱中培养,待细胞融合度达到 60% ~ 70% 时,弃去原培养基,分别更换为成脂、成软骨和成骨诱导分化培养基,每 3 天换液。诱导 14 d 后,分别用油红 O 染液、Masson 染液、茜素红 S 染液染色,倒置相差显微镜下观察细胞的成脂、成软骨、成骨分化情况。
1.2.4 hucMSCs 与 HaCaT transwell 共培养 取 HaCaT 接种于六孔板中,接种密度为 5 × 104/ml,2 ml/孔。在 HaCaT 上方放置 transwell 小室,实验组 transwell 上室接种 P3 代hucMSCs,细胞密度为 5 × 104/ml,1 ml/孔,对照组的 transwell 上室添加等量 DMEM 培养基。每个处理组设置3 个重复孔。在 37 ℃、5% CO2细胞培养箱中连续培养 24、48 和 72 h,倒置显微镜下观察 HaCaT 的细胞形态。
1.2.5 HaCaT 增殖检测 参照 1.2.4 所述方法,于 24 孔板中接种并培养 HaCaT 和hucMSCs。培养结束后,弃去 hucMSCs 及小室,每孔加入 200 μl CCK8 工作液,37 ℃孵育 2 h,酶标仪检测 450 nm 处吸光值。
1.2.6 划痕法检测 HaCaT 细胞迁移 按照 1.2.4 所述方法接种并培养 HaCaT 细胞。36 h后,培养板孔底形成稀疏的单细胞层,用微量移液管尖在细胞中央作一个十字划痕,得到上、下、左、右四个无细胞的空白区域,并在四个象限区域的十字划痕上分别取点标记。用 PBS 洗涤细胞两次,去除 HaCaT 细胞碎片。接着,按 1.2.4 所述方法处理实验组和对照组细胞,用无血清 DMEM 培养基继续培养,在 0、12 和 24 h 时显微镜观察相同位置划痕区弥合情况并拍照记录。迁移率计算方法为:12 h 或 24 h 所测划痕区域与 0 h 划痕区域的空白面积作差,差值除以 0 h 测空白面积,所得百分比即 12 h 或 24 h 细胞迁移率。划痕实验每组设平行孔 2 个,独立重复 3 次实验。
1.2.7 qRT-PCR 检测基因 mRNA 表达 按照 1.2.4 所述方法培养 HaCaT 和 hucMSCs,连续培养 24、48 h 后,采用 Trizol 法提取 HaCaT 细胞总 RNA,反转录为 cDNA,–20 ℃保存。采用qRT-PCR 测定 HaCaT 细胞纤连蛋白(Fibronectin)、基质金属蛋白酶-1(MMP-1)、I 型胶原(Collagen I)、人角质细胞生长因子-2(KGF-2)、人成纤维细胞生长因子受体-2(FGFR-2)和转化生长因子-β1(TGF-β1)的 mRNA 表达。PCR 扩增条件:50 ℃保持 2 min,95 ℃预变性 2 min,95 ℃变性 3 s,60 ℃退火 30 s,循环 40 次,95 ℃延伸 15 s,60 ℃延伸 1 min,95 ℃延伸 15 s。基因引物序列见表 1。
1.3 统计学分析
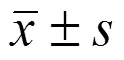
2 结果
2.1 hucMSCs 表面抗原鉴定
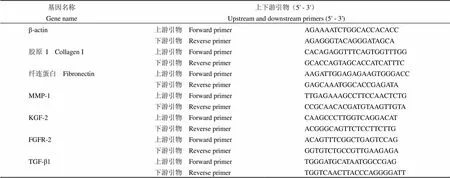
表 1 qRT-PCR基因引物序列
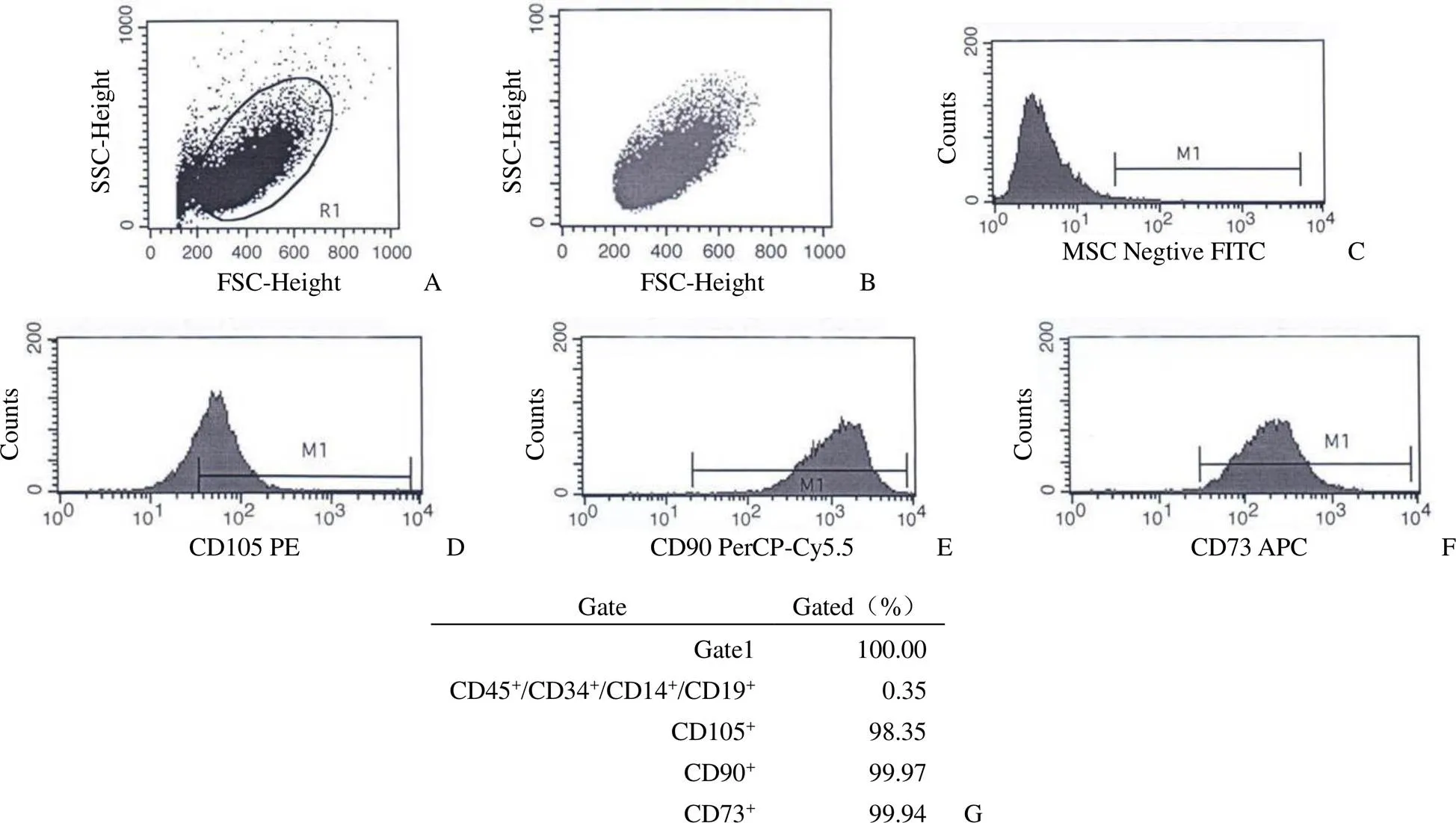
图 1 hucMSCs 表面标志性抗原流式鉴定结果(A:总细胞散点分布;B:活性细胞;C:阴性对照;D ~ F:CD105+、CD90+、CD73+ 细胞比例;G:阳性细胞比例)
Figure 1 Phenotype characterization of hucMSCs through flow cytometry (A: Total cells scatter diagram; B: Alive cells; C: Negative staining; D - F: CD105+, CD90+, CD73+cells ratio; G: Positive cell proportion)
2.2 hucMSCs 三向分化能力鉴定
P3 代 hucMSCs 接种后 12 h 贴壁良好,细胞呈典型成纤维细胞样生长,以放射状或平行状紧密排列,连续培养 3 d 左右细胞密度达到 85% ~ 90%(图 2A)。成脂诱导培养 16 d 后进行油红 O 染色,观察到大小不等的红色脂滴,细胞核呈蓝色,脂滴随着诱导时长的增加而增大、增多,同时细胞形态从梭形、多角形向椭球形转变,表现出脂肪细胞特点;成骨诱导培养 16 d 后进行茜素红 S 染色,观察到细胞体积增大,出现大量橘色沉淀颗粒和多层结节状结构,提示细胞出现钙化沉积,表现出成骨细胞特点;成软骨诱导培养 16 d 后进行 Masson 染色,观察到细胞突起收回,趋向扁平圆形生长,细胞基质和纤维呈蓝紫色,表现出成软骨细胞样特点(图 2B ~ D)。三向分化实验结果表明本研究制备的 hucMSCs 具有很好的成脂、成骨和成软骨分化潜能。
2.3 hucMSCs 共培养对 HaCaT 细胞形态的影响
对比 hucMSCs 共培养 24、48 和 72 h 对 HaCaT 细胞形态和增殖状况的影响,结果显示培养 24 h 时,HaCaT 贴壁良好,细胞形态与轮廓清晰,共培养组较对照组细胞聚集更好、团块更大;48 h 时,共培养组细胞已联结成片、间隙大大缩小;72 h时,共培养组细胞间隙消失,呈扁平铺路石状排列,较对照组细胞更紧密(图 3)。提示与 hucMSCs共培养的 HaCaT 细胞形态良好、增殖更快。
2.4 hucMSCs 对 HaCaT 细胞增殖的影响
将 hucMSCs 处理组与对照组的450作差,再与对照组450作比,计算 HaCaT细胞存活率的增加比例。结果显示(图 4、表 2),hucMSCs 与 HaCaT 共培养 24、48 和 72 h,HaCaT 细胞存活率分别显著增加了 20.42%(< 0.01)、36.30%(< 0.01)和 27.31%(< 0.05),与形态学观察结果(图 3)一致。提示 hucMSCs 共培养能够持续促进 HaCaT 细胞的增殖。
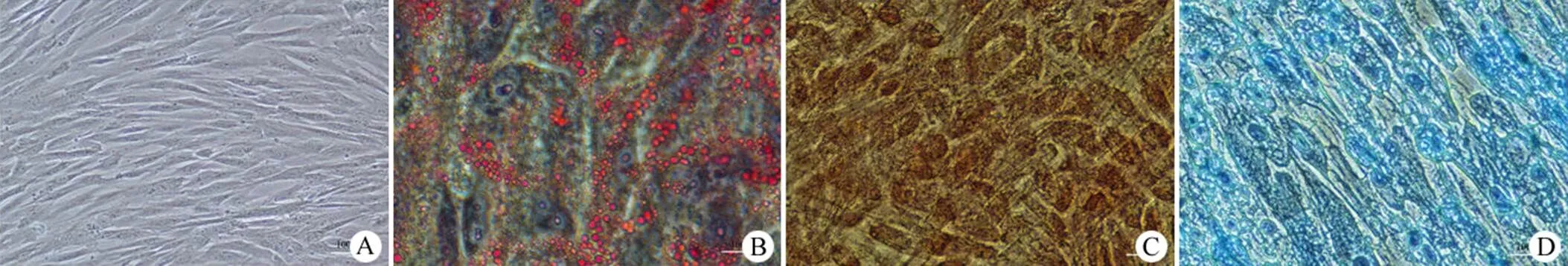
图 2 hucMSCs 成脂、成骨、成软骨三向诱导分化结果(A:正常 hucMSCs 细胞;B:油红 O 染色;C:茜素红 S 染色;D:Masson 染色;× 200)
Figure 2 Adipogenic, osteogenic and chondrogenic differentiation capacities of hucMSCs (A: Normal hucMSCs morphology; B: Oil red O staining; C: Alizarin red S staining; D: Masson staining; × 200)
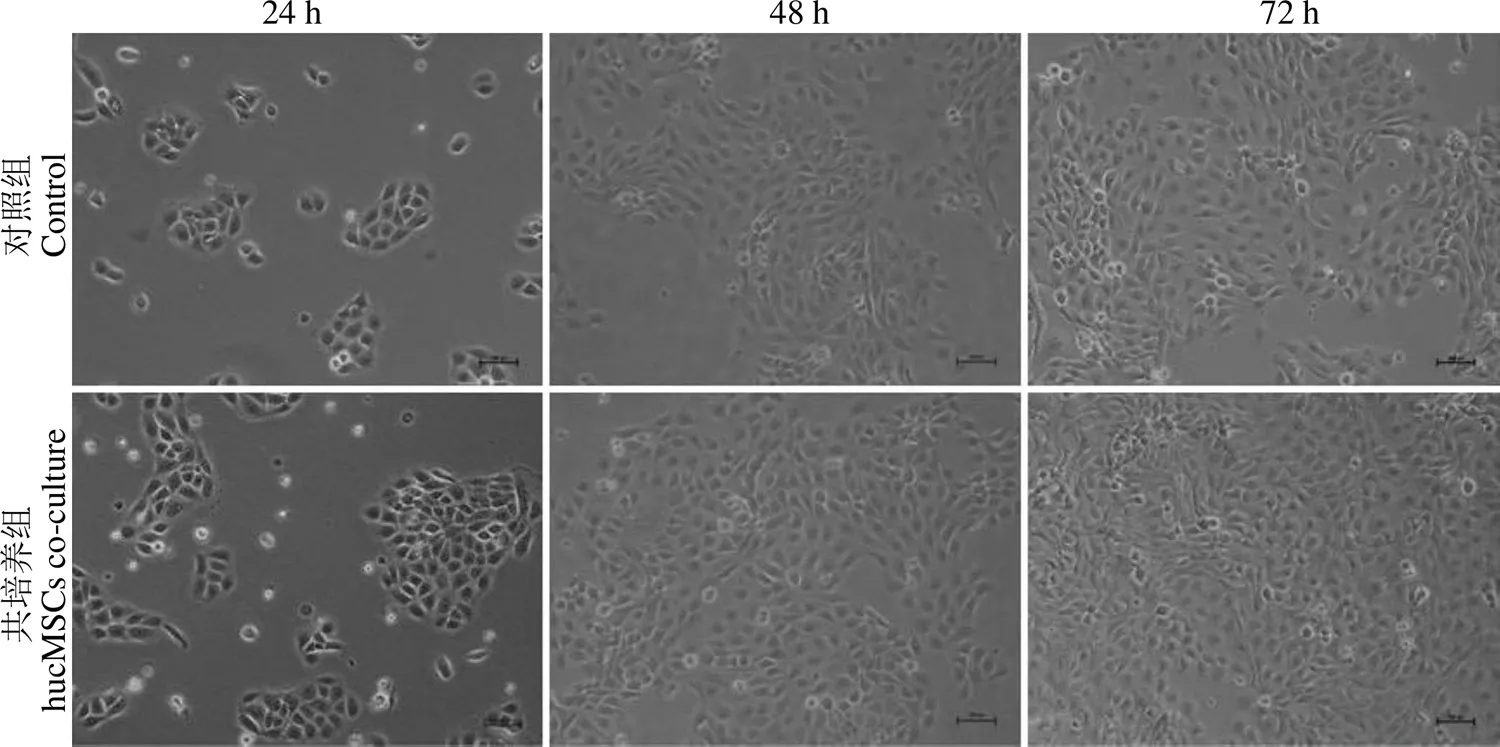
图 3 hucMSCs 共培养对 HaCaT 细胞生长及形态的影响(× 100)
Figure 3 The effects of hucMSCs co-culture on HaCaT cell growth and morphology (× 100)
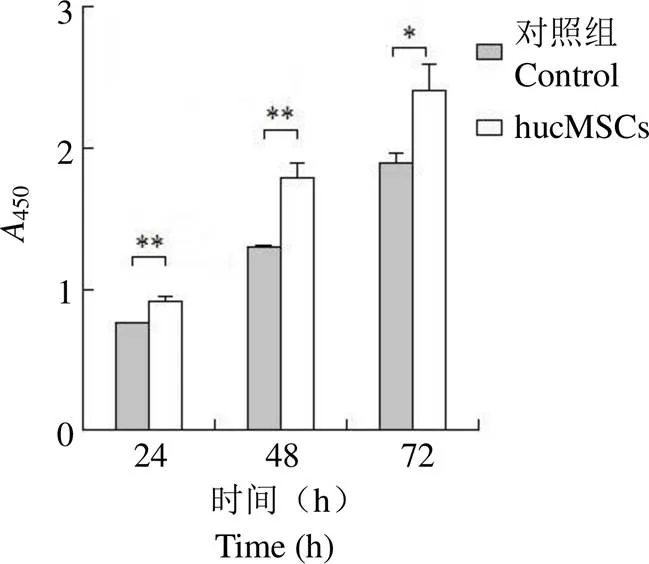
图 4 HaCaT 细胞 CCK8 增殖检测结果(*P < 0.05,**P < 0.01)
Figure 4 HaCaT cell proliferation assay by CCK8 method (*< 0.05,**< 0.01)
2.5 hucMSCs 对 HaCaT 细胞迁移的影响
细胞划痕实验结果显示,HaCaT 细胞对照组和共培养组初始空白区域面积分别为(44458.37 ± 1838.50)μm2和(42080.05 ± 2895.85)μm2,无显著差异(> 0.05,图 5B);继续培养 12 和 24 h,对照组与 hucMSCs 共培养组细胞均向划痕处迁移(图 5A)。12 h 时,对照组和 hucMSCs 处理组的空白区域面积分别为(36354.19 ± 1705.32)μm2和(29497.63 ± 1286.49)μm2,迁移率分别为18.23% 和 29.90%,差异显著(< 0.05,图 5 B);培养24 h 时,对照组空白区域面积为(13086.65 ±1695.85)μm2,迁移率为 70.56%,共培养组空白区域面积为(2895.69 ± 224.32)μm2,迁移率为 93.12%,划痕处几乎已经重新铺满细胞,空白区域面积差异显著(< 0.05,图 5B)。表明 hucMSCs 能够显著促进 HaCaT 细胞的迁移,加速划痕空白区域弥合。
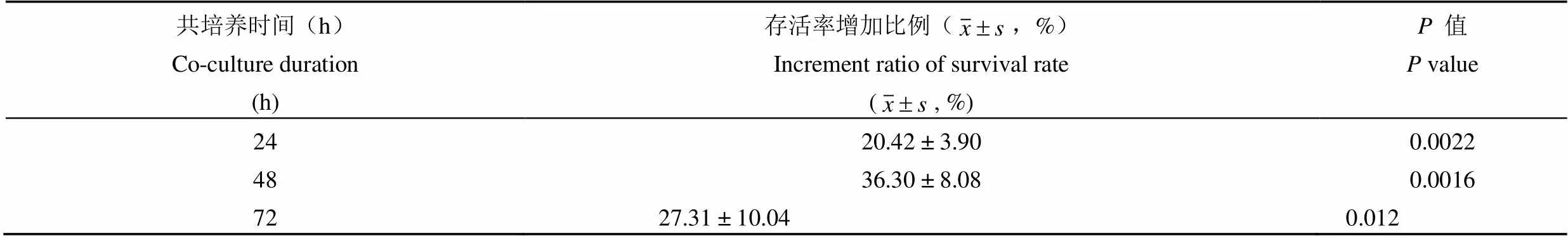
表 2 HaCaT 存活率分析
2.6 hucMSCs 对 HaCaT 细胞外基质蛋白和生长因子基因表达的影响
本研究进一步测定了 hucMSCs 共培养 24 和 48 h 时 HaCaT 细胞迁移、黏附相关细胞因子及细胞外基质相关蛋白的 mRNA 表达水平,初步探究 hucMSCs 的作用机制。结果显示,与对照组相比,hucMSCs 共培养 48 h 显著提高了 Fibronectin(= 0.013,图 6A)和 FGFR-2(= 0.011,图 6E)的基因表达水平;共培养 24 h、48 h,KGF-2(= 0.033 和= 0.022,图 6D)和TGF-β1(= 0.023和= 0.033,图 6F)mRNA 水平都得到显著提高;共培养 48 h,MMP-1(= 0.020,图 6B)mRNA 表达显著降低;共培养 24 h、48 h,Collagen I(= 0.686 和= 0.315,图 6C)的基因表达水平均无显著变化。这些结果提示hucMSCs 可能通过上调促 HaCaT 黏附、迁移及增殖相关生长因子表达,维持细胞外基质蛋白水平来促进角质形成细胞的迁移和增殖。
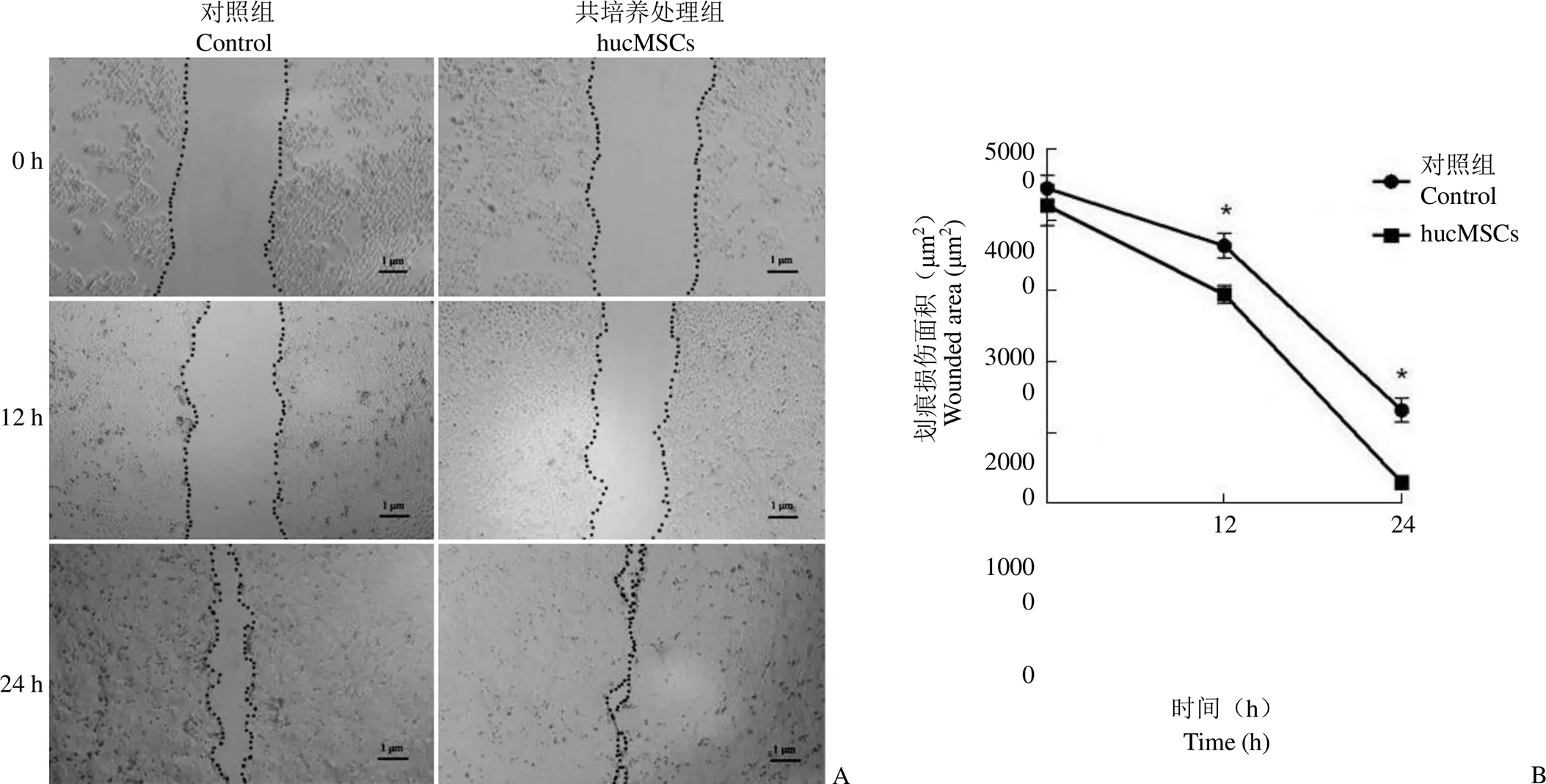
图 5 hucMSCs 共培养对 HaCaT 细胞迁移的影响(A:hucMSCs 共培养 12 h、24 h 细胞向划痕区域迁移状况;B:hucMSCs 共培养 12 和24 h 时细胞划痕区面积的变化;*P < 0.05)
Figure 5 The effects of hucMSCs on the migration of HaCaT cells determined by scratch method (A: Migration and growth of HaCaT cells after 12 h and 24 h co-culture with hucMSCs; B: The wounded area of HaCaT cells after 12 h and 24 h hucMSCs treatment;*< 0.05)
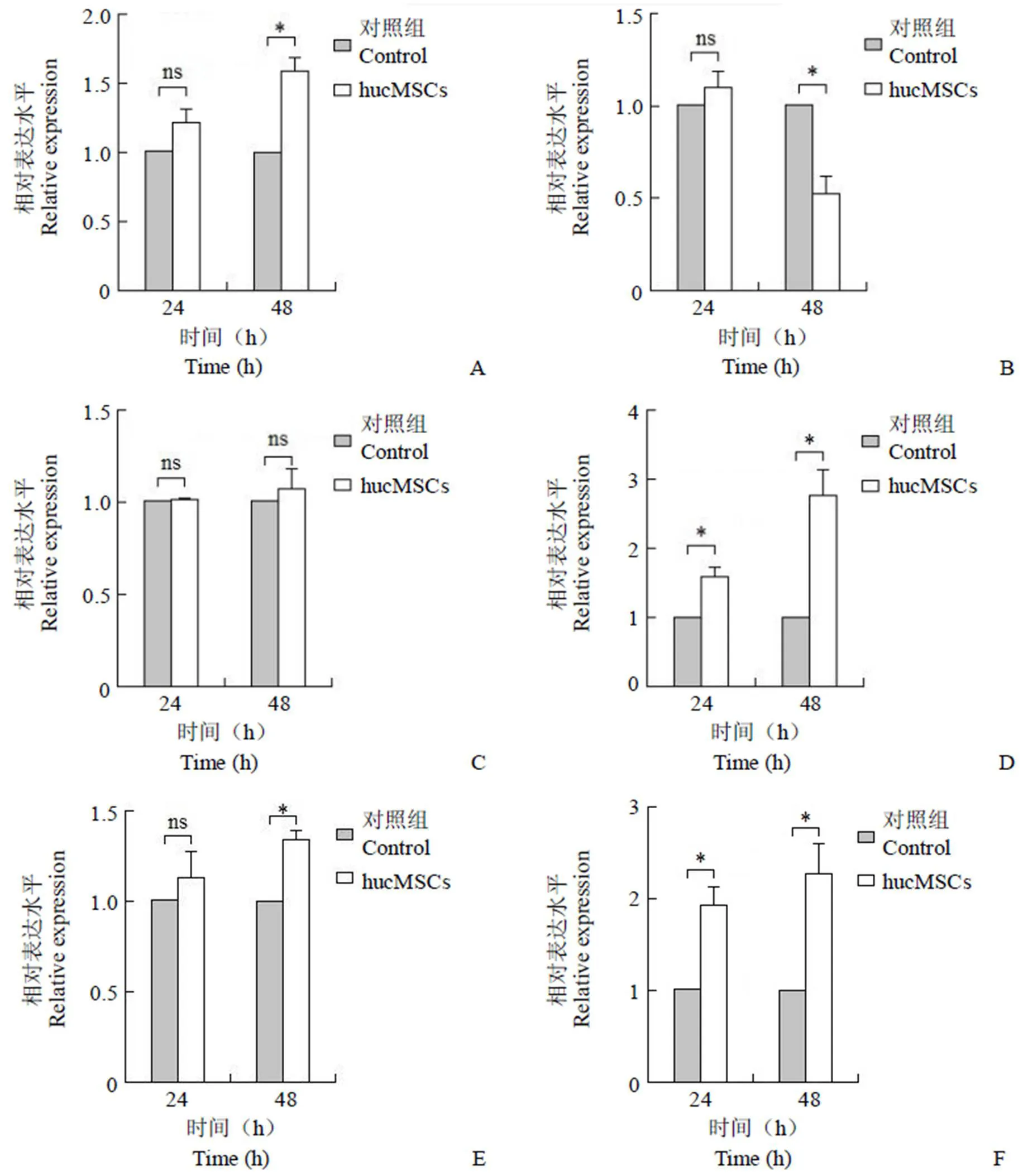
图 6 HaCaT 细胞外基质蛋白及细胞生长因子基因表达检测结果(A:纤连蛋白;B:基质金属蛋白酶-1;C:I 型胶原;D:人角质细胞生长因子-2;E:人成纤维细胞生长因子受体-2;F:转化生长因子-β1;nsP > 0.05,*P < 0.05)
Figure 6 The mRNA levels of extracellular matrix and cell growth factors of HaCaT cells determined by qRT-PCR (A: Fibronectin; B: MMP-1; C: Collagen I; D: KGF-2; E: FGFR-2; F: TGF-β1;ns> 0.05,*< 0.05)
3 讨论
创伤愈合长期以来是行外科手术或烧灼伤后的临床关注重点,它与手术后感染、并发症,烧灼伤患者病程长短、后期瘢痕形成等均有密切关系。伤口愈合是一个高度复杂的过程,涉及多种生化途径和细胞活动,主要包括炎症反应、上皮再生、纤维增生和血管生成[12]。在愈合的早期阶段,表皮中主要的细胞类型角化形成细胞被激活,在上皮-间质转化的同时迁移到创伤部位并启动再上皮化和诱导伤口收缩,接着进行细胞增殖以重建复层上皮,因此,角质形成细胞对于伤口的最佳闭合至关重要[13]。Guerid 等[14]在前瞻性随机临床试验中,用角化细胞悬浮液处理整形手术后人前大腿内侧皮肤,发现能够显著减轻伤口痛感、缩短愈合时长,并指出其可能通过释放生长因子或原位增殖来诱导和刺激愈合。Horváth 等[15]研究发现,肌球蛋白磷酸酶通过不同程度地激活角质形成细胞的迁移和分化,促进 HaCaT 划痕伤口修复,帮助维持皮肤的正常稳态。Shibata 等[2]研究也表明,脂联素在 ERK 信号通路的介导下通过促进角化细胞的增殖和迁移加速皮肤伤口愈合进程。这些研究结果表明,角质形成细胞的增殖和迁移与皮肤创伤愈合密切相关。由于在正常生理状态下,角质形成细胞是形成复层上皮的典型,其在创伤愈合时的迁移运动则以侧向爬行为主,因此,我们用基于无血清培养的划痕实验模拟探究 hucMSCs 对 24 h 周期内 HaCaT 细胞迁移的影响。结果显示,hucMSCs 共培养 12、24 h 均显著提高 HaCaT 细胞的迁移率。CCK8 存活率检测结果也显示,hucMSCs 非接触处理 24、48 和72 h 均能显著提高 HaCaT 细胞的存活率。这些结果表明,hucMSCs 能够有效提高 HaCaT 细胞的增殖和迁移能力,提示脐带源 MSCs 能够潜在地促进皮肤伤口愈合。
细胞外基质(extracellular matrix,ECM)及其与细胞间复杂的信号传导与细胞黏附、迁移、生长等代谢活动相关。ECM 可以影响角质形成细胞活性,并通过胶原酶分泌和整合素受体通路调节细胞迁移,进而参与皮肤损伤愈合和组织再生[16]。纤连蛋白是角质形成细胞特异性黏附和迁移的重要底物,以时间和剂量依赖方式发挥作用,同时也是表皮再植和皮肤损伤修复过程中影响上皮细胞迁移的关键蛋白[17]。本研究结果显示 hucMSCs 在促进 HaCat 细胞迁移的同时,显著上调了纤连蛋白的 mRNA 表达,且呈现时间依赖性,提示纤连蛋白可能是 hucMSCs 影响 HaCaT 细胞迁移的重要蛋白,与 Clark 等[17]结果一致。胶原是哺乳动物细胞 ECM 的重要组成部分和主要结构蛋白,能够促进 ECM 的成熟、加强和支持结缔组织,也是皮肤刚性和抗张强度的生物学基础。胶原在多种正常生理过程和病理条件下会被MMPs 降解,包括组织重塑、器官形成、伤口愈合、皮肤老化和炎症发生等[18]。MMPs 则主要通过裂解包括胶原蛋白在内的 ECM 组分而在组织重塑过程中发挥重要作用。其中,MMP-1 是裂解 I ~ III 型胶原三重螺旋结构的主要酶。在皮肤炎性反应或辐照损伤条件下,细胞 MMP-1 水平的升高和 I 型前胶原蛋白水平降低,可以引发结缔组织损伤并加速皮肤老化[19]。本研究结果显示,hucMSCs 共培养能够显著下调 HaCaT 细胞 MMP-1 的 mRNA 水平,而I 型胶原蛋白表达无显著变化,提示间充质干细胞通过抑制I 型胶原蛋白和纤连蛋白的降解,进而促进角质形成细胞的迁移活动。
可溶性生长因子及其受体间相互作用也被认为是皮肤细胞增殖、迁移活动及伤口愈合各阶段的重要调节因子,包括转化生长因子 β(transforming growth factor β,TGF-β),角质细胞生长因子(keratinocyte growth factor,KGF)及其受体,成纤维细胞生长因子(fibroblast growth factor,FGF)和表皮生长因子(epidermal growth factor,EGF)等[20-21]。TGF-β 是常见的细胞因子,Grose 等[22]和 O′Leary 等[23]研究发现,TGF-β1 可以通过上调特定整合素的表达促进角质细胞的迁移和运动,并促进皮肤细胞增殖,最终加速皮肤创伤愈合。与之相一致地,我们发现 hucMSCs 共培养 24 h 和48 h 后 TGF-β1 的 mRNA 表达分别上调为对照组的 1.92 倍和 2.26 倍,呈现时间依赖效应,提示 hucMSCs 促进 HaCaT 的增殖和迁移可能与 TGF-β 通路的激活有关。KGF-2 是人体皮下组织细胞分泌的一种重要生长因子,能够特异性结合上皮细胞的FGFR-2,再经过一系列信号传递过程促进上皮细胞的增殖、分化和迁移[24]。在动物模型中,KGF-2 能够显著促进皮肤移植、机械损伤造成的创面愈合,提高新生皮肤胶原含量,增加皮肤抗张强度和上皮厚度[25-26]。本研究结果也显示,hucMSCs 显著上调 HaCaT 细胞KGF-2 的 mRNA 表达并呈时间效应关系,在共培养处理 48 h 后其特异性受体FGFR-2 mRNA 水平也显著上调 1.34 倍,提示 KGF-2 及其受体参与hucMSCs 对 HaCaT 增殖和迁移的调节作用。
近年来,越来越多研究指出,MSCs 在皮肤医学领域应用前景广阔,除了具有降低炎性反应[27]、缓解纤维化[8]、减轻瘢痕形成[28]等作用,还被发现能够促进皮肤损伤愈合,是有潜力的皮肤创面移植材料。Rashtbar 等[29]研究表明,添加了 MSCs 的绵羊小肠黏膜下层细胞外基质材料与不添加 MSCs 相比,能够更有效地促进大鼠创伤皮肤的上皮形成、伤口收缩和愈合。Pérez-Díaz 等[30]则基于脂肪源 MSCs 开发了纳米级抗生物膜细胞敷料,可以有效减少皮肤水分流失、防止细菌感染和促进创伤部位皮肤再生。Martinello 等[31]从外周血中提取 MSCs,用于处理手术造成的绵羊皮肤伤口,使得伤口边缘皮肤细胞增殖更快,加速创伤部位肉芽组织、新生血管、结构蛋白和皮肤附件的形成与成熟,同时不会引起炎症反应,指出 MSCs 对大型哺乳动物表皮和全层皮肤创伤均具有很好的修复作用。值得一提的是,MSCs 在皮肤上尤其是真皮层的移植植入率低,原位增殖和分化细胞有限,其对皮肤的有益作用更可能通过旁分泌作用和产生免疫调节因子来实现[32-33]。
综上,我们研究发现 hucMSCs 能够在非物理接触情况下有效促进 HaCaT 的增殖与迁移,这可能与其对细胞外基质蛋白、细胞增殖与迁移相关生长因子的 mRNA 表达调控有关,包括上调纤连蛋白、下调 MMP-1 基因表达,并维持I 型胶原蛋白的 mRNA 水平,同时,不同程度地上调 TGF-β1、KGF-2 及 FGFR-2 的 mRNA 水平,呈时间依赖效应,这些结果提示 hucMSCs 是促进表皮创伤愈合的有潜力的种子细胞。接下来,我们将在 3D 皮肤模型及动物模型上进一步探究 hucMSCs 促进角质形成细胞增殖和迁移的作用方式及分子机制,为开发基于 hucMSCs 的皮肤伤口愈合敷料提供数据支持。
[1] Morhenn VB. Keratinocyte proliferation in wound healing and skin diseases. Immunol Today, 1988, 9(4):104-107.
[2] Shibata S, Tada Y, Asano Y, et al. Adiponectin regulates cutaneous wound healing by promoting keratinocyte proliferation and migration via the ERK signaling pathway. J Immunol, 2012, 189(6):3231-3241.
[3] Huang YS, Yang ZC, Carney DH, et al. Effects of thrombin peptides on wound healing and proliferation and migration of normal human epidermal keratinocyte (NHEK). Chin J Burns, 2000, 16(1):26-29. (in Chinese)
黄跃生, 杨宗城, Carney DH, 等. 凝血酶肽类对创面愈合及表皮细胞增生与移行的作用研究. 中华烧伤杂志, 2000, 16(1):26-29.
[4] Walter MN, Wright KT, Fuller HR, et al. Mesenchymal stem cell-conditioned medium accelerates skin wound healing: an in vitro study of fibroblast and keratinocyte scratch assays. Exp Cell Res, 2010, 316(7):1271-1281.
[5] Bhowmick S, Scharnweber D, Koul V. Co-cultivation of keratinocyte-human mesenchymal stem cell (hMSC) on sericin loaded electrospun nanofibrous composite scaffold (cationic gelatin/ hyaluronan/chondroitin sulfate) stimulates epithelial differentiation in hMSCs: In vitro study. Biomaterials, 2016, 88:83-96.
[6] Yang D, Sun S, Wang Z, et al. Stromal cell-derived factor-1 receptor CXCR4-overexpressing bone marrow mesenchymal stem cells accelerate wound healing by migrating into skin injury areas. Cell Reprogram, 2013, 15(3):206-215.
[7] Ma T, Wang X, Jiao Y, et al. Interleukin 17 (IL-17)-induced mesenchymal stem cells prolong the survival of allogeneic skin grafts. Ann Transplant, 2018, 23:615-621.
[8] Wu Y, Huang S, Enhe J, et al. Bone marrow-derived mesenchymal stem cell attenuates skin fibrosis development in mice. Int Wound J, 2014, 11(6):701-710.
[9] Zheng K, Wu W, Yang S, et al. Bone marrow mesenchymal stem cell implantation for the treatment of radioactivity‑induced acute skin damage in rats. Mol Med Rep, 2015, 12(5):7065-7071.
[10] Zhang Y, Chen KJ, Li P, et al. Effects of cryopreservation methods on human pMSCs: programmed versus stepwise freezing. Chin Med Biotechnol, 2017, 12(6):513-519. (in Chinese)
章毅, 陈侃俊, 李萍, 等. 程控降温法与二步法对胎盘间充质干细胞冻存效果的影响. 中国医药生物技术, 2017, 12(6):513-519.
[11] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006, 8(4):315-317.
[12] Kur-Piotrowska A, Bukowska J, Kopcewicz MM, et al. Foxn1 expression in keratinocytes is stimulated by hypoxia: further evidence of its role in skin wound healing. Sci Rep, 2018, 8(1):5425.
[13] Porter G, Leonards U, Troscianko T, et al. Dealing with illumination in visual scenes: effects of ageing and Alzheimer's disease. PLoS One, 2012, 7(9):e45104.
[14] Guerid S, Darwiche SE, Berger MM, et al. Autologous keratinocyte suspension in platelet concentrate accelerates and enhances wound healing - a prospective randomized clinical trial on skin graft donor sites: platelet concentrate and keratinocytes on donor sites. Fibrogenesis Tissue Repair, 2013, 6(1):8.
[15] Horváth D, Sipos A, Major E, et al. Myosin phosphatase accelerates cutaneous wound healing by regulating migration and differentiation of epidermal keratinocytes via Akt signaling pathway in human and murine skin. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(10): 3268-3280.
[16] O'Toole EA. Extracellular matrix and keratinocyte migration. Clin Exp Dermatol, 2001, 26(6):525-530.
[17] Clark RA, Folkvord JM, Wertz RL. Fibronectin, as well as other extracellular matrix proteins, mediate human keratinocyte adherence. J Invest Dermatol, 1985, 84(5):378-383.
[18] Jettanacheawchankit S, Sasithanasate S, Sangvanich P, et al. Acemannan stimulates gingival fibroblast proliferation; expressions of keratinocyte growth factor-1, vascular endothelial growth factor, and type I collagen; and wound healing. J Pharmacol Sci, 2009, 109(4): 525-531.
[19] Kim MS, Kim YK, Cho KH, et al. Regulation of type I procollagen and MMP-1 expression after single or repeated exposure to infrared radiation in human skin. Mech Ageing Dev, 2006, 127(12):875-882.
[20] Palmqvist S, Hertze J, Minthon L, et al. Comparison of brief cognitive tests and CSF biomarkers in predicting Alzheimer's disease in mild cognitive impairment: six-year follow-up study. PLoS One, 2012, 7(6): e38639.
[21] Chen WW, Tjin MS, Chua AWC, et al. Probing the role of integrins in keratinocyte migration using bioengineered extracellular matrix mimics. ACS Appl Mater Interfaces, 2017, 9(42):36483-36492.
[22] Grose R, Hutter C, Bloch W, et al. A crucial role of beta 1 integrins for keratinocyte migration in vitro and during cutaneous wound repair. Development, 2002, 129(9):2303-2315.
[23] O'Leary R, Rerek M, Wood EJ. Fucoidan modulates the effect of transforming growth factor (TGF)-beta1 on fibroblast proliferation and wound repopulation in in vitro models of dermal wound repair. Biol Pharm Bull, 2004, 27(2):266-270.
[24] Yen TT, Thao DT, Thuoc TL. An overview on keratinocyte growth factor: from the molecular properties to clinical applications. Protein Pept Lett, 2014, 21(3):306-317.
[25] Soler PM, Wright TE, Smith PD, et al. In vivo characterization of keratinocyte growth factor-2 as a potential wound healing agent. Wound Repair Regen, 1999, 7(3):172-178.
[26] Jimenez PA, Rampy MA. Keratinocyte growth factor-2 accelerates wound healing in incisional wounds. J Surg Res, 1999, 81(2):238-242.
[27] Ti D, Hao H, Fu X, et al. Mesenchymal stem cells-derived exosomal microRNAs contribute to wound inflammation. Sci China Life Sci, 2016, 59(12):1305-1312.
[28] Millán-Rivero JE, Martinez CM, Romecin PA, et al. Silk fibroin scaffolds seeded with Wharton's jelly mesenchymal stem cells enhance re-epithelialization and reduce formation of scar tissue after cutaneous wound healing. Stem Cell Res Ther, 2019, 10(1):126.
[29] Rashtbar M, Hadjati J, Ai J, et al. Critical-sized full-thickness skin defect regeneration using ovine small intestinal submucosa with or without mesenchymal stem cells in rat model. J Biomed Mater Res B Appl Biomater, 2018, 106(6):2177-2190.
[30] Pérez-Díaz MA, Silva-Bermudez P, Jiménez-López B, et al. Silver-pig skin nanocomposites and mesenchymal stem cells: suitable antibiofilm
cellular dressings for wound healing. J Nanobiotechnol, 2018, 16(1):2.
[31] Martinello T, Gomiero C, Perazzi A, et al. Allogeneic mesenchymal stem cells improve the wound healing process of sheep skin. BMC Vet Res, 2018, 14(1):202.
[32] Khosrotehrani K. Mesenchymal stem cell therapy in skin: why and what for? Exp Dermatol, 2013, 22(5):307-310.
[33] Kim S, Lee SK, Kim H, et al. Exosomes secreted from induced pluripotent stem cell-derived mesenchymal stem cells accelerate skin cell proliferation. Int J Mol Sci, 2018, 19(10):3119-3134.
Effects of human umbilical cord mesenchymal stem cells on the proliferation and migration of HaCaT cells
ZHANG Yi, CHEN Kan-jun, WU Ting, ZHANG Han, QI Cheng, KONG Fan-rui, CHEN Liang, HU Xiao-xi, LI Pin-zhou
Shanghai Cord Blood Bank/Shanghai Stem Cell Technology Co., Ltd./China Stem Cell Group Co., Ltd., Shanghai 200051, China
To investigate the effects of human umbilical cord mesenchymal stem cells (hucMSCs) on the proliferation and migration of human epidermal keratinocytes and its potential mechanisms.
HucMSCs were isolated from neonatal umbilical cord using type II collagenase digestion method. Flow cytometry was applied to identify the characteristic antigenic markers of P3-generation hucMSCs. Oil red O staining, alizarin red S staining and Masson staining were used to identify the differentiation abilities of hucMSCs. Then, HaCaT keratinocytes and hucMSCs were co-cultured using a transwell membrane. After 24, 48 and 72 h, the cell viability of HaCaT was measured by CCK8 assay and cell morphology was photographed. Moreover, scratch assay was applied to determine the migration of HaCaT cells co-cultured with hucMSCs for 12 h and 24 h. The mRNA expression of growth factors associated with cell migration, proliferation and extracellular matrix proteins were further characterized by qRT-PCR.
P3-generation hucMSCs showed fibroblast-like adherent growth and expression of CD105, CD90 and CD73, while lack of CD45, CD34, CD14 and CD19. After 16 d of induction culture, lipogenic, osteogenic and chondrogenic characteristics were also observed. Consistent with the morphologic observations, the viability of HaCaT cells co-cultured with hucMSCs was significantly increased for (20.42 ± 3.90)% (= 0.002), (36.30 ± 8.08)% (= 0.001) and (27.31 ± 10.04)% (= 0.012) for 24, 48 and 72 h, respectively. Wound scrath assay revealed that hucMSCs significantly promoted the migration of HaCaT after 12 h and 24 h incubation (< 0.05). Furthermore, the mRNA expression of KGF-2 and TGF-β1 in HaCaT were up-regulated by 1.24 and 1.92 folds after 24 h co-culture with hucMSCs, KGF-2, TGF-β1, FGFR-2 and Fibronectin mRNA expression were up-regulated by 2.01, 2.26, 1.34 and 1.59 folds after 48 h co-culture, while MMP-1 was down-regulated by 0.52 folds.
HucMSCs can significantly promote the proliferation and migration of HaCaT cells, which may be related to regulation of keratinocytes proliferation, migration-related growth factors and extracellular matrix proteins mRNA expression in HaCaT. These results suggest that hucMSCs be potential seed cells for epidermal wound healing.
Umbilical cord mesenchymal stem cells; Wound healing; HaCaT; Cell migration
WU Ting, Email: wuting@shanghaicordblood.org
10.3969/j.issn.1673-713X.2020.03.007
上海市自然科学基金(16ZR1429200);上海市科委研发平台专项(16DZ2293000);上海张江国家自主创新示范区专项发展资金重大项目(ZJ2017-ZD-010);上海围产干细胞工程技术研究中心(18DZ2250800)
伍婷,Email:wuting@shanghaicordblood.org
2019-12-11
*同为第一作者
