柠檬酸对紫色红曲菌液态发酵产Monacolin K能力的影响
2020-06-18李颖慧朱倩倩石嘉辰王成涛
李颖慧,朱倩倩,焦 梓,石嘉辰,张 函,王成涛,2,张 婵,2,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
红曲菌是一种丝状真菌,属真子囊菌纲(Euascomycetes),散子囊菌目(Eurotiales),红曲菌科(Monascaceae),红曲菌属(MonascusvanTieghem)[1]。我国对红曲菌的应用历史悠久,红曲起源于中国,自唐代起就用于食品加工中,在我国的生产和应用已经有1000多年的历史,在大米上接种红曲菌,并经过发酵而制得红曲米[2]。红曲菌次级代谢产物繁多,包括Monacolin K[3]、红曲色素[4-5]、γ-氨基丁酸[6-9]、麦角固醇[10]、桔霉素等[11-13],而Monacolin K和红曲色素是目前应用最广泛的次级代谢产物[14-15]。1979年,日本的远藤章教授从红色红曲菌(Monascusruber)的发酵液中分离出一种能够强力抑制胆固醇合成的活性物质,并将其命名为Monacolin K。现代研究表明,Monacolin K竞争性抑制胆固醇合成通路中的限速酶HMG-CoA还原酶,具有显著的降胆固醇功效,是目前医药界公认的降低胆固醇的理想药物之一,因此引起科研工作者的深入研究[16]。红曲色素作为天然优质食用色素,有抗突变、防腐等作用,在食品、医药等行业应用较广,具有广阔的市场前景[17-18]。
目前,我国工业化生产红曲色素和Monacolin K均存在成本高、产量低等问题,因此提高红曲菌菌株发酵产红曲色素和Monacolin K的能力具有重要的现实意义[16]。近年来,出现了许多促进红曲菌次级代谢产物高产的策略,包括诱变育种、优化发酵条件、构建工程菌株等。Zhang等[19]发现添加谷氨酸可提高Monacolin K的产量,其中谷氨酸能使Monacolin K的产量达到对照组的3.5倍。朱蕊等[20]发现酵母的代谢产物对红曲菌发酵产洛伐他汀(Monacolin K)有一定影响,酿酒酵母对洛伐他汀产量提高最为明显,相比未共发酵条件下的洛伐他汀产量提高了34.5%。常聪等[21]发现经紫外诱变、氯化锂化学诱变及紫外-氯化锂复合诱变,可获取能稳定高产Monacolin K或红曲色素的红曲菌株。本实验通过前期分析[19],推测在添加谷氨酸后,抑制了柠檬酸循环的代谢,从而使乙酰辅酶A更多的用于合成 Monacolin K。有文献报道,在红曲菌发酵过程中添加TCA循环中关键中间产物柠檬酸也会提高Monacolin K产量[22]。因此,本实验进一步来探究柠檬酸类物质促进红曲菌对紫色红曲菌液态发酵产Monacolin K能力的影响。在培养菌株的过程中加入3个不同浓度梯度:0.05%、0.1%、0.2%的柠檬酸,分别取第5、8、12、15 d发酵液作为样品,通过紫外分光光度计对样品色价、高效液相色谱对Monacolin K产量、菌体干重生物量的测定和荧光定量PCR对Monacolin K合成关键基因的分析,探究柠檬酸类物质的添加对于红曲菌菌体、次级代谢产物和关键基因的影响。
1 材料与方法
1.1 材料与仪器
产量稳定的紫色红曲菌菌株(Monascuspurpureus)M1 本实验室保存;RNAprepPure多糖多酚植物总RNA提取试剂、FastQuant cDNA第一链合成试剂盒 天根生化科技(北京)有限公司;PDA、葡萄糖、豆粕粉、甘油、蛋白胨、KH2PO4、NaNO3、MgSO4·7H2O、ZnSO4·7H2O、50×TBE、DEPC 北京奥博星生物技术责任有限公司。
20A型高效液相色谱仪 日本岛津公司;CFX96 实时荧光定量PCR仪 美国Bio-Rad公司;SW-CJ-IFD 清洁工作台 苏净集团苏州安泰空气技术有限公司;ZWP-A1230恒温恒湿培养箱 上海智城分析仪器有限公司;ZDC100C通风柜 北京航天科恩实验室装备科学技术有限公司;RF-20Axs 荧光检测器 日本岛津公司;LDZX-75KBS 立式压力蒸汽灭菌器 上海申安医疗器械厂;HZQ-F160 型全温震荡培养箱 上海一恒科技有限公司;FM50 雪花制冰机 北京长流科学仪器公司;BSA224S 型数字电子天平 Sartorius 公司;SU8010扫描电子显微镜 日本日立公司。
1.2 培养基
平板培养基(g/L)[23]:PDA37 g,琼脂7.5 g。
普通液体种子培养基(g/L)[23]:葡萄糖30 g,甘油70 g,豆粕粉15 g,蛋白胨10 g,KH2PO42 g,NaNO32 g,MgSO4·7H2O 1 g。
普通液体发酵培养基(g/L)[23](空白对照组):甘油90 g,大米粉20 g,蛋白胨10 g,KH2PO42.5 g,NaNO35 g,MgSO4·7H2O 1 g,ZnSO4·7H2O 2 g。
0.05%柠檬酸-发酵培养基(g/L):甘油90 g,大米粉20 g,蛋白胨10 g,KH2PO42.5 g,NaNO35 g,MgSO4·7H2O 1 g,ZnSO4·7H2O 2 g,柠檬酸0.5 g。
0.10%柠檬酸-发酵培养基(g/L):甘油90 g,大米粉20 g,蛋白胨10 g,KH2PO42.5 g,NaNO35 g,MgSO4·7H2O 1 g,ZnSO4·7H2O 2 g,柠檬酸1.0 g。
0.20%柠檬酸-发酵培养基(g/L):甘油90 g,大米粉20 g,蛋白胨10 g,KH2PO42.5 g,NaNO35 g,MgSO7·H2O 1 g,ZnSO4·7H2O 2 g,柠檬酸2.0 g。
1.3 实验方法
1.3.1 菌株培养 将红曲菌M1菌株在PDA固体培养基上进行培养,并在M1的基础上活化2代,每代约2~3 d后,将活化好的菌株接种于液体种子培养基中,以30 ℃、200 r/min培养至种子液培养基呈浅粉色,约需48 h,将红曲菌种子液以10%的接种量接种于50 mL的液体发酵培养基中培养,并以30 ℃、150 r/min培养48 h,后将温度改为25 ℃继续培养至第15 d。
1.3.2 柠檬酸最适浓度的摸索 发酵培养第3 d,分别向液体发酵培养基中加入四个浓度:0.1%、0.5%、1%、2%的柠檬酸溶液。收集红曲菌第12 d发酵液置于2 mL离心管中,测定在这四个浓度下Moncolin K的产值,并进一步细分化柠檬酸的浓度。
1.3.3 柠檬酸最适添加浓度的确定 活化步骤同上,在发酵培养第3 d向液体发酵培养基中分别加入0.05%、0.1%、0.2%的柠檬酸。分别收集红曲菌第5、8、12、15 d发酵液置于2 mL离心管中,12000 r/min离心10 min,弃去上清液,用灭过菌的超纯水重悬,反复四次,用枪头吸除离心管中剩余水分(此步水分需全部吸除干净)后,置于-80 ℃冰箱中保存。
1.3.4 Monacolin K含量、红曲色素色价及生物量的测定
1.3.4.1 Monacolin K的检测 先进行发酵液的预处理,取5 mL发酵液,加入15 mL的75%甲醇,超声波萃取30 min,静置(避光),取其中的上清液,用0.45 μm的有机微孔滤膜过滤,检测滤液中Monacolin K含量。然后采用HPLC法,HPLC检测条件:色谱柱:InertsilODS-3 C18(150 mm×4.6 mm×5 μm),流动相:0.1%磷酸∶甲醇=1∶3,流速:1 mL/min,检测器:紫外检测器(PDA),检测波长:237 nm,检测温度:30 ℃,进样量:10 μL[24]。
1.3.4.2 色价的测定 红曲色素常规提取工艺及色价测定采用国家标准GB4926-2008。根据红曲复合色素在505、448、410 nm有吸收主峰的特征,测定发酵液经离心的上清稀释液在505、448、410 nm处的吸光度,以70%乙醇溶液为空白对照[25],计算其总色价。
总色价=稀释倍数×吸光度/发酵液体积(mL)
1.3.4.3 生物量检测 使用三层纱布,反复洗涤,用烘箱烘干至恒重,取5 mL红曲菌发酵液用纱布过滤,再用蒸馏水冲洗菌液至滴下的滤液不在呈现红色,拧干水分,在60 ℃烘箱中烘干至恒重,称量减去纱布的重量即为5 mL红曲菌发酵液中红曲霉菌丝体干重[26]。
生物量(g/L)=干物质质量(g)/发酵液体积(L)
1.3.5 菌丝体超微结构观察 在25 ℃温度下,将M1菌丝体固定在25%戊二醛溶液中,在磷酸盐缓冲液(PBS)中固定12h。在pH7.2的PBS中用0.1 mol/L H3PO4溶液冲洗菌丝体细胞悬液,离心(12000 r/min,5 min,4 ℃)。弃上清液,分别用乙醇(30%、50%、70%、80%、90%和100%)进行梯度洗脱,悬浮、脱水、离心(12000 r/min,5 min)获得菌丝体。用乙酸异戊酯-乙醇溶液(1∶1,v∶v)去除乙醇,静置10 min,12000 r/min离心5 min,弃上清液。采用适量的六甲基二硅氮烷(HMDS)对菌丝体进行再悬浮,离心时棉花堵塞管上部,在60 ℃时将样品干燥成粉末,初步固定后用金钯包覆2 min。然后用SU8010扫描电子显微镜获取显微照片。
1.3.6 Monacolin K合成相关基因的转录量分析
1.3.6.1 荧光定量PCR引物设计 用Beacon Designer 8.0软件,根据NCBI网站(http://www. ncbi. nlm. nih. gov/nuccore/DQ176595.1)上的红曲菌Monacolin K 合成相关基因序列信息,选取mokA、mokB、mokC、mokD、mokE、mokF、mokG、mokH、mokI以及LaeA十段基因组序列为模板,以GAPDH基因为内参基因,按照实时荧光定量PCR(Reverse Transcription-quantitative real-time polymerasechain reaction,RT-qPCR)的要求设计特异性引物,引物序列见表1。

表1 红曲菌MonacolinK合成相关基因实时荧光定量PCR引物Table 1 Target genes and primers of Monacolin K in M.purpureus
1.3.6.2 实时荧光定量PCR分析 分别取原始培养基和添加0.1%柠檬酸培养基的紫色红曲菌发酵菌液2 mL,用超纯水洗涤4次后,提取菌丝体RNA,反转录为cDNA,利用RT-qPCR法测定mokA-mokI和LaeA十段基因的转录水平。根据天根生化科技(北京)有限公司的SuperReal荧光定量SYBR Green试剂盒进行扩增。RT-qPCR反应体系:2×SuperReal Pre Mix Plus 10 μL;正向引物(10 μmol/L)0.6 μL;反向引物(10 μmol/L)0.6 μL;cDNA模板1 μL;RNase-free ddH2O至20 μL。采用三步法PCR程序反应,荧光定量PCR反应条件如下:95 ℃预变性4 min,然后35个循环,每个循环包括94 ℃ 变性30 s,60 ℃ 退火30 s,72 ℃ 延伸30 s,循环结束后72 ℃ 延伸10 min。
1.4 数据处理
实验操作重复三次,采用Excel进行数据计算,Origin 8.5软件进行绘图。
2 结果与分析
2.1 柠檬酸最适浓度的探索
从图1中可知,当添加柠檬酸浓度为0.1%时,Monacolin K的产量是最高的,达到了原始培养基的2.36倍,有显著的促进效果(P<0.05);当柠檬酸浓度为0.5%时,Monacolin K的产量是原始培养基的1.23倍,促进效果不显著;而当柠檬酸浓度过大,达到1%和2%时,Monacolin K的产量分别为原始培养基的76.2%和18.1%,抑制了Monacolin K的产生。因此,下文对柠酸浓度为0.05%、0.1%、0.2%的三个浓度进行考察,从而探寻促使Monacolin K产量最大化的柠檬酸最适添加浓度。
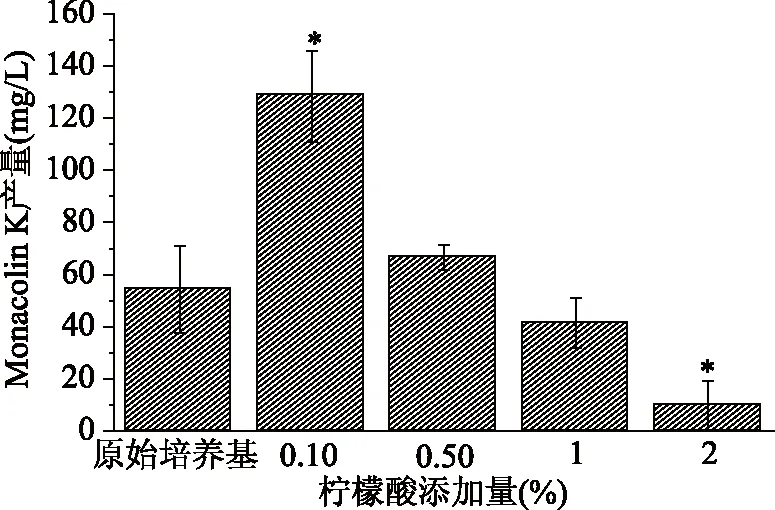
图1 柠檬酸浓度对Monacolin K产量的影响Fig.1 Effect of citric acid concentrationon the production of Monacolin K.注:*代表与对照组相比差异显著,P<0.05,**代表与对照组相比差异极显著,P<0.01;图2、图3、图6同。
从图2中可以发现,Monacolin K的产量随着时间推移而增多,在第12 d达到最高积累量,而第15 d呈现下降趋势。第12 d时分别添加三个浓度的柠檬酸都能对Monacolin K的产量有明显的促进作用。添加0.05%、0.1%、0.2%三个浓度柠檬酸所产生的Monacolin K产量分别是原始培养基产生Monacolin K量的2.39倍、2.71倍、2.54倍,通过上述检测结果可以确定,添加浓度在0.1%的柠檬酸可以最大程度促进Monacolin K的合成。
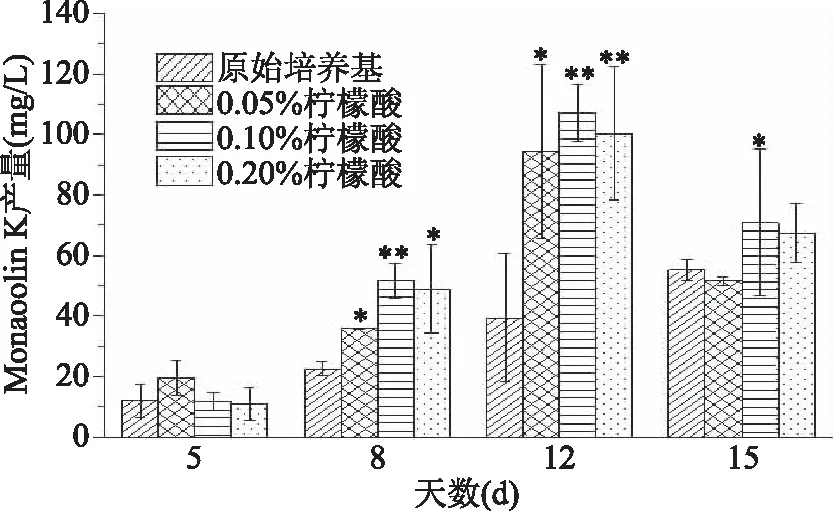
图2 柠檬酸浓度对Monacolin K产量的影响Fig.2 Effect of citric acid concentrationon the production of Monacolin K
2.3 红曲色素色价检测
由图3可知,在12 d时,添加不同浓度柠檬酸后,红曲红色素、橙色素、黄色素色价明显下降,说明柠檬酸对色素色价有着一定程度的影响,且都表现为抑制作用。红曲色素与Monacolin K同属聚酮体合成途径,起始均由乙酰辅酶A和丙二酰辅酶A合成丁酮,接下来便分为两条代谢途径,推测二者间存在竞争关系。柴诗缘等[16]通过培养基中添加谷氨酸对红曲菌Monacolin K和红曲色素的影响发现,谷氨酸会增加Monacolin K的产量,但同时也降低了红曲色素的产量,本研究的结果与其具有一致性。

图3 发酵过程中柠檬酸浓度对红曲色素色价的影响Fig.3 Effect of citric acid concentration on color value ofMonascus pigment during fermentation
2.4 生物量的检测
通过比较添加柠檬酸培养基中的菌株和原始培养基中M1菌株在不同阶段生物量的差异,研究柠檬酸对红曲菌菌丝体生物量的影响,结果如图4所示,在第2~8 d中生物量一直呈现下降趋势,而第8 d之后出现明显的增长直至第12 d。在添加柠檬酸培养基中的M1菌株和在原始培养基中的M1菌株菌丝体变化趋势一致,且差异并不明显。
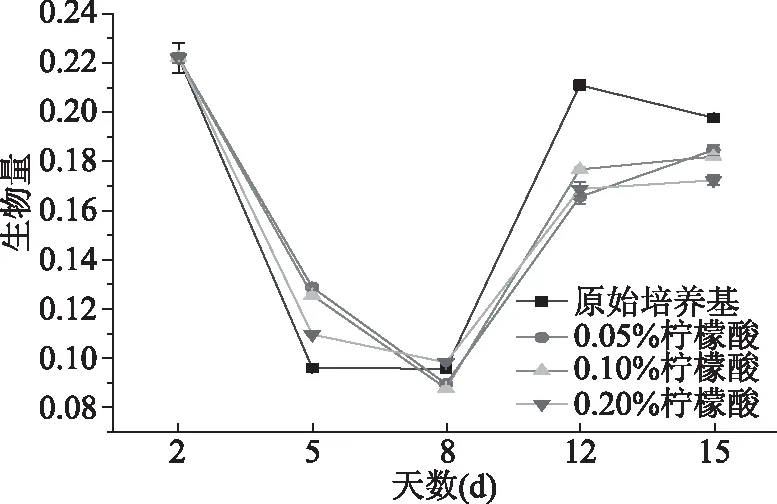
图4 不同浓度的柠檬酸对生物量的影响Fig.4 Effects of different concentrationsof citric acid on biomass
2.5 菌丝体超微结构观察
通过扫描电镜对普通培养基和柠檬酸培养基中的红曲菌菌丝体的超微结构进行了观察,扫描电镜结果见图5。与原培养基中的红曲菌M1菌丝体相比,添加柠檬酸培养基中的红曲菌菌丝体表面呈现出更多的褶皱,而原始培养基中的菌丝体相对饱满。因此推测,柠檬酸可能是通过提高红曲菌细胞膜通透性,将细胞合成的Monacolin K 及时分泌到细胞外,细胞质中的Monacolin K浓度降低,进而达到Monacolin K积累量增加的效果。

图5 添加柠檬酸菌株与M1菌株在不同倍率下扫描电镜图Fig.5 Scanning electron microscopic diagram ofcitric acid strain and M1 strain at different magnification注:A:M1菌株5000×;B:柠檬酸添加菌株5000×;C:M1菌株10000×;D:柠檬酸添加菌株10000×。
2.6 Monacolin K合成相关基因的转录量分析
对发酵过程中五个时间点的菌体RNA中十条基因进行转录水平的分析,分别是菌体前期生长的2 d,积累增长最快的对数期5 d,菌体进入稳定期的8 d,菌体积累量最高和合成Monacolin K速率最高的12 d,Monacolin K合成速率稳定的15 d。
原始培养基与添加柠檬酸的培养基中,红曲菌菌丝体Monacolin K合成相关基因的表达量变化情况如图6所示,从图6中可以看出,在原始培养基与柠檬酸培养基的红曲菌菌丝体中,Monacolin K合成相关基因的表达量在2 d时无变化,后期呈现一定的上升趋势,mokA、mokB、mokC、mokD、mokE、mokF、mokG、mokH、mokI和LaeA的表达水平与Monacolin K的合成趋势呈正相关。因此柠檬酸可能对这些Monacolin K合成基因的表达量起到一定的促进作用,也就是说,柠檬酸可能是通过上调这10段基因的表达量来刺激红曲菌Monacolin K的合成。
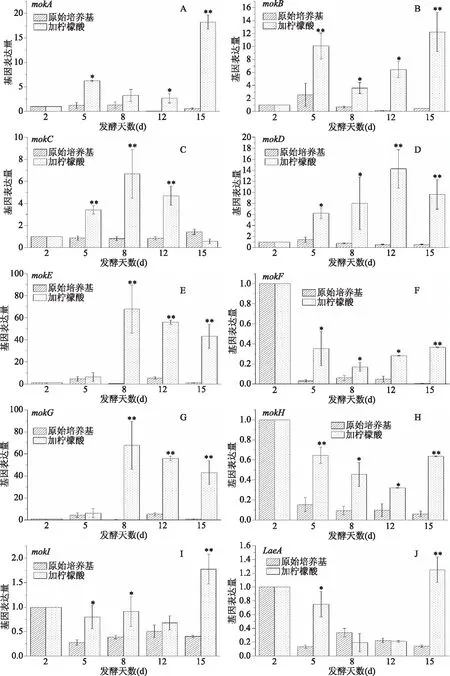
图6 发酵过程中Monacolin K生物合成相关基因的表达量变化情况Fig.6 Expression of monacolin K biosynthesis-related genes during fermentation
3 结论
通过不同浓度柠檬酸的添加,与原始培养基中的M1菌株对比,分析柠檬酸对红曲菌主要次级代谢产物Monacolin K产量的影响。研究发现,当添加柠檬酸的浓度在0.1%左右时,对Monacolin K产量的促进效果最为明显,即Monacolin K的产量提高了2.71倍。但加不同浓度柠檬酸后,均对红曲红色素、橙色素、黄色素色价有着一定程度的抑制作用。在生物量方面,并无显著变化。后续通过扫描电镜进行菌丝体超微结构观察,发现柠檬酸可能提高了红曲菌菌丝体通透性,加速了Monacolin K分泌到细胞外的过程,细胞质中的Monacolin K浓度降低,进而达到Monacolin K积累量增加的效果。最后通过RT-qPCR测定了红曲菌Monacolin K合成相关基因的表达量发现,添加柠檬酸能够促进Monacolin K合成的关键基因mokA-mokI和LaeA的表达量,从而提高Monacolin K的产量。
