铁观音茶末多糖的分离纯化和抗氧化活性
2020-06-18吴金松陈晓培耿广威丁德刚王保营
吴金松,张 岩,陈晓培,耿广威,丁德刚,徐 军,王保营
(河南牧业经济学院,河南郑州 450046)
铁观音是乌龙茶中的主要优良品种之一,素有“绿叶红镶边,七泡有余香”的美称[1-2]。铁观音茶叶由于其含有丰富的茶多酚、氨基酸、活性多糖、生物碱、矿物质等营养成分越来越受到人们的青睐[3],其中茶多糖(TPS)是一类与蛋白质紧密结合的复合活性多糖类物质[4],具有降血糖、降血脂、降血压、增强免疫力、减慢心率、抗凝血和耐缺氧等功效[5]。
目前,铁观音茶末多糖的提取方法主要有水提醇沉法、酶提取法、酸碱提取法、超声提取法、微波辅助萃取法以及多种辅助提取相结合法等[6-9]。陈义勇等[9]通过响应面优化超声-微波协同辅助优化茶多糖提取工艺,与传统的水浴浸提法相比,超声-微波协同辅助提取法在较短的超声提取时间下,茶多糖的得率从2.95%提高到4.19%,纯度从70.15%提高到86.08%;郑霖华等[10]通过响应面优化铁观音茶末多糖提取工艺,在茶多糖质量浓度为0.5 mg/mL时清除率达89. 67%。活性多糖的分级过程主要包括乙醇沉淀分级、季铵盐沉淀分级、金属盐沉淀法分级和DEAE-纤维素凝胶色谱分离等方法[11-14],通常一次分级纯化很难达到理想的分离效果,国内外鲜有关于茶末多糖分离纯化工艺方面的报道。目前在工业生产过程中对废弃铁观音碎茶末的再利用仅限于初加工层面,而从铁观音碎茶叶末中分离纯化出活性物质(比如活性多糖等)并进行生物活性研究,不仅使废弃茶叶末资源实现了再利用[15],而且具有重要的科研意义。
本研究通过乙醇沉淀分级粗提和DEAE-52纤维素、Sephadex-100葡聚糖凝胶色谱分离相结合的方法纯化出主要洗脱组分,结合纯度鉴定、分子量的测定、红外光谱扫描等进行分析,最后进行DPPH自由基、羟自由基以及还原力的测定等抗氧化活性探究,以期为铁观音茶叶末废弃材料的再利用以及功能食品添加剂的研究开发提供数据参考。
1 材料与方法
1.1 材料与仪器
铁观音茶叶末(产地为福建泉州安溪县) 购于郑州姚桥农贸市场;苯酚、硫酸、盐酸、氢氧化钠、氯化钠 分析纯,洛阳市化学试剂厂;葡萄糖、抗坏血酸 分析纯,南京森贝伽生物科技有限公司;无水乙醇、甲醇、水杨酸、硫酸亚铁、双氧水、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁 分析纯,天津科密欧化学试剂有限公司;1,1-二苯基-2-苦味基肼(DPPH自由基) 分析纯,成都化夏化学试剂有限公司;DEAE-52纤维素、Sephadex-100、Sephadex-150葡聚糖凝胶、各种标准葡聚糖和蓝色葡聚糖(Dextran T-2000) 北京索莱宝科技有限公司。
玻璃层析柱(Φ2.6 cm×40 cm,Φ2.6 cm×60 cm) 郑州赛克斯玻璃仪器公司;Kd723可见光分光光度计 上海美析仪器有限公司;FA2204B分析天平 上海佑科仪器仪表有限公司;101-1恒温鼓风干燥箱 天津市泰斯特仪器有限公司;RE-52C旋转蒸发仪 上海亚荣生化仪器有限公司;SHZ-III循环水式多用真空泵 郑州长城科工贸有限公司;UV1902双光束紫外可见分光光度计 北京普析通用仪器有限公司;Nicolet iS10傅立叶变换红外光谱仪 美国尼高力公司。
1.2 实验方法
1.2.1 铁观音茶末多糖提取工艺 首先取铁观音茶叶样品进行干燥(55 ℃恒温干燥),研碎后过100目筛),然后进行索氏提取器连续抽提脱脂处理,再进行烘干;精确称取5.0 g以料液比1∶30于85 ℃水浴锅中浸提,滤液抽滤后浓缩,再低温静置(4 ℃,12 h)醇沉(同体积提取液加入不同比例的无水乙醇使之产生不同的乙醇终浓度),再进行减压过滤、同浓度乙醇抽洗于55 ℃烘箱中干燥至恒重,即得到铁观音茶末粗多糖[13]。
1.2.2 铁观音茶末多糖得率的计算 采用苯酚-硫酸法,称取葡萄糖标准品0.1000 g,溶解定容后得到浓度为0.1 mg/mL的葡萄糖标准溶液。量取0、0.2、0.4、0.6、0.8、1.0 mL的0.1 mg/mL葡萄糖标准品溶液,用蒸馏水补至1.0 mL。依次加入1.0 mL 5%的苯酚溶液,5.0 mL浓硫酸,混匀后,静置0.5 h,于490 nm波长处测定其吸光度[16-17],依据所测得的吸光度值得到其线性回归方程式为y=0.0094x+0.006,R2=0.9995。
将不同乙醇终浓度提取到的粗多糖样品研碎后分别称取20.0 mg用蒸馏水定容至250 mL容量瓶中,分别用吸量管量取1.0 mL样液于试管中,蒸馏水做空白样,测得吸光值代入葡萄糖标准曲线中的线性回归方程,根据下列公式从而计算出不同乙醇终浓度下的铁观音茶末多糖得率。
式(1)
式中:C:为样品葡萄糖浓度(μg/mL);V:为铁观音茶末多糖溶液总体积(mL);D:为稀释倍数;M:为铁观音茶末粉质量(g)。
测定出最佳得率下的乙醇浓度后,用该浓度的乙醇对铁观音茶末多糖进行大量提取备用。
1.2.3 铁观音茶末多糖的分离纯化 取乙醇最佳提取终浓度提取到的粗多糖样品200 mg,用少量蒸馏水溶解后上DEAE-52纤维素层析柱(Φ2.6 cm×40 cm)分级,依次使用蒸馏水、0.05、0.10、0.20、0.50 mol/L的NaCl溶液进行梯度洗脱,控制流速0.5 mL/min,将每种洗脱液洗脱下来的组分依次命名为TPS-1、TPS-2、TPS-3、TPS-4、TPS-5。用试管收集洗脱液时4 mL/管,然后从每支试管中用吸量管吸取1.0 mL,采用苯酚-硫酸法于490 nm处测定其吸光度值,记录数据并绘制洗脱曲线图;对各吸收峰洗脱液分别进行收集,旋转蒸发浓缩后冷冻干燥,得到的各个组分质量除以进样质量即为纯化后各组分得率;对得率较高的洗脱组分进行Sephadex-100葡聚糖凝胶二次分级纯化并进行得率大小的测定[12]。
1.2.4 铁观音茶末多糖组分的纯度鉴定
1.2.4.1 凝胶过滤法 分别取Sephadex-150葡聚糖凝胶分级纯化后的主要组分TPS-1A和TPS-4C,溶解后上Sephadex-150葡聚糖凝胶层析柱,以蒸馏水为洗脱液,收集洗脱液4 mL/管,通过苯酚硫酸法跟踪检测,每管洗脱液以490 nm波长处吸光度对洗脱液管数,做洗脱曲线图[12]。
1.2.4.2 紫外光谱扫描法 将分离纯化到的铁观音茶末多糖组分TPS-1A和TPS-4C配制成1.0 mg/mL的溶液,在紫外可见分光光度计进行全波段扫描(190~400 nm),根据紫外扫描图谱在260~280 nm波长段是否出现吸收峰,进而确定分离纯化出的茶叶末多糖组分中是否含有蛋白质、核酸等大分子物质[18-19]。
1.2.5 铁观音茶末多糖分子量Mr的测定 采用葡聚糖凝胶过滤法(GPC)[12,20],SephadexG-100湿法装柱,层析柱规格为60 cm×2.6 cm,纯水平衡12 h。洗脱速度0.5 mL/min,洗脱液采用蒸馏水。各标准葡聚糖和蓝色葡聚糖(Dextran T-2000)上样量均为2.0 mg,首先用蓝色葡聚糖测得洗脱体积为V0,然后用型号T-110、T-70、T-40、T-10标准葡聚糖相继上柱。手动分管收集洗脱液,每管3 mL,苯酚-硫酸法跟踪检测,根据吸光度测定洗脱体积Ve。以Ve/V0为纵坐标,分子量的自然对数lgMr为横坐标,绘制标准曲线。标准曲线的回归方程是:(Ve/V0)=-1.4384(lgMr)+8.1382,R2=0.9988。在同样洗脱条件下,取纯化后的多糖2.0 mg上柱,测定各自的洗脱体积Ve′,结合标准曲线和Ve′/V0值计算出相应的分子量。
1.2.6 铁观音茶末多糖的红外光谱扫描 称取少量经纯化干燥后的多糖组分TPS-1A和TPS-4C分别与溴化钾充分研磨混合后制成压片,放入红外光谱仪中进行波谱扫描[19]。
1.2.7 铁观音茶末多糖的抗氧化活性
1.2.7.1 DPPH自由基清除率的测定 配制出不同浓度的多糖样品溶液(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL),同时配制0.125 mmol/L的DPPH甲醇溶液。取一支试管,向其中加入2.0 mL多糖溶液后,再加入2.0 mL 0.125 mmol/L DPPH的甲醇溶液,充分振荡后,于室温下暗处反应30 min。在波长517 nm处,使用无水甲醇调零后测定其吸光度(A)。同等条件下,对照组(Ab)为2.0 mL多糖溶液和1.0 mL的无水甲醇,空白组(A0)为2.0 mL的无水甲醇和1.0 mL的DPPH溶液,以同浓度的抗坏血酸VC作为阳性对照组[21-22]。测定完成后,按照式(2)计算不同浓度的多糖溶液对DPPH自由基的清除率:
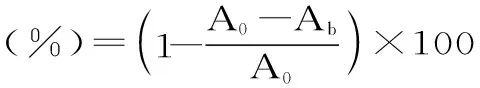
式(2)
1.2.7.2 羟自由基清除率测定 将不同浓度的多糖溶液(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL)2.0 mL分别放入不同的试管中并做好标记,再逐一加入2.0 mL 6 mmol/L的FeSO4溶液,2.0 mL 6 mmol/L的H2O2溶液,将其充分摇匀,并于室温静置10 min,之后将2.0 mL新配制的6 mmol/L水杨酸的乙醇溶液加入其中,并混合均匀,在37 ℃下反应30 min后,测定它们的吸光度(Ax),波长设置为510 nm。与此同时,样品对照组实验,使用相同体积的乙醇来替代水杨酸溶液(Ay);空白对照组则使用相同体积的蒸馏水替代多糖溶液(Az),以同浓度的抗坏血酸VC作为阳性对照组,在相同的条件下测定其吸光度值[22]。测定完成后,按照式(3)计算各浓度多糖溶液对羟自由基的清除率:

式(3)
1.2.7.3 还原力的测定 分别取1.0 mL各浓度的多糖溶液于不同试管中将2.5 mL pH=6.6、0.2 mol/L的磷酸缓冲溶液加入其中,再加入2.5 mL的1 g/100 mL的K3Fe(CN)6溶液,充分混匀,并在50 ℃的条件下水浴20 min,取出后迅速将其放入冷水中冷却,同时再加入2.5 mL 10 g/100 mL的三氯乙酸溶液,混合摇匀。将样品放入离心机中,在5000 r/min的条件下离心5 min,吸取1.5 mL反应液至试管中,加入0.2 mL新配制的0.1 g/100 mL的FeCl3水溶液,再加入1.0 mL蒸馏水混合均匀,在暗处反应30 min,以同浓度的抗坏血酸VC作为阳性对照组。用蒸馏水校零后,在700 nm波长处测定各试样的吸光度值[23],记录数据。
1.3 数据处理
使用Origin 8.6和Excel进行图表的绘制和相关数据的处理。
2 结果与分析
2.1 不同乙醇终浓度沉淀铁观音茶末粗多糖的得率分析
由图1可知,在等体积的提取液中加入不同体积的无水乙醇,使之产生不同的乙醇终浓度沉淀多糖,铁观音茶末粗多糖的得率随着乙醇终浓度的升高而增大,当乙醇浓度达到最大90%时,铁观音茶末粗多糖分级沉淀的得率最高,为1.97%,因此本实验选用90%的乙醇终浓度分级沉淀提取的铁观音茶末粗多糖进行后续的分离纯化。

图1 在不同乙醇终浓度下铁观音茶末粗多糖的得率Fig.1 The yield of polysaccharide from Tieguanyin teaat the end of different ethanol concentration
2.2 不同浓度洗脱液对铁观音茶末粗多糖样品的DEAE-52纤维素分级纯化
由图3可知,不同浓度的洗脱液对铁观音茶末粗多糖样品均有一定的洗脱效果,将洗脱下来的多糖组分按照洗脱液浓度大小分别命名为TPS-1、TPS-2、TPS-3、TPS-4、TPS-5。分别收集各吸收峰的洗脱液经过旋转蒸发冷冻干燥,计算出各组分的得率分别为17.9%、4.2%、3.8%、33.7%、9.6%,由于TPS-2、TPS-3、TPS-5得率太低,而TPS-1和TPS-4较高,所以选择TPS-1和TPS-4进行下一步的Sephadex-100葡聚糖凝胶纯化。
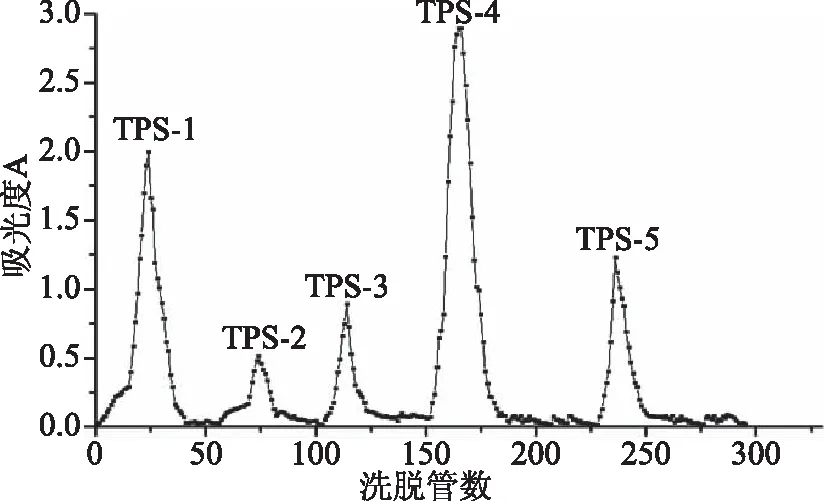
图2 铁观音茶末多糖DEAE-52纤维素层析柱洗脱曲线Fig.2 Elution curve of DEAE-52 cellulose column ofTieguanyin tea dust polysaccharide
2.3 TPS-1和TPS-4的Sephadex-100葡聚糖凝胶洗脱曲线
由图3、图4可知,经过DEAE-52纤维素分级纯化后的组分TPS-1和TPS-4分别用纯水、0.10、0.20 mol/L的NaCl溶液经过Sephadex-100葡聚糖凝胶进行梯度洗脱,其中TPS-1洗脱后得到TPS-1A、TPS-1B和TPS-1C三种多糖组分,其得率分别为46.2%、6.8%、5.9%;TPS-4洗脱后得到TPS-4A、TPS-4B、TPS-4C三种多糖组分,其得率分别为10.9%、11.8%、45.6%;由于TPS-1B和TPS-1C、TPS-4A、TPS-4B得率太低,所以本研究选择得率最高的TPS-1A和TPS-4C进行后续的定性分析和抗氧化活性实验。

图3 铁观音茶末多糖组分TPS-1Sephadex-100葡聚糖凝胶洗脱曲线Fig.3 The elution curves of TPS-1 Sephadex-100chromatographic column of Tieguanyin tea dust polysaccharide
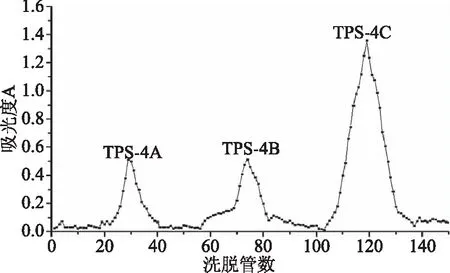
图4 铁观音茶末多糖组分TPS-4Sephadex-100葡聚糖凝胶洗脱曲线Fig.4 The elution curves of TPS-4 Sephadex-100chromatographic column of Tieguanyin tea dust polysaccharide
2.4 铁观音茶叶末多糖组分纯度结果分析
由图5、图6可知,TPS-1A、TPS-4C经纯水洗脱后,洗脱曲线均呈单一对称峰,结合在260~280 nm波长段处,铁观音茶叶末多糖组分TPS-1A和TPS-4C无明显吸收峰,纯化后的铁观音茶末多糖组分TPS-1A和TPS-4C样品中不含或含有极少量蛋白质或核酸,结合凝胶过滤法洗脱曲线,并且通过测定其多糖含量,测得其纯度分别为96.2%、95.1%,经过两次分级纯化后分离效果较好。
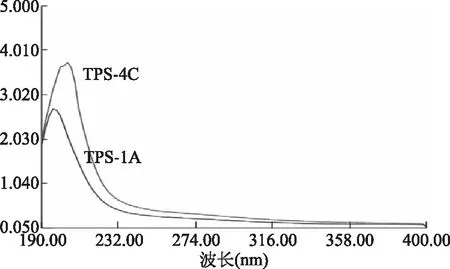
图5 组分TPS-1A、TPS-4C的紫外扫描光谱图Fig.5 Ultraviolet scanning spectra ofcomponent TPS-1A,TPS-4C
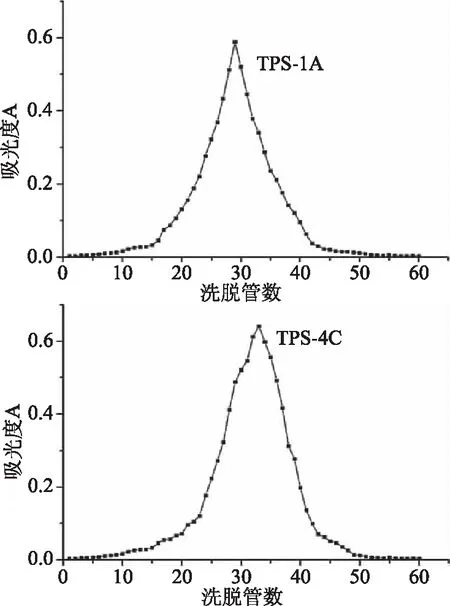
图6 铁观音茶末多糖TPS-1A、TPS-4CSephadex-150葡聚糖凝胶洗脱曲线Fig.6 The elution curves of TPS-1A,TPS-4C Sephadex-150chromatographic column of Tieguanyin tea dust polysaccharide
2.5 铁观音茶叶末多糖组分TPS-1A和TPS-4C的红外扫描图谱
从图7中可以看出,组分TPS-1A和TPS-4C分别在波数3424、3421 cm-1产生的-OH伸缩振动吸收峰;分别在2942、2927 cm-1处产生的C-H伸缩振动吸收峰;分别在1647、1643 cm-1处产生的羰基伸缩振动吸收峰;分别在1442、1412 cm-1及1019 cm-1处产生的-OH弯曲振动吸收峰;分别在800、803 cm-1处产生的β-型糖苷键吸收峰[19,24-25]。结合紫外和红外吸收图谱可知,两种茶末多糖组分均为β-型糖多糖类物质。

图7 组分TPS-1A、TPS-4C的红外扫描图谱Fig.7 Infrared scanning map ofcomponent TPS-1A,TPS-4C
2.6 铁观音茶末多糖组分分子量Mr结果分析
由图8可知,分别收集TPS-1A、TPS-4C吸光度大于0.1的管数为21~41管、27~45管,洗脱体积Ve,分别为63、57 mL。已测得标准蓝色葡聚糖外水体积V0为30 mL,根据Ve,/V0值,计算其分子量为15792、21722 Da。

图8 TPS-1A、TPS-4C SephadexG-100洗脱曲线Fig.8 SephadexG-100 elution curve of TPS-1A,TPS-4C
2.7 铁观音茶末多糖组分TPS-1A和TPS-4C抗氧化活性测定结果
2.7.1 铁观音茶末多糖组分TPS-1A和TPS-4C的DPPH自由基清除率 由图9可知,在铁观音茶末多糖组分TPS-1A和TPS-4C质量浓度0.2~1.2 mg/mL范围内,DPPH自由基清除率随着质量浓度的不断增加而增加,即DPPH自由基的清除率与质量浓度呈依赖关系,TPS-1A和TPS-4C的IC50值分别为0.64和0.58 mg/mL,均高于对照组VC的0.33 mg/mL,当其浓度为1.2 mg/mL时DPPH自由基清除率分别达到95.41%、97.71%,均低于阳性对照组VC,但与郑霖华等[10]提取的铁观音茶多糖DPPH自由基清除率最高的89.67%相比,说明两种茶末多糖组分具有较强的DPPH自由基清除效果,且TPS-4C强于TPS-1A。

图9 不同浓度多糖组分对DPPH自由基的清除率Fig.9 Removal rate of DPPH free radicalsat different concentrations of polysaccharide component
2.7.2 铁观音茶末多糖组分TPS-1A和TPS-4C的羟自由基清除率 羟自由基的氧化活性较强,会对人体细胞造成很大的危害,从而诱使多种疾病的产生[26-27]。由图10可知,在铁观音茶末多糖组分TPS-1A和TPS-4C质量浓度0.2~1.2 mg/mL范围内,羟自由基清除率随着质量浓度的不断增加而增加,即羟自由基的清除率与质量浓度呈依赖关系;TPS-1A和TPS-4C的IC50值分别为0.63和0.52 mg/mL,均高于对照组VC的0.31 mg/mL,当其浓度为1.2 mg/mL时,羟自由基清除率分别达到93.39%、94.21%,均低于阳性对照组VC的96.76%,但是与丁世环等[26]粗提的茶多糖在3.2 mg/mL对羟自由基的清除率最高可达60.37%相比,分离纯化后的两种茶末多糖组分均具有较强的羟自由基清除效果,且TPS-4C强于TPS-1A。
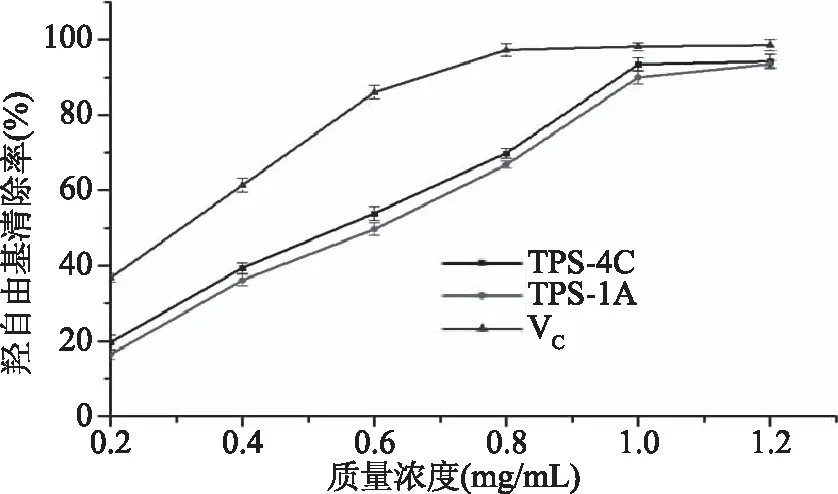
图10 不同浓度的多糖组分对羟自由基清除率Fig.10 Removal rate of hydroxyl radicalsby different concentrations of polysaccharide component
2.7.3 铁观音茶末多糖组分TPS-1A和TPS-4C的还原力 根据铁总还原力测定法,吸光度值的变化大小反映出样品总还原力的高低,吸光度越大,则样品的还原力就越强[27-28]。由图11可知,铁观音茶叶末多糖组分TPS-1A和TPS-4C总还原力随着质量浓度的不断增加而增大,即总还原力与质量浓度呈依赖关系。当TPS-1A和TPS-4C质量浓度为1.2 mg/mL时,吸光度值分别为0.699、0.712,均低于阳性对照组VC的1.106,说明铁观音茶末多糖组分TPS-1A和TPS-4C的还原力弱于VC,具有一定的还原力,且TPS-4C强于TPS-1A,这与两种多糖组分的DPPH自由基和羟自由基清除效果一致。由此可知,TPS-4C的抗氧化性强于TPS-1A,但均弱于阳性对照组VC。
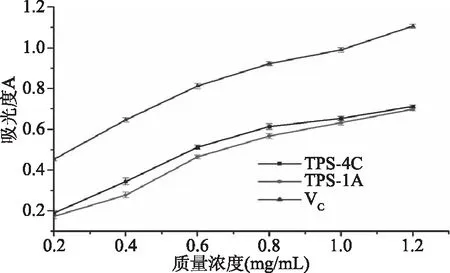
图11 不同浓度多糖组分的还原力Fig.11 Reduction force of polysaccharidecomponentat different concentrations
3 结论
乙醇终浓度为90%提取铁观音茶末多糖得率最高,为1.97%,在此条件下提取的粗多糖进行DEAE-52纤维素和Sephadex-100葡聚糖凝胶分级纯化,得到主要多糖组分TPS-1A和TPS-4C,两者纯度较高,分别为96.2%、95.1%,均具有β-型糖苷键多糖,分子量分别为15792、21722 Da;TPS-1A和TPS-4C抗氧化活性均随着组分浓度的增加而逐渐增强,结合DPPH自由基和羟自由基的清除率效果、IC50值以及总还原力的吸光度大小分析比较,说明铁观音茶末多糖具有较强的抗氧化活性,且TPS-4C强于TPS-1A。本研究为铁观音茶末废弃资源的再利用以及功能产品的研究开发提供一定的理论依据。由于本研究仅对分离纯化后的铁观音茶末多糖进行了简单的构型分析和体外抗氧化活性测定,有关铁观音茶末多糖的单糖分子量、组成、糖苷键等结构分析以及降低胆固醇、抑制肿瘤等其他生物活性有待进一步的研究。
