沙棘酵素发酵过程中代谢产物及抗氧化活性研究
2020-06-18张浩然范昊安顾逸菲王珍珍沙如意毛建卫
张浩然,范昊安,顾逸菲,王珍珍,沙如意,*,毛建卫,4,*
(1.浙江科技学院生物与化学工程学院,浙江杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,浙江杭州 310023;3.浙江省农业生物资源生化制造协同创新中心,浙江杭州 310023;4.浙江工业职业技术学院,浙江绍兴 312006)
沙棘(HippophaerhamnoidesLinn.)是一种落叶性灌木[1],具有耐旱、抗风沙、可以在盐碱化土地上生存的特性,因此被广泛用于水土保持,特别是在中国西北部地区,由于沙漠绿化的需要,种植有大量沙棘[2-3]。沙棘为药食同源植物,其果实含有丰富的营养物质和生物活性物质,包括人体所需要的各种氨基酸、脂肪酸、维生素、亚油酸、超氧化物歧化酶等活性物质,以及异鼠李素、槲皮素等7种黄酮类物质和多种微量元素,具有增强免疫力、延缓衰老、保护肝脏、保护胃肠道、加快细胞的造血、抗辐射、抗突变、抗肿瘤等作用[4-8]。
沙棘在食品、医药、轻工、农牧渔业等国民经济的许多领域都有很好的应用前景[2,9]。市面上比较流行的沙棘产品有沙棘果汁、沙棘茶、沙棘钙片、沙棘胶囊、沙棘果油、沙棘籽油等[3]。沙棘的一个新的研究方向是通过发酵来制备沙棘酵素,目前,关于沙棘酵素的研究较少。食用植物酵素(Edible plant source Jiaosu)是以一种或多种新鲜蔬菜、水果和谷豆类、海藻类、药食两用本草类等为原料,加(或不加)糖类物质,经多种有益菌通过较长时间发酵而生产的功能性微生物发酵产品,拥有丰富的次生代谢产物、植物本身营养成分和益生菌等功能成分,特别是富有小分子功能成分,研究表明该类产品具有抗衰老、抗菌消炎、净化血液、增强机体免疫能力及解毒抗癌等多种保健功能[10-13]。开发沙棘酵素,加强对于沙棘酵素的研究有利于促进沙棘产业向深层次发展。
本文以野生沙棘果实为原料,研究沙棘酵素在发酵过程中总糖、总酸、琥珀酸、苹果酸、酒石酸、抗坏血酸、醋酸、总酚等活性成分含量、抗氧化活性(羟基自由基清除能力、ABTS自由基清除能力和还原力)变化以及微生物菌落总数变化规律,同时利用相关性分析和主成分分析对各评价指标进行分析,为沙棘的综合开发利用提供基础数据。
1 材料与方法
1.1 材料与仪器
野生沙棘果实 采自山西吕梁山,2018年2月采样;低聚异麦芽糖 由浙江省农产品化学与生物加工技术重点实验室提供;双氧水(H2O2)、福林酚(10%)、铁氰化钾、三氯化铁、蒽酮、甲醇、碳酸钙、氯化钠(分析纯) 国药集团化学试剂有限公司;乙醇、抗坏血酸(VC)、三氯乙酸、2,2-联氮基-双-二胺盐(ABTS)(分析纯)、磷酸二氢钾(HPLC级) 上海阿拉丁试剂有限公司;甲醇 HPLC级,美国天地有限公司;葡萄糖、胰蛋白胨、琼脂粉、酵母浸粉 北京奥博星生物技术有限公司;马铃薯葡萄糖琼脂 杭州百思生物科技有限公司;草酸、富马酸、马来酸、苹果酸、柠檬酸标准品 国家食品药品检测中心;酒石酸 Sigma公司;抗坏血酸、莽草酸、没食子酸、醋酸、乳酸标准品 上海阿拉丁生化科技股份有限公司。
PTX-FA210型电子天平 福州华志科学仪器有限公司;Allegra X-12R离心机 贝克曼库尔特有限公司;PHS-3C型精密酸度计 杭州齐威仪器有限公司;KQ-300E型超声波清洗器 昆山市超声仪器有限公司;UV-5500PC型紫外分光光度计 上海市元析仪器有限公司;XMTD-204型数显式电热恒温水浴锅 常州诺基仪器有限公司;Waters e2695型高效液相色谱(配备Waters 2998二极管阵列紫外检测器) Waters公司;MB-150CL型恒温恒湿培养箱 青岛明博环保科技有限公司;20L不锈钢发酵罐 浙江省农产品化学与生物加工技术重点实验室研制。
1.2 实验方法
1.2.1 培养基的配制 PCA培养基:酵母粉2.5 g,蛋白胨5 g,葡萄糖1 g,琼脂15 g,蒸馏水1000 mL,121 ℃湿热灭菌15 min。
YEPD培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 mL,121 ℃湿热灭菌15 min。
GYCA培养基:酵母粉5 g,蛋白胨3 g,葡萄糖30 g,碳酸钙10 g,琼脂20 g,蒸馏水1000 mL,121 ℃湿热灭菌15 min。
1.2.2 沙棘酵素的制备 取灭菌、冷却后的无菌水轻轻冲洗沙棘表面,自然沥干、打浆,按沙棘∶低聚异麦芽糖∶水的质量比3∶3∶1,加入灭菌过的发酵罐,密闭、室温发酵,每隔10 d取一定量发酵液,8000 r/min条件下离心10 min,保留上层清液备用。
1.2.3 总酚含量测定 采用福林酚法[14]测定样品中总酚含量。取30 μL沙棘酵素离心上清液,加水至0.5 mL,加入10%福林酚溶液(v/v)2.5 mL,常温静置反应3 min,加入7.5% Na2CO3溶液(w/v)2 mL,混匀,于25 ℃反应1 h,以去离子水为空白,在765 nm下测定吸光度。并以没食子酸为标品,绘制标准曲线。
1.2.4 pH测定 参照GB 10468-1989《水果和蔬菜产品pH的测定方法》[15],使用精密pH计测定样品pH。
1.2.5 总酸含量测定 参照GB/T 12456-2008《食品中总酸的测定方法》[16],取样品0.5 mL,加水定容至50 mL,取10 mL稀释液于锥形瓶中,以1%酚酞试剂为指示剂,记录消耗0.01 mol/L的氢氧化钠溶液滴定体积,计算总酸含量(以苹果酸计)。
1.2.6 有机酸种类及含量测定 样品配制:用流动相将样品稀释5倍,经0.22 μm微孔滤膜过滤,采用HPLC检测有机酸含量。
混合标准品配制:配制草酸、L-酒石酸、苹果酸、莽草酸、抗坏血酸、乳酸、醋酸、马来酸、柠檬酸、琥珀酸、富马酸、没食子酸的混合标准溶液,其质量浓度分别为0.1、0.1、0.5、0.01、0.1、1、1、0.01、1、0.01、1、0.01 mg/mL。
色谱条件:色谱柱为Atiantis® T3 C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇:磷酸二氢钾缓冲液(pH2.7)=2∶98 (v/v);流速为1.0 mL/min;柱温为20 ℃;检测波长为210 nm;检测器:二极管阵列检测器。
1.2.7 总糖含量测定 采用蒽酮-硫酸法[17]测定样品中总糖含量。分别配制20、40、60、80、120、160 μg/mL的标准葡萄糖溶液,各标准溶液1 mL,加入4 mL 2 mg/mL蒽酮-硫酸溶液,混合均匀后置于沸水浴中反应10 min,冰浴中冷却至室温后,在620 nm处测定其吸光度,绘制得葡萄糖的标准曲线。沙棘酵素发酵液样品经适当稀释后,采用上述方法测定总糖含量。
1.2.8 羟基自由基清除能力的测定 取50 μL样品,加去离子水补至2 mL,加入1.4 mL 6 mmol/L H2O2溶液,0.6 mL 20 mmol/L水杨酸钠和2 mL 1.5 mmol/L硫酸亚铁,混匀,37 ℃下恒温水浴1 h。在510 nm下,以去离子水为空白,检测样品吸光度。羟基自由基清除能力计算见式(1)[18-19]。
式(1)
式中,A0是空白对照液的吸光度,A1为样品测定管的吸光度,A2为样品本底管的吸光度。
1.2.9 ABTS自由基清除能力的测定 用5 mmol/L pH7.4的PBS缓冲液将ABTS稀释到7 mmol/L,加入过硫酸钾溶液,得到最终浓度为2.45 mmol/L ABTS溶液,在暗处室温放置12~16 h。使用前,在波长734 nm处,用PBS缓冲液将ABTS溶液稀释,使其吸光度为0.70±0.02。
取7.5 μL样品,用上述PBS溶液补足至300 μL,加入5 mL上述ABTS自由基稀释液,30 ℃下反应1 h,734 nm下测吸光度。ABTS自由基清除能力计算见式(2)[20]。
式(2)
式中,A0是空白对照液的吸光度,A1为样品测定管的吸光度,A2为样品本底管的吸光度。
1.2.10 还原力的测定 取50 μL样品,加入0.2 mol/L磷酸缓冲液(pH6.6)补足至2.5 mL,加入1%(w/v)铁氰化钾水溶液2.5 mL,混合均匀,于50 ℃恒温反应30 min,加入10%(w/v)三氯乙酸水溶液2.5 mL,混匀,避光静置10 min,取2.5 mL上清液,加入2.5 mL去离子水和0.5 mL 0.1%(w/v)三氯化铁水溶液,混匀,在700 nm下,以去离子水为空白,检测样品吸光度[21]。
1.2.11 菌落总数的测定 参照GB 4789.2-2016 《食品微生物学检验菌落总数测定》[22]的方法,用10倍稀释法,将体积分数分别为10-2~10-5稀释菌液涂布于PCA培养基上,28 ℃培养48 h后计数。
1.2.12 酵母菌菌落数的测定 参照GB 4789.15-2016 《食品微生物学检验霉菌和酵母计数》[23]的方法,用10倍稀释法,将体积分数分别为10-2~10-5稀释菌液涂布于YEPD培养基上,28 ℃培养48 h后计数。
1.2.13 醋酸菌菌落数的测定 参照王玉冰[2]的方法,用10倍稀释法,将体积分数分别为10-2~10-5稀释菌液涂布于GYCA培养基上,28 ℃培养48 h后计数。
1.3 数据处理
每组实验均重复三次,采用Origin 8.6进行绘图,结果以平均值±标准差表示。
2 结果与分析
2.1 沙棘酵素发酵过程中总酚含量的变化
总酚的标准曲线如图1所示,y=0.0104x-0.0253,R2=0.9998。沙棘酵素发酵过程中总酚含量变化如图2所示。随着发酵时间的延长,总酚含量呈先快速上升然后再趋于动态平衡的趋势。发酵到第40 d,总酚含量达到最高,为1.29 mg/mL。发酵前40 d,总酚含量快速上升,可能主要与此阶段沙棘中多酚类物质在高渗透压作用下逐渐溶出以及微生物代谢有关。
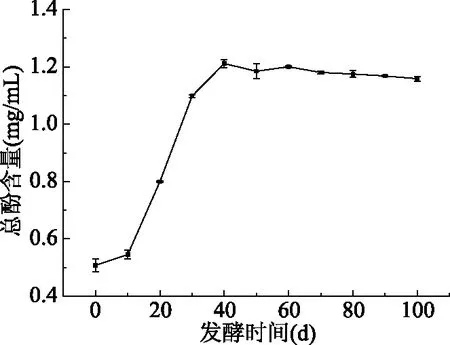
图2 发酵过程中总酚含量的变化Fig.2 Changes of total phenolic content during fermentation
2.2 沙棘酵素发酵过程中总酸含量与pH的变化
总酸在一定程度上可反映酵素发酵中微生物生长代谢情况,而pH通常可以作为判定微生物生长正常与否的重要指标。沙棘酵素发酵过程中总酸与pH含量变化趋势如图3所示,发酵过程中pH呈先降低再动态平衡的趋势,总酸含量整体上呈先快速增加再动态平衡的趋势。

图3 发酵过程中总酸和pH的变化Fig.3 Changes in total acid and pH during fermentation
在发酵的前20 d,pH迅速下降,总酸含量明显提高,这可能是由于原料中有机酸的大量溶出及醋酸菌等大量微生物代谢产生了醋酸等有机酸[24-26]。20 d后,pH基本稳定,总酸含量呈现缓慢上升的趋势,发酵到第100 d,总酸含量达到最高为80.80 mg/mL。沙棘酵素在发酵过程中的总酸含量和pH变化趋势与火龙果酵素、苹果酵素基本一致,只是趋于稳定的时间有所区别(火龙果酵素是40 d,苹果酵素是14 d),这可能与原料的品种特性以及参与自然发酵的微生物种类不同有关[2,27]。
2.3 沙棘酵素发酵过程中有机酸含量的变化
各有机酸的标准曲线如表1所示。沙棘酵素不同发酵时间点的样品中的有机酸种类及含量变化见表2。由表2可知,沙棘酵素发酵过程中检测到草酸、酒石酸、苹果酸、莽草酸、抗坏血酸、醋酸、马来酸、柠檬酸、富马酸、琥珀酸和没食子酸,其中苹果酸、酒石酸、抗坏血酸的含量较高,呈先明显升高再缓慢降低的趋势。吴紫洁等[28]研究了12个沙棘品种果实中的有机酸组分,发现沙棘果实的有机酸有草酸、奎尼酸、苹果酸、抗坏血酸和柠檬酸;戴达勇等[29]研究表明沙棘果粉中苹果酸含量最高。由表2可知,醋酸和琥珀酸含量呈现不断增加的趋势,其余几种有机酸的含量较低且变化不明显;发酵过程中未检测到乳酸;沙棘酵素中醋酸的含量明显增加,经过100 d的发酵,从0.19203 mg/mL增加到1.31003 mg/mL,这可能是由于在发酵过程中,醋酸菌代谢旺盛,利用糖生成醋酸。发酵过程中新检测到的有机酸有马来酸、琥珀酸和没食子酸,其中琥珀酸含量增加较为显著,从第20 d开始检测到琥珀酸,发酵100 d时,其含量为0.73932 mg/mL。Tsuji等[30]研究表明酵母菌等微生物发酵形成琥珀酸的路径有三条:TCA循环的还原性分支,其主要在完全厌氧条件下活化;TCA循环的氧化分支,其主要在有氧条件下活化;以及乙醛酸支路。本实验中琥珀酸含量的增加可能是酵母菌在代谢过程中大量繁殖造成的。

表1 有机酸标准曲线Table 1 Standard curves of organic acids

表2 发酵过程中12种有机酸变化Table 2 Changes of twelve organic acids during fermentation
沙棘果实经过微生物发酵后,含量最高的仍为苹果酸,同时形成了新的有机酸,包括马来酸、琥珀酸和没食子酸,醋酸含量也明显增加,这对其发挥生物学活性具有重要作用和意义。
2.4 沙棘酵素发酵过程中总糖含量的变化
总糖的标准曲线如图4所示,y=0.00274x-0.00368,R2=0.9992。糖作为酵素发酵过程中微生物利用的主要碳源,其含量变化可以作为微生物代谢的核心指标之一。沙棘酵素发酵过程中的总糖含量变化如图5所示。发酵的前30 d,总糖含量快速下降,在这个时间段内,一方面沙棘果原料中的水分在高糖渗透压条件下,逐渐渗出,稀释发酵液中的糖,使得发酵液中糖含量降低;另一方面,糖被酵母菌、醋酸菌等微生物作为碳源利用,用于合成和分解代谢[31]。杨小幸等[27]研究表明苹果酵素中的蔗糖在21 d内被分解为葡萄糖和果糖,二者又被酵母菌和醋酸等微生物利用生成乙醇和醋酸等代谢产物。发酵至第50 d,总糖含量降低至初始总糖含量的49.94%,为0.42 g/mL;之后,总糖含量有缓慢增加的趋势并逐渐趋于稳定,发酵至第100 d,总糖浓度相比最低点上升5.78%,这可能是由于微生物的生长繁殖和代谢导致发酵液中的总糖浓度下降与含糖代谢产物的产生共同影响造成的。
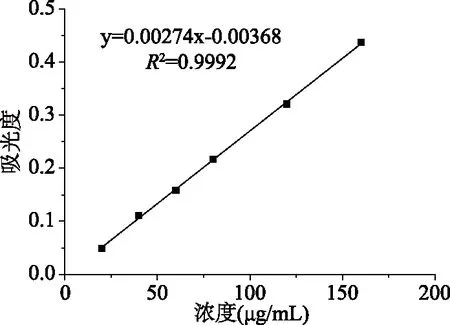
图4 葡萄糖标准曲线Fig.4 The standard curve of glucose
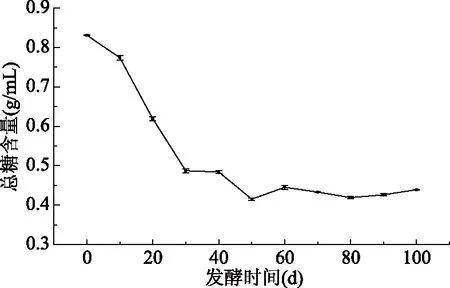
图5 发酵过程中总糖含量变化Fig.5 Changes in concentration oftotal sugar during fermentation
2.5 沙棘酵素发酵过程中抗氧化性能评价
2.5.1 羟基自由基清除能力的变化 羟基自由基是人体内一种常见的自由基,同时也是一种毒性最强的活性氧自由基,能够杀死红细胞,引起细胞膜、DNA等结构的氧化损伤[32]。沙棘酵素发酵过程中羟基自由基清除能力变化情况如图6所示,随着发酵时间的延长,沙棘酵素对羟基自由基清除能力明显提高,发酵至40 d清除率达到最高为64.44%,随后清除率趋于稳定。Li等[33]研究发现沙棘原料的抗氧化能力较低,而本文中沙棘经过发酵后,沙棘酵素的抗氧化能力提高非常明显。沙棘酵素具有较强的羟基自由基清除能力,可能与其含有的酚类物质含量较高有关,Seyda等[34]研究表明酚类物质可以提供大量氢离子,经过共振杂化会变得稳定,从而促进了自由基清除能力的提高。
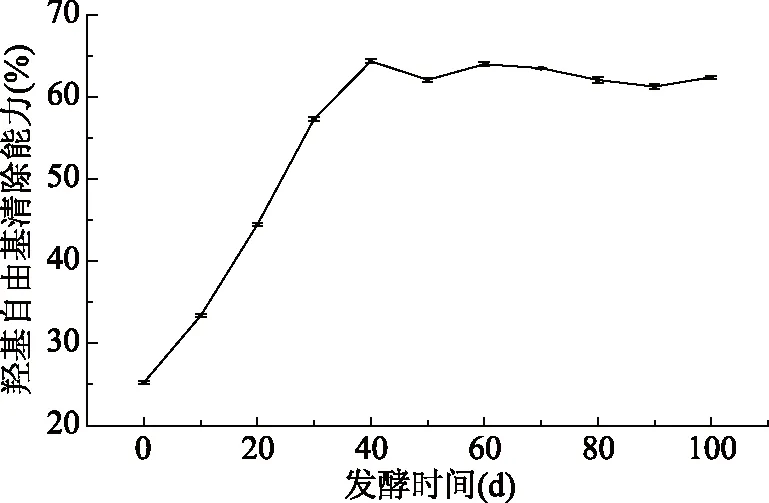
图6 发酵过程中羟基自由基清除能力变化Fig.6 Changes in hydroxyl free radicalscavenging ability during the fermentation
2.5.2 ABTS自由基清除能力的变化 ABTS自由基常被用作亲水性和亲脂性物质的抗氧化能力的评价。沙棘酵素发酵过程中ABTS自由基清除能力变化情况如图7所示,发酵的前40 d,ABTS自由基的清除能力明显增强,发酵至第40 d时清除率达到47.45%,40 d之后清除率有明显上下浮动。Floegel等[35]研究表明与DPPH自由基清除能力相比较,ABTS自由基的抗氧化活性效果更好,特别是对于色素含量较高和亲水性原料。Erel等[36]研究表明酚类物质与ABTS自由基的清除能力具有显著的正相关性,其中酚类物质的分子质量、羟基取代基的性质和芳香环的数量起到了关键作用。
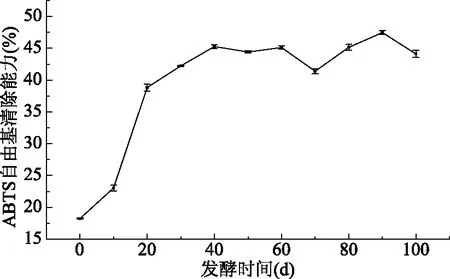
图7 发酵过程中对ABTS自由基清除能力变化Fig.7 Changes in ABTS free radicalscavenging ability during the fermentation
2.5.3 还原力的变化 还原力是反映抗氧化能力的另一指标,与多种抗氧化机制有关,包括还原能、结合自由基的清除、过氧化物的降解等,样品的还原能力与吸光度呈正相关[37-38],通过测定反应液在700 nm处的吸光度来评价还原力的大小。沙棘酵素发酵过程中还原力的变化情况如图8所示,随着发酵时间的延长,还原力明显提高,至40 d达到0.55,随后还原力又缓慢上升并趋于稳定的趋势,整体呈现“先快后慢”的趋势。

图8 发酵过程中还原力的变化Fig.8 Changes in reducing power during fermentation
2.6 沙棘酵素抗氧化活性与代谢产物的相关性分析
沙棘酵素在不同发酵时间的样品具有明显的羟基自由基清除能力、ABTS自由基清除能力和较高的还原力,这可能与沙棘酵素中含有的总酚、总酸、酒石酸、苹果酸、抗坏血酸、醋酸、琥珀酸、总糖等代谢产物有关。沙棘酵素的抗氧化活性影响指标众多,众多指标之间可能会存在着部分信息的冗余,因而可以利用相关性分析来排除众多相关变量的影响,对数据进行标准化处理,标准化后的数据进行相关性分析的结果如表3所示。

表3 经标准化处理后各参数的相关性分析Table 3 Correlation analysis of parameters after normalization

表5 旋转前因子载荷矩阵Table 5 Rotated component matrix
由表3可知,在沙棘酵素发酵过程中,羟基自由基、ABTS自由基的清除能力和还原力这3个抗氧化指标之间呈现极显著的正相关性(P<0.01),总酚、总酸和琥珀酸与3个抗氧化能力指标之间具有极显著的正相关性(P<0.01),醋酸与3个抗氧化能力指标之间具有良好的正相关性(P<0.05),可见沙棘酵素所含的酚类物质和有机酸等物质具有一定的抗氧化作用。总糖含量与抗氧化活性具有极显著负相关(P<0.01),说明发酵过程中微生物利用糖类物质代谢产生酚类等活性物质,从而提高了沙棘酵素的抗氧化活性。潘梓源等[39]研究表明桂圆酵素经过微生物发酵总酚含量是原桂圆水提液的5.05倍,其中新生成的酚类物质至少有16种,是多种微生物代谢产生的结果。
2.7 主成分分析
2.7.1 主成分分析的特征值 为了进一步明确沙棘酵素中各变量之间的相互关系,通过主成分分析对各变量进行降维处理。
沙棘酵素主成分的特征值、贡献率和累积贡献率如表4所示。以特征值1.0为纳入标准,提取出2个主成分。其中第1主成分的贡献率为69.166%,第2主成分的贡献率为22.305%,二者累积方差贡献率高达91.471%,即二者能够反映原始变量91.471%的信息,可以用于描述大部分变量的信息。其中,第一主成分反映了总糖、羟基自由基清除率、还原力、总酚、ABTS自由基清除率、琥珀酸、总酸、pH和醋酸的变异信息,第二主成分反映了苹果酸、抗坏血酸和酒石酸的变异信息。因此,对原先的12种变量指标进行降维处理后获得2个新的变量,2个新变量分别用F1、F2表示,它们之间的线性关系为:
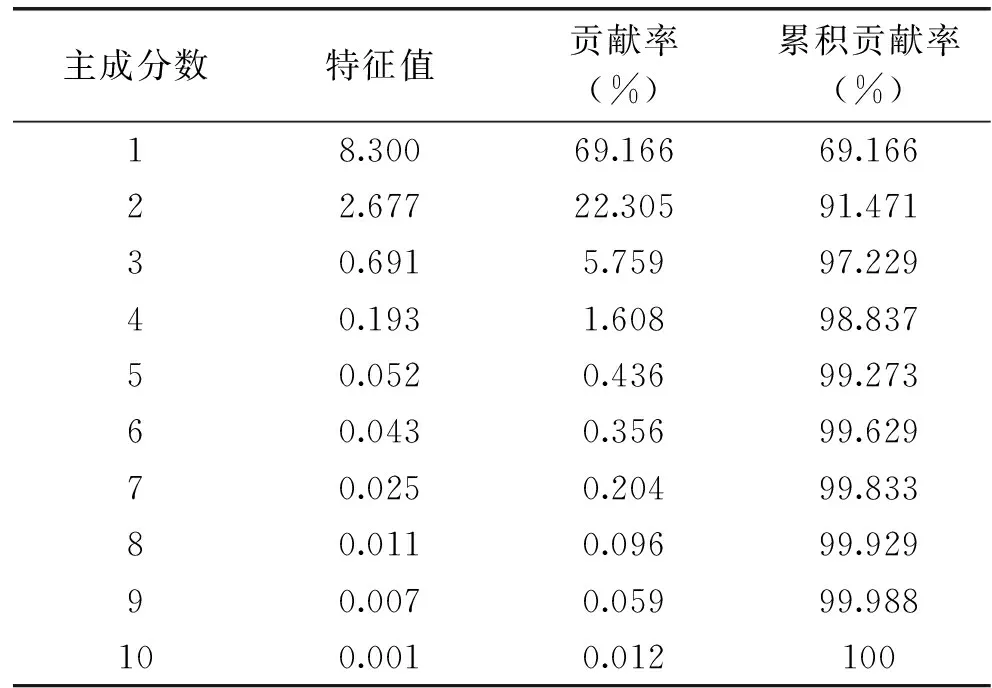
表4 主成分的特征值、贡献率和累积贡献率Table 4 The eigenvalue,contribution rate and thecumulative contribution rate of principal components
F1=-0.343×ZTS+0.341×ZHR+0.338×ZRP+0.338×ZTPC+0.337×ZABTS+0.333×ZSUA+0.329×ZAC-0.314×ZpH+0.251×ZACA-0.014×ZMAA-0.103×ZVC+0.179×ZTAA
F2=0.019×ZTS+0.007×ZHR-0.094×ZRP-0.043×ZTPC+0.064×ZABTS-0.150×ZSUA+0.091×ZAC-0.166×ZpH-0.097×ZACA+0.607×ZMAA+0.560×ZVC+0.485×ZTAA
2.7.2 主成分分析法构建抗氧化能力综合评价指标 通过主成分分析法构建不同发酵时间样品的综合评价指标(Comprehensive evaluation index,CEI),即以每个主成分所对应的特征值占所提取主成分的特征值之和的比例,再进行线性加权求和得到综合评价指标。
式(3)
不同发酵时间沙棘酵素的综合评价指标如图9所示。发酵前40 d的CEI值明显升高,发酵40 d之后上升趋势明显减缓并趋于平稳。参考CEI值的变化,结果表明,发酵至40 d,各种代谢指标已基本稳定。
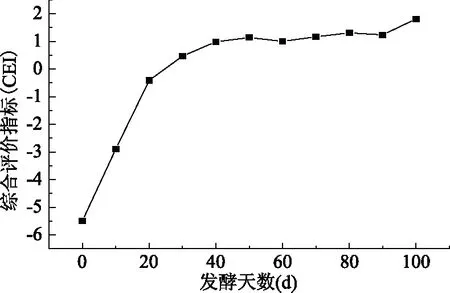
图9 沙棘酵素综合评价指标图Fig.9 Comprehensive evaluation index of seabuckthorn jiaosu
2.8 沙棘酵素发酵过程中微生物菌群的变化
对沙棘酵素发酵过程中菌落总数、酵母菌、醋酸菌等菌落数量变化进行研究,如图10所示。从酵母菌和醋酸菌菌落数的变化趋势可以明显看到迟缓期、对数期、稳定期、衰退期[40]。在发酵初期,由于菌种对生长环境需要适应,使得10~20 d的酵母菌和醋酸菌菌种数量增加缓慢,即二者需要经历迟缓期来适应环境,所以菌落数增加较少;随后20~30 d的酵母菌和20~40 d的醋酸菌分别进入对数生长期,二者适应环境之后数量快速增加;随后菌种的繁殖达到动态平衡,酵母菌和醋酸菌分别在30~60 d和40~80 d进入稳定期;最后当外部的环境不再适合菌种生长时,即菌种的分解代谢超过了合成代谢,导致酵母菌在最后的60~100 d开始进入衰退期。
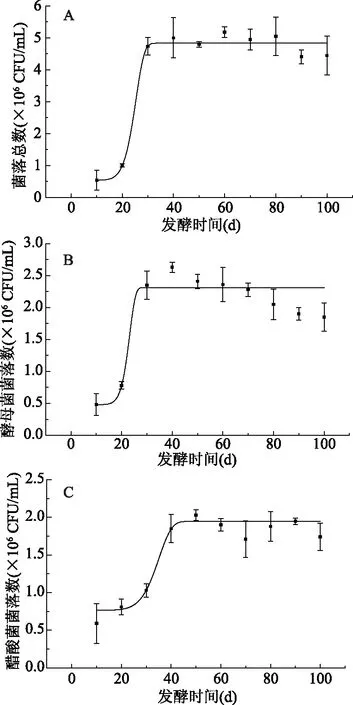
图10 发酵过程中微生物菌群的变化Fig.10 Changes in the microbialcommunity during fermentation注:A:菌落总数;B:酵母菌;C:醋酸菌。
菌落数与总酚和总酸的变化趋势基本一致,醋酸菌数量的增加验证了发酵过程中醋酸含量不断增加的原因,酵母菌含量的增加可能是导致发酵过程中琥珀酸含量增加的原因。叶陵等[41]研究表明剁辣椒在短期自然发酵过程中菌落总数和酵母菌菌落数呈现先增加再趋于平衡的趋势,发酵初期的养分充足,微生物快速生长,但随着发酵时间的延长,微生物代谢产生的醋酸等物质具有抗菌活性,从而使菌株生长放缓,这与本研究结果相一致。
3 结论
总酚与总酸含量、抗氧化能力(羟基自由基清除能力、ABTS自由基清除能力、还原力)呈先快速上升再动态平衡的趋势;pH、总糖含量呈先快速降低再动态平衡的趋势;沙棘酵素中的有机酸主要以酒石酸、苹果酸、抗坏血酸为主,发酵过程中新检测到的有机酸有马来酸、琥珀酸和没食子酸,醋酸和琥珀酸呈现不断增加的趋势。综合评价指标分析结果表明:发酵前40 d的CEI呈逐渐上升趋势,40 d之后上升趋势明显减缓并趋于平稳,说明发酵至40 d,各种代谢指标已基本稳定。对沙棘酵素发酵过程中的菌落总数、酵母菌和醋酸菌数量进行研究,发现沙棘酵素发酵过程中醋酸菌呈先快速上升再动态平衡的趋势,酵母菌呈先快速上升再动态平衡最后缓慢下降的趋势,从微生物的角度反映了沙棘酵素的代谢过程。
